荧光探针Fluo-3/AM和FuraRed测量单细胞中比率钙
作者:马晓冬 朱晓亮 赵 清 张 瑾 张 飒 雷国华 黄行许 鲍永耀
单位:马晓冬 赵 清 张 瑾 张 飒 雷国华 黄行许 鲍永耀(第一军医大学 中心实验室);朱晓亮 (南方医院皮肤科, 广东广州 510515)
关键词:激光扫描共聚焦显微镜;Fluo-3/AM;FuraRed ;比率钙
中国医学物理学杂志990320 摘要:应用ACAS570激光扫描共聚焦显微镜(laser scanning confocal microscope,LSCM简称共焦显微镜)和钙离子指示剂Fluo-3/AM 、FuraRed荧光探剂双标记技术,测定了单个活细胞内比率钙的动态变化。结果显示37 ℃, Fluo-3/AM浓度10 μmol/L,FuraRed浓度10 μmol/L的条件下,昆明小鼠巨噬细胞负载1 h左右即可获良好的标记效果。用比率探针测量细胞内Ca2+的动态变化,使Ca2+的定性定量测定不受染料浓度、细胞大小、照射光强度以及一定程度的光漂白和染料泄漏等因素的影响,提供了一种准确定性定量细胞内Ca2+的实时、动态、原位变化的新方法。
, 百拇医药
中图分类号:Q74 文献标识码:A 文章编号:1005-202X(1999)03-0180-03
Ratiometric calcium measurements in single cells with visible wavelength probes fluo-3/AM and furared
MA Xiao-donget al.
First Military Medical University,Central Laboratory,,ZHU Xiao-liang
Department of Dermatology of Nanfang Hospital , Guangzhou 510515,China
Abstract:Using laser scanning confocal microscope(LSCM)and highly sensitive Ca2+ fluorescent dye, Fluo-3/AM and FuraRed, we measureed the kinetic changes of ratiometric calcium in single intact living cells. The results showed, incubated for 1h at 37℃ with 10 μmol/L Fluo-3/AM and 10 μmol/L FuraRed, the murine peritoneal macrophages cultured on gass cover slips were manifested excellent LSCM imaging of intracellular Ca2+. The use of ratiometric probes can be qualified and quantified intracellular Ca2+ more accurately, since it allows calcium quantitation independent of dye concentration, cell volume, illumination intensity, and reduces the effect of photobleaching and dye leakage. The results indicated that, by using laser scanning confocal microscope and sensitive Ca2+ fluorescent dye, Flul-3/AM and FuraRed,provided a exactly new method for real time、continuous and in situ detection of kinetic variations in intracellular Ca2+.
, 百拇医药
Key words:laser scanning confocal microscope ; fluo-3/AM; furared; ratiometric calcium.
细胞内游离Ca2+不仅作为一种重要的第二信使广泛参与细胞的运动、分泌、代谢和分化等多种细胞功能活动的调节[1];而且胞内游离Ca2+浓度的变化与调控对于参与维持存在于细胞质膜或细胞器膜两侧的跨膜Ca2+梯差,介导细胞对外界刺激的应答反应具有重要的调节作用[2-4]。因此,在完整细胞上准确测定胞内游离Ca2+浓度的动态变化,其重要性是显而易见的。本文利用ACAS570激光扫描共聚焦显微镜(laser scanning confocal microscope,LSCM),采用单激发单发射指示剂Fluo-3/AM和FuraRed双标记法测定了外源性刺激剂地塞米松诱导胞浆游离Ca2+的动态变化,获得了良好的测定效果。
, 百拇医药
1 材料与方法
1.1 材料
(1)试剂:①地塞米松,用不含Ca2+、Mg2+的PBS缓冲液配制,RPMI1640培养基(Gibco, 德国),小牛血清(Gibco,德国)。②Fluo-3/AM 、FuraRed(Molecular Probes Inc,USA)用二甲基亚砜配成1 mmol/L,置于-20℃冰箱保存,PluronicF-127(Sigma,USA)。③不含Ca2+、Mg2+的PBS缓冲液(g/L): 8.01 gNaCl、Na2HPO4.12H2O、0.23 g NaH2PO4.2H2O。④Hepes缓冲液。⑤昆明种雄性小鼠(第一军医大学动物所提供)腹腔巨噬细胞培养。
, http://www.100md.com
(2)仪器:ACAS570激光扫描共聚焦显微镜(Meridian,USA)
1.2 方法
(1)巨噬细胞培养
18~20 g雄性昆明小鼠,按1次/天,1 ml/次连续三天腹腔注射1%巯基乙醇酸钠,停一天,按鄂征等人的方法取腹腔巨噬细胞(台酚兰吞噬实验显示99%为巨噬细胞),以1×106个/ml接种于特制的Petri培养皿(Meridian,USA),用含10%小牛血清的RPMI-1640培养于37℃,含5%CO2孵箱内。2 d后即可进行实验。
(2)荧光探针标记
将培养2 d的小鼠腹腔巨噬细胞用Hepes缓冲液漂洗3次,滴入终浓度为10 μmol/L的Fluo-3/AM 和FuraRed,加入1 μl 25% pluronic F-127,在37 ℃、5%CO2孵箱中孵育1 h,其间轻轻振荡几次,经Hepes缓冲液漂洗2次后,再滴入Hepes液0.5 ml。
, 百拇医药
(3)Ca2+动态变化的LSCM测定
LSCM由共聚焦显微镜主体,激光器(Ar+激光)和微型计算机构成。激光束的扫描与控制以及图像数据的采集和加工均由计算机完成。将标记好荧光探剂Fluo-3/AM和FuraRed的小鼠腹腔巨噬细胞,放入激光扫描共聚焦显微镜测定小室,用装有Olympus
IMT-2倒置相差显微镜和40×物镜ACAS570激光扫描共聚焦显微镜系统扫描成像。用488 nm氩离子激光同时激发两种染料,用ACAS570多彩色滤光盘(Molti-Color Filter Wheel)提供的530/30 nm带通滤光器和605 nm长通滤光器将两者的发射光分开,用有增辉电路的DageCCD摄像机,以1.0秒的间隔记录。数据通过图像采集器直接送入计算机,然后用ACAS570-IQ分析软件分析。
2 结果
, 百拇医药
(1)用外源性刺激剂地塞米松测得巨噬细胞中Fluo-3和FuraRed对细胞内Ca2+的荧光强度变化曲线。在本实验中,将地塞米松(终浓度为1.5μM)加到巨噬细胞培养液中(100sec后),引起细胞内Ca2+迅速增加,随后逐渐达到平台。两种染料的荧光强度动态变化曲线清楚的表明,加地塞米松时(100sec)引发Fluo-3荧光急剧增强,同时伴有FuraRed荧光减弱,提示Ca2+增加(图1)。在加地塞米松前和Ca2+反应的峰值时,两种染料的相对荧光强度以灰度图表示(图2)。
图1 地塞米松刺激后,小鼠腹腔巨噬细胞负载Fluo-3/AM和FuraRed的荧光强度变化曲线检测器1(Det1)Fluo-3/AM通过530/30nm带能滤光器后单激发的荧光强度变化曲线检测器2(Det2) FuraRed 通过605 nm长通滤光器后单激发的荧光强度变化曲线
, 百拇医药
(上图)
(下图)
图2 地塞米松处理前,小鼠腹腔巨噬细胞负载Fluo-3/AM、FuraRed的荧光灰度图像(上图)和处理后小鼠腹腔巨噬细胞负载Fluo-3/AM、FuraRed的荧光灰度图像(下图)。检测器1(Detector1)表示负载Fluo-3/AM。检测器2(Detector2)表示负载FuraRed。
(2)为了定量荧光变化,按实验中每个时间点求得Fluo-3/AM探针发射强度与FuraRed探针发射强度的比率。巨噬细胞对地塞米松反应的动态变化曲线表明,荧光比率迅速增加1.2倍,随后逐渐达到饱和状态(图3)。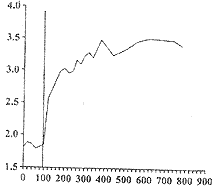
, 百拇医药 图3 地塞米松处理后,小鼠腹腔巨噬细胞负载
Fluo-3/AM、FuraRed的比率荧光动态变化曲线
3 讨论
(1)在比率法中用两种染料同时标记,需要其比率在细胞内Ca2+浓度不变时保持稳定。两种染料的泄漏、区域化分布、漂白或代谢等均能导致实验过程中比率不稳定。Fluo-3/AM和FuraRed都对光漂白敏感,对经过10 μmol/LFluo-3/AM和10 μmol/LFuraRed孵育的巨噬细胞连续扫描,在本实验中地塞米松处理之前两种染料荧光强度的基线值(图1)及其比率荧光强度的基线值(图3)都是稳定的。这些结果表明:巨噬细胞中染料无预先发生的光漂白或泄漏;Fluo-3/AM和FuraRed用在比率法中是可行的。
(2)FuraRed是近年来研制的一种独特的Ca2+指示剂,发射640nm波长的荧光,荧光强度随FuraRed与Ca2+结合的增加而减弱[5,6]。相反Fluo-3发射530nm较短波长的荧光,荧光强度随Fluo-3/AM与Ca2+结合的增加而增强[7,8]。据此提供了一种定量细胞内Ca2+可见光激发的比率方法:将Fluo-3/AM和FuraRed联合使用,用488nm的可见光(激光)激发,来测定细胞内比率Ca2+的实时、动态变化。由于这两种染料与Ca2+结合发出的荧光量呈相反的变化,所以增加了对Ca2+检测的灵敏度。
, http://www.100md.com
(3)Fluo-3/AM和FuraRed都是很好的Ca2+指示剂。联合使用两种指示剂,用单一可见光激发能为用比率法测量细胞内比率Ca2+提供一种独特的有价值的方法。类似的比率测定法还有很多,如用两种染料同时测量Ca2+和pH[5,9]。但这些方法需要两种不同的荧光探针,而且须特别注意染料负载、光漂白和染料泄漏,每一种因素在各次实验之间可能明显地影响比率。使用Fluo-3/AM和FuraRed能提供一种Ca2+测量方法并具有可见光激发的优点。
参考文献:
[1] Capham D E. Cell, 1995,80: 259 .
[2] Yang F Y, Tu Y P. Biochem Biophys Res Commun, 1991,175: 366.
, http://www.100md.com
[3] Fan G F, Huang Y G, Bai Y H, et al. FEBS Lett, 1995,357: 13.
[4] Yang X Y, Fan G F, Huang Y G, et al. Chin Sci Bull, 1996; 41: 338.
[5] Haugland R P. (1992) Molecular probes Catalog.
[6] Durebayashi N, Harkins A B, and Baylor S M. Biophysical J, 1992, 61: A160.
[7] Minta A, Kao J P Y, and Tsien R Y. Biol Chem, 1989,264: 8171.
[8] Kao J P Y, Harootunian A T, and Tsien R Y. Biol Chem, 1989,264: 817.
[9] Rijkers G T , Justement L R, Griffeoen A W, and J. C. Cambier Cytometry, 1990,11: 923.
收稿日期:1998-07-06, 百拇医药
单位:马晓冬 赵 清 张 瑾 张 飒 雷国华 黄行许 鲍永耀(第一军医大学 中心实验室);朱晓亮 (南方医院皮肤科, 广东广州 510515)
关键词:激光扫描共聚焦显微镜;Fluo-3/AM;FuraRed ;比率钙
中国医学物理学杂志990320 摘要:应用ACAS570激光扫描共聚焦显微镜(laser scanning confocal microscope,LSCM简称共焦显微镜)和钙离子指示剂Fluo-3/AM 、FuraRed荧光探剂双标记技术,测定了单个活细胞内比率钙的动态变化。结果显示37 ℃, Fluo-3/AM浓度10 μmol/L,FuraRed浓度10 μmol/L的条件下,昆明小鼠巨噬细胞负载1 h左右即可获良好的标记效果。用比率探针测量细胞内Ca2+的动态变化,使Ca2+的定性定量测定不受染料浓度、细胞大小、照射光强度以及一定程度的光漂白和染料泄漏等因素的影响,提供了一种准确定性定量细胞内Ca2+的实时、动态、原位变化的新方法。
, 百拇医药
中图分类号:Q74 文献标识码:A 文章编号:1005-202X(1999)03-0180-03
Ratiometric calcium measurements in single cells with visible wavelength probes fluo-3/AM and furared
MA Xiao-donget al.
First Military Medical University,Central Laboratory,,ZHU Xiao-liang
Department of Dermatology of Nanfang Hospital , Guangzhou 510515,China
Abstract:Using laser scanning confocal microscope(LSCM)and highly sensitive Ca2+ fluorescent dye, Fluo-3/AM and FuraRed, we measureed the kinetic changes of ratiometric calcium in single intact living cells. The results showed, incubated for 1h at 37℃ with 10 μmol/L Fluo-3/AM and 10 μmol/L FuraRed, the murine peritoneal macrophages cultured on gass cover slips were manifested excellent LSCM imaging of intracellular Ca2+. The use of ratiometric probes can be qualified and quantified intracellular Ca2+ more accurately, since it allows calcium quantitation independent of dye concentration, cell volume, illumination intensity, and reduces the effect of photobleaching and dye leakage. The results indicated that, by using laser scanning confocal microscope and sensitive Ca2+ fluorescent dye, Flul-3/AM and FuraRed,provided a exactly new method for real time、continuous and in situ detection of kinetic variations in intracellular Ca2+.
, 百拇医药
Key words:laser scanning confocal microscope ; fluo-3/AM; furared; ratiometric calcium.
细胞内游离Ca2+不仅作为一种重要的第二信使广泛参与细胞的运动、分泌、代谢和分化等多种细胞功能活动的调节[1];而且胞内游离Ca2+浓度的变化与调控对于参与维持存在于细胞质膜或细胞器膜两侧的跨膜Ca2+梯差,介导细胞对外界刺激的应答反应具有重要的调节作用[2-4]。因此,在完整细胞上准确测定胞内游离Ca2+浓度的动态变化,其重要性是显而易见的。本文利用ACAS570激光扫描共聚焦显微镜(laser scanning confocal microscope,LSCM),采用单激发单发射指示剂Fluo-3/AM和FuraRed双标记法测定了外源性刺激剂地塞米松诱导胞浆游离Ca2+的动态变化,获得了良好的测定效果。
, 百拇医药
1 材料与方法
1.1 材料
(1)试剂:①地塞米松,用不含Ca2+、Mg2+的PBS缓冲液配制,RPMI1640培养基(Gibco, 德国),小牛血清(Gibco,德国)。②Fluo-3/AM 、FuraRed(Molecular Probes Inc,USA)用二甲基亚砜配成1 mmol/L,置于-20℃冰箱保存,PluronicF-127(Sigma,USA)。③不含Ca2+、Mg2+的PBS缓冲液(g/L): 8.01 gNaCl、Na2HPO4.12H2O、0.23 g NaH2PO4.2H2O。④Hepes缓冲液。⑤昆明种雄性小鼠(第一军医大学动物所提供)腹腔巨噬细胞培养。
, http://www.100md.com
(2)仪器:ACAS570激光扫描共聚焦显微镜(Meridian,USA)
1.2 方法
(1)巨噬细胞培养
18~20 g雄性昆明小鼠,按1次/天,1 ml/次连续三天腹腔注射1%巯基乙醇酸钠,停一天,按鄂征等人的方法取腹腔巨噬细胞(台酚兰吞噬实验显示99%为巨噬细胞),以1×106个/ml接种于特制的Petri培养皿(Meridian,USA),用含10%小牛血清的RPMI-1640培养于37℃,含5%CO2孵箱内。2 d后即可进行实验。
(2)荧光探针标记
将培养2 d的小鼠腹腔巨噬细胞用Hepes缓冲液漂洗3次,滴入终浓度为10 μmol/L的Fluo-3/AM 和FuraRed,加入1 μl 25% pluronic F-127,在37 ℃、5%CO2孵箱中孵育1 h,其间轻轻振荡几次,经Hepes缓冲液漂洗2次后,再滴入Hepes液0.5 ml。
, 百拇医药
(3)Ca2+动态变化的LSCM测定
LSCM由共聚焦显微镜主体,激光器(Ar+激光)和微型计算机构成。激光束的扫描与控制以及图像数据的采集和加工均由计算机完成。将标记好荧光探剂Fluo-3/AM和FuraRed的小鼠腹腔巨噬细胞,放入激光扫描共聚焦显微镜测定小室,用装有Olympus
IMT-2倒置相差显微镜和40×物镜ACAS570激光扫描共聚焦显微镜系统扫描成像。用488 nm氩离子激光同时激发两种染料,用ACAS570多彩色滤光盘(Molti-Color Filter Wheel)提供的530/30 nm带通滤光器和605 nm长通滤光器将两者的发射光分开,用有增辉电路的DageCCD摄像机,以1.0秒的间隔记录。数据通过图像采集器直接送入计算机,然后用ACAS570-IQ分析软件分析。
2 结果
, 百拇医药
(1)用外源性刺激剂地塞米松测得巨噬细胞中Fluo-3和FuraRed对细胞内Ca2+的荧光强度变化曲线。在本实验中,将地塞米松(终浓度为1.5μM)加到巨噬细胞培养液中(100sec后),引起细胞内Ca2+迅速增加,随后逐渐达到平台。两种染料的荧光强度动态变化曲线清楚的表明,加地塞米松时(100sec)引发Fluo-3荧光急剧增强,同时伴有FuraRed荧光减弱,提示Ca2+增加(图1)。在加地塞米松前和Ca2+反应的峰值时,两种染料的相对荧光强度以灰度图表示(图2)。

图1 地塞米松刺激后,小鼠腹腔巨噬细胞负载Fluo-3/AM和FuraRed的荧光强度变化曲线检测器1(Det1)Fluo-3/AM通过530/30nm带能滤光器后单激发的荧光强度变化曲线检测器2(Det2) FuraRed 通过605 nm长通滤光器后单激发的荧光强度变化曲线

, 百拇医药
(上图)

(下图)
图2 地塞米松处理前,小鼠腹腔巨噬细胞负载Fluo-3/AM、FuraRed的荧光灰度图像(上图)和处理后小鼠腹腔巨噬细胞负载Fluo-3/AM、FuraRed的荧光灰度图像(下图)。检测器1(Detector1)表示负载Fluo-3/AM。检测器2(Detector2)表示负载FuraRed。
(2)为了定量荧光变化,按实验中每个时间点求得Fluo-3/AM探针发射强度与FuraRed探针发射强度的比率。巨噬细胞对地塞米松反应的动态变化曲线表明,荧光比率迅速增加1.2倍,随后逐渐达到饱和状态(图3)。

, 百拇医药 图3 地塞米松处理后,小鼠腹腔巨噬细胞负载
Fluo-3/AM、FuraRed的比率荧光动态变化曲线
3 讨论
(1)在比率法中用两种染料同时标记,需要其比率在细胞内Ca2+浓度不变时保持稳定。两种染料的泄漏、区域化分布、漂白或代谢等均能导致实验过程中比率不稳定。Fluo-3/AM和FuraRed都对光漂白敏感,对经过10 μmol/LFluo-3/AM和10 μmol/LFuraRed孵育的巨噬细胞连续扫描,在本实验中地塞米松处理之前两种染料荧光强度的基线值(图1)及其比率荧光强度的基线值(图3)都是稳定的。这些结果表明:巨噬细胞中染料无预先发生的光漂白或泄漏;Fluo-3/AM和FuraRed用在比率法中是可行的。
(2)FuraRed是近年来研制的一种独特的Ca2+指示剂,发射640nm波长的荧光,荧光强度随FuraRed与Ca2+结合的增加而减弱[5,6]。相反Fluo-3发射530nm较短波长的荧光,荧光强度随Fluo-3/AM与Ca2+结合的增加而增强[7,8]。据此提供了一种定量细胞内Ca2+可见光激发的比率方法:将Fluo-3/AM和FuraRed联合使用,用488nm的可见光(激光)激发,来测定细胞内比率Ca2+的实时、动态变化。由于这两种染料与Ca2+结合发出的荧光量呈相反的变化,所以增加了对Ca2+检测的灵敏度。
, http://www.100md.com
(3)Fluo-3/AM和FuraRed都是很好的Ca2+指示剂。联合使用两种指示剂,用单一可见光激发能为用比率法测量细胞内比率Ca2+提供一种独特的有价值的方法。类似的比率测定法还有很多,如用两种染料同时测量Ca2+和pH[5,9]。但这些方法需要两种不同的荧光探针,而且须特别注意染料负载、光漂白和染料泄漏,每一种因素在各次实验之间可能明显地影响比率。使用Fluo-3/AM和FuraRed能提供一种Ca2+测量方法并具有可见光激发的优点。
参考文献:
[1] Capham D E. Cell, 1995,80: 259 .
[2] Yang F Y, Tu Y P. Biochem Biophys Res Commun, 1991,175: 366.
, http://www.100md.com
[3] Fan G F, Huang Y G, Bai Y H, et al. FEBS Lett, 1995,357: 13.
[4] Yang X Y, Fan G F, Huang Y G, et al. Chin Sci Bull, 1996; 41: 338.
[5] Haugland R P. (1992) Molecular probes Catalog.
[6] Durebayashi N, Harkins A B, and Baylor S M. Biophysical J, 1992, 61: A160.
[7] Minta A, Kao J P Y, and Tsien R Y. Biol Chem, 1989,264: 8171.
[8] Kao J P Y, Harootunian A T, and Tsien R Y. Biol Chem, 1989,264: 817.
[9] Rijkers G T , Justement L R, Griffeoen A W, and J. C. Cambier Cytometry, 1990,11: 923.
收稿日期:1998-07-06, 百拇医药