猪繁殖和呼吸综合征病毒膜蛋白和核衣壳蛋白基因在大肠杆菌中的表达
作者:蔡家利** 蔡宝祥 姜 平
单位:蔡家利 西南农业大学动物养殖学院,重庆 400716;蔡宝祥 姜 平 南京农业大学动物医学院,南京 210095
关键词:猪繁殖和呼吸综合征病毒;质粒pBV220;表达;M蛋白;N蛋白
中国病毒学/990309 摘 要 以PRRSV弱毒株膜蛋白(M)和核衣壳(N)蛋白基因为模板,设计的一对含有EcoRI和BamHI酶切位点的引物,通过RT-PCR扩增出一约900 bp的MN基因片段,将此基因片段成功克隆于高效表达载体pBV220,构建成重组质粒pBVMN,导入大肠杆菌DH5α,经温敏诱导,成功地表达了MN基因。表达产物经SDS-PAGE电泳和Western blot印迹分析,其分子量约34 kD,与兔抗PRRSV高免血清发生反应,经光密度扫描分析,表达产物量占菌体总蛋白的12%。该研究为PRRS基因诊断抗原的研制奠定了基础。
, 百拇医药
Expression of the M and N Protein Gene of Porcine Reproductive
and Respiratory Syndrome Virus in E.coli
Cai Jiali2 Cai Baoxiang1 Jiang Pin1
(Animal Medical College, Nanjiang Agricultural University, Nanjiang 210095)
Abstract The primers for RT-PCR were designed on the basis of M and N gene sequence of PRRSV. A gene fragment about 900 bp, which has digestion sites of EcoRI and BamHI, was amplified by RT-PCR. The M and N gene were cloned into expression vector pBV220 and one recombinant PBVMN was constructed which highly expressed a 34 kD protein in E. coli DH5α. The expressed product was identified by SDS-PAGE and Western blotting, which occupies 12% of total bacterial protein. The report has laid a basis for the development of molecular diagnostic antigen of PRRSV.
, 百拇医药
Key words Porcine reproductive and respiratory syndrome virus(PRRSV), pBV220, Expression, M protein, N protein
猪繁殖和呼吸综合征(PRRS)是新发现的一种动物传染病[1,2],其病原PRRSV现归为动脉炎病毒科[3]。PRRSV为正链单股RNA病毒,基因组总长为15 kb,有8个开放阅读框,PRRSV的M蛋白和N蛋白基因分别位于ORF6和ORF7,有8 bp叠合相连,是较保守的基因序列[4],相关的结构蛋白在诊断上有重要意义。pBV220是一个带有双强启动子的表达载体,M和N蛋白基因在pBV220中表达未见报道。本研究拟将M和N基因插入pBV220,探讨MN基因在pBV220中的表达作用,为PRRS基因诊断抗原的研制奠定基础。
1 材料和方法
, http://www.100md.com
1.1 毒株和细胞 PRRS弱毒株,美国引进;MARC-145细胞,南京动植物检疫局馈赠。
1.2 载体和宿主菌 pBV220、DH5α由南京农业大学生物技术发展中心保存。
1.3 酶及化学试剂 RT-PCR试剂盒,Promerga公司产品;犊牛血清、EcoRI、BamHI内切酶、Taq DNA聚合酶、T4DNA连接酶、溶菌酶、HRPO-羊抗兔IgG结合物均为华美生物工程公司产品;DMEM培养基,美国产;其它化学试剂均为国产分析纯或电泳级试剂。
1.4 引物的设计与合成 根据PRRSV的基因序列和pBV220的酶切图谱,通过DNA同源性、酶切位点、ORF及模拟表达分析,设计了一对能够合成MN蛋白基因及含有EcoRI和BamHI酶切位点的PCR引物,上游引物(P1)序列为5′CCG AAT TCC AGA GTT TCA GCG G3′,下游引物为5′TGG GAT CCA CCA CGC ATT CTT C3′。
, http://www.100md.com
1.5 MARC-145细胞培养和PRRSV的制备 参考Kim HS介绍方法[5],MARC-145细胞培养选用DMEM培养基,含10%犊牛血清,100 u/mL的青霉素和链霉素,长成单层后接种1∶10稀释的PRRS弱毒,37 ℃培养72 h,出现显著的CPE后收获。经三次冻融处理,8 000 r/min离心15 min,取上清,45 000 r/min离心2 h,用原体积1/20的TE缓冲液(10 mmol/L Tris-HCl pH 8.0, 1.0 mmol/L EDTA)稀释沉淀,-20 ℃保存备用。
1.6 病毒RNA的制备 按侯云德介绍方法进行[6]。
1.7 PRRSV高免血清制备 将纯化的PRRSV制成油乳剂。油相用10号白油、司本80、硬脂酸铝。水相将纯化的PRRSV加2%的吐温80。油相和水相按比例混合后乳化成油包水乳剂。选择健康成年公兔2只,间隔一周免疫一次,共免疫4次,初次免疫用0.5 mL/只,以后每次递增0.5 mL/只。作分点肌肉或皮下注射。第4次免疫后10 d颈动脉放血分离血清。琼脂扩散试验测定血清效价,备用。
, 百拇医药
1.8 pBVMN表达质粒的构建 以PRRSV RNA为模板,参照Promega的RT-system操作说明进行反转录合成cDNA。再以cDNA为模板,作PCR反应,94 ℃变性1 min,55 ℃复性1 min,72 ℃延伸1 min。pBV220质粒制备按常规方法[7],扩增出的MN蛋白基因片段和pBV220质粒分别经EcoRI和BamHI酶切,然后进行连接反应,构建成重组质粒pBVMN,转化入大肠杆菌DH5α。
1.9 MN蛋白的表达及鉴定 酶切分析鉴定pBVMN,筛选出的阳性克隆进行温敏诱导表达。重组质粒菌经30℃活化,1∶100稀释到LB培养基,30 ℃摇床增殖,待浓度达到OD600=0.2~0.4时,迅速升温至42 ℃继续摇振培养4~6 h。取表达菌液1.5 mL 8 000 r/min离心5 min,去上清,用0.05 mol/L pH 7.2 PBS 100 μL稀释沉淀,加入溶菌酶使含量为500 μg/mL,37 ℃ 1 h,冻融三次,15 000 r/min 10 min,弃上清。沉淀用变性液稀释(8 mol/L尿素,50 mmol/L β-巯基乙醇,pH 7.5 0.1 mol/L PBS)。加等量2倍蛋白载样液,沸水浴煮沸10 min后上样进行SDS-PAGE电脉[7]。分离胶用12%,积层胶用5%,80V电泳1 h,150 V电泳3 h,考马斯亮蓝染色。用光密度扫描仪对表达量进行估算。同时用未染色的分离胶作Western-blot[7],对表达蛋白作进一步鉴定。
, http://www.100md.com
Western-blot采取半干转移,用转移电脉仪DYⅢ7B型(北京六一仪器厂),半干转移电泳槽(Semi-dry transfer cell, U.S.A)进行转移,硝酸纤维素膜为Boeheringer Mannheim公司产品,电压5V,电流1 mA/cm2,转移1.5 h,转移后,加2%BSA pH7.5 PBS封闭37 ℃ 2 h,加1∶100兔抗PRRSV高免血清,4 ℃过夜,37 ℃ 1 h,0.02%吐温 80 pH 7.4 PBS漂洗2次加羊抗兔HRP酶标抗体37 ℃ 1 h,漂洗2次,加DAB染色。
2 结果
2.1 RT-PCR扩增产物及其重组质粒的鉴定 经RT-PCR扩增出的MN基因片段约为900 bp(图1),与试验设计相同。重组质粒pBVMN经限制性酶消化鉴定获得的DNA片段与扩增产物大小一致(图2),初步证明为MN蛋白基因。序列分析证实所克隆的基因片段阅读框架与报道一致[8](另文报道)。
, http://www.100md.com
图1 RT-PCR产物的1.5%琼脂糖凝胶电泳分析
1-3.MN cDNA片段;4.λDNA EcoRI/Hind Ⅲ Markers.
Fig.1 Ethidium bromide-stained 1.5% gel showing RT-PCR Product.
Lane 1-3. MN cDNA fragment; Lane 4. λDNA EcoRI/HindⅢ Markers.
图2 pBVMN重组质粒EcoRI/BamHI酶切鉴定
1.pBV220质粒. 2-4.EcoRI和BamHI消化的重组质粒,4为克隆筛选的阳性质粒,5λDNA EcoRI/HIndⅢ Markers
, http://www.100md.com
Fig.2 Identification of the recombinant plasmid PBVMN with digestion of EcoRI and BamHI, Lane1. pBV220 plasmid; Lane 2 to 4 recombinant plasmids digested by EcoRI and BamHI. Lane 4. cloned pBVMN plasmid digested by EcoRI and BamHI. Lane 5. λDNA EcoRI/HindⅢ Markers.
2.2 SDS-PAGE和免疫印迹 重组质粒pBVMN在PRPL双强启动子控制下进行温控表达,表达产物经SDS-PAGE电泳和考马斯亮蓝染色分析,显示一条约34 kD大小的表达蛋白染色带(图3),与试验设计相同。经Western-blot免疫印迹分析,该蛋白带与兔抗PRRSV高免血清反应,而与pBV220质粒菌体裂解液不发生反应(图4)。对染色凝胶进行光密度扫描,表明表达蛋白约占整个菌体的12%。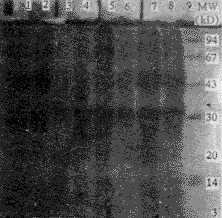
, 百拇医药
图3 pBVMN表达产物的SDS-PAGE电泳分析
1-2. pBV220;3. pBVMN诱导前;4-8 pBVMN诱导后;9.蛋白分子量标准
Fig.3 Analysis of pBVMN expression products by SDS-PAGE
Lane 1-2 pBV220;Lane 3.uninduced pBVMN;Lane 4-8.induced pBVMN;Lane 9.Markers of protein molecular weight
图4 pBVMN阳性克隆表达产物的Western-blot分析
1.pBV220;2.诱导前的pBVMN;3.诱导后的pBVMN.
, http://www.100md.com
Fig.4 Immunoblotting analysis of expression products of pBVMN recombinant plasmid
Lane 1. pBV220, Lane2. uninduced pBVMN; Lane 3. induced pBVMN.
3 讨论
PRRSV根据基因结构的不同划分为美洲型和欧洲型。M和N基因是PRRSV中较保守的片段[4],各种分子生物学诊断方法都缘于这段基因[9,10],克隆这两种蛋白的基因进行表达是研究的热点。M和N蛋白属非糖基化蛋白,分子量分别为19 kD和15 kD。这两种蛋白基因已分别克隆于杆状病毒载体进行表达,并用于诊断[11]。本研究是将M和N蛋白基因同时克隆于原核表达载体pBV220,一方面简化操作,另一方面力图提高表达产物在诊断中的敏感度,同时也为今后基因分段剪切克隆、表达、诊断等创造良好条件。结果与设计相符,展示出良好的应用前景。
, 百拇医药
M和N蛋白是PRRSV的两种表面结构蛋白,与其它结构蛋白相比,在诊断和基因分型上有更重要的意义。现已研制出相应的单克隆抗体[12]。M和N基因重组于pBV220进行表达尚未见报道。pBV220是我国学者构建的一种高效表达载体,含有双强启动子PRPL和多克隆位点,已有多种外源基因在pBV220中得到高效表达[13],表达产物量多在10%~20%。本研究选择了常用的内切酶EcoRI和BamHI酶切位点,成功地克隆进MN基因,表达产物与兔抗PRRSV高免血清发生反应,论证了MN蛋白具有较强的免疫原性,需要进一步探讨表达产物的纯化及诊断上的应用。
pBV220载体适应的宿主菌较多,有必要进一步筛选适宜于MN蛋白表达的宿主菌,提高表达产物量,为诊断抗原的研制应用等奠定基础。
参考文献
1 郭宝清,陈章水,刘文兴等.从疑似PRRS流产胎儿分离猪生殖和呼吸综合征病毒(PRRSV)的研究.中国畜禽传染病,1996(2):1~3
, 百拇医药
2 姜平,陈溥言,蔡宝祥等.我国猪繁殖和呼吸综合征流行病学调查及病毒分离.南京农业大学学报,1996(3):118
3 Conzelman KK, Visser N, Van Woensel PV et al. Molecular characterization of porcine reprductive and respiratory syndrome virus, a member of the Arterivirus gruop. Virology, 1993, 193:329~339
4 Meng XJ, Paul PS, Halbour PG et al. Phylogenetic analyses of the putative N (ORF6) and N (ORF7) genes of porcine reproductine and respiratory syndrome virus (PRRSV): implication for the existence of two genotypes of PRRSV in the USA and Europe. Arch Virol, 1995, 140:745~755
, http://www.100md.com
5 Kim HS, Kwang J, Yoon IJ et al. Enhanced replication of porcine reproductive and respiratory syndrome (PRRS) virus in a homogeneous subpopulation of MA-104 cell line. Arch virol, 1993, 133:477~483
6 侯云德,杨崇泰,吴淑华等.病毒基因工程的原理与方法.第一版.北京:人民卫生出版社.1985.73~79
7 萨母布鲁克E,弗里奇EF, 曼尼阿蒂斯T等著,金冬雁,黎孟枫,候云德等译校.分子克隆实验指南.第二版.北京:科学出版社, 1992.19~23, 880~897
8 Mardassi H, Mounir S, Dea S et al. Molecular analysis of the ORFs 3 to 7 of porcine reproductive and respiratory virus, Quebec reference strain. Arch Virol, 1995, 40:1045~1418
, 百拇医药
9 Renee larochelle, Maradassi H, Dea S. Detection of porcine reproduction and respiratory syndrome virus in cell cultures and formalin-fixed tissues by in situ hybridization using a digoxigenin-labeled probe. J Vet Diagn Invest, 1996,8:3~10
10 Suarez P, Zardoya R, Prieto C et al. Direct detection of the porcine reproductive and respiratory syndrome (PRRS) vius by reverse polymerase chain reaction (RT-PCR). Arch Virol, 1994, 135:89~99
, 百拇医药
11 Nieuwstadt APV, Meulenberg JJM, Essen-Zanbergen AV et al. Proteins encoded by open reading frames 3 and 4 of the genome of Lelystad virus (Arterivi ridae) are structural proteins of the virion. J Virol, 1996, 70:4767~4772
12 Wieczorek-krohmer M, Weiland F, Conzelmann K et al. Porcine reproductive and respiratory syndrome virus (PRRSV) monoclonal antibodies detect common epitopes on two viral proteins of European and U.S. isolates. Veterinary Microbiology, 1996, 51:257~266
13 张智清,姚立红,候云德.含PRRL启动子的原核高效表达载体的组建及其应用.病毒学报,1990,6(2):111~116, 百拇医药(蔡家利** 蔡宝祥 姜 平)
单位:蔡家利 西南农业大学动物养殖学院,重庆 400716;蔡宝祥 姜 平 南京农业大学动物医学院,南京 210095
关键词:猪繁殖和呼吸综合征病毒;质粒pBV220;表达;M蛋白;N蛋白
中国病毒学/990309 摘 要 以PRRSV弱毒株膜蛋白(M)和核衣壳(N)蛋白基因为模板,设计的一对含有EcoRI和BamHI酶切位点的引物,通过RT-PCR扩增出一约900 bp的MN基因片段,将此基因片段成功克隆于高效表达载体pBV220,构建成重组质粒pBVMN,导入大肠杆菌DH5α,经温敏诱导,成功地表达了MN基因。表达产物经SDS-PAGE电泳和Western blot印迹分析,其分子量约34 kD,与兔抗PRRSV高免血清发生反应,经光密度扫描分析,表达产物量占菌体总蛋白的12%。该研究为PRRS基因诊断抗原的研制奠定了基础。
, 百拇医药
Expression of the M and N Protein Gene of Porcine Reproductive
and Respiratory Syndrome Virus in E.coli
Cai Jiali2 Cai Baoxiang1 Jiang Pin1
(Animal Medical College, Nanjiang Agricultural University, Nanjiang 210095)
Abstract The primers for RT-PCR were designed on the basis of M and N gene sequence of PRRSV. A gene fragment about 900 bp, which has digestion sites of EcoRI and BamHI, was amplified by RT-PCR. The M and N gene were cloned into expression vector pBV220 and one recombinant PBVMN was constructed which highly expressed a 34 kD protein in E. coli DH5α. The expressed product was identified by SDS-PAGE and Western blotting, which occupies 12% of total bacterial protein. The report has laid a basis for the development of molecular diagnostic antigen of PRRSV.
, 百拇医药
Key words Porcine reproductive and respiratory syndrome virus(PRRSV), pBV220, Expression, M protein, N protein
猪繁殖和呼吸综合征(PRRS)是新发现的一种动物传染病[1,2],其病原PRRSV现归为动脉炎病毒科[3]。PRRSV为正链单股RNA病毒,基因组总长为15 kb,有8个开放阅读框,PRRSV的M蛋白和N蛋白基因分别位于ORF6和ORF7,有8 bp叠合相连,是较保守的基因序列[4],相关的结构蛋白在诊断上有重要意义。pBV220是一个带有双强启动子的表达载体,M和N蛋白基因在pBV220中表达未见报道。本研究拟将M和N基因插入pBV220,探讨MN基因在pBV220中的表达作用,为PRRS基因诊断抗原的研制奠定基础。
1 材料和方法
, http://www.100md.com
1.1 毒株和细胞 PRRS弱毒株,美国引进;MARC-145细胞,南京动植物检疫局馈赠。
1.2 载体和宿主菌 pBV220、DH5α由南京农业大学生物技术发展中心保存。
1.3 酶及化学试剂 RT-PCR试剂盒,Promerga公司产品;犊牛血清、EcoRI、BamHI内切酶、Taq DNA聚合酶、T4DNA连接酶、溶菌酶、HRPO-羊抗兔IgG结合物均为华美生物工程公司产品;DMEM培养基,美国产;其它化学试剂均为国产分析纯或电泳级试剂。
1.4 引物的设计与合成 根据PRRSV的基因序列和pBV220的酶切图谱,通过DNA同源性、酶切位点、ORF及模拟表达分析,设计了一对能够合成MN蛋白基因及含有EcoRI和BamHI酶切位点的PCR引物,上游引物(P1)序列为5′CCG AAT TCC AGA GTT TCA GCG G3′,下游引物为5′TGG GAT CCA CCA CGC ATT CTT C3′。
, http://www.100md.com
1.5 MARC-145细胞培养和PRRSV的制备 参考Kim HS介绍方法[5],MARC-145细胞培养选用DMEM培养基,含10%犊牛血清,100 u/mL的青霉素和链霉素,长成单层后接种1∶10稀释的PRRS弱毒,37 ℃培养72 h,出现显著的CPE后收获。经三次冻融处理,8 000 r/min离心15 min,取上清,45 000 r/min离心2 h,用原体积1/20的TE缓冲液(10 mmol/L Tris-HCl pH 8.0, 1.0 mmol/L EDTA)稀释沉淀,-20 ℃保存备用。
1.6 病毒RNA的制备 按侯云德介绍方法进行[6]。
1.7 PRRSV高免血清制备 将纯化的PRRSV制成油乳剂。油相用10号白油、司本80、硬脂酸铝。水相将纯化的PRRSV加2%的吐温80。油相和水相按比例混合后乳化成油包水乳剂。选择健康成年公兔2只,间隔一周免疫一次,共免疫4次,初次免疫用0.5 mL/只,以后每次递增0.5 mL/只。作分点肌肉或皮下注射。第4次免疫后10 d颈动脉放血分离血清。琼脂扩散试验测定血清效价,备用。
, 百拇医药
1.8 pBVMN表达质粒的构建 以PRRSV RNA为模板,参照Promega的RT-system操作说明进行反转录合成cDNA。再以cDNA为模板,作PCR反应,94 ℃变性1 min,55 ℃复性1 min,72 ℃延伸1 min。pBV220质粒制备按常规方法[7],扩增出的MN蛋白基因片段和pBV220质粒分别经EcoRI和BamHI酶切,然后进行连接反应,构建成重组质粒pBVMN,转化入大肠杆菌DH5α。
1.9 MN蛋白的表达及鉴定 酶切分析鉴定pBVMN,筛选出的阳性克隆进行温敏诱导表达。重组质粒菌经30℃活化,1∶100稀释到LB培养基,30 ℃摇床增殖,待浓度达到OD600=0.2~0.4时,迅速升温至42 ℃继续摇振培养4~6 h。取表达菌液1.5 mL 8 000 r/min离心5 min,去上清,用0.05 mol/L pH 7.2 PBS 100 μL稀释沉淀,加入溶菌酶使含量为500 μg/mL,37 ℃ 1 h,冻融三次,15 000 r/min 10 min,弃上清。沉淀用变性液稀释(8 mol/L尿素,50 mmol/L β-巯基乙醇,pH 7.5 0.1 mol/L PBS)。加等量2倍蛋白载样液,沸水浴煮沸10 min后上样进行SDS-PAGE电脉[7]。分离胶用12%,积层胶用5%,80V电泳1 h,150 V电泳3 h,考马斯亮蓝染色。用光密度扫描仪对表达量进行估算。同时用未染色的分离胶作Western-blot[7],对表达蛋白作进一步鉴定。
, http://www.100md.com
Western-blot采取半干转移,用转移电脉仪DYⅢ7B型(北京六一仪器厂),半干转移电泳槽(Semi-dry transfer cell, U.S.A)进行转移,硝酸纤维素膜为Boeheringer Mannheim公司产品,电压5V,电流1 mA/cm2,转移1.5 h,转移后,加2%BSA pH7.5 PBS封闭37 ℃ 2 h,加1∶100兔抗PRRSV高免血清,4 ℃过夜,37 ℃ 1 h,0.02%吐温 80 pH 7.4 PBS漂洗2次加羊抗兔HRP酶标抗体37 ℃ 1 h,漂洗2次,加DAB染色。
2 结果
2.1 RT-PCR扩增产物及其重组质粒的鉴定 经RT-PCR扩增出的MN基因片段约为900 bp(图1),与试验设计相同。重组质粒pBVMN经限制性酶消化鉴定获得的DNA片段与扩增产物大小一致(图2),初步证明为MN蛋白基因。序列分析证实所克隆的基因片段阅读框架与报道一致[8](另文报道)。

, http://www.100md.com
图1 RT-PCR产物的1.5%琼脂糖凝胶电泳分析
1-3.MN cDNA片段;4.λDNA EcoRI/Hind Ⅲ Markers.
Fig.1 Ethidium bromide-stained 1.5% gel showing RT-PCR Product.
Lane 1-3. MN cDNA fragment; Lane 4. λDNA EcoRI/HindⅢ Markers.

图2 pBVMN重组质粒EcoRI/BamHI酶切鉴定
1.pBV220质粒. 2-4.EcoRI和BamHI消化的重组质粒,4为克隆筛选的阳性质粒,5λDNA EcoRI/HIndⅢ Markers
, http://www.100md.com
Fig.2 Identification of the recombinant plasmid PBVMN with digestion of EcoRI and BamHI, Lane1. pBV220 plasmid; Lane 2 to 4 recombinant plasmids digested by EcoRI and BamHI. Lane 4. cloned pBVMN plasmid digested by EcoRI and BamHI. Lane 5. λDNA EcoRI/HindⅢ Markers.
2.2 SDS-PAGE和免疫印迹 重组质粒pBVMN在PRPL双强启动子控制下进行温控表达,表达产物经SDS-PAGE电泳和考马斯亮蓝染色分析,显示一条约34 kD大小的表达蛋白染色带(图3),与试验设计相同。经Western-blot免疫印迹分析,该蛋白带与兔抗PRRSV高免血清反应,而与pBV220质粒菌体裂解液不发生反应(图4)。对染色凝胶进行光密度扫描,表明表达蛋白约占整个菌体的12%。

, 百拇医药
图3 pBVMN表达产物的SDS-PAGE电泳分析
1-2. pBV220;3. pBVMN诱导前;4-8 pBVMN诱导后;9.蛋白分子量标准
Fig.3 Analysis of pBVMN expression products by SDS-PAGE
Lane 1-2 pBV220;Lane 3.uninduced pBVMN;Lane 4-8.induced pBVMN;Lane 9.Markers of protein molecular weight

图4 pBVMN阳性克隆表达产物的Western-blot分析
1.pBV220;2.诱导前的pBVMN;3.诱导后的pBVMN.
, http://www.100md.com
Fig.4 Immunoblotting analysis of expression products of pBVMN recombinant plasmid
Lane 1. pBV220, Lane2. uninduced pBVMN; Lane 3. induced pBVMN.
3 讨论
PRRSV根据基因结构的不同划分为美洲型和欧洲型。M和N基因是PRRSV中较保守的片段[4],各种分子生物学诊断方法都缘于这段基因[9,10],克隆这两种蛋白的基因进行表达是研究的热点。M和N蛋白属非糖基化蛋白,分子量分别为19 kD和15 kD。这两种蛋白基因已分别克隆于杆状病毒载体进行表达,并用于诊断[11]。本研究是将M和N蛋白基因同时克隆于原核表达载体pBV220,一方面简化操作,另一方面力图提高表达产物在诊断中的敏感度,同时也为今后基因分段剪切克隆、表达、诊断等创造良好条件。结果与设计相符,展示出良好的应用前景。
, 百拇医药
M和N蛋白是PRRSV的两种表面结构蛋白,与其它结构蛋白相比,在诊断和基因分型上有更重要的意义。现已研制出相应的单克隆抗体[12]。M和N基因重组于pBV220进行表达尚未见报道。pBV220是我国学者构建的一种高效表达载体,含有双强启动子PRPL和多克隆位点,已有多种外源基因在pBV220中得到高效表达[13],表达产物量多在10%~20%。本研究选择了常用的内切酶EcoRI和BamHI酶切位点,成功地克隆进MN基因,表达产物与兔抗PRRSV高免血清发生反应,论证了MN蛋白具有较强的免疫原性,需要进一步探讨表达产物的纯化及诊断上的应用。
pBV220载体适应的宿主菌较多,有必要进一步筛选适宜于MN蛋白表达的宿主菌,提高表达产物量,为诊断抗原的研制应用等奠定基础。
参考文献
1 郭宝清,陈章水,刘文兴等.从疑似PRRS流产胎儿分离猪生殖和呼吸综合征病毒(PRRSV)的研究.中国畜禽传染病,1996(2):1~3
, 百拇医药
2 姜平,陈溥言,蔡宝祥等.我国猪繁殖和呼吸综合征流行病学调查及病毒分离.南京农业大学学报,1996(3):118
3 Conzelman KK, Visser N, Van Woensel PV et al. Molecular characterization of porcine reprductive and respiratory syndrome virus, a member of the Arterivirus gruop. Virology, 1993, 193:329~339
4 Meng XJ, Paul PS, Halbour PG et al. Phylogenetic analyses of the putative N (ORF6) and N (ORF7) genes of porcine reproductine and respiratory syndrome virus (PRRSV): implication for the existence of two genotypes of PRRSV in the USA and Europe. Arch Virol, 1995, 140:745~755
, http://www.100md.com
5 Kim HS, Kwang J, Yoon IJ et al. Enhanced replication of porcine reproductive and respiratory syndrome (PRRS) virus in a homogeneous subpopulation of MA-104 cell line. Arch virol, 1993, 133:477~483
6 侯云德,杨崇泰,吴淑华等.病毒基因工程的原理与方法.第一版.北京:人民卫生出版社.1985.73~79
7 萨母布鲁克E,弗里奇EF, 曼尼阿蒂斯T等著,金冬雁,黎孟枫,候云德等译校.分子克隆实验指南.第二版.北京:科学出版社, 1992.19~23, 880~897
8 Mardassi H, Mounir S, Dea S et al. Molecular analysis of the ORFs 3 to 7 of porcine reproductive and respiratory virus, Quebec reference strain. Arch Virol, 1995, 40:1045~1418
, 百拇医药
9 Renee larochelle, Maradassi H, Dea S. Detection of porcine reproduction and respiratory syndrome virus in cell cultures and formalin-fixed tissues by in situ hybridization using a digoxigenin-labeled probe. J Vet Diagn Invest, 1996,8:3~10
10 Suarez P, Zardoya R, Prieto C et al. Direct detection of the porcine reproductive and respiratory syndrome (PRRS) vius by reverse polymerase chain reaction (RT-PCR). Arch Virol, 1994, 135:89~99
, 百拇医药
11 Nieuwstadt APV, Meulenberg JJM, Essen-Zanbergen AV et al. Proteins encoded by open reading frames 3 and 4 of the genome of Lelystad virus (Arterivi ridae) are structural proteins of the virion. J Virol, 1996, 70:4767~4772
12 Wieczorek-krohmer M, Weiland F, Conzelmann K et al. Porcine reproductive and respiratory syndrome virus (PRRSV) monoclonal antibodies detect common epitopes on two viral proteins of European and U.S. isolates. Veterinary Microbiology, 1996, 51:257~266
13 张智清,姚立红,候云德.含PRRL启动子的原核高效表达载体的组建及其应用.病毒学报,1990,6(2):111~116, 百拇医药(蔡家利** 蔡宝祥 姜 平)