甲型肝炎病毒结构蛋白的分离纯化及鉴定
作者:卢银平 林雨霖 姚学军 钱奇珍 李 晖 张蔚英
单位:卢银平 同济医科大学附属协和医院病毒室,武汉 430022;林雨霖 姚学军 钱奇珍 李 晖 张蔚英 湖北医科大学病毒研究所,武汉 430071
关键词:甲型肝炎病毒;结构蛋白;分离;纯化;鉴定
中国病毒学/990304摘 要 利用高效持续带毒增殖的细胞株传代增殖获取甲型肝炎病毒(HAV)。采用不连续蔗糖/甘油密度梯度超速离心分离高度纯化的HAV颗粒。温和病毒裂解液裂解病毒后,运用高效液相色谱分离出三种蛋白,SDS-PAGE和Western-blot证实所分离蛋白为HAV三种主要结构蛋白VP1、VP2和VP3,蛋白含量较高。
Separation, Purification and Identification of
, http://www.100md.com
Structural Proteins of Hepatitis A Virus
Lu Yinping1 Lin Yulin2 Yao Xuejun2 Qin Qizhen2 Li Hui2 Zhang Weiying2
1 (Department of Virology, Union Hospital of Tongji Medical University, Wuhan 430022)
2 (Virus Research Institute, Hubei Medical University, Wuhan 430071)
Abstract A cell line persistently infected by Hepatitis A virus (HAV) was ultilized to produce high yield viral particles of HAV. HAV particles were recovered in a single ultracentrifugation step through discontinuous sucrose/glycerol density gradients. Three kinds of major structural protein of HAV were separated and purified by high performance liquid chormatography. SDS-PAGE demonstrated the molecular weight of three structural proteins of HAV being 33, 29 and 27 kD. The special immune reactions were shown in Western-blot test, suggesting the proteins with 33, 29 and 27 kD are VP1, VP2 and VP3 of the virus, respectively. The total contents of the proteins, VP1, VP2 and VP3 were respectively 687, 220.8, 68 and 213.6 μg from 11 200 cm\+2 cells infected with HAV. The highly purified particles and sturctural proteins of HAV may be used in research for the development of vaccine, clinical diagnosis and pathogenesis of HAV.
, http://www.100md.com
Key words Hepatitis A virus, Structural proteins, Separation, Purification, Identification
甲型肝炎病毒的发病率在各型病毒性肝炎中仍居首位,然而HAV感染的始发机理一直都是亟待解决但尚未弄清楚的课题,至今没有阐明感染始发有关衣壳蛋白种类及各种衣壳蛋白在感染始发中的相互作用。因此有效分离出高度纯化和保持蛋白天然空间结构的HAV三种主要结构蛋白VP1、VP2和VP3,对研究解决HAV感染始发机理具有重要意义。国外有学者报道分离出几种HAV结构蛋白,但因实验中使用蛋白变性剂,所获蛋白为变性结构蛋白[1,2];国内尚未见到有关HAV结构蛋白分离纯化的报道。本研究采用超速离心和高效液相色谱技术,首次成功分离出具有蛋白本身天然结构的HAV的三种主要结构蛋白,旨在为解决HAV感染始发机制研究提供丰富材料和有力手段。
, http://www.100md.com
1 材料和方法
1.1 细胞和病毒 HAV HM-175株适应于恒河猴胚肾传代细胞FRhK4并形成持续感染,参考Simmonds等方法[3]传代,每周传代一次,可维持生长两周。
1.2 材料和仪器 超速离心机为日立SCP85H型,高效液相色谱仪为岛津LC-6A型,电泳仪为Bio-Rad 3000Xi型。抗HAV VP1、VP3单克隆抗体由上海市传染病医院免疫室提供,甲肝患者恢复期血清由武汉市传染病医院提供。
1.3 间接免疫荧光检测细胞中HAV抗原 按Provost等[4]方法加以改进,HAV感染细胞用胰酶消化后制成抗原片,加入HAV患者恢复期血清,湿盒中置37 ℃恒温箱45 min,洗涤吹干,加入羊抗人IgG荧光抗体,37 ℃孵育45 min,洗涤吹干后在荧光显微镜下观察,测细胞阳性率,确定HAV在FRhK4细胞增殖高峰时间。
, http://www.100md.com
1.4 不连续蔗糖/甘油密度梯度超速离心制备高纯度HAV HAV持续感染传代细胞培养两周后弃去培养液,用胰酶/EDTA消化细胞,低速离心收集细胞沉淀,共收集400方瓶(28 cm2/瓶)细胞沉淀物,加入终浓度1%NP40裂解细胞膜,离心去除细胞核和细胞残渣,加入终浓度为2%的SDS,以进一步裂解剩余少量细胞残余物。12 mL水平离心管用带细长针管注射器由管底依次缓慢加入1.8 mL 100 g/L的蔗糖(含1%SDS)、1.8 mL 200 g/L的蔗糖、1.8 mL 300 g/L的蔗糖、0.5 mL体积分数为80%的甘油,然后在离心管上部加入5.3 mL粗制HAV悬液,离心管放入水平离心转头(Hitashi SW40), 37 000 r/min(170 000×g),18 ℃离心6 h,最后用带细长针头注射器从管底收集1 mL液体,即为高纯度病毒悬液,其它部分也分部收集1 mL供检测[5,6]。
1.5 高效液相色谱(HPLC)分离HAV结构蛋白 超速离心所得HAV加入终浓度为4 mol/L盐酸胍(GuHCl)和1 mmol/L二硫苏糖醇(DTT),50 ℃恒温水浴10 min以裂解HAV颗粒。HPLC色谱柱为Shim-pack DIOL-150,流动相为0.01 mol/L pH6.6 PBS,流速为0.6 mL/min,紫外检测器波长为280 nm,温度为25 ℃,每次进样量为50 μL,出峰后从半峰高起收集各蛋白峰[2,7]。
, 百拇医药
1.6 SDS-PAGE测定蛋白质分子量 分离胶浓度为12.5%,浓缩胶浓度3%,样品加入处理液煮沸3 min后加样电泳,同时加入标准分子量作对照,稳流电泳,开始电流为15 mA,样品浓缩成线进入分离胶后加大到30 mA,总共电泳约5 h,剥胶后考马斯亮蓝染色。电泳后根据标准蛋白分子量和其相对迁移率在半对数坐标纸上作分子量标准曲线,然后根据待测蛋白的相对迁移率从标准曲线上查知其分子量。
1.7 Western-blot 样品经SDS-PAGE后,将凝胶上蛋白条带电泳转印到硝酸纤维膜上,丽春红染色后将蛋白条带切下,条带用1% BSA 4 ℃封闭过夜,TBS洗涤,置反应槽内,加1.5 mL TBS-Tween20稀释的一抗HAV患者恢复期血清或鼠抗HAV McAb,37 ℃温箱振荡孵育2 h,TBS洗涤后加入酶标二抗羊抗人IgG-HRP或羊抗鼠IgG-HRP 1.5 mL,37 ℃振荡孵育2 h。洗涤后加入1.5 mL底物液,振荡15 min,待充分显色后,自来水冲洗终止反应。
, http://www.100md.com
1.8 蛋白质薄层扫描 将SDS-PAGE后剥下的凝胶进行薄层扫描,紫外检测,波长为280 nm,根据峰面积计算蛋白质含量(标准蛋白作为对照)及HPLC分离蛋白回收率。
2 结果
2.1 IFA检测HAV在细胞内增殖 不同培养时间细胞所做抗原片,IFA在荧光显微镜下见到感染HAV FRhK4细胞胞浆内有大量黄绿色砂粒状荧光颗粒,培养一周后细胞荧光阳性率达69.4%,培养两周后阳性率几乎达100%。
2.2 IEM观察超速离心所得HAV 透射电镜下,超速离心收集的离心管底1 mL悬液观察到大量聚集在一起的典型的HAV颗粒,大小约27nm,无包膜,可见到实心颗粒和空心颗粒,以实心颗粒为主(见图1)。其它分部收集物仅见少量HAV颗粒或无。
, http://www.100md.com
图1 负染免疫电镜照片。示超速离心后样品HAV被抗HAV McAb凝集成的病毒聚集体。
病毒直径约27 nm,分实心和空心颗粒两种(60000X)。
Fig.1 HAV with typical morphology recovered from ultracentrifugation were observed by immune electron microscopy (IME) (60,000X)
2.3 HPLC分离HAV结构蛋白及重复性 分离到三个大致呈正态分布的较窄的蛋白峰,保留时间分别为10.72 min、13.73 min、16.58 min(见图2),将收集到三个峰样品分别重新进样,各自得到一个峰,保留时间与原最初样品保留时间相对应。样品多次进样出峰和保留时间也无改变。
, 百拇医药
图2 高效液相色谱分离HAV结构蛋白三个洗脱峰。保留时间分别为10.72 min、13.73 min、16.58 min。
Fig.2 The structural proteins of HAV were separated by high liquid chormatography (HPLC),three peaks of protein with elution time being 10.72 min, 13.73 min and 16.58 min were respectively collected
2.4 分子量测定 HAV结构蛋白分子量分别为33、29、27 kD;HPLC所得三个峰样品分子量:保留时间10.72 min的为33 kD;保留时间13.73 min的为29 kD;保留时间16.58 min的为27 kD(见图3)。
, 百拇医药
图3 SDS-PAGE照片。1.标准分子量; 2.HAV; 3.HPLC分离物(16.58 min); 4.HPLC分离物(13.73 min);
5.HPLC分离物(10.72 min)。
Fig.3 SDS-PAGE demonstrated the molecular weight of three structural proteins of HAV. Lane 1, molecular weight markers; Lane 2, virions of HAV; Lane 3 to 5, products of HPLC with different elution time.
2.5 Western-blot鉴定各结构蛋白
2.5.1 用HAV患者恢复期血清和羊抗人IgG-HRP分别作一抗和二抗,超速离心HAV样品出现三条反应带,而HPLC收集到的三个峰样品与抗血清反应也分别显出一条带(见图4)。证明HPLC收集到的三个峰样品都为HAV结构蛋白。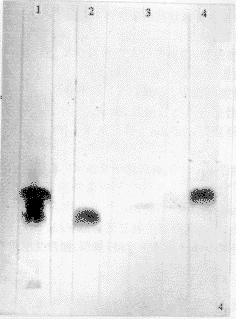
, 百拇医药
图4 Western-blot,用HAV患者恢复期血清和羊抗人IgG-HRP反应系统。1.HAV; 2. 27 kD蛋白(16.58 min峰);3. 29 kD蛋白(13.73 min峰);4.33 kD蛋白(10.72 min峰)。
Fig.4 Western-blot analysis of sera of patient infected by HAV with complete virions (Lane 1) and HPLC purified structural proteins of HAV (Lane 2 to 4).
2.5.2 用抗HAV VP1 McAb bF4和羊抗鼠IgG-HRP分别作一抗和二抗,超速离心HAV样品出现分子量为33 kD一条带,而HPLC收集到的三个峰样品仅见保留时间为10.72 min(33 kD)者出现阳性条带,其它二峰值样品为阴性反应,未见条带(见图5),证明保留时间为10.72 min的蛋白是HAV结构蛋白VP1。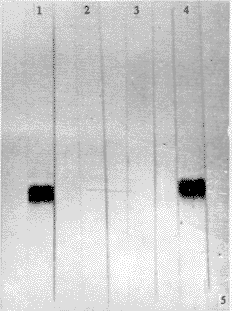
, http://www.100md.com
图5 Western-blot。用抗HAV VP1单抗bF4和羊抗鼠IgG-HRP反应系统。1.HAV; 2.27 kD蛋白(16.58 min峰); 3. 29 kD蛋白(13.73 min峰); 4. 33 kD蛋白(10.72 min峰)。
Fig.5 Western-blot analysis of McAb against HAV VP1 with complete virions (Lane 1) and HPLC purified structural proteins of HAV(Lane 2 to 4).2.5.3 用抗HAV VP3 McAb 3D9和 羊抗鼠IgG-HRP分别作一抗和二抗,超速离心HAV颗粒出现分子量为27 kD一条带,HPLC收集的样品仅见保留时间为16.58 min的峰(27 kD)处者出现一条带,其它二峰未见条带(见图6),证明保留时间为16.58 min的蛋白(27 kD)为HAV结构蛋白VP3。
, http://www.100md.com
图6 Western-blot。用抗HAV VP3单抗3D9和羊抗鼠IgG-HRP反应系统。1. HAV; 2. 27 kD蛋白(16.58 min峰); 3. 29 kD蛋白(13.73 min峰)。 4. 33 kD蛋白(10.72 min峰)。
Fig.6 Western-blot analysis of McAb against HAV VP3 with complete virions (Lane 1) and HPLC purified structural proteins of HAV(Lane 2 to 4).
2.5.4 HPLC收集的保留时间为13.73 min (29 kD)样品能与HAV患者恢复期血清发生免疫反应,而不能与抗HAV VP3、VP1单克隆抗体发生免疫反应,证明它为HAV另一种结构蛋白VP2,其分子量与文献报道分子量[2]相吻合。
, 百拇医药
2.6 蛋白质含量的测定 超速离心共收集到6 mL高度纯化的HAV,经薄层扫描与标准蛋白比较计算,每100 μL含HAV蛋白11.45 μg;HPLC每进样100 μL超速离心样品,可收获VP1 3.68 μg、VP2 1.14 μg和VP3 3.56 μg。HPLC的回收率为73.2%。400方瓶(280 cm2)细胞共可收获高度纯化HAV蛋白687 μg、VP1 220.8 μg、VP2 68 μg和VP3 213.6 μg。
3 讨论
本研究充分利用HAV本身在细胞培养上的一些生长特性,即生长缓慢、病毒复制产量低、不产生细胞病变、不形成缺陷干扰颗粒、易形成持续感染[3,8,9]。将HAV标准原型毒株HM175适应至恒河猴胚肾传代细胞株FRhK4,病毒能随细胞传代而稳定增殖,形成持续感染,省去了病毒接种。每周仅传代一次,细胞可维持生长2周,节省了大量人力物力,细胞生长二周时IFA检测阳性率达100%,这样就较容易得到大量病毒材料。
, 百拇医药
裂解感染HAV细胞释放病毒时,采用了非离子表面去垢剂1% NP40。NP40短时间作用能使细胞膜破坏而使胞浆中病毒释放,核膜不会破裂,低速离心就能去除细胞核。因为病毒是在胞浆中增殖,去除胞核既不使病毒产量损失,又去除了核物质可能形成的污染。密度梯度离心前,所收集病毒上清中加入高浓度阴离子表面去垢剂2%SDS,其作用是使上清液中残余细胞碎片进一步充分裂解,使其沉降系数降低,超速离心时留在较上层蔗糖梯度介质中。HAV结构非常致密,对高浓度SDS有抵抗力,故不受到破坏,超速离心时,因其沉降系数最高,会沉降至离心管底部甘油层,这样就通过一步超速离心就收获到高纯度的HAV颗粒。
本研究采用了不连续蔗糖/甘油密度梯度,十分经济简便。少量甘油(0.5 mL)铺垫于离心管底部,一步离心后,病毒颗粒直接进入甘油介质处,收集底部1 mL液体就可收获绝大多数病毒颗粒。另外,采用了水平离心转头,缩短了离心时间[10]。
病毒蛋白分离纯化经常采用的方法是亲和层析和SDS-PAGE电泳洗脱法。亲和层析需应用多种病毒高效价McAb分别偶联色谱柱,一种McAb只能分离一种蛋白,偶联活化色谱柱费时费力有毒且柱效不高。SDS-PAGE电泳洗脱法在蛋白质凝胶电泳时,因SDS和β-ME的使用会改变蛋白质的天然空间构象,影响其生物学活性和蛋白质结构本身,尚需逐一从凝胶上切下各蛋白带后电泳洗脱,电泳洗脱产物损失较大,回收率更低。本研究采用高效液相色谱成功分离出HAV三种结构蛋白,一次进样就能将三种主要结构蛋白一一分出,重复性好,回收率高,且保持了蛋白质的天然构象。色谱柱是DIOL-150柱,其分离原理是分子排阻,柱效高,由于不同分子量蛋白质在色谱柱中保留时间不同,大分子量蛋白质保留时间短,小分子量蛋白质保留时间长,这样就能将不同分子量的蛋白质分离开来。另外采用了较低pH值的磷酸盐缓冲液作流动相,以便HAV三种疏水性蛋白质充分溶解,不相互聚集,且蛋白质不会变性。蛋白质分子量较大,扩散系数较小,流量对分辨率有较大影响,一般流量是1 mL/min或更低,本研究采用0.6 mL/min,分离效果较好。
, http://www.100md.com
SDS-PAGE与Western-blot证实了HPLC所分离三种蛋白质的分子量及血清学反应的特异性,11 200 cm2细胞共收获HAV总蛋白687 μg,比国外同样条件下产量高6倍以上[6],HPLC的回收率为73.2%,共收获HAV结构蛋白VP1、VP2和VP3分别是220.8 μg、68 μg\,213.6 μg(11 200 cm2细胞)。本实验分离出的高度纯化的HAV颗粒及三种主要结构蛋白,为研究HAV结构蛋白理化和免疫特性、探讨HAV感染始发机制、研制HAV灭活疫苗和亚单位疫苗、实验诊断等提供了丰富材料和有力手段。
致谢 本实验得到中科院武汉病毒所唐建客老师及湖北医科大学实验中心崔冶建老师大力支持,在此表示衷心感谢!
参考文献
1 Hughes JV, Stanto LW, Tomassini JE et al. Neutralizing monoclonal antibodies to hepatitis A virus: partial localization of a nutralizing site. J Virol, 1984,52:123~131
, 百拇医药
2 Gauss-M llerV, Lottspeich F, Deihardt F. Characterization of hepatitis A structural proteins. Virology, 1986, 155:732~736
llerV, Lottspeich F, Deihardt F. Characterization of hepatitis A structural proteins. Virology, 1986, 155:732~736
3 Simmonds RS, Szucs G, Metcalf TG et al. Persistently infected cultures as a source of hepatitis A virus. Appl Environ Microbiol, 1985, 49:749~755
4 Provost PJ, Hilleman MR. Propagation of human hepatitis A virus in cell culture in vitro. Proc Soc Exp Biol Med, 1979,160:213~221
, 百拇医药
5 Anderson DA, Ross BC. Morphogenesis of hepatitis A virus: isolation and characterization of subviral particles. J Virol, 1990,64:5284~5289
6 Bishop NE, Hago DL, Borovec SV et al . Rapid and efficient purification of hepatitis A virus from cell culture. J Virol Methods, 1994, 47:203~216
7 Heukeshoven J, Dernick R. Reverse-phase high-performance liquid chromatography of virus proteins and other hydrophobic proteins. Chromatographia, 1984, 19:95~100
, 百拇医药
8 Anderson DA, Ross BC, Locarnini SA. Restricted replication of hepatitis A virus in cell culture: encapsidation of viral RNA depletes the pool of RNA available for replication. J Virol, 1988,62:4201~4206
9 Cho MW, Ehrenfeld E. Rapid completion of the replication cycle of hepatitis A virus subsequent to reversal of guanidine inhibition. Virology, 1991, 180:770~780
10 Lemon SM, Jansen RW, Newbold JE. Infectious hepatitis A virus particles produced in cell culture consist of three distinct types with different buoyant densities in CsCl. J Virol, 1985,54:78~85, http://www.100md.com
单位:卢银平 同济医科大学附属协和医院病毒室,武汉 430022;林雨霖 姚学军 钱奇珍 李 晖 张蔚英 湖北医科大学病毒研究所,武汉 430071
关键词:甲型肝炎病毒;结构蛋白;分离;纯化;鉴定
中国病毒学/990304摘 要 利用高效持续带毒增殖的细胞株传代增殖获取甲型肝炎病毒(HAV)。采用不连续蔗糖/甘油密度梯度超速离心分离高度纯化的HAV颗粒。温和病毒裂解液裂解病毒后,运用高效液相色谱分离出三种蛋白,SDS-PAGE和Western-blot证实所分离蛋白为HAV三种主要结构蛋白VP1、VP2和VP3,蛋白含量较高。
Separation, Purification and Identification of
, http://www.100md.com
Structural Proteins of Hepatitis A Virus
Lu Yinping1 Lin Yulin2 Yao Xuejun2 Qin Qizhen2 Li Hui2 Zhang Weiying2
1 (Department of Virology, Union Hospital of Tongji Medical University, Wuhan 430022)
2 (Virus Research Institute, Hubei Medical University, Wuhan 430071)
Abstract A cell line persistently infected by Hepatitis A virus (HAV) was ultilized to produce high yield viral particles of HAV. HAV particles were recovered in a single ultracentrifugation step through discontinuous sucrose/glycerol density gradients. Three kinds of major structural protein of HAV were separated and purified by high performance liquid chormatography. SDS-PAGE demonstrated the molecular weight of three structural proteins of HAV being 33, 29 and 27 kD. The special immune reactions were shown in Western-blot test, suggesting the proteins with 33, 29 and 27 kD are VP1, VP2 and VP3 of the virus, respectively. The total contents of the proteins, VP1, VP2 and VP3 were respectively 687, 220.8, 68 and 213.6 μg from 11 200 cm\+2 cells infected with HAV. The highly purified particles and sturctural proteins of HAV may be used in research for the development of vaccine, clinical diagnosis and pathogenesis of HAV.
, http://www.100md.com
Key words Hepatitis A virus, Structural proteins, Separation, Purification, Identification
甲型肝炎病毒的发病率在各型病毒性肝炎中仍居首位,然而HAV感染的始发机理一直都是亟待解决但尚未弄清楚的课题,至今没有阐明感染始发有关衣壳蛋白种类及各种衣壳蛋白在感染始发中的相互作用。因此有效分离出高度纯化和保持蛋白天然空间结构的HAV三种主要结构蛋白VP1、VP2和VP3,对研究解决HAV感染始发机理具有重要意义。国外有学者报道分离出几种HAV结构蛋白,但因实验中使用蛋白变性剂,所获蛋白为变性结构蛋白[1,2];国内尚未见到有关HAV结构蛋白分离纯化的报道。本研究采用超速离心和高效液相色谱技术,首次成功分离出具有蛋白本身天然结构的HAV的三种主要结构蛋白,旨在为解决HAV感染始发机制研究提供丰富材料和有力手段。
, http://www.100md.com
1 材料和方法
1.1 细胞和病毒 HAV HM-175株适应于恒河猴胚肾传代细胞FRhK4并形成持续感染,参考Simmonds等方法[3]传代,每周传代一次,可维持生长两周。
1.2 材料和仪器 超速离心机为日立SCP85H型,高效液相色谱仪为岛津LC-6A型,电泳仪为Bio-Rad 3000Xi型。抗HAV VP1、VP3单克隆抗体由上海市传染病医院免疫室提供,甲肝患者恢复期血清由武汉市传染病医院提供。
1.3 间接免疫荧光检测细胞中HAV抗原 按Provost等[4]方法加以改进,HAV感染细胞用胰酶消化后制成抗原片,加入HAV患者恢复期血清,湿盒中置37 ℃恒温箱45 min,洗涤吹干,加入羊抗人IgG荧光抗体,37 ℃孵育45 min,洗涤吹干后在荧光显微镜下观察,测细胞阳性率,确定HAV在FRhK4细胞增殖高峰时间。
, http://www.100md.com
1.4 不连续蔗糖/甘油密度梯度超速离心制备高纯度HAV HAV持续感染传代细胞培养两周后弃去培养液,用胰酶/EDTA消化细胞,低速离心收集细胞沉淀,共收集400方瓶(28 cm2/瓶)细胞沉淀物,加入终浓度1%NP40裂解细胞膜,离心去除细胞核和细胞残渣,加入终浓度为2%的SDS,以进一步裂解剩余少量细胞残余物。12 mL水平离心管用带细长针管注射器由管底依次缓慢加入1.8 mL 100 g/L的蔗糖(含1%SDS)、1.8 mL 200 g/L的蔗糖、1.8 mL 300 g/L的蔗糖、0.5 mL体积分数为80%的甘油,然后在离心管上部加入5.3 mL粗制HAV悬液,离心管放入水平离心转头(Hitashi SW40), 37 000 r/min(170 000×g),18 ℃离心6 h,最后用带细长针头注射器从管底收集1 mL液体,即为高纯度病毒悬液,其它部分也分部收集1 mL供检测[5,6]。
1.5 高效液相色谱(HPLC)分离HAV结构蛋白 超速离心所得HAV加入终浓度为4 mol/L盐酸胍(GuHCl)和1 mmol/L二硫苏糖醇(DTT),50 ℃恒温水浴10 min以裂解HAV颗粒。HPLC色谱柱为Shim-pack DIOL-150,流动相为0.01 mol/L pH6.6 PBS,流速为0.6 mL/min,紫外检测器波长为280 nm,温度为25 ℃,每次进样量为50 μL,出峰后从半峰高起收集各蛋白峰[2,7]。
, 百拇医药
1.6 SDS-PAGE测定蛋白质分子量 分离胶浓度为12.5%,浓缩胶浓度3%,样品加入处理液煮沸3 min后加样电泳,同时加入标准分子量作对照,稳流电泳,开始电流为15 mA,样品浓缩成线进入分离胶后加大到30 mA,总共电泳约5 h,剥胶后考马斯亮蓝染色。电泳后根据标准蛋白分子量和其相对迁移率在半对数坐标纸上作分子量标准曲线,然后根据待测蛋白的相对迁移率从标准曲线上查知其分子量。
1.7 Western-blot 样品经SDS-PAGE后,将凝胶上蛋白条带电泳转印到硝酸纤维膜上,丽春红染色后将蛋白条带切下,条带用1% BSA 4 ℃封闭过夜,TBS洗涤,置反应槽内,加1.5 mL TBS-Tween20稀释的一抗HAV患者恢复期血清或鼠抗HAV McAb,37 ℃温箱振荡孵育2 h,TBS洗涤后加入酶标二抗羊抗人IgG-HRP或羊抗鼠IgG-HRP 1.5 mL,37 ℃振荡孵育2 h。洗涤后加入1.5 mL底物液,振荡15 min,待充分显色后,自来水冲洗终止反应。
, http://www.100md.com
1.8 蛋白质薄层扫描 将SDS-PAGE后剥下的凝胶进行薄层扫描,紫外检测,波长为280 nm,根据峰面积计算蛋白质含量(标准蛋白作为对照)及HPLC分离蛋白回收率。
2 结果
2.1 IFA检测HAV在细胞内增殖 不同培养时间细胞所做抗原片,IFA在荧光显微镜下见到感染HAV FRhK4细胞胞浆内有大量黄绿色砂粒状荧光颗粒,培养一周后细胞荧光阳性率达69.4%,培养两周后阳性率几乎达100%。
2.2 IEM观察超速离心所得HAV 透射电镜下,超速离心收集的离心管底1 mL悬液观察到大量聚集在一起的典型的HAV颗粒,大小约27nm,无包膜,可见到实心颗粒和空心颗粒,以实心颗粒为主(见图1)。其它分部收集物仅见少量HAV颗粒或无。

, http://www.100md.com
图1 负染免疫电镜照片。示超速离心后样品HAV被抗HAV McAb凝集成的病毒聚集体。
病毒直径约27 nm,分实心和空心颗粒两种(60000X)。
Fig.1 HAV with typical morphology recovered from ultracentrifugation were observed by immune electron microscopy (IME) (60,000X)
2.3 HPLC分离HAV结构蛋白及重复性 分离到三个大致呈正态分布的较窄的蛋白峰,保留时间分别为10.72 min、13.73 min、16.58 min(见图2),将收集到三个峰样品分别重新进样,各自得到一个峰,保留时间与原最初样品保留时间相对应。样品多次进样出峰和保留时间也无改变。

, 百拇医药
图2 高效液相色谱分离HAV结构蛋白三个洗脱峰。保留时间分别为10.72 min、13.73 min、16.58 min。
Fig.2 The structural proteins of HAV were separated by high liquid chormatography (HPLC),three peaks of protein with elution time being 10.72 min, 13.73 min and 16.58 min were respectively collected
2.4 分子量测定 HAV结构蛋白分子量分别为33、29、27 kD;HPLC所得三个峰样品分子量:保留时间10.72 min的为33 kD;保留时间13.73 min的为29 kD;保留时间16.58 min的为27 kD(见图3)。

, 百拇医药
图3 SDS-PAGE照片。1.标准分子量; 2.HAV; 3.HPLC分离物(16.58 min); 4.HPLC分离物(13.73 min);
5.HPLC分离物(10.72 min)。
Fig.3 SDS-PAGE demonstrated the molecular weight of three structural proteins of HAV. Lane 1, molecular weight markers; Lane 2, virions of HAV; Lane 3 to 5, products of HPLC with different elution time.
2.5 Western-blot鉴定各结构蛋白
2.5.1 用HAV患者恢复期血清和羊抗人IgG-HRP分别作一抗和二抗,超速离心HAV样品出现三条反应带,而HPLC收集到的三个峰样品与抗血清反应也分别显出一条带(见图4)。证明HPLC收集到的三个峰样品都为HAV结构蛋白。

, 百拇医药
图4 Western-blot,用HAV患者恢复期血清和羊抗人IgG-HRP反应系统。1.HAV; 2. 27 kD蛋白(16.58 min峰);3. 29 kD蛋白(13.73 min峰);4.33 kD蛋白(10.72 min峰)。
Fig.4 Western-blot analysis of sera of patient infected by HAV with complete virions (Lane 1) and HPLC purified structural proteins of HAV (Lane 2 to 4).
2.5.2 用抗HAV VP1 McAb bF4和羊抗鼠IgG-HRP分别作一抗和二抗,超速离心HAV样品出现分子量为33 kD一条带,而HPLC收集到的三个峰样品仅见保留时间为10.72 min(33 kD)者出现阳性条带,其它二峰值样品为阴性反应,未见条带(见图5),证明保留时间为10.72 min的蛋白是HAV结构蛋白VP1。

, http://www.100md.com
图5 Western-blot。用抗HAV VP1单抗bF4和羊抗鼠IgG-HRP反应系统。1.HAV; 2.27 kD蛋白(16.58 min峰); 3. 29 kD蛋白(13.73 min峰); 4. 33 kD蛋白(10.72 min峰)。
Fig.5 Western-blot analysis of McAb against HAV VP1 with complete virions (Lane 1) and HPLC purified structural proteins of HAV(Lane 2 to 4).2.5.3 用抗HAV VP3 McAb 3D9和 羊抗鼠IgG-HRP分别作一抗和二抗,超速离心HAV颗粒出现分子量为27 kD一条带,HPLC收集的样品仅见保留时间为16.58 min的峰(27 kD)处者出现一条带,其它二峰未见条带(见图6),证明保留时间为16.58 min的蛋白(27 kD)为HAV结构蛋白VP3。

, http://www.100md.com
图6 Western-blot。用抗HAV VP3单抗3D9和羊抗鼠IgG-HRP反应系统。1. HAV; 2. 27 kD蛋白(16.58 min峰); 3. 29 kD蛋白(13.73 min峰)。 4. 33 kD蛋白(10.72 min峰)。
Fig.6 Western-blot analysis of McAb against HAV VP3 with complete virions (Lane 1) and HPLC purified structural proteins of HAV(Lane 2 to 4).
2.5.4 HPLC收集的保留时间为13.73 min (29 kD)样品能与HAV患者恢复期血清发生免疫反应,而不能与抗HAV VP3、VP1单克隆抗体发生免疫反应,证明它为HAV另一种结构蛋白VP2,其分子量与文献报道分子量[2]相吻合。
, 百拇医药
2.6 蛋白质含量的测定 超速离心共收集到6 mL高度纯化的HAV,经薄层扫描与标准蛋白比较计算,每100 μL含HAV蛋白11.45 μg;HPLC每进样100 μL超速离心样品,可收获VP1 3.68 μg、VP2 1.14 μg和VP3 3.56 μg。HPLC的回收率为73.2%。400方瓶(280 cm2)细胞共可收获高度纯化HAV蛋白687 μg、VP1 220.8 μg、VP2 68 μg和VP3 213.6 μg。
3 讨论
本研究充分利用HAV本身在细胞培养上的一些生长特性,即生长缓慢、病毒复制产量低、不产生细胞病变、不形成缺陷干扰颗粒、易形成持续感染[3,8,9]。将HAV标准原型毒株HM175适应至恒河猴胚肾传代细胞株FRhK4,病毒能随细胞传代而稳定增殖,形成持续感染,省去了病毒接种。每周仅传代一次,细胞可维持生长2周,节省了大量人力物力,细胞生长二周时IFA检测阳性率达100%,这样就较容易得到大量病毒材料。
, 百拇医药
裂解感染HAV细胞释放病毒时,采用了非离子表面去垢剂1% NP40。NP40短时间作用能使细胞膜破坏而使胞浆中病毒释放,核膜不会破裂,低速离心就能去除细胞核。因为病毒是在胞浆中增殖,去除胞核既不使病毒产量损失,又去除了核物质可能形成的污染。密度梯度离心前,所收集病毒上清中加入高浓度阴离子表面去垢剂2%SDS,其作用是使上清液中残余细胞碎片进一步充分裂解,使其沉降系数降低,超速离心时留在较上层蔗糖梯度介质中。HAV结构非常致密,对高浓度SDS有抵抗力,故不受到破坏,超速离心时,因其沉降系数最高,会沉降至离心管底部甘油层,这样就通过一步超速离心就收获到高纯度的HAV颗粒。
本研究采用了不连续蔗糖/甘油密度梯度,十分经济简便。少量甘油(0.5 mL)铺垫于离心管底部,一步离心后,病毒颗粒直接进入甘油介质处,收集底部1 mL液体就可收获绝大多数病毒颗粒。另外,采用了水平离心转头,缩短了离心时间[10]。
病毒蛋白分离纯化经常采用的方法是亲和层析和SDS-PAGE电泳洗脱法。亲和层析需应用多种病毒高效价McAb分别偶联色谱柱,一种McAb只能分离一种蛋白,偶联活化色谱柱费时费力有毒且柱效不高。SDS-PAGE电泳洗脱法在蛋白质凝胶电泳时,因SDS和β-ME的使用会改变蛋白质的天然空间构象,影响其生物学活性和蛋白质结构本身,尚需逐一从凝胶上切下各蛋白带后电泳洗脱,电泳洗脱产物损失较大,回收率更低。本研究采用高效液相色谱成功分离出HAV三种结构蛋白,一次进样就能将三种主要结构蛋白一一分出,重复性好,回收率高,且保持了蛋白质的天然构象。色谱柱是DIOL-150柱,其分离原理是分子排阻,柱效高,由于不同分子量蛋白质在色谱柱中保留时间不同,大分子量蛋白质保留时间短,小分子量蛋白质保留时间长,这样就能将不同分子量的蛋白质分离开来。另外采用了较低pH值的磷酸盐缓冲液作流动相,以便HAV三种疏水性蛋白质充分溶解,不相互聚集,且蛋白质不会变性。蛋白质分子量较大,扩散系数较小,流量对分辨率有较大影响,一般流量是1 mL/min或更低,本研究采用0.6 mL/min,分离效果较好。
, http://www.100md.com
SDS-PAGE与Western-blot证实了HPLC所分离三种蛋白质的分子量及血清学反应的特异性,11 200 cm2细胞共收获HAV总蛋白687 μg,比国外同样条件下产量高6倍以上[6],HPLC的回收率为73.2%,共收获HAV结构蛋白VP1、VP2和VP3分别是220.8 μg、68 μg\,213.6 μg(11 200 cm2细胞)。本实验分离出的高度纯化的HAV颗粒及三种主要结构蛋白,为研究HAV结构蛋白理化和免疫特性、探讨HAV感染始发机制、研制HAV灭活疫苗和亚单位疫苗、实验诊断等提供了丰富材料和有力手段。
致谢 本实验得到中科院武汉病毒所唐建客老师及湖北医科大学实验中心崔冶建老师大力支持,在此表示衷心感谢!
参考文献
1 Hughes JV, Stanto LW, Tomassini JE et al. Neutralizing monoclonal antibodies to hepatitis A virus: partial localization of a nutralizing site. J Virol, 1984,52:123~131
, 百拇医药
2 Gauss-M
 llerV, Lottspeich F, Deihardt F. Characterization of hepatitis A structural proteins. Virology, 1986, 155:732~736
llerV, Lottspeich F, Deihardt F. Characterization of hepatitis A structural proteins. Virology, 1986, 155:732~7363 Simmonds RS, Szucs G, Metcalf TG et al. Persistently infected cultures as a source of hepatitis A virus. Appl Environ Microbiol, 1985, 49:749~755
4 Provost PJ, Hilleman MR. Propagation of human hepatitis A virus in cell culture in vitro. Proc Soc Exp Biol Med, 1979,160:213~221
, 百拇医药
5 Anderson DA, Ross BC. Morphogenesis of hepatitis A virus: isolation and characterization of subviral particles. J Virol, 1990,64:5284~5289
6 Bishop NE, Hago DL, Borovec SV et al . Rapid and efficient purification of hepatitis A virus from cell culture. J Virol Methods, 1994, 47:203~216
7 Heukeshoven J, Dernick R. Reverse-phase high-performance liquid chromatography of virus proteins and other hydrophobic proteins. Chromatographia, 1984, 19:95~100
, 百拇医药
8 Anderson DA, Ross BC, Locarnini SA. Restricted replication of hepatitis A virus in cell culture: encapsidation of viral RNA depletes the pool of RNA available for replication. J Virol, 1988,62:4201~4206
9 Cho MW, Ehrenfeld E. Rapid completion of the replication cycle of hepatitis A virus subsequent to reversal of guanidine inhibition. Virology, 1991, 180:770~780
10 Lemon SM, Jansen RW, Newbold JE. Infectious hepatitis A virus particles produced in cell culture consist of three distinct types with different buoyant densities in CsCl. J Virol, 1985,54:78~85, http://www.100md.com