内皮素1对人牙髓细胞胶原合成的影响
作者:严焱 刘正
单位:200011 上海第二医科大学口腔医学院
关键词:内皮缩血管肽类;胶原;酶联免疫吸附测定;免疫组织化学
中华口腔医学杂志/990311 【摘要】 目的 探讨内皮素1 (endothelin-1,ET-1)对人牙髓细胞(human dental pulp cells,HDPC)胶原合成的影响。方法 采用细胞培养、酶联免疫吸附分析及免疫组化染色等方法,就ET-1对HDPC胶原合成的影响进行了研究。结果 ET-1较对照组除24小时时相外,均有不同程度的促HDPC可溶性I型胶原合成作用,但对III型胶原作用不明显;经免疫组化染色证实:ET-1尚可同时促进细胞非溶解性I型胶原合成。结论 ET-1促进HDPC I型胶原合成增加,可能对牙髓组织的自身修复起作用。
Effects of endothelin -1 on the collagen synthesis of cultured human dental pulp cells YAN Yan,LIU Zheng. School of Stomatology, Shanghai Second Medical University, Shanghai 200011
, http://www.100md.com
【Abstract】 Objective To study the effects of endothelin-1(ET-1) on the collagen synthesis of cultured human dental pulp cells. Methods Cell cultured, enzyme linked immmun sorbent assay (ELISA),and ABC immunhistochemical staining were used in the study. Results ET-1 increased the synthesis of soluble type I collagen in different periods besides the 24h group, and had no effects on the type III collagen; immunohistochemical staining revealed that ET-1 also increased the synthesis of unsoluble type I collagen. Conclusion ET-1 can stimulate type I collagenic synthesis of human dental pulp cells and might have an effect on pulp self-restoration.
, 百拇医药
【Key words】 Endothelins Collagen Enzyme-linked immmunosorbent assay Immunohistochemistry
细胞外间质(extro cellular matrix,ECM)是由胶原等蛋白组成,目前认为ECM除了支持、保护作用外,还与细胞增生、分化、伤口愈合及钙化等机体功能有着密切联系。内皮素1(endothelin-1,ET-1)具有促进人牙髓细胞(human dental pulp cells ,HDPC)增生及促进细胞内Ca2+增加等作用,但ET-1对HDPC胶原合成的作用迄今尚未见报道。为此,我们运用细胞培养、酶联免疫吸附测定及免疫组化染色等方法对ET-1对HDPC胶原的合成作用进行了研究。
材料与方法
1.材料:①I型Collage单抗 (Sigma,U.S.A.);②III型Collage单抗 (Sigma,U.S.A.);③ET-1 (Sigma,U.S.A.);④ABC试剂盒 (Vector,U.S.A.);⑤羊抗小鼠II抗 (华美);⑥Vitarmin C (上海);⑦I、III型胶原标准品 (华美)。
, 百拇医药
2.实验分组:①空白对照组:DMEM+10%FBS;②实验ET-1组:含10-6 mol/L ET-1的10% FBS;③实验VitC组:将50 mg/L VitC溶于10% FBS。
3.实验方法(enzyme-linked immunosorbent assay,ELISA)[1]:细胞第8代,按2万/孔接种于24孔板内,每孔内含1 cm×1 cm大小的盖玻片,每组6孔。12% FBS置于37℃培养箱常规培养,48小时后待细胞长成单层,培养液换成含实验所需条件10% FBS的DMEM,连续置于37℃、5% CO2中培养,分别于3小时、12小时、24小时及72小时取出,收集培养液,于-70℃下保存待测。
4.绘制标准曲线:将胶原(I型、III型)所用包被液(pH 9.6的碳酸缓冲液)稀释为0.1、0.2、0.4、0.8、1.6、3.2、6.4及12.8 mg/L,再将此胶原稀释液加入聚苯乙烯微孔板小孔内,每孔100 μl,置4℃下12小时。用PBS-tween 20洗3次,加I、III型胶原抗血清(1∶1 000)100 μl,放37℃湿盒1小时,取出孔板,用PBS-tween 20洗3次,加入羊抗小鼠(过氧化物酶标记)IgG,每孔100 μl,37℃湿盒1小时。取出,用PBS-tween 20漂洗,加入酶底物(邻苯二胺),室温湿盒中反应30 min,然后加入25 μl 2 mol/L 的H2SO4终止反应,在490 nm波长下比色,以A490为纵座标,绘制标准曲线。
, 百拇医药
5.样本测试:参照绘制标准曲线的方法,将100 μl样本放入聚苯乙烯微孔内(用NaOH调pH至9.6),用100 μl的10% FBS调零,4℃下12小时,以后各步骤同上。
6.ABC免疫组织化学法[2]:95% 丙酮固定,用0.25% TritonX-100及5% DMSO漂洗10 min,浸入37℃ 0.75%及1.5%的H2O2-PBS中15 min(阻断内源性过氧化物酶)。PBS洗3次,滴加正常马血清,置37℃湿盒内30 min,清除非特异性染色,30 min后弃去马血清。滴加小鼠抗人I型胶原特异性抗体(1∶1 000),4℃12小时,PBS振洗3 min,共3次,ABC复合试剂37℃ 30 min,PBS振洗2次,THB振洗3 min。DAB显色10~20 min。水洗5 min,逐级乙醇脱水,石碳酸、二甲苯透明、封片,镜下观察。
7.统计学方法:数据以 ±s表示,采用方差分析,以P<0.05为显著性标准。
±s表示,采用方差分析,以P<0.05为显著性标准。
, 百拇医药
结果
1. ET-1对人牙髓细胞I型胶原合成的影响:经ELISA方法检测,与对照组相比,ET-1、VitC组I型胶原浓度在12及72小时明显增加,P<(0.05~0.01);但在3、24及48小时3组间I型胶原浓度差异均无显著性,P> 0.05(图1)。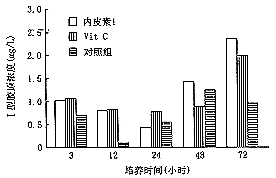
图1 内皮素1、VitC及I型胶原的浓度比较
2. ET-1对人牙髓细胞III型胶原合成的影响:图2所示,ET-1、VitC与对照组细胞相比,3组间对III型胶原的作用差异无显著性,P>0.05。
图2 内皮素1、VitC及III型胶原的浓度比较
, 百拇医药
3.I型胶原ABC免疫组化染色观察:3组培养细胞均可见I型胶原阳性着色。胶原多呈网织、条索状,其间可见散在的牙髓细胞胞核,部分胞核成团,形态较模糊。ET-1(图3)及VitC组(图4)的阳性程度均强于对照组(图5)。
图3 对照组12小时,I型胶原染色弱阳性(↑),胶原呈稀疏条索状,细胞核散在,部分融合成团(N),形态较模糊 (ABC×224)
图4 ET-1组12小时,I型胶原染色阳性(↑),胶原密集呈网状 (ABC×140)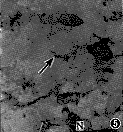
图5 Vit C组12小时,I型胶原染色阳性(↑),胶原密集呈树枝状分布,细胞核清晰(N) (ABC×224)
, 百拇医药
讨论
胶原是牙髓组织中细胞外间质的主要成分。它对局部牙髓组织中牙髓细胞的分化、增殖及牙髓修复、抗损伤等均有重要意义。本组实验发现,ET-1较对照组除实验24小时时相外,均有不同程度的促I型胶原合成作用,以12及72小时最为显著,但对III型胶原的作用不明显。这提示ET-1在促进HDPC的胶原合成中有亚型的区别。本组结果与Rizvi和Myers[3]一致。这可能与牙髓内I型胶原含量最高,HDPC受ET-1刺激后优先表达I型胶原有关。由此我们认为,ET-1对牙髓组织疾病状态时的自身修复起作用。
ET-1促HDPC胶原合成的机制仍不清楚,这可能与抑制细胞内胶原酶活性[4]、ET-1与受体结合后不易分离,延长了其刺激效应[5]及ET-1通过细胞内其它生长因子的表达而调节胶原水平[6]有关。ET-1促HDPC胶原合成机制尚有待进一步研究。
, 百拇医药
本实验发现,在实验初始3~24小时,各组胶原浓度均有下降趋势,这可能与细胞对置换较低浓度血清不适应、表现出的不稳定状态有关。研究还发现,实验中0.4%及1% FBS血清的低浓度不能支持HDPC,使用后细胞出现漂浮。由此证明:牙髓细胞是十分娇嫩的细胞,实验中所能耐受的最低血清浓度为10% FBS。
免疫吸附分析法(ELISA)于1980年被改良,可利用特异性抗体直接测量组织内胶原。Buckley等[6]及Burke等[7]以往的研究均证明,细胞培养时合成分泌的胶原为可溶性胶原,且多分布在培养液内。本研究采用ELISA方法,利用I、III型胶原单抗检测了不同实验组HDPC的可溶性胶原浓度,并结合免疫组化法直接观察了细胞染色情况,结果表明两种实验方法结果基本一致。提示HDPC所分泌的胶原,除部分为可溶性溶解在培养液内,其余部分则为不溶解性分泌沉积在细胞外周,以形成三维结构的胞外基质,利于细胞的多层粘附、生长。由于两组实验结果平行,我们认为ELISA与免疫组化法均可选择,可根据不同实验目的来决定取舍。
, 百拇医药
参考文献
[1] 李玉瑞, 主编.细胞外间质生物化学及研究方法. 第1版.北京: 人民卫生出版社, 1988.232-234.
[2] 司徒镇强, 吴军正,主编. 细胞培养. 第1版.西安:世界图书出版公司,1996.202-203.
[3] Rizvi MA, Myers PR . Nitric oxide modulates basal and endothelin-induced coronary artery vascular smooth muscle cell proliferation and collagen levels. J Mol Cell Cardiol, 1997, 29: 1779-1789.
[4] Guarda E. Myers P. Karwa L. Effects of endothelins on collagen turnover in cardiac fiborblasts. Cardiovasc Res, 1993, 27:2130-2134.
, 百拇医药
[5] Hirata Y, Yoshimi H, Takaichi S, et al. Binding and receptor down-regulation of a novel vasoconstrictor endothelin in cultured rat vascular smooth muscle cells. FEBS Lett, 1988 ,239: 13-17.
[6] Buckley A, Hill KE, Davidson JM. Collagen metabolism. Methods Enzymol, 1988,163: 674- 694.
[7] Burke J, Balian G, Ross R, et al. Synthesis of type I and III procollagen and collagen by monkey aortic smooth muscle cells in vitro. Biochemistry, 1977, 16:3243-3249.
(收稿:1998-07-07 修回:1999-01-26), 百拇医药
单位:200011 上海第二医科大学口腔医学院
关键词:内皮缩血管肽类;胶原;酶联免疫吸附测定;免疫组织化学
中华口腔医学杂志/990311 【摘要】 目的 探讨内皮素1 (endothelin-1,ET-1)对人牙髓细胞(human dental pulp cells,HDPC)胶原合成的影响。方法 采用细胞培养、酶联免疫吸附分析及免疫组化染色等方法,就ET-1对HDPC胶原合成的影响进行了研究。结果 ET-1较对照组除24小时时相外,均有不同程度的促HDPC可溶性I型胶原合成作用,但对III型胶原作用不明显;经免疫组化染色证实:ET-1尚可同时促进细胞非溶解性I型胶原合成。结论 ET-1促进HDPC I型胶原合成增加,可能对牙髓组织的自身修复起作用。
Effects of endothelin -1 on the collagen synthesis of cultured human dental pulp cells YAN Yan,LIU Zheng. School of Stomatology, Shanghai Second Medical University, Shanghai 200011
, http://www.100md.com
【Abstract】 Objective To study the effects of endothelin-1(ET-1) on the collagen synthesis of cultured human dental pulp cells. Methods Cell cultured, enzyme linked immmun sorbent assay (ELISA),and ABC immunhistochemical staining were used in the study. Results ET-1 increased the synthesis of soluble type I collagen in different periods besides the 24h group, and had no effects on the type III collagen; immunohistochemical staining revealed that ET-1 also increased the synthesis of unsoluble type I collagen. Conclusion ET-1 can stimulate type I collagenic synthesis of human dental pulp cells and might have an effect on pulp self-restoration.
, 百拇医药
【Key words】 Endothelins Collagen Enzyme-linked immmunosorbent assay Immunohistochemistry
细胞外间质(extro cellular matrix,ECM)是由胶原等蛋白组成,目前认为ECM除了支持、保护作用外,还与细胞增生、分化、伤口愈合及钙化等机体功能有着密切联系。内皮素1(endothelin-1,ET-1)具有促进人牙髓细胞(human dental pulp cells ,HDPC)增生及促进细胞内Ca2+增加等作用,但ET-1对HDPC胶原合成的作用迄今尚未见报道。为此,我们运用细胞培养、酶联免疫吸附测定及免疫组化染色等方法对ET-1对HDPC胶原的合成作用进行了研究。
材料与方法
1.材料:①I型Collage单抗 (Sigma,U.S.A.);②III型Collage单抗 (Sigma,U.S.A.);③ET-1 (Sigma,U.S.A.);④ABC试剂盒 (Vector,U.S.A.);⑤羊抗小鼠II抗 (华美);⑥Vitarmin C (上海);⑦I、III型胶原标准品 (华美)。
, 百拇医药
2.实验分组:①空白对照组:DMEM+10%FBS;②实验ET-1组:含10-6 mol/L ET-1的10% FBS;③实验VitC组:将50 mg/L VitC溶于10% FBS。
3.实验方法(enzyme-linked immunosorbent assay,ELISA)[1]:细胞第8代,按2万/孔接种于24孔板内,每孔内含1 cm×1 cm大小的盖玻片,每组6孔。12% FBS置于37℃培养箱常规培养,48小时后待细胞长成单层,培养液换成含实验所需条件10% FBS的DMEM,连续置于37℃、5% CO2中培养,分别于3小时、12小时、24小时及72小时取出,收集培养液,于-70℃下保存待测。
4.绘制标准曲线:将胶原(I型、III型)所用包被液(pH 9.6的碳酸缓冲液)稀释为0.1、0.2、0.4、0.8、1.6、3.2、6.4及12.8 mg/L,再将此胶原稀释液加入聚苯乙烯微孔板小孔内,每孔100 μl,置4℃下12小时。用PBS-tween 20洗3次,加I、III型胶原抗血清(1∶1 000)100 μl,放37℃湿盒1小时,取出孔板,用PBS-tween 20洗3次,加入羊抗小鼠(过氧化物酶标记)IgG,每孔100 μl,37℃湿盒1小时。取出,用PBS-tween 20漂洗,加入酶底物(邻苯二胺),室温湿盒中反应30 min,然后加入25 μl 2 mol/L 的H2SO4终止反应,在490 nm波长下比色,以A490为纵座标,绘制标准曲线。
, 百拇医药
5.样本测试:参照绘制标准曲线的方法,将100 μl样本放入聚苯乙烯微孔内(用NaOH调pH至9.6),用100 μl的10% FBS调零,4℃下12小时,以后各步骤同上。
6.ABC免疫组织化学法[2]:95% 丙酮固定,用0.25% TritonX-100及5% DMSO漂洗10 min,浸入37℃ 0.75%及1.5%的H2O2-PBS中15 min(阻断内源性过氧化物酶)。PBS洗3次,滴加正常马血清,置37℃湿盒内30 min,清除非特异性染色,30 min后弃去马血清。滴加小鼠抗人I型胶原特异性抗体(1∶1 000),4℃12小时,PBS振洗3 min,共3次,ABC复合试剂37℃ 30 min,PBS振洗2次,THB振洗3 min。DAB显色10~20 min。水洗5 min,逐级乙醇脱水,石碳酸、二甲苯透明、封片,镜下观察。
7.统计学方法:数据以
 ±s表示,采用方差分析,以P<0.05为显著性标准。
±s表示,采用方差分析,以P<0.05为显著性标准。, 百拇医药
结果
1. ET-1对人牙髓细胞I型胶原合成的影响:经ELISA方法检测,与对照组相比,ET-1、VitC组I型胶原浓度在12及72小时明显增加,P<(0.05~0.01);但在3、24及48小时3组间I型胶原浓度差异均无显著性,P> 0.05(图1)。

图1 内皮素1、VitC及I型胶原的浓度比较
2. ET-1对人牙髓细胞III型胶原合成的影响:图2所示,ET-1、VitC与对照组细胞相比,3组间对III型胶原的作用差异无显著性,P>0.05。

图2 内皮素1、VitC及III型胶原的浓度比较
, 百拇医药
3.I型胶原ABC免疫组化染色观察:3组培养细胞均可见I型胶原阳性着色。胶原多呈网织、条索状,其间可见散在的牙髓细胞胞核,部分胞核成团,形态较模糊。ET-1(图3)及VitC组(图4)的阳性程度均强于对照组(图5)。

图3 对照组12小时,I型胶原染色弱阳性(↑),胶原呈稀疏条索状,细胞核散在,部分融合成团(N),形态较模糊 (ABC×224)

图4 ET-1组12小时,I型胶原染色阳性(↑),胶原密集呈网状 (ABC×140)

图5 Vit C组12小时,I型胶原染色阳性(↑),胶原密集呈树枝状分布,细胞核清晰(N) (ABC×224)
, 百拇医药
讨论
胶原是牙髓组织中细胞外间质的主要成分。它对局部牙髓组织中牙髓细胞的分化、增殖及牙髓修复、抗损伤等均有重要意义。本组实验发现,ET-1较对照组除实验24小时时相外,均有不同程度的促I型胶原合成作用,以12及72小时最为显著,但对III型胶原的作用不明显。这提示ET-1在促进HDPC的胶原合成中有亚型的区别。本组结果与Rizvi和Myers[3]一致。这可能与牙髓内I型胶原含量最高,HDPC受ET-1刺激后优先表达I型胶原有关。由此我们认为,ET-1对牙髓组织疾病状态时的自身修复起作用。
ET-1促HDPC胶原合成的机制仍不清楚,这可能与抑制细胞内胶原酶活性[4]、ET-1与受体结合后不易分离,延长了其刺激效应[5]及ET-1通过细胞内其它生长因子的表达而调节胶原水平[6]有关。ET-1促HDPC胶原合成机制尚有待进一步研究。
, 百拇医药
本实验发现,在实验初始3~24小时,各组胶原浓度均有下降趋势,这可能与细胞对置换较低浓度血清不适应、表现出的不稳定状态有关。研究还发现,实验中0.4%及1% FBS血清的低浓度不能支持HDPC,使用后细胞出现漂浮。由此证明:牙髓细胞是十分娇嫩的细胞,实验中所能耐受的最低血清浓度为10% FBS。
免疫吸附分析法(ELISA)于1980年被改良,可利用特异性抗体直接测量组织内胶原。Buckley等[6]及Burke等[7]以往的研究均证明,细胞培养时合成分泌的胶原为可溶性胶原,且多分布在培养液内。本研究采用ELISA方法,利用I、III型胶原单抗检测了不同实验组HDPC的可溶性胶原浓度,并结合免疫组化法直接观察了细胞染色情况,结果表明两种实验方法结果基本一致。提示HDPC所分泌的胶原,除部分为可溶性溶解在培养液内,其余部分则为不溶解性分泌沉积在细胞外周,以形成三维结构的胞外基质,利于细胞的多层粘附、生长。由于两组实验结果平行,我们认为ELISA与免疫组化法均可选择,可根据不同实验目的来决定取舍。
, 百拇医药
参考文献
[1] 李玉瑞, 主编.细胞外间质生物化学及研究方法. 第1版.北京: 人民卫生出版社, 1988.232-234.
[2] 司徒镇强, 吴军正,主编. 细胞培养. 第1版.西安:世界图书出版公司,1996.202-203.
[3] Rizvi MA, Myers PR . Nitric oxide modulates basal and endothelin-induced coronary artery vascular smooth muscle cell proliferation and collagen levels. J Mol Cell Cardiol, 1997, 29: 1779-1789.
[4] Guarda E. Myers P. Karwa L. Effects of endothelins on collagen turnover in cardiac fiborblasts. Cardiovasc Res, 1993, 27:2130-2134.
, 百拇医药
[5] Hirata Y, Yoshimi H, Takaichi S, et al. Binding and receptor down-regulation of a novel vasoconstrictor endothelin in cultured rat vascular smooth muscle cells. FEBS Lett, 1988 ,239: 13-17.
[6] Buckley A, Hill KE, Davidson JM. Collagen metabolism. Methods Enzymol, 1988,163: 674- 694.
[7] Burke J, Balian G, Ross R, et al. Synthesis of type I and III procollagen and collagen by monkey aortic smooth muscle cells in vitro. Biochemistry, 1977, 16:3243-3249.
(收稿:1998-07-07 修回:1999-01-26), 百拇医药