角膜内皮细胞对丝裂原刺激的淋巴细胞活化和增殖的抑制作用△
作者:李志杰 林剑 李辰
单位:510632 广州,暨南大学组织移植与免疫实验中心,眼科学教研室
关键词:角膜;内皮细胞;免疫赦免;免疫调控;前房相关免疫偏离;细胞培养
角膜内皮细胞对丝裂原刺激的淋巴细胞 活化和增殖的抑制作用 摘要 目的 观察角膜内皮细胞(CEC)对淋巴细胞活化和增殖的抑制活性,并分析其机制。方法 通过植片技术分离大鼠和兔CEC。在CEC单层上,观察淋巴细胞对丝裂原刀豆蛋白A(Con A)和同种异体抗原刺激的增殖反应。另外,将CEC培养上清直接转移到由Con A刺激的淋巴细胞增殖系统以观察CEC释放某些因子的抑制效应。结果 CEC对Con A或同种异体抗原刺激的淋巴细胞增殖反应可以施加有效的抑制效应。在这些检测系统中所观察到的抑制效应不具有MHC限制性。将CEC培养上清直接转移到由ConA刺激的淋巴细胞增殖系统,并未观察到显著的抑制效应。然而,当CEC培养上清经过浓缩和酸处理后,则在胸腺细胞共刺激实验中显示剂量-反应形式的抑制效应。 结论 CEC通过细胞交互作用和(或)释放某些抑制性因子对淋巴细胞的活化和增殖发挥潜在的抑制作用。CEC可能是构成眼前房免疫赦免的因素之一。
, http://www.100md.com
[眼科新进展 1999;19(3)∶145-148]
Inhibition of corneal endothelial cells on lymphocyte activation and proliferation induced by mitogen
LI Zhi-Jie,LIN Jian,LI Chen
Abstract Objective To investigate the inhibitory activity of corneal endothelial cells(CECs) on lymphocyte activation and proliferation,and to analyze its mechanism.Methods The CECs were isolated from rat and rabbit corneas by explant technique.On the monolayers of CECs,the proliferation reaction of lymphocytes to Concanavalin A(Con A) and alloantigens were investigated.In addition,CEC culture supernatant was transferred directly into the lymphocyte proliferation system stimulated by Con A to observe the inhibitory effects of factors released by CECs.Results CECs exerted a potent inhibitory effect on in vitro proliferation system of lymphocytes stimulated by Con A or alloantigen.The inhibitory effects that observed in these assays were not MHC-restricted.The CECs culture supernatant was transferred directly into the proliferation system of lymphocytes stimulated by Con A,but significant inhibitory effect was not observed.However,when the supernatant from CECs was concentrated and treated by acid activation,it exhibited the inhibitory effect of the thymocyte costimulation assays in dose-response way.Conclusions CECs have potent inhibition effect on lymphocyte activation and proliferation by cell interaction and/or some inhibitory factors,and would take a role in contributing to the immune privilege of anterior chamber.
, 百拇医药
Key words corneal;endothelial cell;immune privilege;immunoregulation;anterior chamber-associated immune deviation;cell culture
[Rec Adv Ophthalmol 1999;19(3)∶145-148]
眼前房具有独特的免疫学特征,针对抗原刺激,可诱导全身性抗原特异性迟发型超敏反应(delayed type hypersensitivity,DTH)的抑制,但保留正常的体液免疫反应和细胞毒T细胞反应。我们将该现象称为前房相关免疫偏离(anterior chamber-associated immune deviation,ACAID)[1]。ACAID的诱导与眼部独特的免疫微环境有着密切的关系。已证实,虹膜睫状体细胞可直接抑制淋巴细胞的增殖和活化;房水含有许多免疫抑制因子,包括转化生长因子-β(TGF-β)、血管活性肠肽、α-黑素细胞刺激激素和其它尚未辨明的小分子多肽,对抗原和丝裂原诱导的淋巴细胞增殖具有显著的抑制作用[2,3]。本文旨在观察内衬前房前壁的角膜内皮细胞(corneal endothelial cells,CEC)对淋巴细胞活化和增殖的调节效应,并对其相关机制进行了讨论。
, http://www.100md.com
1 材料和方法
1.1 CEC的培养及条件培养基的制备 使用植片法建立大鼠和兔角膜内皮细胞原代和传代培养[4]。在24孔板选择生长良好汇合的传代细胞。在12h内使用无血清IMDM培养基换液3次以去除残留的培养基。然后,每孔加入新鲜无血清培养基2mL,继续培养,每24h收集上清1次,共收集3次。2000r.min-1×10min,离心上清,去除细胞碎屑,加入1g.L-1牛血清白蛋白(FBS)。使用3.47u分子截流量透析袋透析浓缩25倍,-20℃冻存。在使用前分2组。其中一组进行酸激活处理:取200μL浓缩的培养上清,加1.5μL 6mol.L-1 HCl使pH≤3.5,在22℃孵育5~30min,然后加30μL中和缓冲液,然后按1∶4加入5mL.L-1FBS-RPMI1640培养基稀释,以备进行胸腺细胞增殖试验检测活性。
, 百拇医药
1.2 Con A诱导的脾淋巴细胞增殖[5] 断颈处死Lewis大鼠,无菌取脾,筛网研磨制备单细胞悬液,调整细胞浓度至5×109个.L-1,使用96孔培养板,每孔加细胞100μL,再加入Con A至终浓度为2.5mg.L-1。5mL.L-1 CO2,37℃培养48h。每孔加[3H]-TdR50μCi(20μL),继续培养24h。自动细胞收集器收集细胞,液闪计数测定同位素掺入量,结果用cpm表示。
1.3 混合淋巴细胞反应(mixed lymphocyte reaction,MLR)[6] 分别处死Lewis大鼠(反应细胞)和Wistar大鼠(刺激细胞),筛网研磨制备脾脏单细胞悬液,调整细胞浓度至0.5×109个.L-1。使用96孔板,每孔加反应细胞和刺激细胞各100μL。37℃孵育5d,每孔加50μCi(20μL)[3H]-TdR,继续培养24h。收集细胞,液闪测定cpm。
, http://www.100md.com
1.4 胸腺细胞增殖反应[7] 无菌制备C3H/HeJ小鼠胸腺单细胞悬液,调整细胞浓度至30×109个.L-1。使用96孔板,每孔加细胞悬液50μL,加10μL 100000U.L-1重组人白细胞介素1β和50μL PHA(4mg.L-1),最后加连续3倍稀释的CEC条件培养基待测样品100μL,每个样品设3个复孔。37℃,6mL.L-1CO2孵育72h,每孔加50μCi(20μL)[3H]-TdR。继续培养18h,收集细胞,液闪测定cpm。
2 结果
2.1 CEC对丝裂原激活脾细胞的抑制作用 在Con A存在下,脾淋巴细胞发生显著的增殖效应。但将Con A加脾细胞在CEC单层上共育时,则增殖反应显著减弱。但直接转移CEC培养上清对脾细胞的增殖则未见显著影响(见图1)。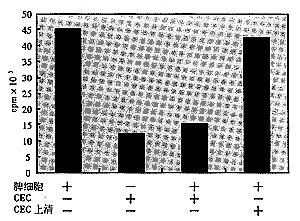
, http://www.100md.com
Figure 1 Inhibition effect of CECs on lymphocyte activation and proliferation
CEC对丝裂原刺激的淋巴细胞活化和增殖的抑制
2.2 非MHC和非种系限制性抑制 使用来自Lewis或Wistar大鼠的CEC,对来自Wistar或Lewis大鼠Con A激活的脾细胞具有同样的抑制作用。使用兔眼的CEC同样也可观察到对Lewis大鼠脾细胞的抑制(见图2)。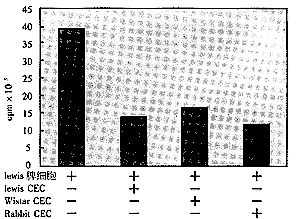
Figure 2 Effect of MHC-restriction on splenocyte proliferation
, 百拇医药
MHC限制性对脾细胞增殖反应的影响
2.3 与CEC共育对淋巴细胞活性的影响 分别将与CEC共育2、4、6d的脾细胞转移到空白孔,加入终浓度为2.5mg.L-1 Con A后,脾细胞的增殖反应可以恢复正常。
2.4 CEC对混合淋巴细胞反应(MLR)的抑制作用在CEC存在时,MLR受到显著抑制(占50%),CEC培养上清无显著抑制效应(图3)。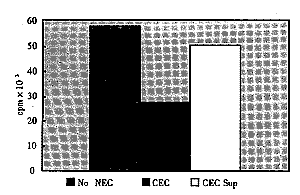
Figure 3 CECs effect of mixed lymphocyte reaction
CEC对混合淋巴细胞反应的影响
, http://www.100md.com
2.5 CEC培养上清酸激活后对胸腺细胞增殖的影响 CEC培养上清经透析浓缩后,发现未处理的样品对IL-1协同刺激的胸腺细胞增殖无显著影响。经酸激活的样品可观察到浓度相关的抑制趋势(图4)。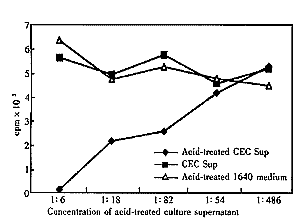
Figure 4 Inhibition effect of CECs culture supernatant which was acid-treated on thymocyte proliferation
CEC培养上清酸处理后对胸腺细胞增殖的抑制效应
3 讨论
最近,Obritsch等[8]证实CEC对抗原特异性T淋巴细胞系的增殖和活化具有强烈抑制作用。本研究发现CEC对丝裂原激活的T细胞增殖和MLR也具有抑制作用。这提示前房的免疫赦免是多因素构成的,CEC至少起着部分作用。
, 百拇医药
本研究发现CEC对脾淋巴细胞活化和增殖的抑制不具有MHC的限制性。在其它眼组织细胞也可观察到这种现象,如视网膜胶质细胞[9]和虹膜睫状体上皮细胞[10]。这提示:眼组织细胞对T细胞活化和增殖的非特异性抑制效应具有高度的进化保守性。这种自然保护现象对于眼局部免受免疫介导性损伤和维持自身的稳定具有重要的调节作用。
本实验发现,预激活脾淋巴细胞与CEC单层共育后仍显示部分抑制作用。这提示CEC对脾淋巴细胞激活后期仍然存在着另外的抑制机制。然而,Obritsch等[8]在抗原刺激的克隆Th细胞系并未发现上述后期抑制现象。我们使用的淋巴细胞是脾单细胞悬液,含有不同亚群的淋巴细胞和辅助细胞。这种细胞的不均一性可能是导致两者之间差异的原因。
关于CEC对淋巴细胞激活的抑制机制尚不清楚。我们将共育的脾细胞与CEC单层分离后,发现对丝裂原的反应可以恢复正常,这种可逆性提示上述抑制不可能是CEC对脾细胞的直接毒性所造成。那么,可能通过下述2条途径来实现抑制作用:一是释放可溶性细胞因子;二是通过细胞膜相关的抑制因子或细胞通讯。但是,将CEC上清直接转移到Con A刺激的增殖系统中,并未发现显著的抑制作用。但仍不能排除这种抑制作用来自释放可溶性因子的可能性。可能与其含量较少或不稳定有关,或发挥抑制作用的前提是需要这些细胞与CEC之间交互作用提供某些特定的环境。进一步的分析似乎支持上述假设。将CEC上清经过浓缩和酸处理后,可观察到浓度依赖的IL-1协同刺激的胸腺细胞增殖反应的抑制。这提示CEC释放的这些因子可能是以结合蛋白的潜活形式存在,必须在某种条件下被激活才能发挥作用。但CEC能否提供某些激活物质和酸性微环境尚待进一步研究。上述CEC培养上清活性需要酸激活的特征,提示细胞培养上清中可能含有TGF-β。业已证实在培养状态下CEC可表达TGF-β的mRNA[11]。但两者之间的关系尚不清楚。
, http://www.100md.com
综上所述,CEC对淋巴细胞活化和增殖的抑制是一多途径、多阶段的过程,可能需要细胞之间的交互作用、释放可溶性细胞因子或2种途径同时发挥作用。CEC可能是前房免疫赦免的构成因素之一。
△ 国家自然科学基金(No.39500158)、国家教育部霍英东教育基金(No.0501031) 和广东省自然科学基金(No.960208)资助
作者简介:李志杰,男,34岁,医学博士,眼科学副教授,免疫学副研究员,硕士生导师。主要从事眼科免疫学的基础和临床研究。Tel:020-85220298;Fax:020-85221941;E-mail:tlzj@jnu.edu.cn
Accepted for publication Feb 25,1999
From the Department of Ophthalmology,Institute of Tissue Transplantation & Immunology,Jinan University,Guangzhou 510632,Guangdong Province,China
, 百拇医药
参考文献
1 李志杰,李辰.眼免疫赦免的现代概念及临床意义.国外医学眼科学分册1996;20∶129- 135.
2 李志杰,李辰.角膜移植免疫赦免的研究现状.眼科研究1996;14∶270-273.
3 Streilein JW.Ocular immune privilege and the Faustian dilemma.Invest Ophthalmol Vis Sci 1997;37∶1940-1950.
4 Yue BYJI,Sugar J,Gilboy JE,et al. Growth of human corneal endothelial cells in culture.Invest Ophthalmol Vis Sci 1989;30∶248-259.
, 百拇医药
5 Coligan JE,Kruisbeek AM,Margulies DH,et al. Current Protocols in Immunology.New York:Greene Publishing and Wiley-Interscience 1991∶PP3.13.5.
6 Coligan JE,Kruisbeek AM,Margulies DH,et al. Current Protocols in Immunology.New York:Greene Publishing and Wiley-Interscience 1991∶PP3.12.6.
7 Granstein RD,Staszewski R,Knisely TL,et al. Aqueous humor contains transforming growth factor-β and a small inhibitor of thymocyte proliferation.J Immunol 1991;144∶3021-3027.
, 百拇医药
8 Obritsch WF,Kawashima H,Evangelista,et al. Inhibition of in vitro T cell activation by corneal endothelial cells.Cell Immunol 1992;144∶80-94.
9 Caspi RR,Roberge FG,Nussenblatt RB.Organ-resident,nonlymphoid cells suppress proliferation of autoimmune T-helper lymphocytes.Science 1989;237∶1029-1032.
10 Helbig H,Gurley RC,Palestine AG,et al. Dual effect of ciliary body cells on T lymphocyte.Eur J Immunol 1990;20∶2457-2463.
11 Wilson SE,Lloyd SA.Epidermal growth factor and receptor,basic fibroblast growth factor,transforming growth factor beta-1,and interleukin-1 alpha messenge RNA production in human corneal endothelial cells.Invest Ophthalmol Vis Sci 1991;32∶2747-2756.
收稿 1999-02-25 修回 1999-03-30, 百拇医药
单位:510632 广州,暨南大学组织移植与免疫实验中心,眼科学教研室
关键词:角膜;内皮细胞;免疫赦免;免疫调控;前房相关免疫偏离;细胞培养
角膜内皮细胞对丝裂原刺激的淋巴细胞 活化和增殖的抑制作用 摘要 目的 观察角膜内皮细胞(CEC)对淋巴细胞活化和增殖的抑制活性,并分析其机制。方法 通过植片技术分离大鼠和兔CEC。在CEC单层上,观察淋巴细胞对丝裂原刀豆蛋白A(Con A)和同种异体抗原刺激的增殖反应。另外,将CEC培养上清直接转移到由Con A刺激的淋巴细胞增殖系统以观察CEC释放某些因子的抑制效应。结果 CEC对Con A或同种异体抗原刺激的淋巴细胞增殖反应可以施加有效的抑制效应。在这些检测系统中所观察到的抑制效应不具有MHC限制性。将CEC培养上清直接转移到由ConA刺激的淋巴细胞增殖系统,并未观察到显著的抑制效应。然而,当CEC培养上清经过浓缩和酸处理后,则在胸腺细胞共刺激实验中显示剂量-反应形式的抑制效应。 结论 CEC通过细胞交互作用和(或)释放某些抑制性因子对淋巴细胞的活化和增殖发挥潜在的抑制作用。CEC可能是构成眼前房免疫赦免的因素之一。
, http://www.100md.com
[眼科新进展 1999;19(3)∶145-148]
Inhibition of corneal endothelial cells on lymphocyte activation and proliferation induced by mitogen
LI Zhi-Jie,LIN Jian,LI Chen
Abstract Objective To investigate the inhibitory activity of corneal endothelial cells(CECs) on lymphocyte activation and proliferation,and to analyze its mechanism.Methods The CECs were isolated from rat and rabbit corneas by explant technique.On the monolayers of CECs,the proliferation reaction of lymphocytes to Concanavalin A(Con A) and alloantigens were investigated.In addition,CEC culture supernatant was transferred directly into the lymphocyte proliferation system stimulated by Con A to observe the inhibitory effects of factors released by CECs.Results CECs exerted a potent inhibitory effect on in vitro proliferation system of lymphocytes stimulated by Con A or alloantigen.The inhibitory effects that observed in these assays were not MHC-restricted.The CECs culture supernatant was transferred directly into the proliferation system of lymphocytes stimulated by Con A,but significant inhibitory effect was not observed.However,when the supernatant from CECs was concentrated and treated by acid activation,it exhibited the inhibitory effect of the thymocyte costimulation assays in dose-response way.Conclusions CECs have potent inhibition effect on lymphocyte activation and proliferation by cell interaction and/or some inhibitory factors,and would take a role in contributing to the immune privilege of anterior chamber.
, 百拇医药
Key words corneal;endothelial cell;immune privilege;immunoregulation;anterior chamber-associated immune deviation;cell culture
[Rec Adv Ophthalmol 1999;19(3)∶145-148]
眼前房具有独特的免疫学特征,针对抗原刺激,可诱导全身性抗原特异性迟发型超敏反应(delayed type hypersensitivity,DTH)的抑制,但保留正常的体液免疫反应和细胞毒T细胞反应。我们将该现象称为前房相关免疫偏离(anterior chamber-associated immune deviation,ACAID)[1]。ACAID的诱导与眼部独特的免疫微环境有着密切的关系。已证实,虹膜睫状体细胞可直接抑制淋巴细胞的增殖和活化;房水含有许多免疫抑制因子,包括转化生长因子-β(TGF-β)、血管活性肠肽、α-黑素细胞刺激激素和其它尚未辨明的小分子多肽,对抗原和丝裂原诱导的淋巴细胞增殖具有显著的抑制作用[2,3]。本文旨在观察内衬前房前壁的角膜内皮细胞(corneal endothelial cells,CEC)对淋巴细胞活化和增殖的调节效应,并对其相关机制进行了讨论。
, http://www.100md.com
1 材料和方法
1.1 CEC的培养及条件培养基的制备 使用植片法建立大鼠和兔角膜内皮细胞原代和传代培养[4]。在24孔板选择生长良好汇合的传代细胞。在12h内使用无血清IMDM培养基换液3次以去除残留的培养基。然后,每孔加入新鲜无血清培养基2mL,继续培养,每24h收集上清1次,共收集3次。2000r.min-1×10min,离心上清,去除细胞碎屑,加入1g.L-1牛血清白蛋白(FBS)。使用3.47u分子截流量透析袋透析浓缩25倍,-20℃冻存。在使用前分2组。其中一组进行酸激活处理:取200μL浓缩的培养上清,加1.5μL 6mol.L-1 HCl使pH≤3.5,在22℃孵育5~30min,然后加30μL中和缓冲液,然后按1∶4加入5mL.L-1FBS-RPMI1640培养基稀释,以备进行胸腺细胞增殖试验检测活性。
, 百拇医药
1.2 Con A诱导的脾淋巴细胞增殖[5] 断颈处死Lewis大鼠,无菌取脾,筛网研磨制备单细胞悬液,调整细胞浓度至5×109个.L-1,使用96孔培养板,每孔加细胞100μL,再加入Con A至终浓度为2.5mg.L-1。5mL.L-1 CO2,37℃培养48h。每孔加[3H]-TdR50μCi(20μL),继续培养24h。自动细胞收集器收集细胞,液闪计数测定同位素掺入量,结果用cpm表示。
1.3 混合淋巴细胞反应(mixed lymphocyte reaction,MLR)[6] 分别处死Lewis大鼠(反应细胞)和Wistar大鼠(刺激细胞),筛网研磨制备脾脏单细胞悬液,调整细胞浓度至0.5×109个.L-1。使用96孔板,每孔加反应细胞和刺激细胞各100μL。37℃孵育5d,每孔加50μCi(20μL)[3H]-TdR,继续培养24h。收集细胞,液闪测定cpm。
, http://www.100md.com
1.4 胸腺细胞增殖反应[7] 无菌制备C3H/HeJ小鼠胸腺单细胞悬液,调整细胞浓度至30×109个.L-1。使用96孔板,每孔加细胞悬液50μL,加10μL 100000U.L-1重组人白细胞介素1β和50μL PHA(4mg.L-1),最后加连续3倍稀释的CEC条件培养基待测样品100μL,每个样品设3个复孔。37℃,6mL.L-1CO2孵育72h,每孔加50μCi(20μL)[3H]-TdR。继续培养18h,收集细胞,液闪测定cpm。
2 结果
2.1 CEC对丝裂原激活脾细胞的抑制作用 在Con A存在下,脾淋巴细胞发生显著的增殖效应。但将Con A加脾细胞在CEC单层上共育时,则增殖反应显著减弱。但直接转移CEC培养上清对脾细胞的增殖则未见显著影响(见图1)。

, http://www.100md.com
Figure 1 Inhibition effect of CECs on lymphocyte activation and proliferation
CEC对丝裂原刺激的淋巴细胞活化和增殖的抑制
2.2 非MHC和非种系限制性抑制 使用来自Lewis或Wistar大鼠的CEC,对来自Wistar或Lewis大鼠Con A激活的脾细胞具有同样的抑制作用。使用兔眼的CEC同样也可观察到对Lewis大鼠脾细胞的抑制(见图2)。

Figure 2 Effect of MHC-restriction on splenocyte proliferation
, 百拇医药
MHC限制性对脾细胞增殖反应的影响
2.3 与CEC共育对淋巴细胞活性的影响 分别将与CEC共育2、4、6d的脾细胞转移到空白孔,加入终浓度为2.5mg.L-1 Con A后,脾细胞的增殖反应可以恢复正常。
2.4 CEC对混合淋巴细胞反应(MLR)的抑制作用在CEC存在时,MLR受到显著抑制(占50%),CEC培养上清无显著抑制效应(图3)。

Figure 3 CECs effect of mixed lymphocyte reaction
CEC对混合淋巴细胞反应的影响
, http://www.100md.com
2.5 CEC培养上清酸激活后对胸腺细胞增殖的影响 CEC培养上清经透析浓缩后,发现未处理的样品对IL-1协同刺激的胸腺细胞增殖无显著影响。经酸激活的样品可观察到浓度相关的抑制趋势(图4)。

Figure 4 Inhibition effect of CECs culture supernatant which was acid-treated on thymocyte proliferation
CEC培养上清酸处理后对胸腺细胞增殖的抑制效应
3 讨论
最近,Obritsch等[8]证实CEC对抗原特异性T淋巴细胞系的增殖和活化具有强烈抑制作用。本研究发现CEC对丝裂原激活的T细胞增殖和MLR也具有抑制作用。这提示前房的免疫赦免是多因素构成的,CEC至少起着部分作用。
, 百拇医药
本研究发现CEC对脾淋巴细胞活化和增殖的抑制不具有MHC的限制性。在其它眼组织细胞也可观察到这种现象,如视网膜胶质细胞[9]和虹膜睫状体上皮细胞[10]。这提示:眼组织细胞对T细胞活化和增殖的非特异性抑制效应具有高度的进化保守性。这种自然保护现象对于眼局部免受免疫介导性损伤和维持自身的稳定具有重要的调节作用。
本实验发现,预激活脾淋巴细胞与CEC单层共育后仍显示部分抑制作用。这提示CEC对脾淋巴细胞激活后期仍然存在着另外的抑制机制。然而,Obritsch等[8]在抗原刺激的克隆Th细胞系并未发现上述后期抑制现象。我们使用的淋巴细胞是脾单细胞悬液,含有不同亚群的淋巴细胞和辅助细胞。这种细胞的不均一性可能是导致两者之间差异的原因。
关于CEC对淋巴细胞激活的抑制机制尚不清楚。我们将共育的脾细胞与CEC单层分离后,发现对丝裂原的反应可以恢复正常,这种可逆性提示上述抑制不可能是CEC对脾细胞的直接毒性所造成。那么,可能通过下述2条途径来实现抑制作用:一是释放可溶性细胞因子;二是通过细胞膜相关的抑制因子或细胞通讯。但是,将CEC上清直接转移到Con A刺激的增殖系统中,并未发现显著的抑制作用。但仍不能排除这种抑制作用来自释放可溶性因子的可能性。可能与其含量较少或不稳定有关,或发挥抑制作用的前提是需要这些细胞与CEC之间交互作用提供某些特定的环境。进一步的分析似乎支持上述假设。将CEC上清经过浓缩和酸处理后,可观察到浓度依赖的IL-1协同刺激的胸腺细胞增殖反应的抑制。这提示CEC释放的这些因子可能是以结合蛋白的潜活形式存在,必须在某种条件下被激活才能发挥作用。但CEC能否提供某些激活物质和酸性微环境尚待进一步研究。上述CEC培养上清活性需要酸激活的特征,提示细胞培养上清中可能含有TGF-β。业已证实在培养状态下CEC可表达TGF-β的mRNA[11]。但两者之间的关系尚不清楚。
, http://www.100md.com
综上所述,CEC对淋巴细胞活化和增殖的抑制是一多途径、多阶段的过程,可能需要细胞之间的交互作用、释放可溶性细胞因子或2种途径同时发挥作用。CEC可能是前房免疫赦免的构成因素之一。
△ 国家自然科学基金(No.39500158)、国家教育部霍英东教育基金(No.0501031) 和广东省自然科学基金(No.960208)资助
作者简介:李志杰,男,34岁,医学博士,眼科学副教授,免疫学副研究员,硕士生导师。主要从事眼科免疫学的基础和临床研究。Tel:020-85220298;Fax:020-85221941;E-mail:tlzj@jnu.edu.cn
Accepted for publication Feb 25,1999
From the Department of Ophthalmology,Institute of Tissue Transplantation & Immunology,Jinan University,Guangzhou 510632,Guangdong Province,China
, 百拇医药
参考文献
1 李志杰,李辰.眼免疫赦免的现代概念及临床意义.国外医学眼科学分册1996;20∶129- 135.
2 李志杰,李辰.角膜移植免疫赦免的研究现状.眼科研究1996;14∶270-273.
3 Streilein JW.Ocular immune privilege and the Faustian dilemma.Invest Ophthalmol Vis Sci 1997;37∶1940-1950.
4 Yue BYJI,Sugar J,Gilboy JE,et al. Growth of human corneal endothelial cells in culture.Invest Ophthalmol Vis Sci 1989;30∶248-259.
, 百拇医药
5 Coligan JE,Kruisbeek AM,Margulies DH,et al. Current Protocols in Immunology.New York:Greene Publishing and Wiley-Interscience 1991∶PP3.13.5.
6 Coligan JE,Kruisbeek AM,Margulies DH,et al. Current Protocols in Immunology.New York:Greene Publishing and Wiley-Interscience 1991∶PP3.12.6.
7 Granstein RD,Staszewski R,Knisely TL,et al. Aqueous humor contains transforming growth factor-β and a small inhibitor of thymocyte proliferation.J Immunol 1991;144∶3021-3027.
, 百拇医药
8 Obritsch WF,Kawashima H,Evangelista,et al. Inhibition of in vitro T cell activation by corneal endothelial cells.Cell Immunol 1992;144∶80-94.
9 Caspi RR,Roberge FG,Nussenblatt RB.Organ-resident,nonlymphoid cells suppress proliferation of autoimmune T-helper lymphocytes.Science 1989;237∶1029-1032.
10 Helbig H,Gurley RC,Palestine AG,et al. Dual effect of ciliary body cells on T lymphocyte.Eur J Immunol 1990;20∶2457-2463.
11 Wilson SE,Lloyd SA.Epidermal growth factor and receptor,basic fibroblast growth factor,transforming growth factor beta-1,and interleukin-1 alpha messenge RNA production in human corneal endothelial cells.Invest Ophthalmol Vis Sci 1991;32∶2747-2756.
收稿 1999-02-25 修回 1999-03-30, 百拇医药