诱导体外扩增的小鼠骨髓CD34+造血细胞分化为树突状细胞*
作者:董强刚 叶闻斐 王亦宾 江晓丰 冯久贤
单位:董强刚 江晓丰 冯久贤(上海市胸科医院,上海市胸部肿瘤研究所(上海200030);叶闻斐(上海医科大学研究生);王亦宾(中国科学院上海细胞生物学研究所研究生)
关键词:树突细胞;CD34;造血干细胞;体外扩增;小鼠
肿瘤990303 目的 诱导体外培养扩增后的小鼠骨髓CD34+造血细胞分化为树突状细胞(DC)。方法 C57BL/6j小鼠骨髓CD34+细胞采用血管内皮细胞共培养方法进行体外扩增,扩增后的CD34+细胞经磁性细胞分选技术纯化,并用GM-CSF等细胞因子诱导其向DC分化。结果 小鼠骨髓CD34+造血细胞不论是否经过体外培养均可被诱导分化为DC,后者具有典型的树突状形态特征,表达高水平的MHC I、II类抗原和CD86共刺激分子,在混合白细胞反应(MLR)中能有效地刺激静息期T淋巴细胞增殖。结论小鼠骨髓CD34+细胞经体外培养扩增后仍然具有向DC分化的能力,通过骨髓细胞体外培养扩增可以显著提高DC产量。
, 百拇医药
INDUCTION OF DENDRITIC CELL DIFFERENTIATION FROM
MURINE BONE MARROW CD34+ HEMA
TOPOIETIC CELLS EXPANDED EX VIVO
Dong Qianggang,Ye Wenfei,Wang Yibin,et al.Shanghai Institute of
Thoracic Tumors,Shanghai Chest Hospital,Shanghai 200030
Objective:To induce the dendritic cell (DC) differentiation from murine bone marrow CD34+ hematopoietic cells expanded ex vivo.Methods:The marrow CD34+ cell of C37BL/6j mice were expandedex vivo by using a bone marrow microvessel endothelial cell co-culture method.The expanded CD34+ cells were purified by MACS and then induced by cytokines including GM-CSF to differentiate into DC.Results:The murine bone marrow CD34+ cells can be induced invitro for DC differentiation,regardless of expanded ex vivo or not.The obtainedcells had a typical morphology constant to DC,expressed a high level of MHC class I and II antigens as well as CD86 co-stimulator molecule,and were potent stimulators for quiescent T lymphocytes in the mixed leukocyte reaction.Furthermore,the expanded marrow cells can be induced directly into DC without the need of purification procedure,and thereby the yield of DC can be further increased.Conclusion:Murine marrow CD34+ cells after expanded exvivo remained the capacity of differentiating into DC.The yield of DC can be,therefore, increased significantly by ex vivo expansion of the marrow hematopoietic cells.
, 百拇医药
Key words Dendritic cells CD34 Hematopoietic stem cells Expansion exvivo Mice
树突状细胞(Dendritic Cells,DC)是体内的专职抗原递呈细胞(ProfessionalAntigen-presenting Cells),其显著特征是能够激活静息期T淋巴细胞,诱导初次免疫应答。这些细胞在许多疾病、特别是恶性肿瘤的生物治疗中具有广泛的应用价值[1~3]。然而,DC及其前体细胞在体内含量甚少,无论用骨髓CD34+原始造血细胞或外周血单个核粘附细胞作体外诱导,要获得足够数量DC进行生物治疗,目前在技术上尚存在相当大的困难。据此,一些学者[4]提
出先对CD34+细胞进行体外培养扩增,然后诱导扩增后的造血细胞分化为DC。这种诱导方法为肿瘤的DC生物治疗研究提供了有利的条件,但目前国内尚缺乏这类报道。
, 百拇医药
作者最近报道[5,6],小鼠骨髓CD34+细胞能选择性地与骨髓微血管内皮细胞(Bone Marrow Microvessel Endothelial Cells,BMEC)粘附,这类粘附的造血细胞在内皮细胞分泌的造血细胞因子刺激下活跃增殖,扩增的细胞半数以上表达CD34抗原和干细胞因子(CSF)受体c-kit。这些细胞具有长期造血重建功能,可以用于小鼠肺癌大剂量化疗后的移植治疗,从而揭示CD34+细胞能够在体外培养扩增并保持造血功能。本文在前期工作的基础上,进一步研究了这类培养扩增后的CD34+细胞分化为DC的可能性。
材料与方法
生化试剂 IMDM培养基干粉购自GIBCO BRL公司。按生产商提供的配方配制,内含10%胎牛血清(FCS,美国Hyclon公司)、5×10-5 mol/L二巯基乙醇及100 U/ml青、链霉素(简称IMDM)。MTT购自SIGMA公司。二甲基亚砜(DMSO,化学纯)购自上海硫酸厂。重组细胞因子、小鼠干细胞因子(Stem Cell Factor,SCF)、小鼠粒细胞-巨噬细胞集落刺激因子(Granulocyte-Macrophage Colony-Stimulating Factor,GM-CSF)、人白细胞介素-6(Interleukin-6,IL-6)和人肿瘤坏死因子α(Tumor Necrosis Factor α,TNFα)购自英国Pepro Tech公司。大鼠抗小鼠CD34单抗杂交瘤MEC 14.7[7]由意大利Mario Negri药理研究所A.Vecchi教授惠赠,其余单抗均购自美国PharMingen公司。
, 百拇医药
动物 BALB/c和C57BL/6j纯种小鼠(雌性,体重18~20 g,8~10周龄)购自中外合资上海西普尔必凯实验动物有限公司。
骨髓细胞的体外培养扩增 详见前文报道[5,6]。
磁性细胞分离(MACS)方法 待分离的细胞与特定的大鼠抗小鼠单抗4℃温育20 min后,离心洗涤2次,加入磁珠交联的羊抗大鼠IgG继续温育20 min。阳性细胞按生产商德国Miltenyi Biotec公司提供的方法,应用MiniMACS Unit进行分离。
树突状细胞的体外诱导 将1×106扩增的骨髓细胞或分离的CD34+细胞置于6孔板小孔中,加入含GM-CSF、IL-6和SCF(各10 ng/ml)的IMDM,体积为4 ml/孔。培养4天(其间在培养2天时添加上述细胞因子一次)后轻轻晃动培养板,吸去非粘附细胞,加入4 ml含GM-CSF(10 ng/ml)的IMDM继续培养3天。第7天时洗涤去除非粘附细胞,加入5 ml生理盐水,用吸管冲吸多次,收集松散粘附细胞,离心后重悬于IMDM中,加入GM-CSF(10 ng/ml)和TNFα(30 ng/ml),培养24 h。收获非粘附的DC供进一步分析。
, 百拇医药
细胞形态观察 培养第0、4、7、8天时分别在相差显微镜下观察并摄片。收获的DC滴于多聚赖氨酸被覆的玻片上,37℃温育4 h后用戊二醛固定,扫描电镜观察并摄片(由中科院上海细胞生物学研究所电镜室协助进行)。
流式细胞仪分析 待测细胞采用直接法或间接法进行抗体染色标记,FACScan流式细胞仪检测阳性细胞比例,方法同前[5,6]。
混合白细胞反应(MLR) 采用MACS方法从BALB/c小鼠脾脏细胞中纯化CD4+T淋巴细胞,用IMDM调整至2×106细胞/ml,于96孔圆底培养板小孔内加入0.1 ml作为反应细胞。刺激细胞为C57小鼠脾脏细胞或收获的DC,用IMDM调整至2×106细胞/ml,加入50μg/ml丝裂霉素(Mitomycin C,日本Kyowa Hakko Kogyo Co.,Ltd.生产),37 ℃水浴温育30min后,离心洗涤3次,重悬于IMDM中。调整至适当细胞浓度后每孔加入0.1 ml。各浓度组重复3个孔,同时设反应细胞和刺激细胞单独培养组作为对照。培养5天后用MTT法测定活细胞[6]。
, 百拇医药
统计处理 采用Student′s t test作统计学分析。
结果
一、CD34+细胞的体外培养扩增和纯化小鼠骨髓中CD34+细胞约占有核细胞总数的5%(见图1B)。这些细胞经过内皮细胞粘附并培养1周后,数量增加了60余倍,其中CD34+细胞比例为45%(见图1C)。采用MACS技术对上述二类骨髓细胞进行分离纯化后,CD34+细胞的纯度达到98%(见图1D)。
图1 小鼠骨髓CD34+细胞的流式细胞仪分析骨髓细胞经间接法荧光标记测定CD34+细胞含量,A)对照组;B)正常C57小鼠骨髓细胞;C)培养扩增后的骨髓细胞;D)MACS分离纯化后的C组骨髓细胞(B组骨髓细胞纯化后结果相同,资料未列)。
, 百拇医药
二、树突状细胞分化成熟过程中的形态改变
分离纯化的CD34+细胞为圆形的非粘附细胞(见图2A),它们在SCF、IL-6和GM-CSF的协同作用下活跃增殖,形成三个细胞群,一是非粘附的粒细胞(表达Gr-1抗原,资料未列);二是牢固粘附的、梭形或卵圆形的单核-巨噬细胞;三是松散粘附的圆形细胞。因此经4天培养后洗涤去除粒细胞,可获得后两类细胞(见图2B)。这些细胞在GM-CSF单独作用下继续培养3天,并经再次洗涤去除粒细胞后,获得粘附的单核-巨噬细胞(用吸管冲洗不易脱落)和松散粘附的圆形细胞团块,后者极易脱落(见图2C)。收集上述细胞团块并用GM-CSF和TNFα培养24 h,即获得大量毛刺状的非粘附细胞(见图2D)。在扫描电镜下(见图3),这些毛刺状细胞表面可见丰富的、呈分叉的树突状(Dendritic)胞浆突起,某些突起形成薄片样结构(sheet-like veils or lamellipodia),符合典型的DC形态特征。
, 百拇医药
图2 树突细胞分化成熟过程中的形态改变
A.CD34+细胞诱导培养后4小时 ×160;B.培养4天并洗涤去除非粘附细胞×160;
C.培养7天并洗涤去除非粘附细胞×160; D.培养第8天收获的DC ×200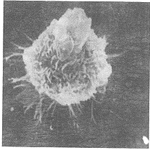
图3 树突状细胞的扫描电镜观察培养第8天的DC ×40,000
三、树突状细胞的抗原表型
应用荧光抗体双标记染色和流式细胞仪检测,对正常小鼠脾脏细胞和体外诱导产生的DC进行了抗原表型的比较分析。结果显示,脾脏细胞98%以上表达MHC I类抗原H-2kb,其中半数左右(57%)表达II类抗原Ia,但CD86(B7-2)抗原染色阴性(见图4B、C);与此相反,DC细胞群中CD86抗原和II类抗原的阳性率均高达99%,并且I类抗原的表达水平明显高于脾脏细胞(见图4E、F)。
, 百拇医药
四、树突状细胞在混合白细胞反应中的刺激作用
以MACS纯化的BALB/c小鼠脾脏CD+4T淋巴细胞(MHC I类抗原为H-2kd)作为反应细胞,经丝裂霉素处理后的C57小鼠脾脏细胞或DC (I类抗原为H-2kb)作为刺激细胞,进行了单向混合白细胞反应(MLR),观察刺激细胞对静息期T细胞的活化作用。图5结果显示,将2×105 DC(A组)或脾脏细胞(C组)与等量CD+4T细胞一起培养,均能有效刺激T细胞增殖,但将刺激细胞数量降低100倍时,DC仍保持明显的刺激作用,而脾脏细胞已几乎不能刺激T细胞增殖,两组间差异极显著(P<0.001)。在此实验中,将DC或脾脏细胞单独培养未见细胞增殖(B、D组),将CD4+细胞单独培养也未见细胞增殖,其光密度与等量刺激细胞相近(数据未列)。
, 百拇医药
图4 树突状细胞的抗原表型分析
正常脾脏细胞和体外诱导产生的DC按直接法用荧光素标记单抗染色和流式细胞仪分析。A、D为对
照组;B、E为抗CD86(PE标记)和抗Ia(FITC标记)抗体染色;C、F为抗H-2k(PE标记)和抗Ia FITC
标记)抗体染色。
五、诱导扩增的骨髓细胞分化为树突状细胞
扩增的骨髓细胞主要由CD34+细胞和Gr-1+细胞组成,两者的比例约为1∶1。因此,作者进一步探索了能否不经过CD34+细胞纯化步骤,直接用扩增的骨髓细胞诱导DC分化。实验结果表明,在培养第4天时只要充分洗涤去除非粘附的粒细胞,应用扩增的骨髓细胞完全可以诱导获得高纯度的DC,用这种方法获得的DC不仅形态完全相同,而且在抗原表型和MLR刺激能力上与用CD34+细胞诱导获得的DC无显著差异(见附表)。同时由于不经过纯化过程,CD34+细胞的损失少,直接应用扩增的骨髓细胞进行诱导可使DC产量进一步增加10倍左右。此外,作者还试图直接用未经纯化的正常骨髓细胞诱导DC,但未能获得成功(资料未列)。
, http://www.100md.com
图5 混合白细胞反应
将BALB/c小鼠CD+4T细胞与C57小鼠脾脏细胞或DC按不同比例混合后培养5天,MTT法测定细胞增
殖。A组:DC+CD+4T细胞;B组:DC单独培养;C组:脾脏细胞+CD+4T细胞;D组:脾脏细胞单独
培养。各点的标准差均<10%。
附表 比较应用不同类型造血细胞诱导产生的树突状细胞
树突状细胞来源
DC产量×106/鼠
抗原表型
, http://www.100md.com
MLR刺激活性*
H-2+Ia+
CD86+Ia+
骨髓CD34+细胞
0.7
98%
99%
9.5
扩增的CD34+细胞
30.0
98%
, 百拇医药
99%
9.1
扩增的骨髓细胞
300.0
98%
97%
8.0
*选择DC∶T细胞比例为1∶10时,DC+T细胞混合培养组与T细胞单独培养组的光密度比值。
讨论
应用细胞因子诱导人体CD34+细胞定向分化为DC近年来已有大量文献报道[8]。最近的研究进一步证明,经体外培养扩增的CD34+细胞可在PMA的刺激下分化为DC[9]。这些资料显示,人体CD34+细胞是DC的前体细胞,此类细胞经过体外培养仍可以被诱导分化为DC。小鼠原始造血细胞表达CD34抗原[10],但小鼠CD34+细胞能否被诱导分化为DC,目前尚无文献报道。本文对此进行了探索。实验资料显示,所得的细胞具有典型的DC形态特征,表达高水平的MHC I、II类抗原递呈分子和CD86共刺激分子,在MLR中能有效刺激异基因小鼠CD4+T细胞增殖。综合上述观察指标,可以认定本文获得的细胞确系DC。因此,本文首次报道,小鼠CD34+细胞无论是否经过体外培养均能被诱导分化为DC。
, http://www.100md.com
通过CD34+细胞体外培养后再使其分化为DC,主要目的是显著提高DC产量。但究竟能多大程度提高DC产量,目前还缺乏确切的数据。本文对此作了初步分析。结果表明,一只小鼠骨髓经过体外培养扩增后可以分离获得1×107 CD34+细胞,经诱导后可得3×107 DC;而直接从骨髓中分离仅能获得约3×105 CD34+细胞(约占骨髓细胞总数的1%),经诱导后可得7×105DC,因此通过CD34+细胞培养可使DC数量增加40余倍。此外,培养扩增的骨髓细胞由于含有高比例的CD34+细胞,可以不经过分离纯化步骤直接用于DC诱导,而正常骨髓细胞不经分离纯化不能用于DC诱导。因此,应用培养的骨髓细胞诱导DC不仅显著节省了费用,而且还能进一步使DC数量达到3×108细胞/鼠,约增加400余倍。最后,实验结果揭示应用本方法能稳定地诱导获得纯度几乎达到100%的DC细胞群。这种高纯度DC对深入研究其细胞生物学特性和免疫学功能十分重要。
, 百拇医药
综上所述,小鼠骨髓CD34+细胞不论是否经过体外培养均可被诱导分化为DC,提示小鼠DC与人体的相应细胞一样,是由CD34+细胞分化成熟形成。此外,本文建立了一种经济、高效的DC诱导方法,即直接应用培养扩增的骨髓细胞诱导DC,借此可以在体外大量培养高纯度DC供进一步研究。
致谢:意大利Mario Negri药理研究所A.Vecchi教授惠赠小鼠CD34抗原特异性单抗杂交瘤,谨表感谢。
*本工作获国家自然科学基金项目及上海市卫生系统“百人计划”资助
参 考 文 献
1 Marland G,Bakker AB,Adema GJ,et al. Dendritic cells in immune response induction.Stem Cells,1996,14:501
, 百拇医药
2 Steinman RM.Dendritic cells and immune-based therapies.Expl Hematol,1996,24:859
3 Mayordomo JI,Zorina T,Struks WJ, et al. Bone marrow-derived dendritic cells serve as potent adjuvants for peptide-based antitumor vaccines.Stem Cells,1997,15:94
4 Scheding S,Kratz-Albers K,Meister B, et al. Ex vivo expansion of hematopoietic progenitor cells for clinical use.Semin Hematol,1998,35:232
5 董强刚,冯久贤,顾伟勇,等.体外扩增的小鼠骨髓CD34+和c-kit+细胞具有长期造血功能.肿瘤,1998,18:66
, http://www.100md.com
6 董强刚,顾伟勇,江晓丰,等.大剂量化疗和体外扩增的骨髓细胞移植治疗小鼠Lewis肺癌的实验研究.肿瘤,1998,18:71
7 Galanda C,Berthier R,Garin J, et al. Characterization of MEC 14.7,a new monoclonal antibody recognizing mouse CD34:a useful reagent for identifying and characterizing blood vessels and hematopoietic precursors.Eur J Cell Biol,1997,73:368
8 Szabolcs P,Moore MAS,Young JW.Expansion of immunostimulatory dendritic cells among the myeloid progeny of human CD34+ bone marrow precursors cultured with c-kit-ligand,GM-CSF, and TNFα. J Immunol,1995,154:5851
, 百拇医药
9 Davis TA,Saini AA,Blair PJ, et al. Phorbol esters induce differentiation of human CD34+ hematopoietic progenitors to dendritic cells:evidence forprotein kinase C-mediated signaling.J Immunol,1998,160:3689
10 Morel F,Szilvassy SJ, Travis M,et al. Primitive hematopoietic cells in murine bone marrow express the CD34 antigen.Blood,1996,88:3774
第一作者简介 董强刚,男,哲学博士,副教授,硕士导师。
(收稿:1998-09-22 修回:1998-12-25), http://www.100md.com
单位:董强刚 江晓丰 冯久贤(上海市胸科医院,上海市胸部肿瘤研究所(上海200030);叶闻斐(上海医科大学研究生);王亦宾(中国科学院上海细胞生物学研究所研究生)
关键词:树突细胞;CD34;造血干细胞;体外扩增;小鼠
肿瘤990303 目的 诱导体外培养扩增后的小鼠骨髓CD34+造血细胞分化为树突状细胞(DC)。方法 C57BL/6j小鼠骨髓CD34+细胞采用血管内皮细胞共培养方法进行体外扩增,扩增后的CD34+细胞经磁性细胞分选技术纯化,并用GM-CSF等细胞因子诱导其向DC分化。结果 小鼠骨髓CD34+造血细胞不论是否经过体外培养均可被诱导分化为DC,后者具有典型的树突状形态特征,表达高水平的MHC I、II类抗原和CD86共刺激分子,在混合白细胞反应(MLR)中能有效地刺激静息期T淋巴细胞增殖。结论小鼠骨髓CD34+细胞经体外培养扩增后仍然具有向DC分化的能力,通过骨髓细胞体外培养扩增可以显著提高DC产量。
, 百拇医药
INDUCTION OF DENDRITIC CELL DIFFERENTIATION FROM
MURINE BONE MARROW CD34+ HEMA
TOPOIETIC CELLS EXPANDED EX VIVO
Dong Qianggang,Ye Wenfei,Wang Yibin,et al.Shanghai Institute of
Thoracic Tumors,Shanghai Chest Hospital,Shanghai 200030
Objective:To induce the dendritic cell (DC) differentiation from murine bone marrow CD34+ hematopoietic cells expanded ex vivo.Methods:The marrow CD34+ cell of C37BL/6j mice were expandedex vivo by using a bone marrow microvessel endothelial cell co-culture method.The expanded CD34+ cells were purified by MACS and then induced by cytokines including GM-CSF to differentiate into DC.Results:The murine bone marrow CD34+ cells can be induced invitro for DC differentiation,regardless of expanded ex vivo or not.The obtainedcells had a typical morphology constant to DC,expressed a high level of MHC class I and II antigens as well as CD86 co-stimulator molecule,and were potent stimulators for quiescent T lymphocytes in the mixed leukocyte reaction.Furthermore,the expanded marrow cells can be induced directly into DC without the need of purification procedure,and thereby the yield of DC can be further increased.Conclusion:Murine marrow CD34+ cells after expanded exvivo remained the capacity of differentiating into DC.The yield of DC can be,therefore, increased significantly by ex vivo expansion of the marrow hematopoietic cells.
, 百拇医药
Key words Dendritic cells CD34 Hematopoietic stem cells Expansion exvivo Mice
树突状细胞(Dendritic Cells,DC)是体内的专职抗原递呈细胞(ProfessionalAntigen-presenting Cells),其显著特征是能够激活静息期T淋巴细胞,诱导初次免疫应答。这些细胞在许多疾病、特别是恶性肿瘤的生物治疗中具有广泛的应用价值[1~3]。然而,DC及其前体细胞在体内含量甚少,无论用骨髓CD34+原始造血细胞或外周血单个核粘附细胞作体外诱导,要获得足够数量DC进行生物治疗,目前在技术上尚存在相当大的困难。据此,一些学者[4]提
出先对CD34+细胞进行体外培养扩增,然后诱导扩增后的造血细胞分化为DC。这种诱导方法为肿瘤的DC生物治疗研究提供了有利的条件,但目前国内尚缺乏这类报道。
, 百拇医药
作者最近报道[5,6],小鼠骨髓CD34+细胞能选择性地与骨髓微血管内皮细胞(Bone Marrow Microvessel Endothelial Cells,BMEC)粘附,这类粘附的造血细胞在内皮细胞分泌的造血细胞因子刺激下活跃增殖,扩增的细胞半数以上表达CD34抗原和干细胞因子(CSF)受体c-kit。这些细胞具有长期造血重建功能,可以用于小鼠肺癌大剂量化疗后的移植治疗,从而揭示CD34+细胞能够在体外培养扩增并保持造血功能。本文在前期工作的基础上,进一步研究了这类培养扩增后的CD34+细胞分化为DC的可能性。
材料与方法
生化试剂 IMDM培养基干粉购自GIBCO BRL公司。按生产商提供的配方配制,内含10%胎牛血清(FCS,美国Hyclon公司)、5×10-5 mol/L二巯基乙醇及100 U/ml青、链霉素(简称IMDM)。MTT购自SIGMA公司。二甲基亚砜(DMSO,化学纯)购自上海硫酸厂。重组细胞因子、小鼠干细胞因子(Stem Cell Factor,SCF)、小鼠粒细胞-巨噬细胞集落刺激因子(Granulocyte-Macrophage Colony-Stimulating Factor,GM-CSF)、人白细胞介素-6(Interleukin-6,IL-6)和人肿瘤坏死因子α(Tumor Necrosis Factor α,TNFα)购自英国Pepro Tech公司。大鼠抗小鼠CD34单抗杂交瘤MEC 14.7[7]由意大利Mario Negri药理研究所A.Vecchi教授惠赠,其余单抗均购自美国PharMingen公司。
, 百拇医药
动物 BALB/c和C57BL/6j纯种小鼠(雌性,体重18~20 g,8~10周龄)购自中外合资上海西普尔必凯实验动物有限公司。
骨髓细胞的体外培养扩增 详见前文报道[5,6]。
磁性细胞分离(MACS)方法 待分离的细胞与特定的大鼠抗小鼠单抗4℃温育20 min后,离心洗涤2次,加入磁珠交联的羊抗大鼠IgG继续温育20 min。阳性细胞按生产商德国Miltenyi Biotec公司提供的方法,应用MiniMACS Unit进行分离。
树突状细胞的体外诱导 将1×106扩增的骨髓细胞或分离的CD34+细胞置于6孔板小孔中,加入含GM-CSF、IL-6和SCF(各10 ng/ml)的IMDM,体积为4 ml/孔。培养4天(其间在培养2天时添加上述细胞因子一次)后轻轻晃动培养板,吸去非粘附细胞,加入4 ml含GM-CSF(10 ng/ml)的IMDM继续培养3天。第7天时洗涤去除非粘附细胞,加入5 ml生理盐水,用吸管冲吸多次,收集松散粘附细胞,离心后重悬于IMDM中,加入GM-CSF(10 ng/ml)和TNFα(30 ng/ml),培养24 h。收获非粘附的DC供进一步分析。
, 百拇医药
细胞形态观察 培养第0、4、7、8天时分别在相差显微镜下观察并摄片。收获的DC滴于多聚赖氨酸被覆的玻片上,37℃温育4 h后用戊二醛固定,扫描电镜观察并摄片(由中科院上海细胞生物学研究所电镜室协助进行)。
流式细胞仪分析 待测细胞采用直接法或间接法进行抗体染色标记,FACScan流式细胞仪检测阳性细胞比例,方法同前[5,6]。
混合白细胞反应(MLR) 采用MACS方法从BALB/c小鼠脾脏细胞中纯化CD4+T淋巴细胞,用IMDM调整至2×106细胞/ml,于96孔圆底培养板小孔内加入0.1 ml作为反应细胞。刺激细胞为C57小鼠脾脏细胞或收获的DC,用IMDM调整至2×106细胞/ml,加入50μg/ml丝裂霉素(Mitomycin C,日本Kyowa Hakko Kogyo Co.,Ltd.生产),37 ℃水浴温育30min后,离心洗涤3次,重悬于IMDM中。调整至适当细胞浓度后每孔加入0.1 ml。各浓度组重复3个孔,同时设反应细胞和刺激细胞单独培养组作为对照。培养5天后用MTT法测定活细胞[6]。
, 百拇医药
统计处理 采用Student′s t test作统计学分析。
结果
一、CD34+细胞的体外培养扩增和纯化小鼠骨髓中CD34+细胞约占有核细胞总数的5%(见图1B)。这些细胞经过内皮细胞粘附并培养1周后,数量增加了60余倍,其中CD34+细胞比例为45%(见图1C)。采用MACS技术对上述二类骨髓细胞进行分离纯化后,CD34+细胞的纯度达到98%(见图1D)。

图1 小鼠骨髓CD34+细胞的流式细胞仪分析骨髓细胞经间接法荧光标记测定CD34+细胞含量,A)对照组;B)正常C57小鼠骨髓细胞;C)培养扩增后的骨髓细胞;D)MACS分离纯化后的C组骨髓细胞(B组骨髓细胞纯化后结果相同,资料未列)。
, 百拇医药
二、树突状细胞分化成熟过程中的形态改变
分离纯化的CD34+细胞为圆形的非粘附细胞(见图2A),它们在SCF、IL-6和GM-CSF的协同作用下活跃增殖,形成三个细胞群,一是非粘附的粒细胞(表达Gr-1抗原,资料未列);二是牢固粘附的、梭形或卵圆形的单核-巨噬细胞;三是松散粘附的圆形细胞。因此经4天培养后洗涤去除粒细胞,可获得后两类细胞(见图2B)。这些细胞在GM-CSF单独作用下继续培养3天,并经再次洗涤去除粒细胞后,获得粘附的单核-巨噬细胞(用吸管冲洗不易脱落)和松散粘附的圆形细胞团块,后者极易脱落(见图2C)。收集上述细胞团块并用GM-CSF和TNFα培养24 h,即获得大量毛刺状的非粘附细胞(见图2D)。在扫描电镜下(见图3),这些毛刺状细胞表面可见丰富的、呈分叉的树突状(Dendritic)胞浆突起,某些突起形成薄片样结构(sheet-like veils or lamellipodia),符合典型的DC形态特征。

, 百拇医药
图2 树突细胞分化成熟过程中的形态改变
A.CD34+细胞诱导培养后4小时 ×160;B.培养4天并洗涤去除非粘附细胞×160;
C.培养7天并洗涤去除非粘附细胞×160; D.培养第8天收获的DC ×200

图3 树突状细胞的扫描电镜观察培养第8天的DC ×40,000
三、树突状细胞的抗原表型
应用荧光抗体双标记染色和流式细胞仪检测,对正常小鼠脾脏细胞和体外诱导产生的DC进行了抗原表型的比较分析。结果显示,脾脏细胞98%以上表达MHC I类抗原H-2kb,其中半数左右(57%)表达II类抗原Ia,但CD86(B7-2)抗原染色阴性(见图4B、C);与此相反,DC细胞群中CD86抗原和II类抗原的阳性率均高达99%,并且I类抗原的表达水平明显高于脾脏细胞(见图4E、F)。
, 百拇医药
四、树突状细胞在混合白细胞反应中的刺激作用
以MACS纯化的BALB/c小鼠脾脏CD+4T淋巴细胞(MHC I类抗原为H-2kd)作为反应细胞,经丝裂霉素处理后的C57小鼠脾脏细胞或DC (I类抗原为H-2kb)作为刺激细胞,进行了单向混合白细胞反应(MLR),观察刺激细胞对静息期T细胞的活化作用。图5结果显示,将2×105 DC(A组)或脾脏细胞(C组)与等量CD+4T细胞一起培养,均能有效刺激T细胞增殖,但将刺激细胞数量降低100倍时,DC仍保持明显的刺激作用,而脾脏细胞已几乎不能刺激T细胞增殖,两组间差异极显著(P<0.001)。在此实验中,将DC或脾脏细胞单独培养未见细胞增殖(B、D组),将CD4+细胞单独培养也未见细胞增殖,其光密度与等量刺激细胞相近(数据未列)。

, 百拇医药
图4 树突状细胞的抗原表型分析
正常脾脏细胞和体外诱导产生的DC按直接法用荧光素标记单抗染色和流式细胞仪分析。A、D为对
照组;B、E为抗CD86(PE标记)和抗Ia(FITC标记)抗体染色;C、F为抗H-2k(PE标记)和抗Ia FITC
标记)抗体染色。
五、诱导扩增的骨髓细胞分化为树突状细胞
扩增的骨髓细胞主要由CD34+细胞和Gr-1+细胞组成,两者的比例约为1∶1。因此,作者进一步探索了能否不经过CD34+细胞纯化步骤,直接用扩增的骨髓细胞诱导DC分化。实验结果表明,在培养第4天时只要充分洗涤去除非粘附的粒细胞,应用扩增的骨髓细胞完全可以诱导获得高纯度的DC,用这种方法获得的DC不仅形态完全相同,而且在抗原表型和MLR刺激能力上与用CD34+细胞诱导获得的DC无显著差异(见附表)。同时由于不经过纯化过程,CD34+细胞的损失少,直接应用扩增的骨髓细胞进行诱导可使DC产量进一步增加10倍左右。此外,作者还试图直接用未经纯化的正常骨髓细胞诱导DC,但未能获得成功(资料未列)。

, http://www.100md.com
图5 混合白细胞反应
将BALB/c小鼠CD+4T细胞与C57小鼠脾脏细胞或DC按不同比例混合后培养5天,MTT法测定细胞增
殖。A组:DC+CD+4T细胞;B组:DC单独培养;C组:脾脏细胞+CD+4T细胞;D组:脾脏细胞单独
培养。各点的标准差均<10%。
附表 比较应用不同类型造血细胞诱导产生的树突状细胞
树突状细胞来源
DC产量×106/鼠
抗原表型
, http://www.100md.com
MLR刺激活性*
H-2+Ia+
CD86+Ia+
骨髓CD34+细胞
0.7
98%
99%
9.5
扩增的CD34+细胞
30.0
98%
, 百拇医药
99%
9.1
扩增的骨髓细胞
300.0
98%
97%
8.0
*选择DC∶T细胞比例为1∶10时,DC+T细胞混合培养组与T细胞单独培养组的光密度比值。
讨论
应用细胞因子诱导人体CD34+细胞定向分化为DC近年来已有大量文献报道[8]。最近的研究进一步证明,经体外培养扩增的CD34+细胞可在PMA的刺激下分化为DC[9]。这些资料显示,人体CD34+细胞是DC的前体细胞,此类细胞经过体外培养仍可以被诱导分化为DC。小鼠原始造血细胞表达CD34抗原[10],但小鼠CD34+细胞能否被诱导分化为DC,目前尚无文献报道。本文对此进行了探索。实验资料显示,所得的细胞具有典型的DC形态特征,表达高水平的MHC I、II类抗原递呈分子和CD86共刺激分子,在MLR中能有效刺激异基因小鼠CD4+T细胞增殖。综合上述观察指标,可以认定本文获得的细胞确系DC。因此,本文首次报道,小鼠CD34+细胞无论是否经过体外培养均能被诱导分化为DC。
, http://www.100md.com
通过CD34+细胞体外培养后再使其分化为DC,主要目的是显著提高DC产量。但究竟能多大程度提高DC产量,目前还缺乏确切的数据。本文对此作了初步分析。结果表明,一只小鼠骨髓经过体外培养扩增后可以分离获得1×107 CD34+细胞,经诱导后可得3×107 DC;而直接从骨髓中分离仅能获得约3×105 CD34+细胞(约占骨髓细胞总数的1%),经诱导后可得7×105DC,因此通过CD34+细胞培养可使DC数量增加40余倍。此外,培养扩增的骨髓细胞由于含有高比例的CD34+细胞,可以不经过分离纯化步骤直接用于DC诱导,而正常骨髓细胞不经分离纯化不能用于DC诱导。因此,应用培养的骨髓细胞诱导DC不仅显著节省了费用,而且还能进一步使DC数量达到3×108细胞/鼠,约增加400余倍。最后,实验结果揭示应用本方法能稳定地诱导获得纯度几乎达到100%的DC细胞群。这种高纯度DC对深入研究其细胞生物学特性和免疫学功能十分重要。
, 百拇医药
综上所述,小鼠骨髓CD34+细胞不论是否经过体外培养均可被诱导分化为DC,提示小鼠DC与人体的相应细胞一样,是由CD34+细胞分化成熟形成。此外,本文建立了一种经济、高效的DC诱导方法,即直接应用培养扩增的骨髓细胞诱导DC,借此可以在体外大量培养高纯度DC供进一步研究。
致谢:意大利Mario Negri药理研究所A.Vecchi教授惠赠小鼠CD34抗原特异性单抗杂交瘤,谨表感谢。
*本工作获国家自然科学基金项目及上海市卫生系统“百人计划”资助
参 考 文 献
1 Marland G,Bakker AB,Adema GJ,et al. Dendritic cells in immune response induction.Stem Cells,1996,14:501
, 百拇医药
2 Steinman RM.Dendritic cells and immune-based therapies.Expl Hematol,1996,24:859
3 Mayordomo JI,Zorina T,Struks WJ, et al. Bone marrow-derived dendritic cells serve as potent adjuvants for peptide-based antitumor vaccines.Stem Cells,1997,15:94
4 Scheding S,Kratz-Albers K,Meister B, et al. Ex vivo expansion of hematopoietic progenitor cells for clinical use.Semin Hematol,1998,35:232
5 董强刚,冯久贤,顾伟勇,等.体外扩增的小鼠骨髓CD34+和c-kit+细胞具有长期造血功能.肿瘤,1998,18:66
, http://www.100md.com
6 董强刚,顾伟勇,江晓丰,等.大剂量化疗和体外扩增的骨髓细胞移植治疗小鼠Lewis肺癌的实验研究.肿瘤,1998,18:71
7 Galanda C,Berthier R,Garin J, et al. Characterization of MEC 14.7,a new monoclonal antibody recognizing mouse CD34:a useful reagent for identifying and characterizing blood vessels and hematopoietic precursors.Eur J Cell Biol,1997,73:368
8 Szabolcs P,Moore MAS,Young JW.Expansion of immunostimulatory dendritic cells among the myeloid progeny of human CD34+ bone marrow precursors cultured with c-kit-ligand,GM-CSF, and TNFα. J Immunol,1995,154:5851
, 百拇医药
9 Davis TA,Saini AA,Blair PJ, et al. Phorbol esters induce differentiation of human CD34+ hematopoietic progenitors to dendritic cells:evidence forprotein kinase C-mediated signaling.J Immunol,1998,160:3689
10 Morel F,Szilvassy SJ, Travis M,et al. Primitive hematopoietic cells in murine bone marrow express the CD34 antigen.Blood,1996,88:3774
第一作者简介 董强刚,男,哲学博士,副教授,硕士导师。
(收稿:1998-09-22 修回:1998-12-25), http://www.100md.com