短暂前脑缺血再灌注鼠海马区迟发性神经元死亡与凋亡的关系
作者:张秋灵 王瑜 王一镗 李鸿宾 杨晓荷 谢康民
单位:南京大学医学院附属南京鼓楼医院急诊中心(210008)
关键词:缺血再灌注;海马;迟发性神经元死亡;凋亡
中国急救医学990303 [摘 要] 目的 系统研究短暂前脑缺血再灌注后,海马迟发性神经元死亡与细胞凋亡的关系。方法 蒙古沙土鼠,前脑缺血5分钟,在再灌注的1小时、1天、3天、5天取海马,分别行末端脱氧核苷酸转移酶介导的d-UTP生物素缺口末端标记(TUNEL)染色光镜观察、透射电镜观察及流式细胞仪检测。结果 缺血再灌注组均出现了TUNEL阳性细胞,以再灌注3天组最为显著,再灌注3天组电镜下可见凋亡小体,再灌注1小时、1天、3天、5天与对照组的凋亡细胞百分比分别为19.20%、25.88%、43.18%、26.73%和18.14%。再灌注3天组凋亡细胞与对照组有显著差异,其余各组与对照组均无显著差异。结论 沙土鼠短暂前脑缺血再灌注损伤后,海马区神经元发生了迟发性死亡,主要表现为细胞凋亡。
, 百拇医药
The relationship between delayed neuronal death and apoptosis in gerbil's Hipocampus after transient forebrain ischemia
Zhang Qiuling,Wang Yu,Wang Yitang,et al.
Department of Emergency Center, Gulou Hospital Affiliated Medical College of Nanjing University,Nanjing 210008
[Abstract] Objective At present,cerebral ischemia-reperfusion may cause neuronal injuries in two patterns:necrosis and apoptosis. The main way of ischemic neuronal death, particular of DND,hasn't been clearly known so far. The purpose of our study was to investigate DND and apoptosis of the hipocampal cells in the gerbils' model induced by bilateral carotid arteria transient ischemia.Methods Gerbils (n=56,controls,n=15)were subjected to 5 minutes of bilateral carotid arteria occlusion and were killed at various time of reperfusion (1 hour,1 day,3 days, 5days). Apoptosis could be observed with light microscopy following TUNEL and electron microscopy. Flow cytometry was used to quantify the apoptotic neurons. Results (1)Light microscopy:Positive neurons, that is apoptotic neurons, wasn't found in th control or the group reperfused for 1 hour, but they were detected in other groups reperfused longer.(2)Electron microscopy:The aggregation of chromatin into dense sharply delineated masses. Cytopasm showed condensation and the development of broad surface protuberances. The organelles remained strucrally intact. (3)Flow cytometry:The apoptotic percentage of the control and groups reperfused for 1 hour,1 day, 3days,5days are 18.14% and 19.20%,25.88%,43.18%,26.73%,18.14% respectively. The data indicated the same time dependance between DND and apoptosis. Conclusion DND and apoptosis have the property of parallel time dependance. At the exact time of DND, neuronal death is proved mainly to be apoptosis from both morphology and biochemistry. The results suggest that DND may be associated mechanistically with apoptotic cell death.
, 百拇医药
[Key Words] Ischemia-reperfusion Hippocampus DND Apoptosis
随着人们生活水平的提高,脑血管疾病也呈逐渐增多的趋势。1982年,Kirino首次提出迟发性神经元死亡(delayed neuronal death,DND)〔1〕的概念。近年来,DND与脑缺血、脑退行性变等的关系受到广泛关注,其发生机制也成为目前研究的热点。坏死是有害信号极度刺激造成的被动的病理性死亡,伴有一系列炎症病理改变。与坏死不同,凋亡〔2〕是一主动过程,是细胞内外因素激活细胞核酸内切酶等导致本身自杀程序而引起。本研究在建立适当动物模型的基础上,从形态和生化两方面,对海马区死亡神经元进行了凋亡细胞的定性和定量检测。
1 资料与方法
1.1 仪器及设备 TUNEL染色试剂盒(美国宝灵曼公司),流式细胞仪(Facsaliur型,美国B-D公司),透视电镜(H-300型,日立公司)。
, 百拇医药
1.2 实验动物及分组 健康成年蒙古沙土鼠,雌雄不限,体重50~80g,随机分为两大组:对照组(n=15);缺血再灌注组(n=56),包括再灌注1小时组(n=10),再灌注1天组(n=15),再灌注3天组(n=16),再灌注5天组(n=15)。
1.3 动物模型制作 腹腔注射0.6%戊巴比妥钠30mg/kg体重,使动物麻醉,结扎双侧颈总动脉,造成前脑缺血。5分钟后,去除阻断,血流再通,形成前脑缺血再灌注模型,缝合颈部切口,待动物苏醒并正常活动后,将其放回笼中,正常喂养。
1.4 TUNEL标本制作
1.4.1 材料与试剂 TdT缓冲液;标记液;抗体;TUNEL反应混合物:1份TdT缓冲液与9份标记液混匀;蛋白酶K:10~20μg/ml,溶于tris/HC1中;PBS:pH7.4、NaH2PO4、K2HPO4、蒸馏水。
, 百拇医药
1.4.2 标本制作 缺血再灌注达预定时间后,在麻醉状态下用4%的中性多聚甲醛磷酸缓冲液作心内灌注,直至动物全身僵硬,以固定鼠脑。迅速分离并取出已固定的脑组织,放入4%的中性多聚甲醛中后固定24~48小时,4℃冰箱保存。常规石蜡切片(约5μm厚)。按试剂盒步骤行TUNEL染色,最后伊红复染,树脂封片,光镜下观察分析。凋亡阳性细胞呈深紫蓝色者。
1.5 电镜标本制作 再灌注达预定时间后,拉颈处死,立即断头取脑并分离出海马,常规电镜超薄切片(厚约1.0μm),上透视电镜观察。
1.6 流式细胞分析 再灌注达预定时间后,拉颈处死,迅速分离脑组织并取出海马,制成细胞悬液,碘化丙啶(Propi-diumiodide,PI)(50mg/L)染色,上流式细胞仪分析。
1.7 数据处理 形态学以照片显示,数据以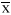 ±s表示,统计学方法为t检验。
±s表示,统计学方法为t检验。
, 百拇医药
2 结果
2.1 TUNEL染色,光镜观察 凋亡阳性细胞(图1)为深紫蓝色,多数散在分布,少数片状或灶性分布,形态有数种,核膜着色,核断片状,不规则,胞膜有程度不等的卷曲并深入胞浆内部,将胞浆分隔成大小不等的片状,有的胞浆与核一起从胞体脱落,外包有完整的胞膜,形成典型的凋亡小体(Apoptotic body),是凋亡在形态学上最典型的特征;对照组(图2)显示正常细胞仅见淡粉红色的胞浆,核不着色,形态规则。
图1 再灌注3天组TUNEL染色,光镜观察(×400)
图2 对照组TUNEL染色,光镜观察(×400)
实验组除再灌注1小时组外,其余各组均出现了凋亡阳性细胞,以再灌注3天组(图1)最为显著。
, http://www.100md.com
2.2 电镜观察 对照组在多个视野内均为正常神经元(图3)。再灌注1天和5天组病变较轻,异常神经元主要表现为核皱缩、异染色质增加并聚集于核膜下。再灌注3天组(图4)异常神经元增多。某些异常神经元可看到核碎片,外有完整的胞膜包绕,并有胞质与完整的细胞器,形成凋亡小体。
图3 电镜下正常神经元(×7500)
图4 电镜下凋亡神经元(×10500)
2.3 流式细胞检测 细胞凋亡过程中,核内DNA被降解成寡核苷酸片段,经PI染色后可直接观察到细胞DNA含量变化,从而得到凋亡细胞比例。各组海马区凋亡细胞百分比见附表。
附表 流式细胞仪检测不同组沙土鼠海马凋亡细胞百分比(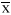 ±s) 组别
±s) 组别
, 百拇医药
再灌注时间
n
凋亡细胞(%)
坏死细胞(%)
对照组
12
18.14±1.23△△
0.95±0.06
缺血再
1小时
6
19.20±0.89△△
, 百拇医药
1.04±0.11
灌注组
1天
8
25.88±1.06△△
1.17±0.12
3天
9
**43.18±1.10△△
1.03±0.09
5天
8
, http://www.100md.com
26.73±1.14△△
0.96±0.11
注:t检验,缺血再灌注组与对照组比较*P<0.05,**P<0.01
凋亡细胞与坏死细胞比较△P<0.05,△△P<0.01
由附表可以看出,细胞死亡以凋亡为主,各组凋亡细胞比例与坏死比较都有非常显著的差异。而缺血再灌注组与对照组的凋亡细胞比较,只有再灌注3天组与对照组有显著差异,其余各组差异均无显著性。
3 讨论
3.1 动物模型的评价 蒙古种沙土鼠Willis环不全,缺少连接颈动脉和椎—基底动脉系统的后交通动脉,一些经过中脑腹侧的微小血管部分地起到交通作用,而在双侧大脑前动脉近端有的也无衔接的血管,阻断双侧颈总动脉后所有实验沙土鼠的前脑局部血流量几乎降至零[3]。在本实验中,我们选用了沙土鼠前脑缺血模型,制作过程简单,缺血结果可靠。研究中用的TUNEL技术[4]、流式细胞术及电镜观察,目前普遍认为是检测凋亡的准确、可行、有较高实用价值的方法,因此是确切可靠的。
, 百拇医药
3.2 迟发性神经元死亡与凋亡 真核细胞死亡有两种方式:坏死(necrosis)和凋亡(apoptosis)。1972年,Kerr[2]等人根据许多正常组织中存在的散在不完整细胞及细胞碎片的形态学特征,首先提出了生物学中的凋亡概念,即细胞发生自然死亡或细胞自杀。凋亡一旦开始便迅速进展,细胞裂解成小碎片,由膜结构包裹,内含碎裂的染色质和完好的细胞器,此为凋亡小体,是凋亡细胞的特有结构。凋亡小体被巨噬细胞或邻近组织细胞吞噬,整个过程不伴炎性反应[5]。凋亡的生化特征,公认的是核酸内切酶活化,产生寡聚核小体,其大小均是DNA长度为180~200碱基对的倍数[6]。坏死是一个被动的细胞死亡过程,当细胞受到严重的理化刺激或生物感染后常以这种方式死亡,早期形态学变化主要反映在细胞质中。
神经元对缺血侵袭具有不同的敏感性,即选择易损性,如海马的CAl区对缺血格外敏感,而与之相邻的齿状回则可耐受相当程度的缺血。1982年,Kirino通过用沙土鼠所做的实验,提出海马CAl区的慢性广泛性神经元丧失,暂时叫做迟发性神经元死亡,这是DND的首次提出[1]。同年,Pulsinelli在利用大白鼠所做的缺血模型中也得到了类似的结果[7]。从此以后,DND成为人们研究的热点,尤其DND的发生机制成为人们研究的兴趣所在。
, http://www.100md.com
凋亡是受基因调控的。有学者在DND模型中检测到凋亡相关基因的改变。C.Y.Hsu等利用大鼠的局部脑缺血再灌注模型,发现缺血后原癌基因c-fos和junB均增加,两者呈一致的时间依赖性。Linnik也在研究中发现,脑缺血后bcl-2的表达可以保护神经元免遭程序性死亡的威胁[8]。这些基因的表达说明缺血刺激能引起基因表达的改变,提示该处神经元死亡是受基因调控的,脑缺血时有凋亡机制参与。
研究发现,脑缺血5分钟再灌注1小时,海马区细胞结构基本正常,凋亡细胞比例与正常对照无显著差异,再灌注1天,可偶然发现凋亡细胞,凋亡比例稍有增加,而再灌注3天,神经元凋亡达到最高峰,5天时细胞结构基本恢复,凋亡发生的高峰期正是迟发性神经元死亡期,凋亡的数量远远高于坏死的数量,过了此高峰期后海马区细胞结构逐渐转为正常,与国外某些研究的结论一致。
凋亡是受基因调控的,而且其发生过程中需要生物大分子的合成,这就提示我们,控制了凋亡相关基因,或者控制其相关大分子的合成,便可以达到控制凋亡的目的,这对临床上治疗尤其是脑缺血引起的DND无疑是一种新的尝试。
, 百拇医药
至于是否控制凋亡的基因皆参与了DND中凋亡的调节,DND中凋亡发生的机制如何,尚需要做进一步探讨。
参考文献
1 Kirno T.Brain Res,1982,25:483-499
2 kerr J F,et al .Br J Cancer,1972,26:239-257
3 Crockard A,et al.Stroke,1980,11:494
4 Gavrieli,Sherman,Shmuel A.J Cell Biology,1992,119(3):493-501
5 Richard C,David M,John Ding-E.科学,1997,224:20-27
6 郑德先.中华病理学杂志,1996,25:50
7 Pulsinelli,W.A.Brierley,et al.Neurol,1982;11:491-498
8 Linnik,Zahos,Geschwind,et al.Stroke,1995,26(9):1670-1675
(收稿:1998-04-16), http://www.100md.com
单位:南京大学医学院附属南京鼓楼医院急诊中心(210008)
关键词:缺血再灌注;海马;迟发性神经元死亡;凋亡
中国急救医学990303 [摘 要] 目的 系统研究短暂前脑缺血再灌注后,海马迟发性神经元死亡与细胞凋亡的关系。方法 蒙古沙土鼠,前脑缺血5分钟,在再灌注的1小时、1天、3天、5天取海马,分别行末端脱氧核苷酸转移酶介导的d-UTP生物素缺口末端标记(TUNEL)染色光镜观察、透射电镜观察及流式细胞仪检测。结果 缺血再灌注组均出现了TUNEL阳性细胞,以再灌注3天组最为显著,再灌注3天组电镜下可见凋亡小体,再灌注1小时、1天、3天、5天与对照组的凋亡细胞百分比分别为19.20%、25.88%、43.18%、26.73%和18.14%。再灌注3天组凋亡细胞与对照组有显著差异,其余各组与对照组均无显著差异。结论 沙土鼠短暂前脑缺血再灌注损伤后,海马区神经元发生了迟发性死亡,主要表现为细胞凋亡。
, 百拇医药
The relationship between delayed neuronal death and apoptosis in gerbil's Hipocampus after transient forebrain ischemia
Zhang Qiuling,Wang Yu,Wang Yitang,et al.
Department of Emergency Center, Gulou Hospital Affiliated Medical College of Nanjing University,Nanjing 210008
[Abstract] Objective At present,cerebral ischemia-reperfusion may cause neuronal injuries in two patterns:necrosis and apoptosis. The main way of ischemic neuronal death, particular of DND,hasn't been clearly known so far. The purpose of our study was to investigate DND and apoptosis of the hipocampal cells in the gerbils' model induced by bilateral carotid arteria transient ischemia.Methods Gerbils (n=56,controls,n=15)were subjected to 5 minutes of bilateral carotid arteria occlusion and were killed at various time of reperfusion (1 hour,1 day,3 days, 5days). Apoptosis could be observed with light microscopy following TUNEL and electron microscopy. Flow cytometry was used to quantify the apoptotic neurons. Results (1)Light microscopy:Positive neurons, that is apoptotic neurons, wasn't found in th control or the group reperfused for 1 hour, but they were detected in other groups reperfused longer.(2)Electron microscopy:The aggregation of chromatin into dense sharply delineated masses. Cytopasm showed condensation and the development of broad surface protuberances. The organelles remained strucrally intact. (3)Flow cytometry:The apoptotic percentage of the control and groups reperfused for 1 hour,1 day, 3days,5days are 18.14% and 19.20%,25.88%,43.18%,26.73%,18.14% respectively. The data indicated the same time dependance between DND and apoptosis. Conclusion DND and apoptosis have the property of parallel time dependance. At the exact time of DND, neuronal death is proved mainly to be apoptosis from both morphology and biochemistry. The results suggest that DND may be associated mechanistically with apoptotic cell death.
, 百拇医药
[Key Words] Ischemia-reperfusion Hippocampus DND Apoptosis
随着人们生活水平的提高,脑血管疾病也呈逐渐增多的趋势。1982年,Kirino首次提出迟发性神经元死亡(delayed neuronal death,DND)〔1〕的概念。近年来,DND与脑缺血、脑退行性变等的关系受到广泛关注,其发生机制也成为目前研究的热点。坏死是有害信号极度刺激造成的被动的病理性死亡,伴有一系列炎症病理改变。与坏死不同,凋亡〔2〕是一主动过程,是细胞内外因素激活细胞核酸内切酶等导致本身自杀程序而引起。本研究在建立适当动物模型的基础上,从形态和生化两方面,对海马区死亡神经元进行了凋亡细胞的定性和定量检测。
1 资料与方法
1.1 仪器及设备 TUNEL染色试剂盒(美国宝灵曼公司),流式细胞仪(Facsaliur型,美国B-D公司),透视电镜(H-300型,日立公司)。
, 百拇医药
1.2 实验动物及分组 健康成年蒙古沙土鼠,雌雄不限,体重50~80g,随机分为两大组:对照组(n=15);缺血再灌注组(n=56),包括再灌注1小时组(n=10),再灌注1天组(n=15),再灌注3天组(n=16),再灌注5天组(n=15)。
1.3 动物模型制作 腹腔注射0.6%戊巴比妥钠30mg/kg体重,使动物麻醉,结扎双侧颈总动脉,造成前脑缺血。5分钟后,去除阻断,血流再通,形成前脑缺血再灌注模型,缝合颈部切口,待动物苏醒并正常活动后,将其放回笼中,正常喂养。
1.4 TUNEL标本制作
1.4.1 材料与试剂 TdT缓冲液;标记液;抗体;TUNEL反应混合物:1份TdT缓冲液与9份标记液混匀;蛋白酶K:10~20μg/ml,溶于tris/HC1中;PBS:pH7.4、NaH2PO4、K2HPO4、蒸馏水。
, 百拇医药
1.4.2 标本制作 缺血再灌注达预定时间后,在麻醉状态下用4%的中性多聚甲醛磷酸缓冲液作心内灌注,直至动物全身僵硬,以固定鼠脑。迅速分离并取出已固定的脑组织,放入4%的中性多聚甲醛中后固定24~48小时,4℃冰箱保存。常规石蜡切片(约5μm厚)。按试剂盒步骤行TUNEL染色,最后伊红复染,树脂封片,光镜下观察分析。凋亡阳性细胞呈深紫蓝色者。
1.5 电镜标本制作 再灌注达预定时间后,拉颈处死,立即断头取脑并分离出海马,常规电镜超薄切片(厚约1.0μm),上透视电镜观察。
1.6 流式细胞分析 再灌注达预定时间后,拉颈处死,迅速分离脑组织并取出海马,制成细胞悬液,碘化丙啶(Propi-diumiodide,PI)(50mg/L)染色,上流式细胞仪分析。
1.7 数据处理 形态学以照片显示,数据以
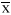 ±s表示,统计学方法为t检验。
±s表示,统计学方法为t检验。, 百拇医药
2 结果
2.1 TUNEL染色,光镜观察 凋亡阳性细胞(图1)为深紫蓝色,多数散在分布,少数片状或灶性分布,形态有数种,核膜着色,核断片状,不规则,胞膜有程度不等的卷曲并深入胞浆内部,将胞浆分隔成大小不等的片状,有的胞浆与核一起从胞体脱落,外包有完整的胞膜,形成典型的凋亡小体(Apoptotic body),是凋亡在形态学上最典型的特征;对照组(图2)显示正常细胞仅见淡粉红色的胞浆,核不着色,形态规则。

图1 再灌注3天组TUNEL染色,光镜观察(×400)

图2 对照组TUNEL染色,光镜观察(×400)
实验组除再灌注1小时组外,其余各组均出现了凋亡阳性细胞,以再灌注3天组(图1)最为显著。
, http://www.100md.com
2.2 电镜观察 对照组在多个视野内均为正常神经元(图3)。再灌注1天和5天组病变较轻,异常神经元主要表现为核皱缩、异染色质增加并聚集于核膜下。再灌注3天组(图4)异常神经元增多。某些异常神经元可看到核碎片,外有完整的胞膜包绕,并有胞质与完整的细胞器,形成凋亡小体。

图3 电镜下正常神经元(×7500)

图4 电镜下凋亡神经元(×10500)
2.3 流式细胞检测 细胞凋亡过程中,核内DNA被降解成寡核苷酸片段,经PI染色后可直接观察到细胞DNA含量变化,从而得到凋亡细胞比例。各组海马区凋亡细胞百分比见附表。
附表 流式细胞仪检测不同组沙土鼠海马凋亡细胞百分比(
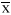 ±s) 组别
±s) 组别, 百拇医药
再灌注时间
n
凋亡细胞(%)
坏死细胞(%)
对照组
12
18.14±1.23△△
0.95±0.06
缺血再
1小时
6
19.20±0.89△△
, 百拇医药
1.04±0.11
灌注组
1天
8
25.88±1.06△△
1.17±0.12
3天
9
**43.18±1.10△△
1.03±0.09
5天
8
, http://www.100md.com
26.73±1.14△△
0.96±0.11
注:t检验,缺血再灌注组与对照组比较*P<0.05,**P<0.01
凋亡细胞与坏死细胞比较△P<0.05,△△P<0.01
由附表可以看出,细胞死亡以凋亡为主,各组凋亡细胞比例与坏死比较都有非常显著的差异。而缺血再灌注组与对照组的凋亡细胞比较,只有再灌注3天组与对照组有显著差异,其余各组差异均无显著性。
3 讨论
3.1 动物模型的评价 蒙古种沙土鼠Willis环不全,缺少连接颈动脉和椎—基底动脉系统的后交通动脉,一些经过中脑腹侧的微小血管部分地起到交通作用,而在双侧大脑前动脉近端有的也无衔接的血管,阻断双侧颈总动脉后所有实验沙土鼠的前脑局部血流量几乎降至零[3]。在本实验中,我们选用了沙土鼠前脑缺血模型,制作过程简单,缺血结果可靠。研究中用的TUNEL技术[4]、流式细胞术及电镜观察,目前普遍认为是检测凋亡的准确、可行、有较高实用价值的方法,因此是确切可靠的。
, 百拇医药
3.2 迟发性神经元死亡与凋亡 真核细胞死亡有两种方式:坏死(necrosis)和凋亡(apoptosis)。1972年,Kerr[2]等人根据许多正常组织中存在的散在不完整细胞及细胞碎片的形态学特征,首先提出了生物学中的凋亡概念,即细胞发生自然死亡或细胞自杀。凋亡一旦开始便迅速进展,细胞裂解成小碎片,由膜结构包裹,内含碎裂的染色质和完好的细胞器,此为凋亡小体,是凋亡细胞的特有结构。凋亡小体被巨噬细胞或邻近组织细胞吞噬,整个过程不伴炎性反应[5]。凋亡的生化特征,公认的是核酸内切酶活化,产生寡聚核小体,其大小均是DNA长度为180~200碱基对的倍数[6]。坏死是一个被动的细胞死亡过程,当细胞受到严重的理化刺激或生物感染后常以这种方式死亡,早期形态学变化主要反映在细胞质中。
神经元对缺血侵袭具有不同的敏感性,即选择易损性,如海马的CAl区对缺血格外敏感,而与之相邻的齿状回则可耐受相当程度的缺血。1982年,Kirino通过用沙土鼠所做的实验,提出海马CAl区的慢性广泛性神经元丧失,暂时叫做迟发性神经元死亡,这是DND的首次提出[1]。同年,Pulsinelli在利用大白鼠所做的缺血模型中也得到了类似的结果[7]。从此以后,DND成为人们研究的热点,尤其DND的发生机制成为人们研究的兴趣所在。
, http://www.100md.com
凋亡是受基因调控的。有学者在DND模型中检测到凋亡相关基因的改变。C.Y.Hsu等利用大鼠的局部脑缺血再灌注模型,发现缺血后原癌基因c-fos和junB均增加,两者呈一致的时间依赖性。Linnik也在研究中发现,脑缺血后bcl-2的表达可以保护神经元免遭程序性死亡的威胁[8]。这些基因的表达说明缺血刺激能引起基因表达的改变,提示该处神经元死亡是受基因调控的,脑缺血时有凋亡机制参与。
研究发现,脑缺血5分钟再灌注1小时,海马区细胞结构基本正常,凋亡细胞比例与正常对照无显著差异,再灌注1天,可偶然发现凋亡细胞,凋亡比例稍有增加,而再灌注3天,神经元凋亡达到最高峰,5天时细胞结构基本恢复,凋亡发生的高峰期正是迟发性神经元死亡期,凋亡的数量远远高于坏死的数量,过了此高峰期后海马区细胞结构逐渐转为正常,与国外某些研究的结论一致。
凋亡是受基因调控的,而且其发生过程中需要生物大分子的合成,这就提示我们,控制了凋亡相关基因,或者控制其相关大分子的合成,便可以达到控制凋亡的目的,这对临床上治疗尤其是脑缺血引起的DND无疑是一种新的尝试。
, 百拇医药
至于是否控制凋亡的基因皆参与了DND中凋亡的调节,DND中凋亡发生的机制如何,尚需要做进一步探讨。
参考文献
1 Kirno T.Brain Res,1982,25:483-499
2 kerr J F,et al .Br J Cancer,1972,26:239-257
3 Crockard A,et al.Stroke,1980,11:494
4 Gavrieli,Sherman,Shmuel A.J Cell Biology,1992,119(3):493-501
5 Richard C,David M,John Ding-E.科学,1997,224:20-27
6 郑德先.中华病理学杂志,1996,25:50
7 Pulsinelli,W.A.Brierley,et al.Neurol,1982;11:491-498
8 Linnik,Zahos,Geschwind,et al.Stroke,1995,26(9):1670-1675
(收稿:1998-04-16), http://www.100md.com