山莨菪碱对家兔急性全脑缺血再灌注期间兴奋性氨基酸释放及生存状况的影响
作者:占成业 邓普珍
单位:同济医科大学附属同济医院急诊科(武汉,430030)
关键词:全脑缺血再灌注;兴奋性氨基酸;山莨菪碱;生存率;神经功能缺陷评分
New Page 1 [摘 要] 目的 了解山莨菪碱对家兔急性全脑缺血再灌注期间兴奋性氨基酸释放及生存状况的影响。方法 56只家兔采用“闭塞双侧颈总动脉和椎动脉+体循环低血压法”建立急性全脑缺血再灌注损伤模型。观察山莨菪碱(Ani)对缺血再灌注期间脑组织兴奋性氨基酸(EAA)含量及动物生存状况的影响。结果 Ani 可降低脑组织EAA含量的下降幅度,提高动物24h生存率,降低神经功能缺陷评分。结论 Ani可抑制EAA过度释放,改善缺血再灌注脑损伤动物的生存状况,在临床脑复苏中可能有一定的应用前景。
The effects of anisodamine on the release of excitatory amino acid and survival condition after acute brain damage following complete cerebral ischemia and reperfusion in the rabbit
, http://www.100md.com
Zhan Chengye, Deng Puzhen.
Department of Emergency, Tongji Hospital, Tongji Medical University, Wuhan 430030
[Abstract] Objective To find out the effects of anisodamine on the release of excitatory amino acid and survival condition after a cute brain damage following complete cerebral ischemia and reperfusion in the rabbit.Methods The model of acute brain damage following complete cerebral ischemia and reperfusion was established in fifty six rabbits by ligation of bilateral carotids and vertebral arteries with systemic hypotension. By observing the effects of Anisodamine (Ani) on the content of excitatory amino acid (EAA) in brain tissues and survival condition in the duration of complete cerebral ischemia and reperfusion, the following results were found:with the use of Ani, the decline in the content of EAA was inhibited. Moreover, there were a increase in survival rate for twenty-four hours and a decrease in neurologic deficit score (NDS).Results We suggested that the use of Ani as early as possible can inhibit the overrelease of EAA and improve the survival condition after acute brain damage following complete cerebral ischemia and reperfusion.Conclusion We conclude that Ani is possibly good for clinic cerebral resuscitation if it is properly used.
, 百拇医药
[Key words] Anisodamine Excitatory amino acid Survival rate Neurologic deficit score Complete cerebral ischemia and reperfusion
兴奋性氨基酸的过度释放激活相应受体而产生的兴奋毒性在脑缺血再灌注损伤中起着极为重要的作用,很大程度上影响脑损伤的预后。然而目前抗兴奋毒性药物大多是通过阻断兴奋性氨基酸受体发挥效应,疗效不尽人意,且具有明显的毒副作用,难以应用于临床。本研究从影响兴奋性氨基酸释放的角度,探讨山莨菪碱(Ani)在对抗兴奋毒性,改善预后方面的前途,为山莨菪碱在临床脑复苏中的应用提供实验依据。
1 资料与方法
1.1 实验动物
健康家兔56只,由本院动物房提供,体重2.0~2.2kg,雌雄兼用,实验前禁食12h。
, http://www.100md.com
1.2 动物模型制备
采用“双侧颈总动脉和椎动脉血管闭塞+体循环低血压法”建立急性全脑缺血再灌注损伤模型。以3%戊巴比妥钠(30mg/kg体重)经耳静脉注射麻醉。分离双侧颈总动脉和椎动脉及一侧股动静脉。待动物清醒后,丝线结扎双侧椎动脉,动脉夹钳夹双侧颈总动脉。同时从股动脉抽血使平均动脉压降至5.3kPa,此为缺血期,时限15min。然后松开动脉夹,从股静脉回输自体血液,即为再灌注期。整个实验过程中以呼吸机维持机械通气。
1.3 脑组织氨基酸含量测定
随机抽取家兔26只,分成4组:对照组(n=5)只作手术操作,不作缺血处理;缺血组(n=7)缺血15min;再灌注组(n=7)再灌注2h;Ani组(n=7)。再灌注前5min静脉给予Ani 5mg/kg体重,后以5mg/h维持2h。达到规定时间后断头取脑组织300mg,用5%三氯醋酸于冰水环境下制成匀浆。低温超速离心15min,去除蛋白沉淀,取上清液在自动分析仪上进行氨基酸微量测定。
, 百拇医药
1.4 生存状况的观察
余下30只家兔随机分成3组:对照组(n=3)只行手术操作;缺血再灌注组(n=13)缺血15min再灌注24h,并于再灌注开始及再灌注6h、12h分别静脉给予甘露醇(20%)10~15ml/kg体重,地塞米松2.5mg/kg体重;Ani治疗组(n=14)除上述处理外,再灌注前5min给予Ani 5mg/kg体重,并以5mg/h维持2h。6h及12h后重复给药。分别于再灌注1h、2h、6h、9h、24h进行神经功能缺陷评分〔1〕(由未参加实验者评定),并统计24h存活数,计算生存率。
1.5 统计学处理
脑组织氨基酸含量的比较采用t检验;生存率的比较采用χ2检验,神经功能缺陷评分(NDS)的比较采用Kruske-wallis检验。
2 结果
, http://www.100md.com
2.1 脑组织氨基酸含量的变化:见表1。
表1 兔脑组织氨基酸含量变化(μmol/g湿组织)( ±s)
±s)
组 别
Glu
Asp
GABA
Gly
对照组(n=5)
10.12±1.73
, http://www.100md.com 3.98±0.74
1.35±0.41
1.31±0.03
缺血组(n=7)
7.28±0.97△
3.54±0.41△
1.68±0.17△
1.32±0.45
再灌注组(n=7)
6.24±1.25△△*
3.37±0.77△△*
, 百拇医药
1.87±0.12△△
1.29±0.67
山莨菪碱组(n=7)
9.21±0.91*#
3.71±0.13*■
1.55±0.55*■
1.32±0.31
与对照组比较 △P<0.05,与对照组比较 △△P<0.01,与缺血组比较 *P<0.05
与再灌注组比较 #P<0.01,与再灌注组比较 ■P<0.05 全脑缺血15min,脑组织兴奋性氨基酸Glu、Asp含量较对照组显著降低(P<0.05)。再灌注2h,其含量进一步下降。而再灌注早期应用Ani后Glu、Asp含量回升,尤以Glu含量增加更为明显(与再灌注组比较P<0.01)。另外,脑组织抑制性氨基酸GABA在缺血再灌注期间明显升高(与对照组比较P<0.05)。应用Ani治疗后,GABA含量有所下降(与再灌注组比较P<0.05)。甘氨酸(Gly)在整个缺血再灌注期间含量无明显变化。
, 百拇医药
2.2 动物神经功能缺陷评分的变化:见图1。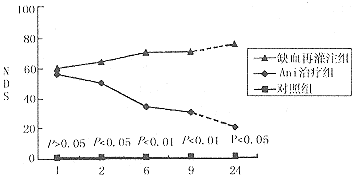
图1 动物神经功能及缺陷评分变化图
再灌注1h、2h、6h、9h、24h缺血再灌注组和Ani治疗组的神经功能缺陷评分(NDS)分别为60、64、70、70、75和56、50、34、30、20。缺血再灌注组NDS随再灌注时间的延长而逐渐升高,Ani治疗组NDS随再灌注时间延长而逐渐降低。除再灌注1h两组得分无统计学差异(P>0.05)外,在其它各时间点,Ani治疗组得分均显著低于缺血再灌注组,尤以再灌注24h这种差异最为明显(P<0.005)。对照组在各时间点得分均为零。
图中P值为缺血再灌注组与山莨菪碱治疗组相比较所得出的。虚线表示在该段时间未进行神经功能缺陷评分。评分对象仅限于存活动物。
, 百拇医药
2.3 动物24小时存活率的变化:见表2。
表2 动物的24小时存活率的变化
组 别
样本数
(只)
存活数
(只)
死亡数
(只)
存活率
(%)
对照组
3
, 百拇医药
3
0
100
缺血再灌注
13
5
8
38.46
Ani治疗组
14
9
5
64.29*
, 百拇医药
与缺血再灌注组比较 *P<0.01 缺血再灌注组13只家兔中存活5只,24h存活率为38.46%,Ani治疗组14只家兔中存活9只,24小时存活率为64.29%,两组存活率之间存在显著差异(P<0.01)。
死亡标准:机械通气下持续深度昏迷,对外界刺激无反应,瞳孔散大固定。瞳孔对光反射,角膜反射及呕吐反射消失,自主呼吸不能恢复。
3 讨论
3.1 山莨菪碱对脑内氨基酸释放的影响
谷氨酸(Glu)、天门冬氨酸(Asp)是脑内主要的兴奋性氨基酸(EAA)递质。它们在正常情况下参与神经系统的发育,可塑性及学习、记忆过程等多种生理功能。但过度释放却能造成神经元损伤,激活AMPA受体和KA受体,引起神经细胞急性渗透性肿胀;激活NMDA受体和代谢型受体使钙内流和钙动员增加,导致钙超载,引起神经细胞迟发性损伤。本实验发现缺血再灌注期间Glu、Asp含量显著下降,而再灌注早期应用Ani可降低Glu、Asp的下降幅度。有研究显示〔2〕,对于缺血再灌注脑损伤,血脑屏障的破坏多发生在再灌注6~12小时以后,最早发生于再灌注3小时后,因此有理由认为缺血再灌注2小时细胞外液EAA不会透过血脑屏障释放入血,脑组织EAA含量取决其释放水平及转化破坏状况。缺血再灌注期间EAA过度释放并且转化增加,因而其含量降低。Ani降低Glu、Asp的下降幅度是其抑制Glu、Asp过度释放的结果。
, 百拇医药
目前认为全脑缺血再灌注期间EAA过度释放的根本原因是脑组织灌流量严重不足或完全中断,使AFP迅速耗竭,同时合成受阻;另一方面缺血期内流的钙大量沉积脑组织线粒体内,干扰氧化磷酸化过程,加重能量代谢障碍〔3〕,抑制质膜上Na+—K+ATPase,使膜电位下降,神经元去极化,导致EAA大量释放,并抑制EAA重摄取〔4〕。
Ani是一种良好的细胞保护剂,在细菌性脑水肿动物模型上已被证实可抑制EAA尤其是Glu的过度释放〔5〕。我们通过对全脑缺血再灌注损伤动物模型的研究得出相同的结论。Ani抑制EAA过度释放可能与下列机制有关:(1)解除微血管痉挛,防止血小板聚集和微血栓形成,从而疏通微循环,增加再灌注早期有效灌流量,促进ATP合成,延缓ATP耗竭〔6〕;(2)阻断电压依赖性钙通道,减少脑细胞线粒体内Ca2+累积,改善能量代谢〔7〕。另外,有人认为〔8〕在释放EAA的突触前末梢存在M受体(主要是M1型受体)。当脑缺血等原因引起Ach释放增加,Ach激活M受体,使细胞膜钾电导降低,膜电位下降,神经元去极化,促使EAA释放。Ani作为一种有效的M受体阻断剂,可阻断突触前兴奋性神经末梢上M受体的上述效应,在一定程度上可抑制EAA的释放。
, http://www.100md.com
r-氨基丁酸(GABA)是脑内主要的抑制性氨基酸之一,它作用于GABA—β型受体可抑制EAA释放及钙内流。缺血再灌注期间由于能量代谢障碍,Glu过度释放,同时Glu脱羧酶活性增强,GABA转氨酶活性降低,使得Glu脱羧转化为GABA增多,且GABA降解减少〔9〕。也就是说GABA含量增高继发于EAA过度释放。Ani抑制了EAA尤其是Glu的过度释放,因而可降低GABA含量。
3.2 山莨菪碱对生存状况的影响
尽快恢复脑血供是脑复苏成功的基础和关键。但随着血液的再灌注,有害物质尤其是EAA的释放及其介导的钙内流呈进行性增加;脑缺血缺氧促使神经元去极化,EAA过度释放;而细胞外液高浓度的EAA可再使神经元极化,进一步加剧EAA的释放。过度释放的EAA通过激活相应受体,引起钙内流;当内流的钙大量沉积于线粒体可加重细胞能量代谢障碍,促使EAA释放进一步增加。这样在EAA释放及钙内流之间形成正反馈恶性循环,EAA过度释放是其始动环节。从而导致神经细胞内钙含量不断增加,神经细胞损伤进行性加重,动物生存状况恶化。本实验提示:Ani可抑制EAA的过度释放,因而能减少EAA介导的钙内流,改善生存状况,提高生存率。此外,再灌注过程中脑组织内氧自由基和游离铁的生成释放增多也会加剧脑损伤。动物实验和临床研究业已证实Ani可抑制氧自由基的生存释放,减少脑组织游离铁含量〔6,10〕,这可能是Ani改善预后的又一重要原因。
, 百拇医药
3.3 山莨菪碱在临床脑复苏中的应用前景
药理学研究表明Ani呈剂量依赖性透过血脑屏障。常规治疗剂量的Ani透过血脑屏障的量很少,而达到5~10mg/kg体重的大剂量时Ani透过血脑屏障的量可达80%以上。因此本实验Ani的用量选择5mg/kg体重。当以1mg.kg-1.min-1的速度静推Ani时,仅有一过性心率加快和血压下降,未见其它明显毒副作用。停药后血压心率很快恢复。总之,Ani毒副作用相对较小,且价格低廉,来源广泛,若能在再灌注初期及早使用,可明显改善缺血再灌注脑损伤动物的生存状况,提高生存率,不失为临床脑复苏中一种较有应用前景的药物。
参考文献
1 D′Aley LG, et al. Dextrose containing intravenous fluid impairs outcome and increase death after eight minutes of cardiac arrest and resuscitation in dogs. Surgery, 1986,100:505-511
, 百拇医药
2 蒲传强,等.脑缺血后血脑屏障超微结构的研究.中华神经科杂志,1994,27:67
3 杜晓冰.钙在细胞损伤中的作用.国外医学.病理生理科学与临床分册,1990,4:189
4 Szatkowski D, et al. Non-vesicular resease of glutamate from glial cells by reversed electrogenic glutamate uptake. Nature,1990,348:443-446
5 岳少杰,等.654-2对实验性兔脑水肿的保护作用.湖南医科大学学报,1995,20(2):113-115
6 陈长志,等.山莨菪碱的细胞制作及其机制.上海医学,1990,13(2):118-119
, 百拇医药
7 徐如祥,等.神经细胞钙通道变化及鼠血脑屏障通透性和外伤性脑水肿的影响.中华神经外科杂志,1992,8(1):41-44
8 刘青松,等.Ach对培养大鼠皮层神经元兴奋性及抑制性突触电流的相反作用.生理学报,1996,48(4):313-319
9 Ferrarese C, et al. Clutamate levels in cerebrospinal fluid:do they reflect in vivo modifications in neurological disorders?In:Clobus MYT.Dietriwh wkeds. The role of neurotransmitters in brain injury. Newyork:plenum press,1992.39-44
10 王致声,等.铁与缺血再灌注脑损伤.国外医学.神经病学.神经外科学分册,1995,22(2):68-70
(收稿:1998-03-20,修回:1998-11-25), http://www.100md.com
单位:同济医科大学附属同济医院急诊科(武汉,430030)
关键词:全脑缺血再灌注;兴奋性氨基酸;山莨菪碱;生存率;神经功能缺陷评分
New Page 1 [摘 要] 目的 了解山莨菪碱对家兔急性全脑缺血再灌注期间兴奋性氨基酸释放及生存状况的影响。方法 56只家兔采用“闭塞双侧颈总动脉和椎动脉+体循环低血压法”建立急性全脑缺血再灌注损伤模型。观察山莨菪碱(Ani)对缺血再灌注期间脑组织兴奋性氨基酸(EAA)含量及动物生存状况的影响。结果 Ani 可降低脑组织EAA含量的下降幅度,提高动物24h生存率,降低神经功能缺陷评分。结论 Ani可抑制EAA过度释放,改善缺血再灌注脑损伤动物的生存状况,在临床脑复苏中可能有一定的应用前景。
The effects of anisodamine on the release of excitatory amino acid and survival condition after acute brain damage following complete cerebral ischemia and reperfusion in the rabbit
, http://www.100md.com
Zhan Chengye, Deng Puzhen.
Department of Emergency, Tongji Hospital, Tongji Medical University, Wuhan 430030
[Abstract] Objective To find out the effects of anisodamine on the release of excitatory amino acid and survival condition after a cute brain damage following complete cerebral ischemia and reperfusion in the rabbit.Methods The model of acute brain damage following complete cerebral ischemia and reperfusion was established in fifty six rabbits by ligation of bilateral carotids and vertebral arteries with systemic hypotension. By observing the effects of Anisodamine (Ani) on the content of excitatory amino acid (EAA) in brain tissues and survival condition in the duration of complete cerebral ischemia and reperfusion, the following results were found:with the use of Ani, the decline in the content of EAA was inhibited. Moreover, there were a increase in survival rate for twenty-four hours and a decrease in neurologic deficit score (NDS).Results We suggested that the use of Ani as early as possible can inhibit the overrelease of EAA and improve the survival condition after acute brain damage following complete cerebral ischemia and reperfusion.Conclusion We conclude that Ani is possibly good for clinic cerebral resuscitation if it is properly used.
, 百拇医药
[Key words] Anisodamine Excitatory amino acid Survival rate Neurologic deficit score Complete cerebral ischemia and reperfusion
兴奋性氨基酸的过度释放激活相应受体而产生的兴奋毒性在脑缺血再灌注损伤中起着极为重要的作用,很大程度上影响脑损伤的预后。然而目前抗兴奋毒性药物大多是通过阻断兴奋性氨基酸受体发挥效应,疗效不尽人意,且具有明显的毒副作用,难以应用于临床。本研究从影响兴奋性氨基酸释放的角度,探讨山莨菪碱(Ani)在对抗兴奋毒性,改善预后方面的前途,为山莨菪碱在临床脑复苏中的应用提供实验依据。
1 资料与方法
1.1 实验动物
健康家兔56只,由本院动物房提供,体重2.0~2.2kg,雌雄兼用,实验前禁食12h。
, http://www.100md.com
1.2 动物模型制备
采用“双侧颈总动脉和椎动脉血管闭塞+体循环低血压法”建立急性全脑缺血再灌注损伤模型。以3%戊巴比妥钠(30mg/kg体重)经耳静脉注射麻醉。分离双侧颈总动脉和椎动脉及一侧股动静脉。待动物清醒后,丝线结扎双侧椎动脉,动脉夹钳夹双侧颈总动脉。同时从股动脉抽血使平均动脉压降至5.3kPa,此为缺血期,时限15min。然后松开动脉夹,从股静脉回输自体血液,即为再灌注期。整个实验过程中以呼吸机维持机械通气。
1.3 脑组织氨基酸含量测定
随机抽取家兔26只,分成4组:对照组(n=5)只作手术操作,不作缺血处理;缺血组(n=7)缺血15min;再灌注组(n=7)再灌注2h;Ani组(n=7)。再灌注前5min静脉给予Ani 5mg/kg体重,后以5mg/h维持2h。达到规定时间后断头取脑组织300mg,用5%三氯醋酸于冰水环境下制成匀浆。低温超速离心15min,去除蛋白沉淀,取上清液在自动分析仪上进行氨基酸微量测定。
, 百拇医药
1.4 生存状况的观察
余下30只家兔随机分成3组:对照组(n=3)只行手术操作;缺血再灌注组(n=13)缺血15min再灌注24h,并于再灌注开始及再灌注6h、12h分别静脉给予甘露醇(20%)10~15ml/kg体重,地塞米松2.5mg/kg体重;Ani治疗组(n=14)除上述处理外,再灌注前5min给予Ani 5mg/kg体重,并以5mg/h维持2h。6h及12h后重复给药。分别于再灌注1h、2h、6h、9h、24h进行神经功能缺陷评分〔1〕(由未参加实验者评定),并统计24h存活数,计算生存率。
1.5 统计学处理
脑组织氨基酸含量的比较采用t检验;生存率的比较采用χ2检验,神经功能缺陷评分(NDS)的比较采用Kruske-wallis检验。
2 结果
, http://www.100md.com
2.1 脑组织氨基酸含量的变化:见表1。
表1 兔脑组织氨基酸含量变化(μmol/g湿组织)(
组 别
Glu
Asp
GABA
Gly
对照组(n=5)
10.12±1.73
, http://www.100md.com 3.98±0.74
1.35±0.41
1.31±0.03
缺血组(n=7)
7.28±0.97△
3.54±0.41△
1.68±0.17△
1.32±0.45
再灌注组(n=7)
6.24±1.25△△*
3.37±0.77△△*
, 百拇医药
1.87±0.12△△
1.29±0.67
山莨菪碱组(n=7)
9.21±0.91*#
3.71±0.13*■
1.55±0.55*■
1.32±0.31
与对照组比较 △P<0.05,与对照组比较 △△P<0.01,与缺血组比较 *P<0.05
与再灌注组比较 #P<0.01,与再灌注组比较 ■P<0.05 全脑缺血15min,脑组织兴奋性氨基酸Glu、Asp含量较对照组显著降低(P<0.05)。再灌注2h,其含量进一步下降。而再灌注早期应用Ani后Glu、Asp含量回升,尤以Glu含量增加更为明显(与再灌注组比较P<0.01)。另外,脑组织抑制性氨基酸GABA在缺血再灌注期间明显升高(与对照组比较P<0.05)。应用Ani治疗后,GABA含量有所下降(与再灌注组比较P<0.05)。甘氨酸(Gly)在整个缺血再灌注期间含量无明显变化。
, 百拇医药
2.2 动物神经功能缺陷评分的变化:见图1。

图1 动物神经功能及缺陷评分变化图
再灌注1h、2h、6h、9h、24h缺血再灌注组和Ani治疗组的神经功能缺陷评分(NDS)分别为60、64、70、70、75和56、50、34、30、20。缺血再灌注组NDS随再灌注时间的延长而逐渐升高,Ani治疗组NDS随再灌注时间延长而逐渐降低。除再灌注1h两组得分无统计学差异(P>0.05)外,在其它各时间点,Ani治疗组得分均显著低于缺血再灌注组,尤以再灌注24h这种差异最为明显(P<0.005)。对照组在各时间点得分均为零。
图中P值为缺血再灌注组与山莨菪碱治疗组相比较所得出的。虚线表示在该段时间未进行神经功能缺陷评分。评分对象仅限于存活动物。
, 百拇医药
2.3 动物24小时存活率的变化:见表2。
表2 动物的24小时存活率的变化
组 别
样本数
(只)
存活数
(只)
死亡数
(只)
存活率
(%)
对照组
3
, 百拇医药
3
0
100
缺血再灌注
13
5
8
38.46
Ani治疗组
14
9
5
64.29*
, 百拇医药
与缺血再灌注组比较 *P<0.01 缺血再灌注组13只家兔中存活5只,24h存活率为38.46%,Ani治疗组14只家兔中存活9只,24小时存活率为64.29%,两组存活率之间存在显著差异(P<0.01)。
死亡标准:机械通气下持续深度昏迷,对外界刺激无反应,瞳孔散大固定。瞳孔对光反射,角膜反射及呕吐反射消失,自主呼吸不能恢复。
3 讨论
3.1 山莨菪碱对脑内氨基酸释放的影响
谷氨酸(Glu)、天门冬氨酸(Asp)是脑内主要的兴奋性氨基酸(EAA)递质。它们在正常情况下参与神经系统的发育,可塑性及学习、记忆过程等多种生理功能。但过度释放却能造成神经元损伤,激活AMPA受体和KA受体,引起神经细胞急性渗透性肿胀;激活NMDA受体和代谢型受体使钙内流和钙动员增加,导致钙超载,引起神经细胞迟发性损伤。本实验发现缺血再灌注期间Glu、Asp含量显著下降,而再灌注早期应用Ani可降低Glu、Asp的下降幅度。有研究显示〔2〕,对于缺血再灌注脑损伤,血脑屏障的破坏多发生在再灌注6~12小时以后,最早发生于再灌注3小时后,因此有理由认为缺血再灌注2小时细胞外液EAA不会透过血脑屏障释放入血,脑组织EAA含量取决其释放水平及转化破坏状况。缺血再灌注期间EAA过度释放并且转化增加,因而其含量降低。Ani降低Glu、Asp的下降幅度是其抑制Glu、Asp过度释放的结果。
, 百拇医药
目前认为全脑缺血再灌注期间EAA过度释放的根本原因是脑组织灌流量严重不足或完全中断,使AFP迅速耗竭,同时合成受阻;另一方面缺血期内流的钙大量沉积脑组织线粒体内,干扰氧化磷酸化过程,加重能量代谢障碍〔3〕,抑制质膜上Na+—K+ATPase,使膜电位下降,神经元去极化,导致EAA大量释放,并抑制EAA重摄取〔4〕。
Ani是一种良好的细胞保护剂,在细菌性脑水肿动物模型上已被证实可抑制EAA尤其是Glu的过度释放〔5〕。我们通过对全脑缺血再灌注损伤动物模型的研究得出相同的结论。Ani抑制EAA过度释放可能与下列机制有关:(1)解除微血管痉挛,防止血小板聚集和微血栓形成,从而疏通微循环,增加再灌注早期有效灌流量,促进ATP合成,延缓ATP耗竭〔6〕;(2)阻断电压依赖性钙通道,减少脑细胞线粒体内Ca2+累积,改善能量代谢〔7〕。另外,有人认为〔8〕在释放EAA的突触前末梢存在M受体(主要是M1型受体)。当脑缺血等原因引起Ach释放增加,Ach激活M受体,使细胞膜钾电导降低,膜电位下降,神经元去极化,促使EAA释放。Ani作为一种有效的M受体阻断剂,可阻断突触前兴奋性神经末梢上M受体的上述效应,在一定程度上可抑制EAA的释放。
, http://www.100md.com
r-氨基丁酸(GABA)是脑内主要的抑制性氨基酸之一,它作用于GABA—β型受体可抑制EAA释放及钙内流。缺血再灌注期间由于能量代谢障碍,Glu过度释放,同时Glu脱羧酶活性增强,GABA转氨酶活性降低,使得Glu脱羧转化为GABA增多,且GABA降解减少〔9〕。也就是说GABA含量增高继发于EAA过度释放。Ani抑制了EAA尤其是Glu的过度释放,因而可降低GABA含量。
3.2 山莨菪碱对生存状况的影响
尽快恢复脑血供是脑复苏成功的基础和关键。但随着血液的再灌注,有害物质尤其是EAA的释放及其介导的钙内流呈进行性增加;脑缺血缺氧促使神经元去极化,EAA过度释放;而细胞外液高浓度的EAA可再使神经元极化,进一步加剧EAA的释放。过度释放的EAA通过激活相应受体,引起钙内流;当内流的钙大量沉积于线粒体可加重细胞能量代谢障碍,促使EAA释放进一步增加。这样在EAA释放及钙内流之间形成正反馈恶性循环,EAA过度释放是其始动环节。从而导致神经细胞内钙含量不断增加,神经细胞损伤进行性加重,动物生存状况恶化。本实验提示:Ani可抑制EAA的过度释放,因而能减少EAA介导的钙内流,改善生存状况,提高生存率。此外,再灌注过程中脑组织内氧自由基和游离铁的生成释放增多也会加剧脑损伤。动物实验和临床研究业已证实Ani可抑制氧自由基的生存释放,减少脑组织游离铁含量〔6,10〕,这可能是Ani改善预后的又一重要原因。
, 百拇医药
3.3 山莨菪碱在临床脑复苏中的应用前景
药理学研究表明Ani呈剂量依赖性透过血脑屏障。常规治疗剂量的Ani透过血脑屏障的量很少,而达到5~10mg/kg体重的大剂量时Ani透过血脑屏障的量可达80%以上。因此本实验Ani的用量选择5mg/kg体重。当以1mg.kg-1.min-1的速度静推Ani时,仅有一过性心率加快和血压下降,未见其它明显毒副作用。停药后血压心率很快恢复。总之,Ani毒副作用相对较小,且价格低廉,来源广泛,若能在再灌注初期及早使用,可明显改善缺血再灌注脑损伤动物的生存状况,提高生存率,不失为临床脑复苏中一种较有应用前景的药物。
参考文献
1 D′Aley LG, et al. Dextrose containing intravenous fluid impairs outcome and increase death after eight minutes of cardiac arrest and resuscitation in dogs. Surgery, 1986,100:505-511
, 百拇医药
2 蒲传强,等.脑缺血后血脑屏障超微结构的研究.中华神经科杂志,1994,27:67
3 杜晓冰.钙在细胞损伤中的作用.国外医学.病理生理科学与临床分册,1990,4:189
4 Szatkowski D, et al. Non-vesicular resease of glutamate from glial cells by reversed electrogenic glutamate uptake. Nature,1990,348:443-446
5 岳少杰,等.654-2对实验性兔脑水肿的保护作用.湖南医科大学学报,1995,20(2):113-115
6 陈长志,等.山莨菪碱的细胞制作及其机制.上海医学,1990,13(2):118-119
, 百拇医药
7 徐如祥,等.神经细胞钙通道变化及鼠血脑屏障通透性和外伤性脑水肿的影响.中华神经外科杂志,1992,8(1):41-44
8 刘青松,等.Ach对培养大鼠皮层神经元兴奋性及抑制性突触电流的相反作用.生理学报,1996,48(4):313-319
9 Ferrarese C, et al. Clutamate levels in cerebrospinal fluid:do they reflect in vivo modifications in neurological disorders?In:Clobus MYT.Dietriwh wkeds. The role of neurotransmitters in brain injury. Newyork:plenum press,1992.39-44
10 王致声,等.铁与缺血再灌注脑损伤.国外医学.神经病学.神经外科学分册,1995,22(2):68-70
(收稿:1998-03-20,修回:1998-11-25), http://www.100md.com