急性间质性肾炎
作者:刘红 王庆文
单位:南京军区南京总医院 解放军肾脏病研究所(南京,210002)
关键词:急性间质性肾炎;急性肾功能衰竭;免疫反应
肾脏病与透析肾移植杂志990320
急性间质性肾炎(AIN)是导致急性肾功能衰竭(ARF)的众多原因中较为常见的一种,约占ARF的15%,大多AIN有明确的诱因,去除病因及对症治疗后病情可以得到不同程度的逆转。因此,掌握AIN的病因及病理生理特点将有助于我们在临床上预防、及时地认识和治疗此类疾病。本文就AIN的病因,发病机制,诊断及治疗的近期进展作一综述。
1 AIN的病因
在AIN的众多病因中,药物和感染仍然是最为普遍的。常见药物有青霉素,头孢类抗生素,磺胺类药和非类固醇类抗炎药(NSAIDs),感染包括细菌、病毒、寄生虫等均可致AIN。此外,大量的研究证实,系统性疾病如系统性红斑狼疮、肉瘤样病变、干燥综合征、原发性胆管硬化征及小管间质肾炎-葡萄膜炎、冷球蛋白血症以及肾小球疾病都可伴有AIN,还有一些根本找不到原因的特发性AIN[1]。
, 百拇医药
2 发病机制
感染时病毒、细菌及其毒素可直接侵袭肾脏引起间质性肾炎,一些药物,毒物,物理因素以及代谢紊乱亦可直接导致AIN,但产生AIN的主要原因是免疫反应,包括抗原特异性的和非抗原特异性所致的间质损伤。在抗原特异性免疫的反应中,首先是靶抗原被抗原呈递细胞摄取表达并呈递给T细胞,使T细胞激活。目前,与人间质性肾炎相关的靶抗原绝大多数尚不清楚,有人认为可能为肾小管基底膜抗原,TH糖蛋白抗原及抗小管刷状缘抗原[1]。在药物所致AIN中,相关药物可作为半抗原,与血清或细胞蛋白结合,被抗原呈递细胞摄取,作为半抗原修饰的多肽,由细胞表面的MHC分子表达呈递,也有一些药物,如磺胺异 唑,可直接与MHC复合物结合,在协同刺激因子协同下,将抗原有效呈递至T细胞,激活T辅助细胞[2]。辅助T细胞一旦被激活,产生多种作用:①产生细胞因子,直接作用于靶细胞;②激活非特异性的效应细胞,如自然杀伤细胞,巨噬细胞;③使B细胞分化成浆细胞,产生特异性抗体;④使其它效应T细胞分化,介导迟发性过敏反应和细胞毒等作用(附图)。上述过程又受到一系列机制的调节,如机体对抗原的清除,免疫细胞的程序化死亡,独特型抗独特型反应及抑制性细胞因子的产生等。经典的抗原介导的间质性肾炎模型是抗小管基底膜疾病伴间质性肾炎。它是用完全弗氏佐剂乳化的肾小管抗原免疫动物,使得宿主体内抗原特异性的T和B细胞激活分化。免疫后7~10天内,循环中即可检测到抗原特异性IgG,肾小管基底膜上可见抗体呈线状沉积,间质内中性粒细胞弥漫浸润,单个肾单位的GFR下降;免疫后2~3周,间质内浸润的中性细胞被大量单核细胞,包括T细胞,B细胞,浆细胞,巨噬细胞和自然杀伤细胞所替代。此时,GFR显著下降。抗体的存在,可通过抗体依赖细胞毒作用加强非特异性细胞的细胞毒作用。间质内浸润的巨噬细胞激活,释放许多有害的物质,其中,释放的酶可降解基底膜,破坏基底膜的完整性影响小管再生,产生严重后果。释放的活性氧物质可导致上皮细胞氧化损伤,活性氮物质如NO介导细胞毒和氧化作用,在上皮细胞损伤中起了重要作用,选择性地抑制诱导型NO(iNO)合成酶的产生会加重疾病的进展[3]。抗原特异性T细胞也可对肾脏产生损害。因为小管上皮细胞可分泌某种糖蛋白,作为靶抗原,呈递至T细胞使之激活,间质内存在的CD4和CD8 T细胞可通过MHCⅡ(CD4+)或MHC Ⅰ(CD8+)限制方式识别小管上皮细胞。而且正常情况下,小管上皮细胞可表达MHC Ⅱ类抗原,在间质性肾炎中,这种表达增强,并可分泌细胞间粘附分子,血管间粘附分子等,使T细胞易于识别。T细胞激活后,产生针对靶抗原的迟发性过敏反应,形成肉芽肿和巨细胞,对小管上皮细胞产生细胞毒作用,使小管上皮细胞脱落、萎缩。浸润的T细胞还可表达多种细胞因子,如γ-干扰素,白介素-2,白介素-4及肿瘤坏死因子等,使一些间质细胞表面表达的分子如MHC Ⅱ类抗原,粘附分子等表达增多,加强免疫反应[4]。
唑,可直接与MHC复合物结合,在协同刺激因子协同下,将抗原有效呈递至T细胞,激活T辅助细胞[2]。辅助T细胞一旦被激活,产生多种作用:①产生细胞因子,直接作用于靶细胞;②激活非特异性的效应细胞,如自然杀伤细胞,巨噬细胞;③使B细胞分化成浆细胞,产生特异性抗体;④使其它效应T细胞分化,介导迟发性过敏反应和细胞毒等作用(附图)。上述过程又受到一系列机制的调节,如机体对抗原的清除,免疫细胞的程序化死亡,独特型抗独特型反应及抑制性细胞因子的产生等。经典的抗原介导的间质性肾炎模型是抗小管基底膜疾病伴间质性肾炎。它是用完全弗氏佐剂乳化的肾小管抗原免疫动物,使得宿主体内抗原特异性的T和B细胞激活分化。免疫后7~10天内,循环中即可检测到抗原特异性IgG,肾小管基底膜上可见抗体呈线状沉积,间质内中性粒细胞弥漫浸润,单个肾单位的GFR下降;免疫后2~3周,间质内浸润的中性细胞被大量单核细胞,包括T细胞,B细胞,浆细胞,巨噬细胞和自然杀伤细胞所替代。此时,GFR显著下降。抗体的存在,可通过抗体依赖细胞毒作用加强非特异性细胞的细胞毒作用。间质内浸润的巨噬细胞激活,释放许多有害的物质,其中,释放的酶可降解基底膜,破坏基底膜的完整性影响小管再生,产生严重后果。释放的活性氧物质可导致上皮细胞氧化损伤,活性氮物质如NO介导细胞毒和氧化作用,在上皮细胞损伤中起了重要作用,选择性地抑制诱导型NO(iNO)合成酶的产生会加重疾病的进展[3]。抗原特异性T细胞也可对肾脏产生损害。因为小管上皮细胞可分泌某种糖蛋白,作为靶抗原,呈递至T细胞使之激活,间质内存在的CD4和CD8 T细胞可通过MHCⅡ(CD4+)或MHC Ⅰ(CD8+)限制方式识别小管上皮细胞。而且正常情况下,小管上皮细胞可表达MHC Ⅱ类抗原,在间质性肾炎中,这种表达增强,并可分泌细胞间粘附分子,血管间粘附分子等,使T细胞易于识别。T细胞激活后,产生针对靶抗原的迟发性过敏反应,形成肉芽肿和巨细胞,对小管上皮细胞产生细胞毒作用,使小管上皮细胞脱落、萎缩。浸润的T细胞还可表达多种细胞因子,如γ-干扰素,白介素-2,白介素-4及肿瘤坏死因子等,使一些间质细胞表面表达的分子如MHC Ⅱ类抗原,粘附分子等表达增多,加强免疫反应[4]。 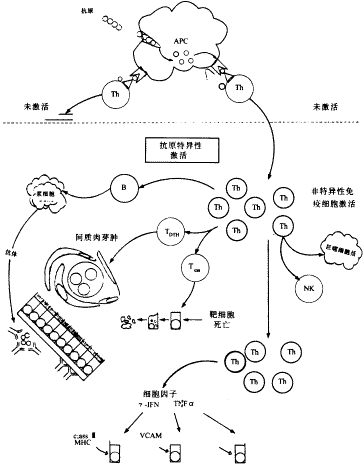
, 百拇医药
附图 急性间质性肾炎中免疫损伤机制
在间质性肾炎伴肾小球肾炎或非炎症性肾小球损伤,有蛋白尿及脂尿时,浸润的细胞为非特异性的免疫细胞如巨噬细胞而不是T细胞。目前认为此时免疫细胞进入间质可能是由于化学因子,脂化学趋化物质,osteopontin等的作用,而T细胞的浸润是非特异性[5]。当巨噬细胞为主要的效应细胞,介导的组织损伤与以T细胞为主要的浸润细胞介导的组织损伤是不一样的,这对于治疗有重要意义。
3 临床表现
AIN病因不同,其临床表现各异,无特征性。主要表现为突然出现的肾功能不全,可伴有恶心呕吐,消瘦,腹痛,疲乏无力,发热,皮疹,关节痛。出现发热,皮疹,嗜酸细胞增多三联症的患者不到30%,多发生在药物相关性AIN。经典的药物相关性AIN,用药后10~20天出现肾功能不全,撤药后肾功能可缓慢恢复,当再次使用致敏的药物时,可迅速(2~3天)发生AIN。一些患者原先对某种药物耐受,但再次使用该药时也可出现AIN。此外,间断使用某种药物,如利福平时特别容易发生 AIN,而且撤药后肾功能减退仍可持续进展。NSAIDs所致AIN有其特殊表现。患者多为老年人,女性多见,一般在服用NSAIDs数月后发生(1~36个月),临床上常缺乏药物过敏的症状及体征,80%的患者可发生肾病样蛋白尿,尿中每日丢失蛋白>3.5g以上,尿中可见红细胞及白细胞增多,尿钠滤过减少,肾外症状少见[6]。
, http://www.100md.com
慢性肾衰患者由于使用多种药物,是并发AIN的高危人群。临床上可见患者肾功能急剧减退,但无其它临床或实验室AIN的表现,也可无白细胞尿。但HIV感染患者,也使用大量药物,他们在病初10年内AIN发生率并不高,这可能与他们体内细胞免疫受抑制相关。随着对HIV抗病毒治疗的改进,加强免疫支持,间质性肾炎日益增多。
另一少见的AIN是小管间质性肾炎-葡萄膜炎综合征。其特点是弥漫性嗜酸细胞性间质性肾炎致ARF伴不明原因的骨髓和淋巴结肉芽肿,多见于青春女性。临床表现为疲乏,消瘦,发热,伴葡萄膜炎,激素治疗有效,但可复发。
4 病理检查
AIN最主要的光镜特点是间质炎细胞浸润。病变弥漫或片状分布。浸润炎细胞包括T淋巴细胞,单核细胞,偶见浆细胞和嗜酸细胞。间质性肾炎伴肾小球疾病,浸润细胞是T淋巴细胞和单核/巨噬细胞,常以CD4+T细胞为主,CD4/CD8比例与血中类似[4]。在药物性AIN,间质内常可见较多嗜酸细胞浸润,而原发性间质性肾炎,可见单核细胞浸润伴肉芽肿形成。小管损害,一般以近端小管和髓袢降支粗段较远端小管严重。常可见刷状缘脱落,细胞扁平,上皮细胞脱落,小管细胞基底侧内折,还可见基底膜断裂,扩张的小管腔内有单核细胞。电镜下,小管基底膜不连续,部分增厚,基底膜分层。肾小球正常或病变较轻。但在NSAIDs相关性AIN表现肾病综合征的患者,可有弥漫性上皮细胞融合,与微小病变相似。电镜下可见系膜区电子致密物沉积。免疫病理绝大多数均正常,无免疫球蛋白沉积,偶尔在小管基底膜有IgG或IgM呈线状或颗粒状沉积[1]。
, http://www.100md.com
5 诊断
临床上突然出现ARF需考虑AIN。典型的AIN,血清肌酐(SCr)和尿素氮进行性升高,GFR下降,但一般不如因感染或中毒所致的ARF产生迅速。ARF可为少尿性或非少尿性。肾小管功能损伤,可表现为Fanconi综合征,出现糖尿,氨基酸尿,磷酸盐尿,近端肾小管酸中毒,也可出现小管型蛋白尿或Ⅳ型肾小管酸中毒,但往往不如慢性间质性肾炎明显[7]。
尿液检查,可见白细胞尿,细胞管型,偶见游离红细胞,红细胞管型罕见。嗜酸细胞尿的出现有助于诊断,但其敏感性只有40%,特异性72%,阳性判断率仅30%[8]。在前列腺炎,快速进展的肾小球肾炎中也可见到嗜酸细胞尿,因而有些学者不再将嗜酸细胞尿作为诊断AIN的指标。蛋白尿变化较大,一般小于1 g/24h,若合并有肾小球损伤如NSAIDs所致AIN,则可出现大量蛋白尿。低渗尿多见,但钠滤过分数一般很少降低。
, 百拇医药
B超可作为诊断ARF的指标,在AIN所致ARF中,肾脏体积增大,皮质回声等同于或高于肝脏回声,但B超在鉴别ARF病因上无特异性。有报道镓扫描有助于诊断AIN,特别是有助于与ATN进行鉴别诊断。镓扫描在AIN中呈阳性,而在ATN中为阴性。但镓扫描特异性差,不能鉴别急慢性间质性肾炎,在肾小球肾炎,肾盂肾炎中也可呈阳性。当存在铁负荷或严重肝脏疾患时可出现假阳性。
肾活检是诊断AIN的最佳指标。对于诊断不明确,停药后肾功能无好转,或考虑使用大剂量免疫抑制剂的患者,应行肾活检术。
6 治疗
治疗AIN主要是支持疗法。首先停用相关药物,避免再次使用同类药物;对感染性AIN,治疗原发感染。若能及时诊断和对症治疗,许多患者在数周内肾功能可以恢复,但一些患者肾功能不全突出,需透析治疗。
若患者SCr迅速升高,停用可疑药物后肾功能无改善,或肾活检示病变弥漫分布者,应早期使用药物治疗。激素的治疗窗是相当窄的,因为间质炎症发生 10~14天后即可出现间质纤维化。当氮质血症超过1~2周,肾组织中已出现广泛的间质纤维化,肾功能恢复的可能性很小,此时再使用免疫抑制剂治疗不仅无明显疗效,相反,副作用明显增强[2]。因此使用免疫抑制剂前必须行肾活检术确诊AIN,了解间质纤维化程度。目前对于激素治疗AIN的疗效尚有争议。有效的报道主要来自前人的经验及小样本,无对照、非随机性的研究。有报道,使用激素后患者尿量增多,SCr下降,肾功能恢复时间缩短,而未用激素治疗的患者肾功能恢复缓慢,甚至进入慢性肾功能衰竭。而且短期内使用激素,无明显副作用。但也有报道认为激素对AIN无明显疗效。
, http://www.100md.com
若患者肾活检发现有抗小管基底膜抗体,在使用激素或CTX治疗的同时还可行血浆置换。每天3~4 L共5天,然后改为隔日1次共1周,但对其疗效尚有争议。
此外,在动物实验中已应用抗原特异性方法,如口服肾小管抗原治疗AIN[9],但尚未用于临床。寻找高效、无毒、选择性好的治疗措施正成为人们研究的热点之一。
7 预后
AIN病因不同,预后不一。一般药物相关的AIN,若能及时诊断,迅速停药(SCr升高1周内)则患者长期预后好,SCr可降至基础水平,若延误诊断,或再次误用药物后迅速出现严重过敏反应,则可发生严重肾功能不全,甚至需要肾替代治疗。刺激因子持续存在,AIN会发展至慢性间质性肾炎,出现间质纤维化和小管萎缩,故AIN伴ARF病程超过3周,则肾功能恢复正常的可能性很小。因此肾功能早期(6~8周内)改善程度与最终的GFR水平相关,是反映长期预后的可靠指标。年龄与最终的GFR程度成反比,而肾外症状,早期肾病表现,性别与预后无显著相关性。半数患者最终的SCr水平高于基础水平[2,10]。
, http://www.100md.com
从组织病理上讲,有弥漫炎细胞浸润的患者,预后较差。中性粒细胞浸润达1%~6%,也提示预后不良。与预后关系最为密切的是间质纤维化的严重程度。小管炎程度和小管表达Vimentin(评价小管损伤的指标)与否,并不能帮助判断预后[10]。
总之,AIN病因多样,临床表现各异,无特征性,是导致ARF的重要原因。若早期诊断,积极治疗,大多患者病情可逆,但若延误诊断,病情迁延,间质小管产生不可逆的损害,直接影响预后。临床医师对于突然出现的ARF,在行肾活检前要高度考虑AIN的可能性。免疫反应是导致AIN发生发展的重要机制,对其研究为寻找更为有效的治疗方法提供了可能的途径。
参考文献
1 Jones CL,Eddy AA.Tubulointerstitial nephritis.Pediatr Nephrol,1992,6:572
, http://www.100md.com
2 Michel DM,Kelly CJ.Acute interstitial Nephritis.J Am Soc Nephrol,1998,9:506
3 Gabbai F,Boggiano C,Peter T et al.Inhibition of inducible nitric oxxide synthase intensifies injury and functional deterioration in autoimmune interstitial nephritis.J Immunol,1997,159:626
4 Kleinknecht D.Interstitial nephritis,the nephrotic syndrome,and chronic renal failiure secondary to nonsteroidal antiinflammatory drugs.Semin Nephrol,1995,15:228
, 百拇医药
5 Pichler R,Giachelli C,Lombardi D et al.Tubulointerstitial disease in glomerulonephritis:Potential role of osteopontin(uropotin).Am J Pathol,1994,144:915
6 Neilson EG.Pathogenesis and therapy of interstitial nephritis.Kidney Int,1995,35:1257
7 Rutling KA,Hoppes P,Blend D.Eosinophils in urine revisited.Clin Nephrol,1994,41:163
8 Rutling KA,Hoppes P,Boend D.Eosinophils in urine revisited.Clin Nephrol,1994,41:163
, http://www.100md.com
9 Pham K,Smoyer W,Archer D.Oral feeding of renal tubular antegen abrogates interstitial nephrites and renal failure in Brown Norway rats.Kidney Int,1997,52:725
10 Ivanyi B,Hamilton-Dutoit SJ,Hanse HE et al.Acute tubulointerstitial nephrites:Phenotype of infiltrating cells and prognostic impact of tubulitis.Virchows Arch,1996,428:5
(1998-05-08收稿,1998-10-22修回), 百拇医药
单位:南京军区南京总医院 解放军肾脏病研究所(南京,210002)
关键词:急性间质性肾炎;急性肾功能衰竭;免疫反应
肾脏病与透析肾移植杂志990320
急性间质性肾炎(AIN)是导致急性肾功能衰竭(ARF)的众多原因中较为常见的一种,约占ARF的15%,大多AIN有明确的诱因,去除病因及对症治疗后病情可以得到不同程度的逆转。因此,掌握AIN的病因及病理生理特点将有助于我们在临床上预防、及时地认识和治疗此类疾病。本文就AIN的病因,发病机制,诊断及治疗的近期进展作一综述。
1 AIN的病因
在AIN的众多病因中,药物和感染仍然是最为普遍的。常见药物有青霉素,头孢类抗生素,磺胺类药和非类固醇类抗炎药(NSAIDs),感染包括细菌、病毒、寄生虫等均可致AIN。此外,大量的研究证实,系统性疾病如系统性红斑狼疮、肉瘤样病变、干燥综合征、原发性胆管硬化征及小管间质肾炎-葡萄膜炎、冷球蛋白血症以及肾小球疾病都可伴有AIN,还有一些根本找不到原因的特发性AIN[1]。
, 百拇医药
2 发病机制
感染时病毒、细菌及其毒素可直接侵袭肾脏引起间质性肾炎,一些药物,毒物,物理因素以及代谢紊乱亦可直接导致AIN,但产生AIN的主要原因是免疫反应,包括抗原特异性的和非抗原特异性所致的间质损伤。在抗原特异性免疫的反应中,首先是靶抗原被抗原呈递细胞摄取表达并呈递给T细胞,使T细胞激活。目前,与人间质性肾炎相关的靶抗原绝大多数尚不清楚,有人认为可能为肾小管基底膜抗原,TH糖蛋白抗原及抗小管刷状缘抗原[1]。在药物所致AIN中,相关药物可作为半抗原,与血清或细胞蛋白结合,被抗原呈递细胞摄取,作为半抗原修饰的多肽,由细胞表面的MHC分子表达呈递,也有一些药物,如磺胺异
 唑,可直接与MHC复合物结合,在协同刺激因子协同下,将抗原有效呈递至T细胞,激活T辅助细胞[2]。辅助T细胞一旦被激活,产生多种作用:①产生细胞因子,直接作用于靶细胞;②激活非特异性的效应细胞,如自然杀伤细胞,巨噬细胞;③使B细胞分化成浆细胞,产生特异性抗体;④使其它效应T细胞分化,介导迟发性过敏反应和细胞毒等作用(附图)。上述过程又受到一系列机制的调节,如机体对抗原的清除,免疫细胞的程序化死亡,独特型抗独特型反应及抑制性细胞因子的产生等。经典的抗原介导的间质性肾炎模型是抗小管基底膜疾病伴间质性肾炎。它是用完全弗氏佐剂乳化的肾小管抗原免疫动物,使得宿主体内抗原特异性的T和B细胞激活分化。免疫后7~10天内,循环中即可检测到抗原特异性IgG,肾小管基底膜上可见抗体呈线状沉积,间质内中性粒细胞弥漫浸润,单个肾单位的GFR下降;免疫后2~3周,间质内浸润的中性细胞被大量单核细胞,包括T细胞,B细胞,浆细胞,巨噬细胞和自然杀伤细胞所替代。此时,GFR显著下降。抗体的存在,可通过抗体依赖细胞毒作用加强非特异性细胞的细胞毒作用。间质内浸润的巨噬细胞激活,释放许多有害的物质,其中,释放的酶可降解基底膜,破坏基底膜的完整性影响小管再生,产生严重后果。释放的活性氧物质可导致上皮细胞氧化损伤,活性氮物质如NO介导细胞毒和氧化作用,在上皮细胞损伤中起了重要作用,选择性地抑制诱导型NO(iNO)合成酶的产生会加重疾病的进展[3]。抗原特异性T细胞也可对肾脏产生损害。因为小管上皮细胞可分泌某种糖蛋白,作为靶抗原,呈递至T细胞使之激活,间质内存在的CD4和CD8 T细胞可通过MHCⅡ(CD4+)或MHC Ⅰ(CD8+)限制方式识别小管上皮细胞。而且正常情况下,小管上皮细胞可表达MHC Ⅱ类抗原,在间质性肾炎中,这种表达增强,并可分泌细胞间粘附分子,血管间粘附分子等,使T细胞易于识别。T细胞激活后,产生针对靶抗原的迟发性过敏反应,形成肉芽肿和巨细胞,对小管上皮细胞产生细胞毒作用,使小管上皮细胞脱落、萎缩。浸润的T细胞还可表达多种细胞因子,如γ-干扰素,白介素-2,白介素-4及肿瘤坏死因子等,使一些间质细胞表面表达的分子如MHC Ⅱ类抗原,粘附分子等表达增多,加强免疫反应[4]。
唑,可直接与MHC复合物结合,在协同刺激因子协同下,将抗原有效呈递至T细胞,激活T辅助细胞[2]。辅助T细胞一旦被激活,产生多种作用:①产生细胞因子,直接作用于靶细胞;②激活非特异性的效应细胞,如自然杀伤细胞,巨噬细胞;③使B细胞分化成浆细胞,产生特异性抗体;④使其它效应T细胞分化,介导迟发性过敏反应和细胞毒等作用(附图)。上述过程又受到一系列机制的调节,如机体对抗原的清除,免疫细胞的程序化死亡,独特型抗独特型反应及抑制性细胞因子的产生等。经典的抗原介导的间质性肾炎模型是抗小管基底膜疾病伴间质性肾炎。它是用完全弗氏佐剂乳化的肾小管抗原免疫动物,使得宿主体内抗原特异性的T和B细胞激活分化。免疫后7~10天内,循环中即可检测到抗原特异性IgG,肾小管基底膜上可见抗体呈线状沉积,间质内中性粒细胞弥漫浸润,单个肾单位的GFR下降;免疫后2~3周,间质内浸润的中性细胞被大量单核细胞,包括T细胞,B细胞,浆细胞,巨噬细胞和自然杀伤细胞所替代。此时,GFR显著下降。抗体的存在,可通过抗体依赖细胞毒作用加强非特异性细胞的细胞毒作用。间质内浸润的巨噬细胞激活,释放许多有害的物质,其中,释放的酶可降解基底膜,破坏基底膜的完整性影响小管再生,产生严重后果。释放的活性氧物质可导致上皮细胞氧化损伤,活性氮物质如NO介导细胞毒和氧化作用,在上皮细胞损伤中起了重要作用,选择性地抑制诱导型NO(iNO)合成酶的产生会加重疾病的进展[3]。抗原特异性T细胞也可对肾脏产生损害。因为小管上皮细胞可分泌某种糖蛋白,作为靶抗原,呈递至T细胞使之激活,间质内存在的CD4和CD8 T细胞可通过MHCⅡ(CD4+)或MHC Ⅰ(CD8+)限制方式识别小管上皮细胞。而且正常情况下,小管上皮细胞可表达MHC Ⅱ类抗原,在间质性肾炎中,这种表达增强,并可分泌细胞间粘附分子,血管间粘附分子等,使T细胞易于识别。T细胞激活后,产生针对靶抗原的迟发性过敏反应,形成肉芽肿和巨细胞,对小管上皮细胞产生细胞毒作用,使小管上皮细胞脱落、萎缩。浸润的T细胞还可表达多种细胞因子,如γ-干扰素,白介素-2,白介素-4及肿瘤坏死因子等,使一些间质细胞表面表达的分子如MHC Ⅱ类抗原,粘附分子等表达增多,加强免疫反应[4]。 
, 百拇医药
附图 急性间质性肾炎中免疫损伤机制
在间质性肾炎伴肾小球肾炎或非炎症性肾小球损伤,有蛋白尿及脂尿时,浸润的细胞为非特异性的免疫细胞如巨噬细胞而不是T细胞。目前认为此时免疫细胞进入间质可能是由于化学因子,脂化学趋化物质,osteopontin等的作用,而T细胞的浸润是非特异性[5]。当巨噬细胞为主要的效应细胞,介导的组织损伤与以T细胞为主要的浸润细胞介导的组织损伤是不一样的,这对于治疗有重要意义。
3 临床表现
AIN病因不同,其临床表现各异,无特征性。主要表现为突然出现的肾功能不全,可伴有恶心呕吐,消瘦,腹痛,疲乏无力,发热,皮疹,关节痛。出现发热,皮疹,嗜酸细胞增多三联症的患者不到30%,多发生在药物相关性AIN。经典的药物相关性AIN,用药后10~20天出现肾功能不全,撤药后肾功能可缓慢恢复,当再次使用致敏的药物时,可迅速(2~3天)发生AIN。一些患者原先对某种药物耐受,但再次使用该药时也可出现AIN。此外,间断使用某种药物,如利福平时特别容易发生 AIN,而且撤药后肾功能减退仍可持续进展。NSAIDs所致AIN有其特殊表现。患者多为老年人,女性多见,一般在服用NSAIDs数月后发生(1~36个月),临床上常缺乏药物过敏的症状及体征,80%的患者可发生肾病样蛋白尿,尿中每日丢失蛋白>3.5g以上,尿中可见红细胞及白细胞增多,尿钠滤过减少,肾外症状少见[6]。
, http://www.100md.com
慢性肾衰患者由于使用多种药物,是并发AIN的高危人群。临床上可见患者肾功能急剧减退,但无其它临床或实验室AIN的表现,也可无白细胞尿。但HIV感染患者,也使用大量药物,他们在病初10年内AIN发生率并不高,这可能与他们体内细胞免疫受抑制相关。随着对HIV抗病毒治疗的改进,加强免疫支持,间质性肾炎日益增多。
另一少见的AIN是小管间质性肾炎-葡萄膜炎综合征。其特点是弥漫性嗜酸细胞性间质性肾炎致ARF伴不明原因的骨髓和淋巴结肉芽肿,多见于青春女性。临床表现为疲乏,消瘦,发热,伴葡萄膜炎,激素治疗有效,但可复发。
4 病理检查
AIN最主要的光镜特点是间质炎细胞浸润。病变弥漫或片状分布。浸润炎细胞包括T淋巴细胞,单核细胞,偶见浆细胞和嗜酸细胞。间质性肾炎伴肾小球疾病,浸润细胞是T淋巴细胞和单核/巨噬细胞,常以CD4+T细胞为主,CD4/CD8比例与血中类似[4]。在药物性AIN,间质内常可见较多嗜酸细胞浸润,而原发性间质性肾炎,可见单核细胞浸润伴肉芽肿形成。小管损害,一般以近端小管和髓袢降支粗段较远端小管严重。常可见刷状缘脱落,细胞扁平,上皮细胞脱落,小管细胞基底侧内折,还可见基底膜断裂,扩张的小管腔内有单核细胞。电镜下,小管基底膜不连续,部分增厚,基底膜分层。肾小球正常或病变较轻。但在NSAIDs相关性AIN表现肾病综合征的患者,可有弥漫性上皮细胞融合,与微小病变相似。电镜下可见系膜区电子致密物沉积。免疫病理绝大多数均正常,无免疫球蛋白沉积,偶尔在小管基底膜有IgG或IgM呈线状或颗粒状沉积[1]。
, http://www.100md.com
5 诊断
临床上突然出现ARF需考虑AIN。典型的AIN,血清肌酐(SCr)和尿素氮进行性升高,GFR下降,但一般不如因感染或中毒所致的ARF产生迅速。ARF可为少尿性或非少尿性。肾小管功能损伤,可表现为Fanconi综合征,出现糖尿,氨基酸尿,磷酸盐尿,近端肾小管酸中毒,也可出现小管型蛋白尿或Ⅳ型肾小管酸中毒,但往往不如慢性间质性肾炎明显[7]。
尿液检查,可见白细胞尿,细胞管型,偶见游离红细胞,红细胞管型罕见。嗜酸细胞尿的出现有助于诊断,但其敏感性只有40%,特异性72%,阳性判断率仅30%[8]。在前列腺炎,快速进展的肾小球肾炎中也可见到嗜酸细胞尿,因而有些学者不再将嗜酸细胞尿作为诊断AIN的指标。蛋白尿变化较大,一般小于1 g/24h,若合并有肾小球损伤如NSAIDs所致AIN,则可出现大量蛋白尿。低渗尿多见,但钠滤过分数一般很少降低。
, 百拇医药
B超可作为诊断ARF的指标,在AIN所致ARF中,肾脏体积增大,皮质回声等同于或高于肝脏回声,但B超在鉴别ARF病因上无特异性。有报道镓扫描有助于诊断AIN,特别是有助于与ATN进行鉴别诊断。镓扫描在AIN中呈阳性,而在ATN中为阴性。但镓扫描特异性差,不能鉴别急慢性间质性肾炎,在肾小球肾炎,肾盂肾炎中也可呈阳性。当存在铁负荷或严重肝脏疾患时可出现假阳性。
肾活检是诊断AIN的最佳指标。对于诊断不明确,停药后肾功能无好转,或考虑使用大剂量免疫抑制剂的患者,应行肾活检术。
6 治疗
治疗AIN主要是支持疗法。首先停用相关药物,避免再次使用同类药物;对感染性AIN,治疗原发感染。若能及时诊断和对症治疗,许多患者在数周内肾功能可以恢复,但一些患者肾功能不全突出,需透析治疗。
若患者SCr迅速升高,停用可疑药物后肾功能无改善,或肾活检示病变弥漫分布者,应早期使用药物治疗。激素的治疗窗是相当窄的,因为间质炎症发生 10~14天后即可出现间质纤维化。当氮质血症超过1~2周,肾组织中已出现广泛的间质纤维化,肾功能恢复的可能性很小,此时再使用免疫抑制剂治疗不仅无明显疗效,相反,副作用明显增强[2]。因此使用免疫抑制剂前必须行肾活检术确诊AIN,了解间质纤维化程度。目前对于激素治疗AIN的疗效尚有争议。有效的报道主要来自前人的经验及小样本,无对照、非随机性的研究。有报道,使用激素后患者尿量增多,SCr下降,肾功能恢复时间缩短,而未用激素治疗的患者肾功能恢复缓慢,甚至进入慢性肾功能衰竭。而且短期内使用激素,无明显副作用。但也有报道认为激素对AIN无明显疗效。
, http://www.100md.com
若患者肾活检发现有抗小管基底膜抗体,在使用激素或CTX治疗的同时还可行血浆置换。每天3~4 L共5天,然后改为隔日1次共1周,但对其疗效尚有争议。
此外,在动物实验中已应用抗原特异性方法,如口服肾小管抗原治疗AIN[9],但尚未用于临床。寻找高效、无毒、选择性好的治疗措施正成为人们研究的热点之一。
7 预后
AIN病因不同,预后不一。一般药物相关的AIN,若能及时诊断,迅速停药(SCr升高1周内)则患者长期预后好,SCr可降至基础水平,若延误诊断,或再次误用药物后迅速出现严重过敏反应,则可发生严重肾功能不全,甚至需要肾替代治疗。刺激因子持续存在,AIN会发展至慢性间质性肾炎,出现间质纤维化和小管萎缩,故AIN伴ARF病程超过3周,则肾功能恢复正常的可能性很小。因此肾功能早期(6~8周内)改善程度与最终的GFR水平相关,是反映长期预后的可靠指标。年龄与最终的GFR程度成反比,而肾外症状,早期肾病表现,性别与预后无显著相关性。半数患者最终的SCr水平高于基础水平[2,10]。
, http://www.100md.com
从组织病理上讲,有弥漫炎细胞浸润的患者,预后较差。中性粒细胞浸润达1%~6%,也提示预后不良。与预后关系最为密切的是间质纤维化的严重程度。小管炎程度和小管表达Vimentin(评价小管损伤的指标)与否,并不能帮助判断预后[10]。
总之,AIN病因多样,临床表现各异,无特征性,是导致ARF的重要原因。若早期诊断,积极治疗,大多患者病情可逆,但若延误诊断,病情迁延,间质小管产生不可逆的损害,直接影响预后。临床医师对于突然出现的ARF,在行肾活检前要高度考虑AIN的可能性。免疫反应是导致AIN发生发展的重要机制,对其研究为寻找更为有效的治疗方法提供了可能的途径。
参考文献
1 Jones CL,Eddy AA.Tubulointerstitial nephritis.Pediatr Nephrol,1992,6:572
, http://www.100md.com
2 Michel DM,Kelly CJ.Acute interstitial Nephritis.J Am Soc Nephrol,1998,9:506
3 Gabbai F,Boggiano C,Peter T et al.Inhibition of inducible nitric oxxide synthase intensifies injury and functional deterioration in autoimmune interstitial nephritis.J Immunol,1997,159:626
4 Kleinknecht D.Interstitial nephritis,the nephrotic syndrome,and chronic renal failiure secondary to nonsteroidal antiinflammatory drugs.Semin Nephrol,1995,15:228
, 百拇医药
5 Pichler R,Giachelli C,Lombardi D et al.Tubulointerstitial disease in glomerulonephritis:Potential role of osteopontin(uropotin).Am J Pathol,1994,144:915
6 Neilson EG.Pathogenesis and therapy of interstitial nephritis.Kidney Int,1995,35:1257
7 Rutling KA,Hoppes P,Blend D.Eosinophils in urine revisited.Clin Nephrol,1994,41:163
8 Rutling KA,Hoppes P,Boend D.Eosinophils in urine revisited.Clin Nephrol,1994,41:163
, http://www.100md.com
9 Pham K,Smoyer W,Archer D.Oral feeding of renal tubular antegen abrogates interstitial nephrites and renal failure in Brown Norway rats.Kidney Int,1997,52:725
10 Ivanyi B,Hamilton-Dutoit SJ,Hanse HE et al.Acute tubulointerstitial nephrites:Phenotype of infiltrating cells and prognostic impact of tubulitis.Virchows Arch,1996,428:5
(1998-05-08收稿,1998-10-22修回), 百拇医药
参见:首页 > 医疗版 > 疾病专题 > 肾脏内科 > 肾病综合征 > 间质性肾炎