抗骨形成蛋白单链抗体的构建与表达
作者:孙远 杨连甲 高玉好 金岩
单位:孙远 杨连甲 高玉好 金岩 第三军医大学附属西南医院口腔科 重庆,400038
关键词:BMP;连接肽;单链抗体;表达
提 要 目的提 要 目的:构建抗骨形成蛋白单链抗体并获得表达。方法:应用一段人工合成的含15个氨基酸的连接肽,采取亚克隆技术,将一株鼠抗BMP单克隆抗体的重链可变区(VH)的N端和轻链可变区(VL)的C端连接起来;将连接产物克隆入融合蛋白表达载体pEGX-4T-l,在大肠杆菌JM109中进行表达。结果:构建的单链抗体(ScFv)全长705 bp,并获得融合表达产物约52×103u。结论:亚克隆方法是一种构建单链抗体快速、简便、可靠的方法。
中图法分类号 R392.11
, http://www.100md.com
Construction and expression of bone morphogenetic protein (BMP) single-chain Fv
Sun Yuan, Yang Lianjia, Gao Yuhao, Jin Yan
Department of Oral-facial-maxillary Surgery, Southwest Hospital, Third Military Medical University, Chongqing,400038
Abstract Objective: To construct and express bone morphogenetic protein (BMP) single-chain Fv (ScFv). Methods: A synthetic linder containing 15 amino acids being used, the C end of the heavy chain gene fragment (V8) and the N end of the light chain gene fragment (V1) of BMP monoclonal antibody were connected with a subclonal method. Then the recombinant BMP ScFv was cloned into pGEX-4T-1 plasmid and induced to express in JM 109 E. coli. Results: BMP ScFv gene consisted of 705 base pairs and the BMP ScFv fusion protein was about 52 kd. Conclusion: Subclonal method is a rapid, simple and reliable way to construct ScFV.
, 百拇医药
Key words bone morphogenetic protein; linker; single-chain Fv; expression
骨形成蛋白(BMP)在正常组织中含量很低,当骨肿瘤发生时,其含量明显增高,因此可作为一种相关抗原应用于骨肿瘤的诊断和导向治疗[1]。但鼠源性BMP单抗所具有的免疫性,限制了其在临床上的直接应用。近年来随着基因工程技术的不断进步,鼠源性单克隆抗体的改建工作得到了突飞猛进的发展,如F(ab′)2、F(ab′)、ScFv等抗体分子片段的构建,更是倍受关注[2],临床应用前景十分广阔[3,4]。在此背景下,我们利用从BMP单抗杂交瘤中扩增、克隆的轻、重链可变区基因片段,并应用一种亚克隆方法,成功地构建了BMP单链抗体,在一种融合蛋白表达载体中获得了表达。
1 材料与方法
1.1 材料
, http://www.100md.com
1.1.1 BMP单抗基因片段
鼠BMP单抗杂交瘤由第四军医大学口腔医学院病理教研室制备并保存,此杂交瘤能稳定地分泌BMP单抗。BMP单抗轻、重链(VL、VH)分别克隆于pUC18、19质粒。
1.1.2 试剂
限制性内切酶、T4 DNA快速连接Kit、cDNA合成Kit购自Boehringer公司,T7 DNA聚合酶测序Kit购自Promega公司。
1.1.3 引物和连接肽
由上海肿瘤所合成。
1.1.3.1 PCR扩增引物,见图1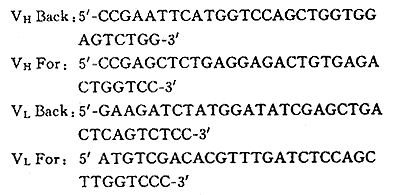
, 百拇医药
图1 PCR引物核苷酸序列
Fig 1 Neucleotide sequeces of PCR primers
1.1.3.2 连接肽LinkerFor中引入Sacl和BamHI酶切粘端序列,见图2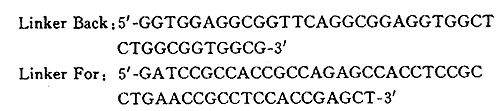
图2 链接肽核苷酸序列
Fig 2 Neucleotide sequeces of linkers
1.1.3.3 质粒
融合表达载体pGEX-4T-l由胡川闽博士惠赠。
, 百拇医药
1.2 方法
1.2.1
BMP单链抗体(BMP ScFv)的构建
1.2.1.1 多肽链的退火 取LinkerBack和LinkerFor各0.1μg/10 μl,加入3 mol/L NaAc 1 μl煮沸5 min,令其自然冷却,再经SacI/BamHI双酶切后纯化。
1.2.1.2 多肽链的克隆 将pUC19 用SacI/BamHI双酶切后,与酶切纯化的多肽链进行连接反应,连接产物常规转化大肠杆菌,挑取阳性克隆酶切鉴定。
1.2.1.3 以pUC 19-VL 重组质粒为模板,VL Back、VL For为引物,常规扩增出VL片段。VL片段经Bgl Ⅱ/SalI双酶切,pUC19-Linker重组质粒亦经BamHI/SalI双酶切后进行连接反应,常规转化和鉴定。
, http://www.100md.com
1.2.1.4 以pUC 19-VH重组质粒为模板,VH Back、VH For为引物,常规扩增出VH片段。VH片段经SacI/EcoRI双酶切后,与经同样双酶切的pUC 19-Linker-VL进行连接反应,反应产物常规转化与鉴定。
1.2.2 BMP单链抗体(BMP ScFv)的表达
1.2.2.1 表达载体的构建 先将pUC 10-VH-Linker-VL重组质粒用EcoRI酶切、Klenow酶补平后,再经SalI酶切,回收切下的约710 bp片段,和用SmaI/SalI双酶切的pGEX-4T-l进行连接反应,连接产物转化大肠杆菌JM 109。
1.2.2.2 诱导表达 阳性克隆经酶切鉴定后,取2 μl过夜菌加入2 ml LB(含氨苄青霉素)中,剧烈振摇2~3 h至对数生长期,加入IPTG至终浓度1 mmol/L,继续剧烈振摇培养4 h。收集菌体进行SDS-PAGE电泳观察结果。
, http://www.100md.com
2 结果
2.1 抗BMP单链抗体构建结果
pUC 19-linker重组质粒经EcoRI/SalI双酶切后,20%聚丙烯酰胺凝胶电泳观察,见一约60 bp片段切下。pUC 19-BMPscFv、pGEX-4T-l-BMPscFv重组质粒均用SalI/EcoRI双酶切后,1.5%琼脂糖凝胶电泳观察,均可见有约710 bp片段切下,见图3。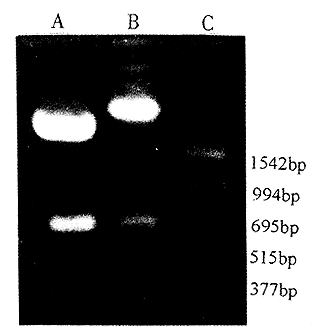
图3 BMP ScFv重组质粒的酶切鉴定
A:重组质粒pUC19-BMP ScFv B:重组质粒pGEX-4T-1-BMP ScFv C:标准分子量
, http://www.100md.com
Fig 3 Identification of pUC19-BMPscFv and pGEX-4T-l-BMP ScFv recombinant plasmid digested with SalI and EcoRI
A:pUC19-BMPscFv (3.40 kb) B:pGEX-4T-l-BMPscFv(5.68 kb) C:PCR markers
2.2 pGEX-4T-l-BMPscFv的诱导表达
经IPTG诱导的pGEX-4T-l-BMPscFv质
粒菌体,在SDS-PAGE电泳谱上出现一条约52×103u左右的新蛋白表达带。其分子量与预计的GST蛋白和BMPscFv抗体蛋白分子量之和一致,见图4。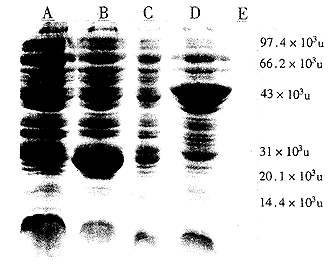
, http://www.100md.com
图4 BMP ScFv融合蛋白SDS-PAGE电泳结果
A:未诱导的pGEX-4T-1 B:诱导的pGEX-4T-1 C:未诱导的pGEX-4F1-BMP ScFv D:诱导的pGEX-4T-1-BMP ScFv E:蛋白标准分子量参照
Fig 4 SDS-PAGE of pGEX-4T-l-BMPscFv
A:without induction of pGEX-4T-l B:induction of pGEX-4T-l C:without induction of pGEX-4T-l-BMPscFv D:induction of pGEX-4T-l-BMPscFv E:molecular weight standard
3 讨论
由于天然抗体的Fv片段中VH与VL为非共价性结合,只是依靠两链之间的两个二硫键以维持其结构和功能,因此在去除Fc片段后,VH与VL片段在浓度很低的条件下极易解离而失去活性。为解决定问题,有人采取了用戊二醛使VH、VL表面的亮氨酸和半胱氨酸聚合、或在Fv骨架区设计链间二硫键等方法来加强VH、VL的联系,但近年来倍受关注的是单链抗体的研究[6,7]。单链抗体是用一条人工合成的多肽链将VH、VL连接起来,使之即保持抗原结合区的完整基因,又不易发生解离的抗体分子片段。为了不影响Fv的空间结构与稳定性,多肽链的设计十分重要,一般是长度为15个氨基酸为最佳,同时具有疏水性和伸展性。Huston等人根据Fab片段X线衍射分析资料,设计出(Cly4Ser)3连接肽,研究表明此连接肽将VH的C端与VL的N端连接后,不影响Fv的二级结构,使之具有较好的稳定性与活性。此连接肽已成为“通用Linker”,广泛应用于ScFv的构建[8]。作者在应用(Gly4Ser)3Linker时,在其For引物上引入了SacI/BamHI限制性酶切位点,便于克隆,同时为VH、VL的定向亚克隆提供了条件。在构建单链抗体的方法上,作者所采用的定向亚克隆方法是一种快速、简便易行的方法,且结果可靠。将所构建的BMPScFv克隆入融合蛋白表达载体pGEX-4T-l中,经IPTG诱导,获得表达。表达产物的进一步纯化与活性检测有待于今后的工作。
, http://www.100md.com
(对第三军医大学基础医学部分子生物学教研室、预防医学系防原医学教研室、免疫学教研室及附属西南医院放射科的大力支持和刘昕、王燕、胡川闽、粟永萍、陈克敏等同志的热情支持与帮助表示衷心感谢!)
基金项目:国家自然科学基金资助项目,No.39470756
作者简介:孙远,男,35岁,主治医师,讲师,博士 第四军医大学口腔医学院病理学教研室 西安,730032
参考文献
1 Jin Yan, Yang Lian-jia. The relationship between bone morphogenetic and neoplastic bone disease. Clin Orthop,1990,259(2):233
2 Winter G, Harris W. Humanization antibodies. Immunology Today,1993,14(6):244
, 百拇医药
3 Debinski W, Pastan I. Monovalent immunotoxin containing trucated form of pseudomonas exotoxin as potent antitumor agent. Cancer Res,1992,52(21):5379
4 吴永刚,胡锦跃,苏见知,等.99m标记单抗Hb3及其片段F(ab′)2在大肠癌显像中的初步应用.中华核医学杂志,1996,16(2):73
5 孙 远,杨连甲,高玉好,等.小鼠BMP-McAb可变区基因的体外扩增、克隆与序列测定.细胞与分子生物学杂志,1997,13(4):12
6 Nieroda C A, Milenic D E, Carrasquillo J A, et al. Improved tumor radioimmunodetection using a single-chain Fv and γ-interferon: Potential clinical applications for radio immunoguided surgery and γ scanning. Cancer Res,1995,55(10):2858
, 百拇医药
7 Reiter Y, Brinkmann U, Kreitman R T, et al. Stabilization of the Fv fragments in recombinant immunotoxins by disulfide bonds engineered into conserved framework regions. Bio Chem,1994,33(18):5451
8 Huston J S, Leuinson D, Mudgett-Honter M, et al. Protein engineering of an antibody binding sites:recovery of specific activity in an anti-digoxin single-chain Fv analogue produced in Escherichia coli. Proc Natl Acad Sci USA,1988,85(16):5 879
收稿:1998-08-11
修回:1998-12-31, http://www.100md.com
单位:孙远 杨连甲 高玉好 金岩 第三军医大学附属西南医院口腔科 重庆,400038
关键词:BMP;连接肽;单链抗体;表达
提 要 目的提 要 目的:构建抗骨形成蛋白单链抗体并获得表达。方法:应用一段人工合成的含15个氨基酸的连接肽,采取亚克隆技术,将一株鼠抗BMP单克隆抗体的重链可变区(VH)的N端和轻链可变区(VL)的C端连接起来;将连接产物克隆入融合蛋白表达载体pEGX-4T-l,在大肠杆菌JM109中进行表达。结果:构建的单链抗体(ScFv)全长705 bp,并获得融合表达产物约52×103u。结论:亚克隆方法是一种构建单链抗体快速、简便、可靠的方法。
中图法分类号 R392.11
, http://www.100md.com
Construction and expression of bone morphogenetic protein (BMP) single-chain Fv
Sun Yuan, Yang Lianjia, Gao Yuhao, Jin Yan
Department of Oral-facial-maxillary Surgery, Southwest Hospital, Third Military Medical University, Chongqing,400038
Abstract Objective: To construct and express bone morphogenetic protein (BMP) single-chain Fv (ScFv). Methods: A synthetic linder containing 15 amino acids being used, the C end of the heavy chain gene fragment (V8) and the N end of the light chain gene fragment (V1) of BMP monoclonal antibody were connected with a subclonal method. Then the recombinant BMP ScFv was cloned into pGEX-4T-1 plasmid and induced to express in JM 109 E. coli. Results: BMP ScFv gene consisted of 705 base pairs and the BMP ScFv fusion protein was about 52 kd. Conclusion: Subclonal method is a rapid, simple and reliable way to construct ScFV.
, 百拇医药
Key words bone morphogenetic protein; linker; single-chain Fv; expression
骨形成蛋白(BMP)在正常组织中含量很低,当骨肿瘤发生时,其含量明显增高,因此可作为一种相关抗原应用于骨肿瘤的诊断和导向治疗[1]。但鼠源性BMP单抗所具有的免疫性,限制了其在临床上的直接应用。近年来随着基因工程技术的不断进步,鼠源性单克隆抗体的改建工作得到了突飞猛进的发展,如F(ab′)2、F(ab′)、ScFv等抗体分子片段的构建,更是倍受关注[2],临床应用前景十分广阔[3,4]。在此背景下,我们利用从BMP单抗杂交瘤中扩增、克隆的轻、重链可变区基因片段,并应用一种亚克隆方法,成功地构建了BMP单链抗体,在一种融合蛋白表达载体中获得了表达。
1 材料与方法
1.1 材料
, http://www.100md.com
1.1.1 BMP单抗基因片段
鼠BMP单抗杂交瘤由第四军医大学口腔医学院病理教研室制备并保存,此杂交瘤能稳定地分泌BMP单抗。BMP单抗轻、重链(VL、VH)分别克隆于pUC18、19质粒。
1.1.2 试剂
限制性内切酶、T4 DNA快速连接Kit、cDNA合成Kit购自Boehringer公司,T7 DNA聚合酶测序Kit购自Promega公司。
1.1.3 引物和连接肽
由上海肿瘤所合成。
1.1.3.1 PCR扩增引物,见图1
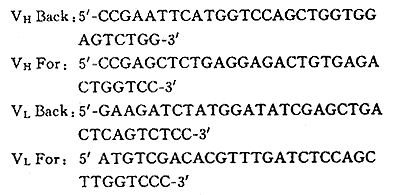
, 百拇医药
图1 PCR引物核苷酸序列
Fig 1 Neucleotide sequeces of PCR primers
1.1.3.2 连接肽LinkerFor中引入Sacl和BamHI酶切粘端序列,见图2
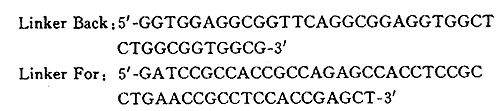
图2 链接肽核苷酸序列
Fig 2 Neucleotide sequeces of linkers
1.1.3.3 质粒
融合表达载体pGEX-4T-l由胡川闽博士惠赠。
, 百拇医药
1.2 方法
1.2.1
BMP单链抗体(BMP ScFv)的构建
1.2.1.1 多肽链的退火 取LinkerBack和LinkerFor各0.1μg/10 μl,加入3 mol/L NaAc 1 μl煮沸5 min,令其自然冷却,再经SacI/BamHI双酶切后纯化。
1.2.1.2 多肽链的克隆 将pUC19 用SacI/BamHI双酶切后,与酶切纯化的多肽链进行连接反应,连接产物常规转化大肠杆菌,挑取阳性克隆酶切鉴定。
1.2.1.3 以pUC 19-VL 重组质粒为模板,VL Back、VL For为引物,常规扩增出VL片段。VL片段经Bgl Ⅱ/SalI双酶切,pUC19-Linker重组质粒亦经BamHI/SalI双酶切后进行连接反应,常规转化和鉴定。
, http://www.100md.com
1.2.1.4 以pUC 19-VH重组质粒为模板,VH Back、VH For为引物,常规扩增出VH片段。VH片段经SacI/EcoRI双酶切后,与经同样双酶切的pUC 19-Linker-VL进行连接反应,反应产物常规转化与鉴定。
1.2.2 BMP单链抗体(BMP ScFv)的表达
1.2.2.1 表达载体的构建 先将pUC 10-VH-Linker-VL重组质粒用EcoRI酶切、Klenow酶补平后,再经SalI酶切,回收切下的约710 bp片段,和用SmaI/SalI双酶切的pGEX-4T-l进行连接反应,连接产物转化大肠杆菌JM 109。
1.2.2.2 诱导表达 阳性克隆经酶切鉴定后,取2 μl过夜菌加入2 ml LB(含氨苄青霉素)中,剧烈振摇2~3 h至对数生长期,加入IPTG至终浓度1 mmol/L,继续剧烈振摇培养4 h。收集菌体进行SDS-PAGE电泳观察结果。
, http://www.100md.com
2 结果
2.1 抗BMP单链抗体构建结果
pUC 19-linker重组质粒经EcoRI/SalI双酶切后,20%聚丙烯酰胺凝胶电泳观察,见一约60 bp片段切下。pUC 19-BMPscFv、pGEX-4T-l-BMPscFv重组质粒均用SalI/EcoRI双酶切后,1.5%琼脂糖凝胶电泳观察,均可见有约710 bp片段切下,见图3。

图3 BMP ScFv重组质粒的酶切鉴定
A:重组质粒pUC19-BMP ScFv B:重组质粒pGEX-4T-1-BMP ScFv C:标准分子量
, http://www.100md.com
Fig 3 Identification of pUC19-BMPscFv and pGEX-4T-l-BMP ScFv recombinant plasmid digested with SalI and EcoRI
A:pUC19-BMPscFv (3.40 kb) B:pGEX-4T-l-BMPscFv(5.68 kb) C:PCR markers
2.2 pGEX-4T-l-BMPscFv的诱导表达
经IPTG诱导的pGEX-4T-l-BMPscFv质
粒菌体,在SDS-PAGE电泳谱上出现一条约52×103u左右的新蛋白表达带。其分子量与预计的GST蛋白和BMPscFv抗体蛋白分子量之和一致,见图4。

, http://www.100md.com
图4 BMP ScFv融合蛋白SDS-PAGE电泳结果
A:未诱导的pGEX-4T-1 B:诱导的pGEX-4T-1 C:未诱导的pGEX-4F1-BMP ScFv D:诱导的pGEX-4T-1-BMP ScFv E:蛋白标准分子量参照
Fig 4 SDS-PAGE of pGEX-4T-l-BMPscFv
A:without induction of pGEX-4T-l B:induction of pGEX-4T-l C:without induction of pGEX-4T-l-BMPscFv D:induction of pGEX-4T-l-BMPscFv E:molecular weight standard
3 讨论
由于天然抗体的Fv片段中VH与VL为非共价性结合,只是依靠两链之间的两个二硫键以维持其结构和功能,因此在去除Fc片段后,VH与VL片段在浓度很低的条件下极易解离而失去活性。为解决定问题,有人采取了用戊二醛使VH、VL表面的亮氨酸和半胱氨酸聚合、或在Fv骨架区设计链间二硫键等方法来加强VH、VL的联系,但近年来倍受关注的是单链抗体的研究[6,7]。单链抗体是用一条人工合成的多肽链将VH、VL连接起来,使之即保持抗原结合区的完整基因,又不易发生解离的抗体分子片段。为了不影响Fv的空间结构与稳定性,多肽链的设计十分重要,一般是长度为15个氨基酸为最佳,同时具有疏水性和伸展性。Huston等人根据Fab片段X线衍射分析资料,设计出(Cly4Ser)3连接肽,研究表明此连接肽将VH的C端与VL的N端连接后,不影响Fv的二级结构,使之具有较好的稳定性与活性。此连接肽已成为“通用Linker”,广泛应用于ScFv的构建[8]。作者在应用(Gly4Ser)3Linker时,在其For引物上引入了SacI/BamHI限制性酶切位点,便于克隆,同时为VH、VL的定向亚克隆提供了条件。在构建单链抗体的方法上,作者所采用的定向亚克隆方法是一种快速、简便易行的方法,且结果可靠。将所构建的BMPScFv克隆入融合蛋白表达载体pGEX-4T-l中,经IPTG诱导,获得表达。表达产物的进一步纯化与活性检测有待于今后的工作。
, http://www.100md.com
(对第三军医大学基础医学部分子生物学教研室、预防医学系防原医学教研室、免疫学教研室及附属西南医院放射科的大力支持和刘昕、王燕、胡川闽、粟永萍、陈克敏等同志的热情支持与帮助表示衷心感谢!)
基金项目:国家自然科学基金资助项目,No.39470756
作者简介:孙远,男,35岁,主治医师,讲师,博士 第四军医大学口腔医学院病理学教研室 西安,730032
参考文献
1 Jin Yan, Yang Lian-jia. The relationship between bone morphogenetic and neoplastic bone disease. Clin Orthop,1990,259(2):233
2 Winter G, Harris W. Humanization antibodies. Immunology Today,1993,14(6):244
, 百拇医药
3 Debinski W, Pastan I. Monovalent immunotoxin containing trucated form of pseudomonas exotoxin as potent antitumor agent. Cancer Res,1992,52(21):5379
4 吴永刚,胡锦跃,苏见知,等.99m标记单抗Hb3及其片段F(ab′)2在大肠癌显像中的初步应用.中华核医学杂志,1996,16(2):73
5 孙 远,杨连甲,高玉好,等.小鼠BMP-McAb可变区基因的体外扩增、克隆与序列测定.细胞与分子生物学杂志,1997,13(4):12
6 Nieroda C A, Milenic D E, Carrasquillo J A, et al. Improved tumor radioimmunodetection using a single-chain Fv and γ-interferon: Potential clinical applications for radio immunoguided surgery and γ scanning. Cancer Res,1995,55(10):2858
, 百拇医药
7 Reiter Y, Brinkmann U, Kreitman R T, et al. Stabilization of the Fv fragments in recombinant immunotoxins by disulfide bonds engineered into conserved framework regions. Bio Chem,1994,33(18):5451
8 Huston J S, Leuinson D, Mudgett-Honter M, et al. Protein engineering of an antibody binding sites:recovery of specific activity in an anti-digoxin single-chain Fv analogue produced in Escherichia coli. Proc Natl Acad Sci USA,1988,85(16):5 879
收稿:1998-08-11
修回:1998-12-31, http://www.100md.com