大黄素甲醚-8-氧葡萄糖苷核磁共振谱线的全归属
作者:李文 沙沂 班允东 钟大放 刘晓秋 吴立军
单位:沈阳药科大学分析测试中心(李文 沙沂 班允东 钟大放);中药系(刘晓秋 吴立军)
关键词:氢检测多键多量子相干核磁共振技术;大黄素甲醚-8-氧葡萄糖苷;碳-13核磁共振
沈阳药科大学学报990410 摘 要 以大黄素甲醚-8-氧葡萄糖苷为例探讨了利用HMBC-NMR技术确定蒽醌苷类化合物结构中糖的连接位置的方法,在对其13C-NMR谱进行全归属的同时,订正了文献中对结构中某些碳信号的错误指认.
分类号 R914.1
The Total Assignment of NMR Signals of Physcion-8-O-glucoside
, 百拇医药
Li Wen,Sha Yi,Ban Yundong,Zhong Dafang,Liu Xiaoqiu,Wu Lijun
Center of Instrumental Analysis,Shenyang Pharmaceutical University,Shenyang 110015
Abstract A measurement technique of HMBC-NMR for the determination of sugar position in the structure of anthraquinone-glucoside was presented,and its application was illustrated with the example of physicion-8-O-glucoside.And all of the 13CNMR spectral signals of physcion-8-O-glucoside were properly assigned,and some of the mistakes occurred in literature〔1〕 were properly corrected in the meantime.
, 百拇医药
Key words HMBC-NMR technique;physicion-8-O-glucoside;13C-NMR
在蒽醌苷类化合物的结构研究中,经常遇到确定糖的连接位置的问题,特别是糖连接在两个α羟基及两个β位羟基的哪一个位置上是很棘手的问题,作者以大黄素甲醚-8-氧葡萄糖苷为例进行研究,采用氢检测多键多量子相干核磁共振技术(HMBC-NMR,1H-detected multiple-bond heteronuclear multiple-quantum coherence NMR)来确定蒽醌苷类化合物结构中糖的连接位置.在对其结构中的所有碳信号进行归属的同时,订正了文献〔1〕中对某些碳信号的错误指认,为蒽醌苷类化合物结构研究工作提供了一个有价值的方法.
1 实验部分
研究用大黄素甲醚-8-氧葡萄糖苷(化合物I)1H-NMR数据与文献报道的同一化合物的数据相同〔2〕.
, http://www.100md.com
NMR谱在Bruker ARX-300 NMR波谱仪上测得,溶剂DMSO(兼做二级化学位移内标).1H和13C-NMR谱的工作频率分别为300.13和75.47 MHz;在恒温40℃的条件下测定.HMBC实验采用标准脉冲程序,谱宽F1域(13C)19 230.770 Hz,F2域(1H)4 504.504 Hz,脉冲间隔1.5 s,D2(1JCH演化时间)3.1 ms,D6(nJCH演化时间)100 ms以获取1H-13C远程偶合相关峰.采样数矩阵为2 048×256,F1域零添充至1 024进行FT变换,两域分别采用Sine bell(SSB=2)、Qsine bell(SSB=0)窗函数进行谱图处理.
, 百拇医药
2 结果与讨论
根据化合物(I)的IR、1H-NMR和13C-NMR光谱数据可推测其结构有3种可能,(见图1).该3种化合物的IR、1H-NMR谱的数据几乎没有差别〔3〕,13C-NMR谱中有三个连氧碳的位置用13C-NMR的取代基位移规律〔4,5〕也很难区分,故难以确定葡萄糖基究竟连接在哪个位置上,对结构中的碳信号也难进行准确归属.利用HMBC-NMR技术可解决这一难题.
Fig.1 The possible structures of compound I
从1H-NMR数据入手分析化合物(I)的HMBC谱(见图2)发现:3位甲基质子δ2.41(3H,s)与δ147.1、δ124.2、δ119.3三个碳信号有远程相关峰;羟基质子δ13.0(1H,s)除与δ124.2有远程相关峰外,还与δ161.7、δ114.5有远程相关峰,说明游离羟基与甲基处在同一环上,即连接在1位上,从而排除了结构(2)的可能性;同时可归属δ161.7为1位碳信号,δ124.2为2位碳信号,δ147.1为与甲基直接相连的3位碳信号.δ119.3除与甲基质子有远程相关峰外,还与2位质子δ7.16(1H,br.s)有远程相关峰,据此可将其归属为4位碳信号.葡萄糖端基质子δ5.13(1H,d,J=7.56 Hz)与δ160.7连接碳信号有远程相关峰,说明葡萄糖基与其直接相连,而δ160.7与7位质子信号δ7.19(1H,d,J=2.52 Hz)有远程相关峰,但与5位质子δ7.36(1H,d,J=2.52 Hz)没有远程相关峰,可将其归属为8位碳信号,从而说明葡萄糖基连接在8位碳上;甲氧基质子δ3.96(3H,s)与连氧碳δ164.7有远程相关峰,说明甲氧基与此碳直接相连,而δ164.7碳信号还同时与5位及7位质子信号有远程相关峰,故应将其归属为6位碳信号,即甲氧基连接在6位上.此结果通过NOE差光谱技术得以验证,即当照射甲氧基质子时,5位及7位质子均产生NOE效应,从而排除了结构(3)的可能性,证明结构(1)中3个连氧基团的连接位置是正确的.δ106.6因与7位质子远程相关峰可归属为5位碳信号,δ107.5因与5位质子远程相关可归属为7位碳信号,δ114.5的吸收峰因其与四个芳香质子均有远程相关峰故可归属为8 a及9 a碳信号;δ136.3因与5位质子有远程相关可归属为10 a碳信号;δ132.1应归属为4 a碳信号;两个羰基的碳信号中因δ181.8与4位及5位质子均有远程相关峰可归属为10位碳信号;而δ186.4无远程相关峰故可归属为9位碳信号.另外,分别将δ100.9、δ73.3、δ77.5、δ69.9、δ76.6及δ60.8归属为葡萄糖1′至6′位上的碳信号.至此,在确定了三个连氧取代基位置,特别是葡萄糖基连接位置的同时,归属了结构中全部13C-NMR信号,并订正了文献〔2〕中对1位碳信号的错误指认,其结果如表1所示.
, 百拇医药
Tab.1 The NMR data of hyscion-8-O-glucoside No
δc
H coupled with C(long-range)
Literature〔1〕
1
161.7
-OH
13.0 s;
H-2
7.16 br.s
146.8
, http://www.100md.com
2
124.2
-CH3
2.41 s;
-OH
13.0 s;
H-4
7.18 br.s
124.3
3
147.1
-CH3
, http://www.100md.com
2.41 s;
146.8
4
119.3
H-2
7.16 br.s
-CH3
2.41 s
119.0
4a
132.1
132.0
, http://www.100md.com
5
106.6
H-7
7.19 d(2.52)
106.4
6
164.7
-OCH3
3.96 s;
H-5
7.36 d(2.52)
H-7
, http://www.100md.com
7.19 d(2.52)
164.6
7
107.5
H-5
7.36 d(2.52)
107.4
8
160.7
anomeric H
5.13 d(7.56);
H-7
, 百拇医药
7.19 d(2.52)
106.6
8a
114.5
H-5
7.36 d(2.52);
H-7
7.19 d(2.52)
118.9
9
186.4
186.3
, http://www.100md.com
9a
114.5
H-2
7.16 br.s;
H-4
7.48 br.s
-OH
13.0 s
114.6
10
181.8
H-4
, 百拇医药 7.48 br.s;
H-5
7.36 d(2.52)
181.8
10a
136.3
H-5
7.36 d(2.52)
136.2
-CH3
21.3
H-2
, 百拇医药
7.16 br.s;
H-4
7.48 br.s
21.3
-OCH3
56.0
56.0
glc-1′
100.9
H-glc-2′
3.48 m
glc 60.8
, 百拇医药
glc-2′
73.7
H-glc-3′
3.34 t(8.67)
69.8
glc-3′
77.5
H-glc-4′
3.34 m;
H-glc-5′
3.18 m
73.2
, http://www.100md.com
glc-4′
69.9
H-glc-3′
3.34 t(8.67)
76.5
glc-5′
76.6
H-glc-6′
3.74.dd(9.45,5.13)
77.4
glc-6′
60.8
, 百拇医药
H-glc-5′
3.18 m
100.8
Literature〔1〕—There are some stars assignments which may be interchanged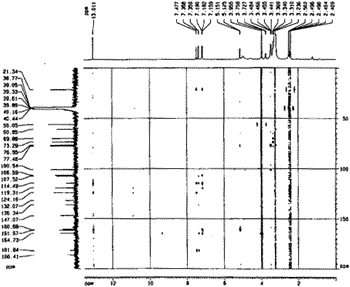
Fig.2 HMBC spectrum of physicon-8-O-glucoside
参考文献
1 Kubo I,Murai Y,Soediro I,et al.Cytotoxic anthraquinones from rheum pulmatum.Phytochemistry,1992,31(3):1063
, 百拇医药
2 加藤 健,森田 丰.酸模根の成分组成について. 1987,41(1):67
1987,41(1):67
3 Kalidhar SB.Structural elucidation in anthraquinones using 1H-NMR glycosylation and alkylation shifts.Phytochemistry,1989,28(12):3459
4 Itokawa H,Mihara K,Takeya K.Studies on a novel anthraquinone and its glycosides isolated from rubia cordifolia and rakane.Chem Pharm Bull,1983,31:2353
5 Berger YM,Berger-Deguee AC.13C nuclear magnetic resonance studies of anthraquinones.Org Magnetic Resonance,1981,15:24
收稿日期:1998-01-18, 百拇医药
单位:沈阳药科大学分析测试中心(李文 沙沂 班允东 钟大放);中药系(刘晓秋 吴立军)
关键词:氢检测多键多量子相干核磁共振技术;大黄素甲醚-8-氧葡萄糖苷;碳-13核磁共振
沈阳药科大学学报990410 摘 要 以大黄素甲醚-8-氧葡萄糖苷为例探讨了利用HMBC-NMR技术确定蒽醌苷类化合物结构中糖的连接位置的方法,在对其13C-NMR谱进行全归属的同时,订正了文献中对结构中某些碳信号的错误指认.
分类号 R914.1
The Total Assignment of NMR Signals of Physcion-8-O-glucoside
, 百拇医药
Li Wen,Sha Yi,Ban Yundong,Zhong Dafang,Liu Xiaoqiu,Wu Lijun
Center of Instrumental Analysis,Shenyang Pharmaceutical University,Shenyang 110015
Abstract A measurement technique of HMBC-NMR for the determination of sugar position in the structure of anthraquinone-glucoside was presented,and its application was illustrated with the example of physicion-8-O-glucoside.And all of the 13CNMR spectral signals of physcion-8-O-glucoside were properly assigned,and some of the mistakes occurred in literature〔1〕 were properly corrected in the meantime.
, 百拇医药
Key words HMBC-NMR technique;physicion-8-O-glucoside;13C-NMR
在蒽醌苷类化合物的结构研究中,经常遇到确定糖的连接位置的问题,特别是糖连接在两个α羟基及两个β位羟基的哪一个位置上是很棘手的问题,作者以大黄素甲醚-8-氧葡萄糖苷为例进行研究,采用氢检测多键多量子相干核磁共振技术(HMBC-NMR,1H-detected multiple-bond heteronuclear multiple-quantum coherence NMR)来确定蒽醌苷类化合物结构中糖的连接位置.在对其结构中的所有碳信号进行归属的同时,订正了文献〔1〕中对某些碳信号的错误指认,为蒽醌苷类化合物结构研究工作提供了一个有价值的方法.
1 实验部分
研究用大黄素甲醚-8-氧葡萄糖苷(化合物I)1H-NMR数据与文献报道的同一化合物的数据相同〔2〕.
, http://www.100md.com
NMR谱在Bruker ARX-300 NMR波谱仪上测得,溶剂DMSO(兼做二级化学位移内标).1H和13C-NMR谱的工作频率分别为300.13和75.47 MHz;在恒温40℃的条件下测定.HMBC实验采用标准脉冲程序,谱宽F1域(13C)19 230.770 Hz,F2域(1H)4 504.504 Hz,脉冲间隔1.5 s,D2(1JCH演化时间)3.1 ms,D6(nJCH演化时间)100 ms以获取1H-13C远程偶合相关峰.采样数矩阵为2 048×256,F1域零添充至1 024进行FT变换,两域分别采用Sine bell(SSB=2)、Qsine bell(SSB=0)窗函数进行谱图处理.
, 百拇医药
2 结果与讨论
根据化合物(I)的IR、1H-NMR和13C-NMR光谱数据可推测其结构有3种可能,(见图1).该3种化合物的IR、1H-NMR谱的数据几乎没有差别〔3〕,13C-NMR谱中有三个连氧碳的位置用13C-NMR的取代基位移规律〔4,5〕也很难区分,故难以确定葡萄糖基究竟连接在哪个位置上,对结构中的碳信号也难进行准确归属.利用HMBC-NMR技术可解决这一难题.

Fig.1 The possible structures of compound I
从1H-NMR数据入手分析化合物(I)的HMBC谱(见图2)发现:3位甲基质子δ2.41(3H,s)与δ147.1、δ124.2、δ119.3三个碳信号有远程相关峰;羟基质子δ13.0(1H,s)除与δ124.2有远程相关峰外,还与δ161.7、δ114.5有远程相关峰,说明游离羟基与甲基处在同一环上,即连接在1位上,从而排除了结构(2)的可能性;同时可归属δ161.7为1位碳信号,δ124.2为2位碳信号,δ147.1为与甲基直接相连的3位碳信号.δ119.3除与甲基质子有远程相关峰外,还与2位质子δ7.16(1H,br.s)有远程相关峰,据此可将其归属为4位碳信号.葡萄糖端基质子δ5.13(1H,d,J=7.56 Hz)与δ160.7连接碳信号有远程相关峰,说明葡萄糖基与其直接相连,而δ160.7与7位质子信号δ7.19(1H,d,J=2.52 Hz)有远程相关峰,但与5位质子δ7.36(1H,d,J=2.52 Hz)没有远程相关峰,可将其归属为8位碳信号,从而说明葡萄糖基连接在8位碳上;甲氧基质子δ3.96(3H,s)与连氧碳δ164.7有远程相关峰,说明甲氧基与此碳直接相连,而δ164.7碳信号还同时与5位及7位质子信号有远程相关峰,故应将其归属为6位碳信号,即甲氧基连接在6位上.此结果通过NOE差光谱技术得以验证,即当照射甲氧基质子时,5位及7位质子均产生NOE效应,从而排除了结构(3)的可能性,证明结构(1)中3个连氧基团的连接位置是正确的.δ106.6因与7位质子远程相关峰可归属为5位碳信号,δ107.5因与5位质子远程相关可归属为7位碳信号,δ114.5的吸收峰因其与四个芳香质子均有远程相关峰故可归属为8 a及9 a碳信号;δ136.3因与5位质子有远程相关可归属为10 a碳信号;δ132.1应归属为4 a碳信号;两个羰基的碳信号中因δ181.8与4位及5位质子均有远程相关峰可归属为10位碳信号;而δ186.4无远程相关峰故可归属为9位碳信号.另外,分别将δ100.9、δ73.3、δ77.5、δ69.9、δ76.6及δ60.8归属为葡萄糖1′至6′位上的碳信号.至此,在确定了三个连氧取代基位置,特别是葡萄糖基连接位置的同时,归属了结构中全部13C-NMR信号,并订正了文献〔2〕中对1位碳信号的错误指认,其结果如表1所示.
, 百拇医药
Tab.1 The NMR data of hyscion-8-O-glucoside No
δc
H coupled with C(long-range)
Literature〔1〕
1
161.7
-OH
13.0 s;
H-2
7.16 br.s
146.8
, http://www.100md.com
2
124.2
-CH3
2.41 s;
-OH
13.0 s;
H-4
7.18 br.s
124.3
3
147.1
-CH3
, http://www.100md.com
2.41 s;
146.8
4
119.3
H-2
7.16 br.s
-CH3
2.41 s
119.0
4a
132.1
132.0
, http://www.100md.com
5
106.6
H-7
7.19 d(2.52)
106.4
6
164.7
-OCH3
3.96 s;
H-5
7.36 d(2.52)
H-7
, http://www.100md.com
7.19 d(2.52)
164.6
7
107.5
H-5
7.36 d(2.52)
107.4
8
160.7
anomeric H
5.13 d(7.56);
H-7
, 百拇医药
7.19 d(2.52)
106.6
8a
114.5
H-5
7.36 d(2.52);
H-7
7.19 d(2.52)
118.9
9
186.4
186.3
, http://www.100md.com
9a
114.5
H-2
7.16 br.s;
H-4
7.48 br.s
-OH
13.0 s
114.6
10
181.8
H-4
, 百拇医药 7.48 br.s;
H-5
7.36 d(2.52)
181.8
10a
136.3
H-5
7.36 d(2.52)
136.2
-CH3
21.3
H-2
, 百拇医药
7.16 br.s;
H-4
7.48 br.s
21.3
-OCH3
56.0
56.0
glc-1′
100.9
H-glc-2′
3.48 m
glc 60.8
, 百拇医药
glc-2′
73.7
H-glc-3′
3.34 t(8.67)
69.8
glc-3′
77.5
H-glc-4′
3.34 m;
H-glc-5′
3.18 m
73.2
, http://www.100md.com
glc-4′
69.9
H-glc-3′
3.34 t(8.67)
76.5
glc-5′
76.6
H-glc-6′
3.74.dd(9.45,5.13)
77.4
glc-6′
60.8
, 百拇医药
H-glc-5′
3.18 m
100.8
Literature〔1〕—There are some stars assignments which may be interchanged

Fig.2 HMBC spectrum of physicon-8-O-glucoside
参考文献
1 Kubo I,Murai Y,Soediro I,et al.Cytotoxic anthraquinones from rheum pulmatum.Phytochemistry,1992,31(3):1063
, 百拇医药
2 加藤 健,森田 丰.酸模根の成分组成について.
 1987,41(1):67
1987,41(1):673 Kalidhar SB.Structural elucidation in anthraquinones using 1H-NMR glycosylation and alkylation shifts.Phytochemistry,1989,28(12):3459
4 Itokawa H,Mihara K,Takeya K.Studies on a novel anthraquinone and its glycosides isolated from rubia cordifolia and rakane.Chem Pharm Bull,1983,31:2353
5 Berger YM,Berger-Deguee AC.13C nuclear magnetic resonance studies of anthraquinones.Org Magnetic Resonance,1981,15:24
收稿日期:1998-01-18, 百拇医药