亚硒酸钠及抗氧化剂抑制小鼠肺泡Arthus血管炎发生的机制△
作者:石新兰 凌允礼 侯健存
单位:中国医学科学院 中国协和医科大学 基础医学研究所病理室, 北京 100005
关键词:亚硒酸钠;抗氧化剂;活性氧;肺泡血管炎;补体活化反馈环
中国医学科学院学报990404 摘要 目的 以小鼠肺泡血管炎动物模型为研究对象,证明亚硒酸钠及其它抗氧化剂,可通过抑制补体—中性粒细胞(PMN)—活性氧(ROS)正反馈活化环的机制抑制炎症反应。方法 以牛血清白蛋白致敏昆明小鼠建立肺泡Arthus反应性血管炎(即急性肺泡炎)的动物模型,观察口服补体活化抑制剂亚硒酸钠或抗氧化剂类黄酮(flavonoid)和维生素E阻断补体活化正反馈环的运转,以抑制小鼠急性肺泡炎的发生(观察补体活化及释放的活性氧在炎症区PMN上的荧光组化表现)。结果 以上3种补体活化抑制剂及抗氧化剂能在不同程度上抑制小鼠肺泡Arthus血管炎的发生,尤以3种抗氧化剂联合应用效果更佳,其抑制率可达75%(P<0.01)。结论 亚硒酸钠抑制补体的活化、类黄酮及维生素E的抗氧化作用可以通过抑制补体活化反馈机制控制炎症应答,从而进一步证明了补体—PMN—ROS正反馈活化环促进炎症反应机制的存在。
, 百拇医药
中图号 R392.31
The Inhibitory Effect of Selenite and Other Antioxidants on
the Complement Mediated Experimental Pulmonary Alveolitis
Shi Xinlan Lin Yunli Hou Jiancun#
(Department of Pathology, Institute of Basic Medical Sciences, CAMS and PUMC Beijing. 100005)
Objective To test the regulatory effect of selenite and other antioxidants on complement PMN activation feedback mechanism mediated inflammatory response in experimantal pulmonary vasculitis. Methods Mouse model of pulmonary Arthus reaction vasculitis developed with BSA sensitization and antigen inhalation was used for tests of inhibitory effect of oral administration of sodium selenite, glycyrrhizin flavonoids and/or vitamin E on the incidence of developing vasculitis, which could reflect the modulation of inflammatory response and tissue injury. Results A remarkable inhibitory effect of selenite or combined flavonoid and vitamin E on the induction of pulmonary vasculitis were observed as the incidence of vasculitis could drop from 100% of the untreated group down to 25% of the antioxidants treated groups, revealing modulation of inflammatory response. Conclusions It indicated a newer insight into mechanism of the inflammatory response could give a novel approach to the modulation of inflammatory response. An adjuvant therapy of selenium and antioxidants to the interventions of inflammatory disorders has been expected.
, 百拇医药
Key words selenite; antioxidants; reactive oxygen species; alveolar vasculitis; complement activation feedback
炎症应答调控的研究是防治炎症性疾病的关键,但至今对炎症的机制尚未完全阐明。近年来多数学者认为在炎症形成过程中补体起着中心作用[1,2]。笔者曾提出补体介导炎症反应及组织损伤机制的新设想[3],即补体的活化既能激活中性粒细胞(PMN)及血管内皮细胞(EC)表达粘附分子,介导PMN跨内皮渗出[4],又能激活PMN释放活性氧(ROS),引起氧化损伤[5];而且ROS又能再反馈激活补体,如此形成一个正反馈活化环致使炎症反应持续并扩大。而抑制补体活化或清除ROS,必将阻断该反馈环的运转,从而起到控制炎症反应减轻组织损伤的作用。本组曾以离体试验证实了补体—PMN—ROS正反馈活化环的存在[6],本研究采用兼有抑制补体活化作用的抗氧化剂亚硒酸钠及甘草类黄酮、维生素E等活性氧清除剂对小鼠肺泡Arthus反应性血管炎动物模型产生的阻断作用,进一步在整体动物水平验证补体介导的活化反馈环调节炎症反应机制的存在。
, http://www.100md.com
1 材料和方法
试剂 牛血清白蛋白(BSA)为天津生化制品厂出品,锰枸橼酸盐缓冲液、DAB显色液与氧合溶液、三羟甲基氨基甲烷缓冲液(TBR)均按文献[7]方法配制,兔抗小鼠C3为本实验室制备,FITC-羊抗兔IgG为军事医学科学院五所产品,FITC-羊抗鼠IgG为北京生物制品研究所产品,亚硒酸钠(selenase, SS, 100 μg/amp)为德国G. N. PHARM药厂提供,甘草类黄酮(glycyrrhiza flavonoid, GF)为呼和浩特迪科医药高新技术产品开发公司产品,50% Vitamin E(VE, 水溶性)为中国预防医学科学院营养卫生研究所提供。
仪器 OTF恒冷低温切片机(英国,Bright),BH2落射荧光显微镜(日本,Olympus)。
小鼠Arthus反应性肺泡血管炎模型的建立 雄性昆明小鼠(4周龄,体重16~20 g)80只,随机取9只作为正常对照组(N),其余的按下列方法免疫:腹股沟皮下多点注射BSA,每只每次0.25 mg,第一次加弗氏完全佐剂,此后于第4、6周分别行强化免疫,第3次免疫2周后接受雾化吸入3 mg/ml BSA 90 min,以引发Arthus肺泡血管炎。
, 百拇医药
分组及给药: (1) 单一用药组,将模型小鼠随机分为4组(每组9~10只):阳性对照组(K1),不给任何药物;SS组,每只给予5 μg/d SS; VE组, 每只250 μg/d VE; GF组,每只25 μg/d GF。各组喂药3 d,喂药方式:灌胃。第3天行雾化吸入 BSA。(2) 联合用药组,共设3组(每组9只):阳性对照组(K2),不给任何药物;EFS组,给予VE+GF+SS; FS组,给予GF+SS。药物剂量与单一用药组相同。喂药第3天行雾化BSA吸入实验。
取材及处理 喂药第3日晨给药2小时后吸入雾化的BSA 90 min。6 h后眼底动脉放血、杀鼠取肺,进行制片和染色。(1) 免疫荧光染色:将最大叶肺纵切成两半,取其一半作低温切片,进行抗C3、抗IgG免疫荧光染色; (2) 组化染色[7,8]:另一半肺叶切成1 mm厚的薄片,按文献[7,8]的方法进行,最后以甲基绿作对比染色。阳性反应者,镜下可见棕褐色反应物,肺泡炎时,主要是PMN胞浆及胞膜产生
组化染色[7,8]:另一半肺叶切成1 mm厚的薄片,按文献[7,8]的方法进行,最后以甲基绿作对比染色。阳性反应者,镜下可见棕褐色反应物,肺泡炎时,主要是PMN胞浆及胞膜产生 ;(3) 其余的肺组织按常规制成石蜡切片、HE染色,全面观察每个切面是否有Arthus血管炎的发生,所有小鼠同种染色的肺组织取材部位一致。
;(3) 其余的肺组织按常规制成石蜡切片、HE染色,全面观察每个切面是否有Arthus血管炎的发生,所有小鼠同种染色的肺组织取材部位一致。
, 百拇医药
此外,将血液静置2 h后离心取血清,作对流免疫电泳测定小鼠抗BSA抗体滴度,计数各实验组小鼠BSA致敏阳性例数,并核查血管炎发生的情况。
统计学处理 各组之间发生血管炎的百分率的差异为计数资料,并且例数<40,故采用精确概率法检验。
2 结果
K1组和K2组抗BSA抗体(+)者均出现Arthus肺泡血管炎病理改变(图1,2),免疫荧光检查显示,阳性对照组炎症部位血管内皮细胞及其周围渗出的PMN胞膜上均可见C3线状沉积(图3,4)。各给药组小鼠肺泡血管炎发生率及PMN、 及补体C3染色阳性率均较对照组明显降低,差异有显著性意义(P<0.05),尤其联合用药EFS组效果更为显著,肺泡血管炎的发生率仅25%(P<0.01)(表1)。N组抗BSA抗体(-),肺部未见病理改变。
及补体C3染色阳性率均较对照组明显降低,差异有显著性意义(P<0.05),尤其联合用药EFS组效果更为显著,肺泡血管炎的发生率仅25%(P<0.01)(表1)。N组抗BSA抗体(-),肺部未见病理改变。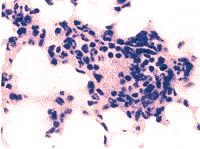
, http://www.100md.com
图 1 Arthus反应性肺泡血管炎
Fig 1 Arthus reaction alveolar vasculitis, showing PMNS and RBC infiltrating alveoluns HE×360
图 2 Arthus反应性肺泡血管炎
Fig 2 Arthus reaction alveolar vasculitis, showing marked endothelial damage and hemorrhages×200
图 3 肺泡壁血管内皮细胞及
, http://www.100md.com
渗出PMN之C3荧光染色
Fig 3 C3 immunoflouresence staining of alveolar infiltrations shows linear deposits of C3 on PMN membrane indicating PMNS activation×360
图 4 组化染色
Fig 4 Histochemical demonstration of superoxide generation of infiltrating PMNs×360
附表 各组肺泡血管炎发生率及PMN- 、C3染色阳性率结果
、C3染色阳性率结果
, http://www.100md.com
Table The incidence of vasculitis and PMN- , C3 stainings in test and control groups Group
, C3 stainings in test and control groups Group
Sensitized
anti-BSA
positive
Cases
Vasculitis
C3
, 百拇医药 Incidence
Positivity
Positivity
No.
%
No.
%
No.
%
SS
8
3
37.5
, 百拇医药
2
25
2
25
VE
7
3
43
3
43
1
14.3
GF
, 百拇医药 5
2
40
2
40
2
40
K1
6
6
100
6
100
6
, 百拇医药
100
EFS
8
2
25
2
25
1
12.5
FS
9
4
44
, 百拇医药
4
44
3
33
K2
9
9
100
8
89
7
78
*P<0.05,**P<0.01 compared to K1 and K2 respectively; SS: selenase; VE: vitaminE; GF:glycyrrhiza flavonoid; K1, K2:control; EFS:VE+GF+SS; FS:GF+SS
, http://www.100md.com
3 讨论
本实验结果显示,以BSA致敏的昆明小鼠在吸入雾化的BSA抗原后,6 h内即可查见肺内支气管旁急性肺泡炎的发生(图3,4),并经血清BSA抗体检测和IgG、C3免疫荧光染色的鉴定得以证实。可以认为这是免疫复合物(IC)引起的组织炎症损伤,即肺泡Arthus反应性血管炎(vasculitis)在小鼠肺组织内的一种表现形式——急性肺泡炎(acute alveolitis)。该炎症模型的成功建立为探讨补体活化介导炎症反应机制提供了可靠的基础。本组以往的工作表明,具有抗氧化作用的亚硒酸钠能有效地抑制动物体内补体的活化[9],尤其口服亚硒酸钠能抑制补体的活化,显著降低流行性出血热患者的死亡率[10]。提示补体活化介导的炎症反应必然与活性氧的产生及其作用有关。本研究在整体动物体内进一步验证了用补体活化抑制剂SS及ROS清除剂GF和VitE能抑制“活化反馈环”的运转,进而抑制炎症反应的新设想。本实验结果表明,单独给予SS、VitE或GF均能在一定程度上抑制肺泡炎的发生(抑制率分别为62.5%、57%、60%),而SS、GF与VitE合用时能更有效地抑制肺泡炎的发生(抑制率为75%),这一结果说明急性肺泡炎的发生是与补体活化和ROS的产生、释放共同作用分不开的。在肺泡炎部位PMN- 组化染色(图4)以及PMN膜C3免疫荧光染色呈现的阳性反应(图3),即表明补体的活化及其片段C3b、C5a等与PMN膜受体的结合及其激活的过程。从而进一步在动物体内验证了补体介导的炎症引起的组织损伤是通过PMN产生的ROS再活化补体这一正反馈活化环起作用的。这是继本组在离体细胞水平验证补体活化—ROS正反馈活化环的存在之后,在整体动物水平对此活化反馈环促发炎症的新设想提供的另一有力的证据。由此不难想象,当某种IC性或非免疫性因素导致补体活化或激活PMN产生ROS时,均可启动该补体活化正反馈环的运转,导致扩大炎症反应,加重组织损伤。反之,若能采取抗氧化剂等有效措施打断这一反馈环,则有可能控制炎症的发生、发展,总之,本研究结果不但为阐明炎症发生、发展和调控机制提供有力的证据,而且也进一步提示人们有可能使用补体活化抑制剂特别是亚硒酸钠以及抗氧化剂,通过切断该“反馈环”以控制炎症反应。从而可能为临床辅佐防治自身免疫性疾病或有关炎症性传染病的研究提供一条新的途径。
组化染色(图4)以及PMN膜C3免疫荧光染色呈现的阳性反应(图3),即表明补体的活化及其片段C3b、C5a等与PMN膜受体的结合及其激活的过程。从而进一步在动物体内验证了补体介导的炎症引起的组织损伤是通过PMN产生的ROS再活化补体这一正反馈活化环起作用的。这是继本组在离体细胞水平验证补体活化—ROS正反馈活化环的存在之后,在整体动物水平对此活化反馈环促发炎症的新设想提供的另一有力的证据。由此不难想象,当某种IC性或非免疫性因素导致补体活化或激活PMN产生ROS时,均可启动该补体活化正反馈环的运转,导致扩大炎症反应,加重组织损伤。反之,若能采取抗氧化剂等有效措施打断这一反馈环,则有可能控制炎症的发生、发展,总之,本研究结果不但为阐明炎症发生、发展和调控机制提供有力的证据,而且也进一步提示人们有可能使用补体活化抑制剂特别是亚硒酸钠以及抗氧化剂,通过切断该“反馈环”以控制炎症反应。从而可能为临床辅佐防治自身免疫性疾病或有关炎症性传染病的研究提供一条新的途径。
, 百拇医药
△国家自然科学基金(39670288)资助;*湖北三峡医学院进修生;#通讯作者
参考文献
1 Reinhard W, Manfred PD. Complement in human Disease. Immunol Today, 1997, 18:460~463
2 Machael M, Louis FF, The Role of Complement in inflammation and Phagocytosis. Immunol Today, 1991, 12:322~326
3 Hou Jiancun.Inhibitory effect of selenite and other antioxidants on complement-mediated tissue injury in the patients with epidemic hemorrhagic fever. Trace Element Res. 1997, 56:125~130
, 百拇医药
4 Forman KE, Glovsky MM, Warner RL, et al, Comparative effect of C3a and C5a on adhesion molecule expression on PMN and endothelial cells. Inflammation, 1996; 20:1~9
5 Roberford M, Calderon PB. Free radicals and oxidation phenomena in biological systems. New York: Marcel Dekker Inc, 1995. 145~164
6 范欣荣, 凌允礼, 吴元德,等.补体活化与中性粒细胞产生活性氧之间的反馈调节作用.中国医学科学院学报 1999, 21(3):175~179
7 Babbs CF, Cregor MD, et al. Methods in laboratory investigation:Endothelial superoxide production in buffer perfused rat lungs, Demonstrated by a new histochemical technique. Lab Invest, 1991, 65:484~496
, 百拇医药
8 Liberman H, Mariassy AT, et al. Morphometric estimation of superoxide generation in allergen-induced airway hyperresponsiveness. Lab Invest, 1995, 72:348~356
9 侯健存,戴 岩, 凌允礼.亚硒酸钠在小鼠体内对补体活化的抑制作用.中国医学科学院学报,1989, 11(4):250~253
10 侯健存,江之云,何志藩,等.硒对流行性出血热患者补体活化的抑制作用与疗效观察.中华医学杂志,1993,73(11):645~646
(1998-07-07 收稿), 百拇医药
单位:中国医学科学院 中国协和医科大学 基础医学研究所病理室, 北京 100005
关键词:亚硒酸钠;抗氧化剂;活性氧;肺泡血管炎;补体活化反馈环
中国医学科学院学报990404 摘要 目的 以小鼠肺泡血管炎动物模型为研究对象,证明亚硒酸钠及其它抗氧化剂,可通过抑制补体—中性粒细胞(PMN)—活性氧(ROS)正反馈活化环的机制抑制炎症反应。方法 以牛血清白蛋白致敏昆明小鼠建立肺泡Arthus反应性血管炎(即急性肺泡炎)的动物模型,观察口服补体活化抑制剂亚硒酸钠或抗氧化剂类黄酮(flavonoid)和维生素E阻断补体活化正反馈环的运转,以抑制小鼠急性肺泡炎的发生(观察补体活化及释放的活性氧在炎症区PMN上的荧光组化表现)。结果 以上3种补体活化抑制剂及抗氧化剂能在不同程度上抑制小鼠肺泡Arthus血管炎的发生,尤以3种抗氧化剂联合应用效果更佳,其抑制率可达75%(P<0.01)。结论 亚硒酸钠抑制补体的活化、类黄酮及维生素E的抗氧化作用可以通过抑制补体活化反馈机制控制炎症应答,从而进一步证明了补体—PMN—ROS正反馈活化环促进炎症反应机制的存在。
, 百拇医药
中图号 R392.31
The Inhibitory Effect of Selenite and Other Antioxidants on
the Complement Mediated Experimental Pulmonary Alveolitis
Shi Xinlan Lin Yunli Hou Jiancun#
(Department of Pathology, Institute of Basic Medical Sciences, CAMS and PUMC Beijing. 100005)
Objective To test the regulatory effect of selenite and other antioxidants on complement PMN activation feedback mechanism mediated inflammatory response in experimantal pulmonary vasculitis. Methods Mouse model of pulmonary Arthus reaction vasculitis developed with BSA sensitization and antigen inhalation was used for tests of inhibitory effect of oral administration of sodium selenite, glycyrrhizin flavonoids and/or vitamin E on the incidence of developing vasculitis, which could reflect the modulation of inflammatory response and tissue injury. Results A remarkable inhibitory effect of selenite or combined flavonoid and vitamin E on the induction of pulmonary vasculitis were observed as the incidence of vasculitis could drop from 100% of the untreated group down to 25% of the antioxidants treated groups, revealing modulation of inflammatory response. Conclusions It indicated a newer insight into mechanism of the inflammatory response could give a novel approach to the modulation of inflammatory response. An adjuvant therapy of selenium and antioxidants to the interventions of inflammatory disorders has been expected.
, 百拇医药
Key words selenite; antioxidants; reactive oxygen species; alveolar vasculitis; complement activation feedback
炎症应答调控的研究是防治炎症性疾病的关键,但至今对炎症的机制尚未完全阐明。近年来多数学者认为在炎症形成过程中补体起着中心作用[1,2]。笔者曾提出补体介导炎症反应及组织损伤机制的新设想[3],即补体的活化既能激活中性粒细胞(PMN)及血管内皮细胞(EC)表达粘附分子,介导PMN跨内皮渗出[4],又能激活PMN释放活性氧(ROS),引起氧化损伤[5];而且ROS又能再反馈激活补体,如此形成一个正反馈活化环致使炎症反应持续并扩大。而抑制补体活化或清除ROS,必将阻断该反馈环的运转,从而起到控制炎症反应减轻组织损伤的作用。本组曾以离体试验证实了补体—PMN—ROS正反馈活化环的存在[6],本研究采用兼有抑制补体活化作用的抗氧化剂亚硒酸钠及甘草类黄酮、维生素E等活性氧清除剂对小鼠肺泡Arthus反应性血管炎动物模型产生的阻断作用,进一步在整体动物水平验证补体介导的活化反馈环调节炎症反应机制的存在。
, http://www.100md.com
1 材料和方法
试剂 牛血清白蛋白(BSA)为天津生化制品厂出品,锰枸橼酸盐缓冲液、DAB显色液与氧合溶液、三羟甲基氨基甲烷缓冲液(TBR)均按文献[7]方法配制,兔抗小鼠C3为本实验室制备,FITC-羊抗兔IgG为军事医学科学院五所产品,FITC-羊抗鼠IgG为北京生物制品研究所产品,亚硒酸钠(selenase, SS, 100 μg/amp)为德国G. N. PHARM药厂提供,甘草类黄酮(glycyrrhiza flavonoid, GF)为呼和浩特迪科医药高新技术产品开发公司产品,50% Vitamin E(VE, 水溶性)为中国预防医学科学院营养卫生研究所提供。
仪器 OTF恒冷低温切片机(英国,Bright),BH2落射荧光显微镜(日本,Olympus)。
小鼠Arthus反应性肺泡血管炎模型的建立 雄性昆明小鼠(4周龄,体重16~20 g)80只,随机取9只作为正常对照组(N),其余的按下列方法免疫:腹股沟皮下多点注射BSA,每只每次0.25 mg,第一次加弗氏完全佐剂,此后于第4、6周分别行强化免疫,第3次免疫2周后接受雾化吸入3 mg/ml BSA 90 min,以引发Arthus肺泡血管炎。
, 百拇医药
分组及给药: (1) 单一用药组,将模型小鼠随机分为4组(每组9~10只):阳性对照组(K1),不给任何药物;SS组,每只给予5 μg/d SS; VE组, 每只250 μg/d VE; GF组,每只25 μg/d GF。各组喂药3 d,喂药方式:灌胃。第3天行雾化吸入 BSA。(2) 联合用药组,共设3组(每组9只):阳性对照组(K2),不给任何药物;EFS组,给予VE+GF+SS; FS组,给予GF+SS。药物剂量与单一用药组相同。喂药第3天行雾化BSA吸入实验。
取材及处理 喂药第3日晨给药2小时后吸入雾化的BSA 90 min。6 h后眼底动脉放血、杀鼠取肺,进行制片和染色。(1) 免疫荧光染色:将最大叶肺纵切成两半,取其一半作低温切片,进行抗C3、抗IgG免疫荧光染色; (2)
 组化染色[7,8]:另一半肺叶切成1 mm厚的薄片,按文献[7,8]的方法进行,最后以甲基绿作对比染色。阳性反应者,镜下可见棕褐色反应物,肺泡炎时,主要是PMN胞浆及胞膜产生
组化染色[7,8]:另一半肺叶切成1 mm厚的薄片,按文献[7,8]的方法进行,最后以甲基绿作对比染色。阳性反应者,镜下可见棕褐色反应物,肺泡炎时,主要是PMN胞浆及胞膜产生 ;(3) 其余的肺组织按常规制成石蜡切片、HE染色,全面观察每个切面是否有Arthus血管炎的发生,所有小鼠同种染色的肺组织取材部位一致。
;(3) 其余的肺组织按常规制成石蜡切片、HE染色,全面观察每个切面是否有Arthus血管炎的发生,所有小鼠同种染色的肺组织取材部位一致。, 百拇医药
此外,将血液静置2 h后离心取血清,作对流免疫电泳测定小鼠抗BSA抗体滴度,计数各实验组小鼠BSA致敏阳性例数,并核查血管炎发生的情况。
统计学处理 各组之间发生血管炎的百分率的差异为计数资料,并且例数<40,故采用精确概率法检验。
2 结果
K1组和K2组抗BSA抗体(+)者均出现Arthus肺泡血管炎病理改变(图1,2),免疫荧光检查显示,阳性对照组炎症部位血管内皮细胞及其周围渗出的PMN胞膜上均可见C3线状沉积(图3,4)。各给药组小鼠肺泡血管炎发生率及PMN、
 及补体C3染色阳性率均较对照组明显降低,差异有显著性意义(P<0.05),尤其联合用药EFS组效果更为显著,肺泡血管炎的发生率仅25%(P<0.01)(表1)。N组抗BSA抗体(-),肺部未见病理改变。
及补体C3染色阳性率均较对照组明显降低,差异有显著性意义(P<0.05),尤其联合用药EFS组效果更为显著,肺泡血管炎的发生率仅25%(P<0.01)(表1)。N组抗BSA抗体(-),肺部未见病理改变。
, http://www.100md.com
图 1 Arthus反应性肺泡血管炎
Fig 1 Arthus reaction alveolar vasculitis, showing PMNS and RBC infiltrating alveoluns HE×360

图 2 Arthus反应性肺泡血管炎
Fig 2 Arthus reaction alveolar vasculitis, showing marked endothelial damage and hemorrhages×200

图 3 肺泡壁血管内皮细胞及
, http://www.100md.com
渗出PMN之C3荧光染色
Fig 3 C3 immunoflouresence staining of alveolar infiltrations shows linear deposits of C3 on PMN membrane indicating PMNS activation×360

图 4 组化染色
Fig 4 Histochemical demonstration of superoxide generation of infiltrating PMNs×360
附表 各组肺泡血管炎发生率及PMN-
 、C3染色阳性率结果
、C3染色阳性率结果, http://www.100md.com
Table The incidence of vasculitis and PMN-
 , C3 stainings in test and control groups Group
, C3 stainings in test and control groups GroupSensitized
anti-BSA
positive
Cases
Vasculitis

C3
, 百拇医药 Incidence
Positivity
Positivity
No.
%
No.
%
No.
%
SS
8
3
37.5
, 百拇医药
2
25
2
25
VE
7
3
43
3
43
1
14.3
GF
, 百拇医药 5
2
40
2
40
2
40
K1
6
6
100
6
100
6
, 百拇医药
100
EFS
8
2
25
2
25
1
12.5
FS
9
4
44
, 百拇医药
4
44
3
33
K2
9
9
100
8
89
7
78
*P<0.05,**P<0.01 compared to K1 and K2 respectively; SS: selenase; VE: vitaminE; GF:glycyrrhiza flavonoid; K1, K2:control; EFS:VE+GF+SS; FS:GF+SS
, http://www.100md.com
3 讨论
本实验结果显示,以BSA致敏的昆明小鼠在吸入雾化的BSA抗原后,6 h内即可查见肺内支气管旁急性肺泡炎的发生(图3,4),并经血清BSA抗体检测和IgG、C3免疫荧光染色的鉴定得以证实。可以认为这是免疫复合物(IC)引起的组织炎症损伤,即肺泡Arthus反应性血管炎(vasculitis)在小鼠肺组织内的一种表现形式——急性肺泡炎(acute alveolitis)。该炎症模型的成功建立为探讨补体活化介导炎症反应机制提供了可靠的基础。本组以往的工作表明,具有抗氧化作用的亚硒酸钠能有效地抑制动物体内补体的活化[9],尤其口服亚硒酸钠能抑制补体的活化,显著降低流行性出血热患者的死亡率[10]。提示补体活化介导的炎症反应必然与活性氧的产生及其作用有关。本研究在整体动物体内进一步验证了用补体活化抑制剂SS及ROS清除剂GF和VitE能抑制“活化反馈环”的运转,进而抑制炎症反应的新设想。本实验结果表明,单独给予SS、VitE或GF均能在一定程度上抑制肺泡炎的发生(抑制率分别为62.5%、57%、60%),而SS、GF与VitE合用时能更有效地抑制肺泡炎的发生(抑制率为75%),这一结果说明急性肺泡炎的发生是与补体活化和ROS的产生、释放共同作用分不开的。在肺泡炎部位PMN-
 组化染色(图4)以及PMN膜C3免疫荧光染色呈现的阳性反应(图3),即表明补体的活化及其片段C3b、C5a等与PMN膜受体的结合及其激活的过程。从而进一步在动物体内验证了补体介导的炎症引起的组织损伤是通过PMN产生的ROS再活化补体这一正反馈活化环起作用的。这是继本组在离体细胞水平验证补体活化—ROS正反馈活化环的存在之后,在整体动物水平对此活化反馈环促发炎症的新设想提供的另一有力的证据。由此不难想象,当某种IC性或非免疫性因素导致补体活化或激活PMN产生ROS时,均可启动该补体活化正反馈环的运转,导致扩大炎症反应,加重组织损伤。反之,若能采取抗氧化剂等有效措施打断这一反馈环,则有可能控制炎症的发生、发展,总之,本研究结果不但为阐明炎症发生、发展和调控机制提供有力的证据,而且也进一步提示人们有可能使用补体活化抑制剂特别是亚硒酸钠以及抗氧化剂,通过切断该“反馈环”以控制炎症反应。从而可能为临床辅佐防治自身免疫性疾病或有关炎症性传染病的研究提供一条新的途径。
组化染色(图4)以及PMN膜C3免疫荧光染色呈现的阳性反应(图3),即表明补体的活化及其片段C3b、C5a等与PMN膜受体的结合及其激活的过程。从而进一步在动物体内验证了补体介导的炎症引起的组织损伤是通过PMN产生的ROS再活化补体这一正反馈活化环起作用的。这是继本组在离体细胞水平验证补体活化—ROS正反馈活化环的存在之后,在整体动物水平对此活化反馈环促发炎症的新设想提供的另一有力的证据。由此不难想象,当某种IC性或非免疫性因素导致补体活化或激活PMN产生ROS时,均可启动该补体活化正反馈环的运转,导致扩大炎症反应,加重组织损伤。反之,若能采取抗氧化剂等有效措施打断这一反馈环,则有可能控制炎症的发生、发展,总之,本研究结果不但为阐明炎症发生、发展和调控机制提供有力的证据,而且也进一步提示人们有可能使用补体活化抑制剂特别是亚硒酸钠以及抗氧化剂,通过切断该“反馈环”以控制炎症反应。从而可能为临床辅佐防治自身免疫性疾病或有关炎症性传染病的研究提供一条新的途径。, 百拇医药
△国家自然科学基金(39670288)资助;*湖北三峡医学院进修生;#通讯作者
参考文献
1 Reinhard W, Manfred PD. Complement in human Disease. Immunol Today, 1997, 18:460~463
2 Machael M, Louis FF, The Role of Complement in inflammation and Phagocytosis. Immunol Today, 1991, 12:322~326
3 Hou Jiancun.Inhibitory effect of selenite and other antioxidants on complement-mediated tissue injury in the patients with epidemic hemorrhagic fever. Trace Element Res. 1997, 56:125~130
, 百拇医药
4 Forman KE, Glovsky MM, Warner RL, et al, Comparative effect of C3a and C5a on adhesion molecule expression on PMN and endothelial cells. Inflammation, 1996; 20:1~9
5 Roberford M, Calderon PB. Free radicals and oxidation phenomena in biological systems. New York: Marcel Dekker Inc, 1995. 145~164
6 范欣荣, 凌允礼, 吴元德,等.补体活化与中性粒细胞产生活性氧之间的反馈调节作用.中国医学科学院学报 1999, 21(3):175~179
7 Babbs CF, Cregor MD, et al. Methods in laboratory investigation:Endothelial superoxide production in buffer perfused rat lungs, Demonstrated by a new histochemical technique. Lab Invest, 1991, 65:484~496
, 百拇医药
8 Liberman H, Mariassy AT, et al. Morphometric estimation of superoxide generation in allergen-induced airway hyperresponsiveness. Lab Invest, 1995, 72:348~356
9 侯健存,戴 岩, 凌允礼.亚硒酸钠在小鼠体内对补体活化的抑制作用.中国医学科学院学报,1989, 11(4):250~253
10 侯健存,江之云,何志藩,等.硒对流行性出血热患者补体活化的抑制作用与疗效观察.中华医学杂志,1993,73(11):645~646
(1998-07-07 收稿), 百拇医药