碱性成纤维细胞生长因子对人牙髓细胞增殖和分化的作用
作者:郝建军 汪平 史俊南 牛忠英 肖明振 王浩军
单位:710032 西安,第四军医大学口腔医学院(郝建军、汪平、史俊南、牛忠英、肖明振),基础部神经生物教研室(王浩军)
关键词:牙髓细胞;碱性成纤维细胞生长因子;细胞培养
New Page 2
【摘要】 目的 探讨碱性成纤维细胞生长因子(basic fibroblast growth factor, bFGF)对培养人牙髓细胞增殖和分化的效应。方法 采用四唑盐法、3H-TdR掺入法、图象分析,检测重组人bFGF(hbFGF)对细胞DNA、胶原蛋白、纤维粘连蛋白、碱性磷酸酶、骨形成蛋白合成和凝集素表达的影响。结果 hbFGF浓度在1~10μg/L时显著促进细胞的增殖,浓度为1~100μg/L时可显著刺激人牙髓细胞DNA的合成。hbFGF在高浓度下(10~1000 μg/L),Ⅰ型胶原、纤维粘连蛋白、刀豆凝集素A受体和碱性磷酸酶的表达增强,而Ⅲ型胶原和麦胚凝聚素受体的合成受到抑制,不同浓度的bFGF对细胞骨形成蛋白的表达无明显影响。结论 bFGF可能促进体外培养的人牙髓细胞向成牙本质细胞分化。
, 百拇医药
The effects of basic fibroblast growth factor on proliferation and differentiation of human dental pulp cells in vitro
HAO Jianjun, WANG Ping, SHI Junnan, et al. School of Stomatology, Fourth Military Medical University, Xi'an 710032
【Abstract】 Objective To evaluate the effects of human basic fibroblast growth factor (hbFGF) on proliferation and differentiation of human dental pulp cells in vitro.Methods The syntheses of DNA, collagen, fibronection (FN), alkaline phosphatase (ALP) and bone morphogenetic protein (BMP), and the expression of agglutinin were measured with imagine processing and analysis system. Results hbFGF at concentration of 1~10 μg/L stimulated the cell proliferation measured by MTT colorimetric assay, and promoted incorporation of 3H-thymidine at 1~100μg/L. The expression of type Ⅰ collagen, FN, Con A receptor, and ALP significantly increased at hbFGF concentration of 10~1 000 μg/L, but the expression of type Ⅲ collagen and WGA receptor markedly decreased at the same concentration. There was no significant difference in expression of BMP.Conclusion bFGF has the capability to promote the differentiation of dental pulp cells to odontoblasts in culture.
, http://www.100md.com
【Key words】 Dental pulp cell Basic fibroblast growth factor Cell culture
碱性成纤维细胞生长因子(basic fibroblast growth factor, bFGF)是成纤维细胞生长因子家族的重要成员之一,对细胞有丝分裂和分化有很强的调节作用,通过自分泌和旁分泌参与胚胎发育和器官发生[1,2]。目前已知bFGF对牙髓细胞的有丝分裂有促进作用[3],但有关细胞分化的调控效应报道很少。我们采用人牙髓细胞体外培养法,通过检测hbFGF对细胞DNA、胶原蛋白、纤维结合素(fibronectin, FN)、碱性磷酸酶(alkaline phosphatase, ALP)、骨形成蛋白(bone morphogenetic protein, BMP)合成及凝集素受体表达的影响,探讨牙髓细胞在hbFGF诱导下生长、分化的生物学效应。
材料和方法
, http://www.100md.com
一、材料
hbFGF,珠海东大公司。3H-胸腺嘧啶脱氧核苷(3H-TdR),中国原子能研究所。3-(4,5-二甲基噻唑-2)-2,5-二苯基四氮唑嗅盐(MTT),华美公司。ABC试剂盒,美国Vector公司。极限必需培养基(DMEM),美国Gibco公司。胎牛血清(FCS),金华清湖犊牛生物制品厂。胰蛋白酶,美国Difco实验室。图象分析仪,Quantament 570型,英国Leico公司。实验用抗体见表1。
二、实验方法
1.实验分组:①对照组:培养液为DMEM加1%FCS。②实验组:将hbFGF原液用含1% FCS的DMEM培养液稀释至0.1 μg/L、1 μg/L、10 μg/L、100 μg/L和1 000 μg/L 5个浓度梯度。
表1 实验所用的抗体和植物凝聚素 抗体
, http://www.100md.com
来源
工作浓度
FN抗体
华美公司
1∶400
Ⅰ型胶原多抗
上海医科大学病理学教研室
1∶100
Ⅲ型胶原单抗
第四军医大学病理学教研室
1∶200
生物素化ConA
, http://www.100md.com
华美公司
10 mg/L
生物素化WGA
华美公司
10 mg/L
ALP单抗
第四军医大学免疫学教研室
1∶100
BMP多抗
第四军医大学口腔病理学教研室
1∶200
2.MTT法:取体外培养人牙髓细胞第5代[4],调整细胞浓度至2×107/L,以每孔100μl接种于96孔板,每组4孔。培养条件为37 ℃、5% CO2、饱和湿度。在含10% FCS的DMEM液中培养48 h后,换成含1% FCS的DMEM液培养24 h,再换成实验所需的各种培养液培养72 h。每孔加入MTT 20 μl,继续培养4 h,弃孔内液体,每孔加入150 μl二甲基亚砜(DMSO)震荡5 min,酶联仪波长490 nm测各孔光密度值(A值),取平均值作统计学处理。
, http://www.100md.com
3.3 H-TdR掺入试验:分组和实验方法同MTT法,终止培养前6 h加入3H-TdR,使终浓度为每孔1.85×107Bq。6 h后终止反应,经常规方法处理,加闪烁液,以液体闪烁计数器测定每个标本的每分钟脉冲数。
4.细胞表面积的测定:培养和实验同MTT法,细胞用4%多聚甲醛液固定,以ABC法对ConA进行染色。图像分析仪测量单个细胞表面积,每20~25个细胞为1个单元,每个实验组测4个单元。
5.Ⅰ型与Ⅲ型胶原、FN、ConA受体、麦胚凝集素(WGA)受体、ALP、BMP的染色方法和半定量测定:细胞培养终止时,以4%多聚甲醛液(pH7.3)固定48 h后,ABC法进行免疫组化染色。图象分析方法和标准同参考文献4。结果
对照组细胞体积缩小,大部分固缩坏死,其中FN、Ⅰ型与Ⅲ型胶原染色较深,单个细胞染色明显深于实验组。各实验组的细胞伸展良好,细胞多为梭形,bFGF(1、10、100 μg/L)组的细胞可见分裂相,FN、Ⅰ型与Ⅲ型胶原、ConA受体、WGA受体、ALP、BMP的阳性染色主要位于胞浆。bFGF组的浓度0.1、1、10、100、100 μg/L,分别用F0.1、F1、F10、F100和F1 000表示。结果见表2,图1~3。
, 百拇医药
一、hbFGF对人牙髓细胞增殖、DNA合成和细胞粘附的作用
结果表明(表2),bFGF(1、10 μg/L)组显著刺激体外培养的人牙髓成纤维细胞增殖,bFGF(1、10、100 μg/L)组明显促进细胞DNA的合成。而FGF(0.1,1 000 μg/L)组则无作用。bFGF(0.1、10 μg/L)组细
图1 hbFGF对人培养牙髓细胞Ⅰ、Ⅲ型胶原和FN表达的作用
图2 hbFGF对培养人牙髓细胞ConA和WGA表达的作用
图3 hbFGF对培养人牙髓细胞ALP和BMP表达的作用
, 百拇医药
表2 hbFGF对人牙髓细胞增殖、DNA合成、细胞粘附的作用(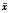 ±s,n=4) 试验项目
±s,n=4) 试验项目
对照
F0.1
F1
F10
F100
F1 000
MTT(A值)
0.14±0.02
0.16±0.01
0.19±0.01
, 百拇医药
0.24±0.03
0.17±0.04
0.14±0.04
3 H-TdR(脉冲数/min)
738±54
636±24
3 219±165
5 076±165
2 975±834
555±71
, 百拇医药
细胞表面积(μm2)
3 592±307
4 161±107
5 197±380
4 315±276
3 444±311
3 282±193
注:P<0.01,各实验组与对照组比较
胞伸展良好。
二、hbFGF对细胞基质表达的作用
, 百拇医药
t检验结果表明(图1),F0.1、F1与F10、F100和F1 000各组之间的细胞Ⅰ型与Ⅲ型胶原、FN表达差异有显著性(P<0.01)。因空白细胞固缩,故不做分析。
三、hbFGF对细胞凝集素受体表达的作用
t检验结果表明(图2),F0.1、F1与其他各组之间差异有显著性(P<0.05)。
四、hbFGF对细胞ALP和BMP表达的作用
t检验结果表明(图3),F10、F100、F1000组的ALP与其他各组之间差异有显著性(P<0.05),BMP各组之间差异无显著性(P>0.05)。讨论
我们采用MTT、3H-TdR掺入两种方法测定bFGF对人牙髓细胞增殖的影响,两者结果不完全相同。掺入法反映细胞增殖早期核酸的变化,而MTT反映细胞分裂后期细胞浆成分的改变。bFGF(0.1~10 μg/L)组细胞表面积增大,说明bFGF对牙髓细胞有粘附效应。
, 百拇医药
I、III型胶原蛋白是牙髓细胞中主要的细胞外基质成份。牙髓细胞的分化成熟过程中,其分泌I、III型胶原的比例也随之变化。牙乳头细胞在向成牙本质细胞分化过程中,I型胶原表达增多,III型胶原成分减少[5]。而成熟的成牙本质细胞表达FN和I型胶原,不分泌III型胶原。本组结果提示随着培养液中bFGF浓度的升高,人牙髓细胞合成I、III型胶原的比例发生变化,细胞有向成牙本质细胞分化的趋势,bFGF有调控牙髓细胞分化的作用。
一种细胞或组织的分化成熟常常伴随着凝集素受体表达的变化。发育成熟的牙髓细胞表达ConA、WGA受体,成牙本质细胞表达ConA受体,不表达WGA受体[6]。本组在高浓度bFGF(10~1 000 μg/L)作用下,体外培养的人牙髓细胞表面凝集素受体发生显著变化,与牙乳头细胞向成牙本质细胞分化时细胞表面凝集素受体的变化相似,证实bFGF有促进牙髓细胞向成牙本质细胞分化的能力。
ALP是牙髓细胞分化和成熟的标志物之一。本组结果表明:bFGF浓度在10~1 000 μg/L时,ALP合成显著增加,提示培养的人牙髓细胞有分化和成熟的趋势。BMP表达有可能反映牙髓细胞的分化状态和形成硬组织的能力。本组中bFGF对牙髓细胞BMP表达无明显影响,这可能是bFGF促进牙髓细胞分化和矿化的能力所限,培养细胞的成熟还未达到一定程度。
, http://www.100md.com
综上所述,bFGF通过调节细胞的增殖状态、基质分泌和细胞表型的表达参与牙髓细胞向成牙本质细胞分化的过程。细胞的分化是一个复杂的过程,需要多种生长因子、胞外基质以及细胞本身特征的综合作用[7],尽管bFGF可能是参与细胞分化的主要因子之一,但其诱导能力是有限的,有关该因子与细胞分化关系的研究尚待深化。
注释:国家自然科学基金资助课题(39700160)
参考文献
[1]郝建军,史俊南.成纤维细胞生长因子的研究进展.牙体牙髓牙周病学杂志,1994,4:111-113.
[2] Thesleff I, Partanen AM, Vainio S. Epithelial-mesenchymal interactions in tooth morphogenesis: the roles of extracellular matrix, growth factors, and cell surface receptors. J Craniofac Genet Devl Biol, 1991, 11:229-237.
, http://www.100md.com
[3] Nakashima M. The effects of growth factors on DNA synthesis and alkaline phosphatase activity in bovine dental pulp cells. Archs Oral Biol, 1992, 37:231-236.
[4] 汪平,史俊南,郝建军.牛血浆纤维粘连蛋白对培养的人牙髓成纤维细胞增殖、DNA合成和细胞形态的影响.牙体牙髓牙周病学杂志,1995,5:17-19.
[5] Bronkers ALJJ, Lyraruu DM, Woltgens JHM. Immunohistochemistry of extracellular matrix proteins during various stages of dentinogenesis. Connect Tissue Res, 1989, 22:65-70.
, http://www.100md.com
[6] Endo K. Lectin histochemical study on human dental pulp: special reference to odontoblasts and pulp cells. Meikai Daiguku Shigaku Zashi, 1989,18:360-381.
[7] Ruch JV, Lesot H, Bege-Kin C, Odontoblast differentiation. Int J Dev Biol, 1995, 39:51-68.
收稿:1998-02-16
修回:1998-12-20, 百拇医药
单位:710032 西安,第四军医大学口腔医学院(郝建军、汪平、史俊南、牛忠英、肖明振),基础部神经生物教研室(王浩军)
关键词:牙髓细胞;碱性成纤维细胞生长因子;细胞培养
New Page 2
【摘要】 目的 探讨碱性成纤维细胞生长因子(basic fibroblast growth factor, bFGF)对培养人牙髓细胞增殖和分化的效应。方法 采用四唑盐法、3H-TdR掺入法、图象分析,检测重组人bFGF(hbFGF)对细胞DNA、胶原蛋白、纤维粘连蛋白、碱性磷酸酶、骨形成蛋白合成和凝集素表达的影响。结果 hbFGF浓度在1~10μg/L时显著促进细胞的增殖,浓度为1~100μg/L时可显著刺激人牙髓细胞DNA的合成。hbFGF在高浓度下(10~1000 μg/L),Ⅰ型胶原、纤维粘连蛋白、刀豆凝集素A受体和碱性磷酸酶的表达增强,而Ⅲ型胶原和麦胚凝聚素受体的合成受到抑制,不同浓度的bFGF对细胞骨形成蛋白的表达无明显影响。结论 bFGF可能促进体外培养的人牙髓细胞向成牙本质细胞分化。
, 百拇医药
The effects of basic fibroblast growth factor on proliferation and differentiation of human dental pulp cells in vitro
HAO Jianjun, WANG Ping, SHI Junnan, et al. School of Stomatology, Fourth Military Medical University, Xi'an 710032
【Abstract】 Objective To evaluate the effects of human basic fibroblast growth factor (hbFGF) on proliferation and differentiation of human dental pulp cells in vitro.Methods The syntheses of DNA, collagen, fibronection (FN), alkaline phosphatase (ALP) and bone morphogenetic protein (BMP), and the expression of agglutinin were measured with imagine processing and analysis system. Results hbFGF at concentration of 1~10 μg/L stimulated the cell proliferation measured by MTT colorimetric assay, and promoted incorporation of 3H-thymidine at 1~100μg/L. The expression of type Ⅰ collagen, FN, Con A receptor, and ALP significantly increased at hbFGF concentration of 10~1 000 μg/L, but the expression of type Ⅲ collagen and WGA receptor markedly decreased at the same concentration. There was no significant difference in expression of BMP.Conclusion bFGF has the capability to promote the differentiation of dental pulp cells to odontoblasts in culture.
, http://www.100md.com
【Key words】 Dental pulp cell Basic fibroblast growth factor Cell culture
碱性成纤维细胞生长因子(basic fibroblast growth factor, bFGF)是成纤维细胞生长因子家族的重要成员之一,对细胞有丝分裂和分化有很强的调节作用,通过自分泌和旁分泌参与胚胎发育和器官发生[1,2]。目前已知bFGF对牙髓细胞的有丝分裂有促进作用[3],但有关细胞分化的调控效应报道很少。我们采用人牙髓细胞体外培养法,通过检测hbFGF对细胞DNA、胶原蛋白、纤维结合素(fibronectin, FN)、碱性磷酸酶(alkaline phosphatase, ALP)、骨形成蛋白(bone morphogenetic protein, BMP)合成及凝集素受体表达的影响,探讨牙髓细胞在hbFGF诱导下生长、分化的生物学效应。
材料和方法
, http://www.100md.com
一、材料
hbFGF,珠海东大公司。3H-胸腺嘧啶脱氧核苷(3H-TdR),中国原子能研究所。3-(4,5-二甲基噻唑-2)-2,5-二苯基四氮唑嗅盐(MTT),华美公司。ABC试剂盒,美国Vector公司。极限必需培养基(DMEM),美国Gibco公司。胎牛血清(FCS),金华清湖犊牛生物制品厂。胰蛋白酶,美国Difco实验室。图象分析仪,Quantament 570型,英国Leico公司。实验用抗体见表1。
二、实验方法
1.实验分组:①对照组:培养液为DMEM加1%FCS。②实验组:将hbFGF原液用含1% FCS的DMEM培养液稀释至0.1 μg/L、1 μg/L、10 μg/L、100 μg/L和1 000 μg/L 5个浓度梯度。
表1 实验所用的抗体和植物凝聚素 抗体
, http://www.100md.com
来源
工作浓度
FN抗体
华美公司
1∶400
Ⅰ型胶原多抗
上海医科大学病理学教研室
1∶100
Ⅲ型胶原单抗
第四军医大学病理学教研室
1∶200
生物素化ConA
, http://www.100md.com
华美公司
10 mg/L
生物素化WGA
华美公司
10 mg/L
ALP单抗
第四军医大学免疫学教研室
1∶100
BMP多抗
第四军医大学口腔病理学教研室
1∶200
2.MTT法:取体外培养人牙髓细胞第5代[4],调整细胞浓度至2×107/L,以每孔100μl接种于96孔板,每组4孔。培养条件为37 ℃、5% CO2、饱和湿度。在含10% FCS的DMEM液中培养48 h后,换成含1% FCS的DMEM液培养24 h,再换成实验所需的各种培养液培养72 h。每孔加入MTT 20 μl,继续培养4 h,弃孔内液体,每孔加入150 μl二甲基亚砜(DMSO)震荡5 min,酶联仪波长490 nm测各孔光密度值(A值),取平均值作统计学处理。
, http://www.100md.com
3.3 H-TdR掺入试验:分组和实验方法同MTT法,终止培养前6 h加入3H-TdR,使终浓度为每孔1.85×107Bq。6 h后终止反应,经常规方法处理,加闪烁液,以液体闪烁计数器测定每个标本的每分钟脉冲数。
4.细胞表面积的测定:培养和实验同MTT法,细胞用4%多聚甲醛液固定,以ABC法对ConA进行染色。图像分析仪测量单个细胞表面积,每20~25个细胞为1个单元,每个实验组测4个单元。
5.Ⅰ型与Ⅲ型胶原、FN、ConA受体、麦胚凝集素(WGA)受体、ALP、BMP的染色方法和半定量测定:细胞培养终止时,以4%多聚甲醛液(pH7.3)固定48 h后,ABC法进行免疫组化染色。图象分析方法和标准同参考文献4。结果
对照组细胞体积缩小,大部分固缩坏死,其中FN、Ⅰ型与Ⅲ型胶原染色较深,单个细胞染色明显深于实验组。各实验组的细胞伸展良好,细胞多为梭形,bFGF(1、10、100 μg/L)组的细胞可见分裂相,FN、Ⅰ型与Ⅲ型胶原、ConA受体、WGA受体、ALP、BMP的阳性染色主要位于胞浆。bFGF组的浓度0.1、1、10、100、100 μg/L,分别用F0.1、F1、F10、F100和F1 000表示。结果见表2,图1~3。
, 百拇医药
一、hbFGF对人牙髓细胞增殖、DNA合成和细胞粘附的作用
结果表明(表2),bFGF(1、10 μg/L)组显著刺激体外培养的人牙髓成纤维细胞增殖,bFGF(1、10、100 μg/L)组明显促进细胞DNA的合成。而FGF(0.1,1 000 μg/L)组则无作用。bFGF(0.1、10 μg/L)组细

图1 hbFGF对人培养牙髓细胞Ⅰ、Ⅲ型胶原和FN表达的作用

图2 hbFGF对培养人牙髓细胞ConA和WGA表达的作用

图3 hbFGF对培养人牙髓细胞ALP和BMP表达的作用
, 百拇医药
表2 hbFGF对人牙髓细胞增殖、DNA合成、细胞粘附的作用(
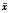 ±s,n=4) 试验项目
±s,n=4) 试验项目对照
F0.1
F1
F10
F100
F1 000
MTT(A值)
0.14±0.02
0.16±0.01
0.19±0.01
, 百拇医药
0.24±0.03
0.17±0.04
0.14±0.04
3 H-TdR(脉冲数/min)
738±54
636±24
3 219±165
5 076±165
2 975±834
555±71
, 百拇医药
细胞表面积(μm2)
3 592±307
4 161±107
5 197±380
4 315±276
3 444±311
3 282±193
注:P<0.01,各实验组与对照组比较
胞伸展良好。
二、hbFGF对细胞基质表达的作用
, 百拇医药
t检验结果表明(图1),F0.1、F1与F10、F100和F1 000各组之间的细胞Ⅰ型与Ⅲ型胶原、FN表达差异有显著性(P<0.01)。因空白细胞固缩,故不做分析。
三、hbFGF对细胞凝集素受体表达的作用
t检验结果表明(图2),F0.1、F1与其他各组之间差异有显著性(P<0.05)。
四、hbFGF对细胞ALP和BMP表达的作用
t检验结果表明(图3),F10、F100、F1000组的ALP与其他各组之间差异有显著性(P<0.05),BMP各组之间差异无显著性(P>0.05)。讨论
我们采用MTT、3H-TdR掺入两种方法测定bFGF对人牙髓细胞增殖的影响,两者结果不完全相同。掺入法反映细胞增殖早期核酸的变化,而MTT反映细胞分裂后期细胞浆成分的改变。bFGF(0.1~10 μg/L)组细胞表面积增大,说明bFGF对牙髓细胞有粘附效应。
, 百拇医药
I、III型胶原蛋白是牙髓细胞中主要的细胞外基质成份。牙髓细胞的分化成熟过程中,其分泌I、III型胶原的比例也随之变化。牙乳头细胞在向成牙本质细胞分化过程中,I型胶原表达增多,III型胶原成分减少[5]。而成熟的成牙本质细胞表达FN和I型胶原,不分泌III型胶原。本组结果提示随着培养液中bFGF浓度的升高,人牙髓细胞合成I、III型胶原的比例发生变化,细胞有向成牙本质细胞分化的趋势,bFGF有调控牙髓细胞分化的作用。
一种细胞或组织的分化成熟常常伴随着凝集素受体表达的变化。发育成熟的牙髓细胞表达ConA、WGA受体,成牙本质细胞表达ConA受体,不表达WGA受体[6]。本组在高浓度bFGF(10~1 000 μg/L)作用下,体外培养的人牙髓细胞表面凝集素受体发生显著变化,与牙乳头细胞向成牙本质细胞分化时细胞表面凝集素受体的变化相似,证实bFGF有促进牙髓细胞向成牙本质细胞分化的能力。
ALP是牙髓细胞分化和成熟的标志物之一。本组结果表明:bFGF浓度在10~1 000 μg/L时,ALP合成显著增加,提示培养的人牙髓细胞有分化和成熟的趋势。BMP表达有可能反映牙髓细胞的分化状态和形成硬组织的能力。本组中bFGF对牙髓细胞BMP表达无明显影响,这可能是bFGF促进牙髓细胞分化和矿化的能力所限,培养细胞的成熟还未达到一定程度。
, http://www.100md.com
综上所述,bFGF通过调节细胞的增殖状态、基质分泌和细胞表型的表达参与牙髓细胞向成牙本质细胞分化的过程。细胞的分化是一个复杂的过程,需要多种生长因子、胞外基质以及细胞本身特征的综合作用[7],尽管bFGF可能是参与细胞分化的主要因子之一,但其诱导能力是有限的,有关该因子与细胞分化关系的研究尚待深化。
注释:国家自然科学基金资助课题(39700160)
参考文献
[1]郝建军,史俊南.成纤维细胞生长因子的研究进展.牙体牙髓牙周病学杂志,1994,4:111-113.
[2] Thesleff I, Partanen AM, Vainio S. Epithelial-mesenchymal interactions in tooth morphogenesis: the roles of extracellular matrix, growth factors, and cell surface receptors. J Craniofac Genet Devl Biol, 1991, 11:229-237.
, http://www.100md.com
[3] Nakashima M. The effects of growth factors on DNA synthesis and alkaline phosphatase activity in bovine dental pulp cells. Archs Oral Biol, 1992, 37:231-236.
[4] 汪平,史俊南,郝建军.牛血浆纤维粘连蛋白对培养的人牙髓成纤维细胞增殖、DNA合成和细胞形态的影响.牙体牙髓牙周病学杂志,1995,5:17-19.
[5] Bronkers ALJJ, Lyraruu DM, Woltgens JHM. Immunohistochemistry of extracellular matrix proteins during various stages of dentinogenesis. Connect Tissue Res, 1989, 22:65-70.
, http://www.100md.com
[6] Endo K. Lectin histochemical study on human dental pulp: special reference to odontoblasts and pulp cells. Meikai Daiguku Shigaku Zashi, 1989,18:360-381.
[7] Ruch JV, Lesot H, Bege-Kin C, Odontoblast differentiation. Int J Dev Biol, 1995, 39:51-68.
收稿:1998-02-16
修回:1998-12-20, 百拇医药