下颌骨髁突软骨细胞传代过程中生物学特性变化
作者:焦岩涛 王大章 韩文利 胡静
单位:610041 华西医科大学口腔医学院口腔颌面外科学教研室
关键词:髁状突;软骨细胞;培养;表型
华西口腔学杂志990419 摘要 目的:观察体外培养及传代对人髁突软骨细胞生物学特性的影响。方法:采用体外细胞培养、免疫生化及分子生物学方法观察传代过程中人髁突软骨细胞形态、Ⅱ型胶原及蛋白多糖合成及Ⅰ、Ⅱ、Ⅲ型前胶原的mRNA水平变化。结果:传代过程中人髁突软骨细胞Ⅱ型胶原合成及其mRNA水平逐渐降低,至第7代已基本丧失。而Ⅰ、Ⅲ型胶原的mRNA水平随传代逐渐升高,同时伴有细胞蛋白多糖合成的减少,细胞壁形态由圆形或多角形转变为长梭形占优势。结论:体外培养及反复传代可影响软骨细胞的表型特征。髁突软骨细胞的反分化标准应从胶原、蛋白多糖合成及细胞形态等方面综合评价。
Phenotypic Changes of Mandibular Condylar Cartilage Cells During Subculture
, 百拇医药
Jiao Yantao, Wang Dazhang, Han Wenli, et al
College of Stomatology, West China University of Medical Sciences
Abstract
Objective: To demonstrate the phenotypic changes of mandibular condylar cartilage(MCC) cells during subculture in vitro. Methods: MCC cells were harvested from human fetus by digestion of collagenase and cultured in DMEM supplemented with 10% newborn calf serum, then they were passaged when reached confluence.Morphological changes were observed under phase-contrast microscope. Type Ⅱ collagen, proteoglycan synthesis and type Ⅰ,Ⅱ and Ⅲ procollagen mRNA levels were also studied in serial monolayer cultures. Results: During subculture,type Ⅱ collagen and proteoglycan synthesis were decreased, being accompanied by a lower type Ⅱ collagen mRNA level. In contrast, type Ⅰ and Ⅲ procollagen mRNA levels were elevated progressively. The morphology of polygonal-shaped chondrocytes was lost to the bipolar fibroblastic cells. Conclusion: Passage and culture can affect the phenotypic property of MCC cells.
, http://www.100md.com
Key words: mandibular condyle cartilage cell culture phenotype
软骨细胞的分化状态直接影响着软骨的生物学性能,软骨细胞分化异常是常见关节疾患——骨关节病的一个重要表现。研究体外环境中细胞分化状态的变化,可为寻找骨关节病有效防治手段及建立性状稳定的软骨细胞库奠定基础。以往研究[1]多为大关节软骨细胞。本研究采用形态学、生物化学及分子生物学方法对体外培养人髁突软骨细胞在传代过程中的生物学行为变化进行了观察。
1 材料和方法
1.1 材料和试剂
Ⅱ型胶原酶(Sigma,USA),DMEM培养基(Gibco,USA),小牛血清(华西医科大学分子生物学实验室),Ⅱ型胶原单克隆抗体(Oncogene Research Products,USA),含Ⅰ、Ⅱ型胶原cDNA片段质粒(北京医科大学运动医学研究所曲绵域教授惠赠),含Ⅲ型胶原及β-Actin cDNA片段的质粒(华西医科大学章锦才教授惠赠),细胞总RNA分离纯化试剂盒及低熔点琼脂糖(Gene Co Ltd,USA),限制性内切酶EcoR I,Hind Ⅲ(Gibco,USA),地高辛标记检测试剂盒及尼龙膜(Boehringer Mannheim,Germany),其它试剂均为国产分析纯。
, http://www.100md.com
1.2 髁突软骨细胞的分离、培养、传代
参照文献[2]方法,下颌骨髁突软骨取自因健康原因需终止妊娠的4~6月水囊引产人胚胎,经机械分离及胰蛋白酶、胶原酶消化,获得高成活率、均一的软骨细胞。接种于含10%小牛血清的DMEM培养基(青霉素100 u/ml,链霉素100 μg/ml,抗坏血酸50 μg/ml),于 CO2孵箱内,37℃,5%CO2饱和湿度下培养。待细胞长满汇合成单层后开始传代,本实验传代7次。
1.3 髁突软骨细胞形态学观察
在原代及传代培养过程中定期进行相差显微镜观察及摄影。
1.4 生长曲线绘制
将不同传代髁突软骨细胞按2×104/孔接种于24孔板。从接种后第1天起,随机取孔,以0.25%胰蛋白酶消化后记数,取均数描记生长曲线。
, 百拇医药
1.5 甲苯胺蓝染色
培养软骨细胞甲苯胺蓝染色参照Takigawa等人[3]的方法。
1.6 培养软骨细胞合成Ⅱ型胶原的免疫检测
取不同传代软骨细胞1瓶(25 ml培养瓶)。用0.25%胰蛋白酶消化获得细胞,用PBS洗涤两次,离心弃上清,加入1×SDS样品缓冲液(50 mmol/L Tris.cl pH 6.8,100 mmol/L二硫苏糖醇,2%SDS,10%甘油)充分混匀,置100 ℃煮沸10 min,移入冰浴,离心取上清,-20 ℃保存备用。
分别取各传代细胞提取物4 μl点样于硝酸纤维素膜上,平行点样不同稀释浓度的成骨细胞(Mc-3T3E1)提取物,室温干燥后装入塑料袋,加入5 ml封闭液(5%脱脂奶粉,0.02%叠氮钠,0.05%吐温-20的PBS),封袋,4 ℃过夜。PBS洗膜后,将膜封于含Ⅱ型胶原单克隆抗体的(1∶20稀释)封闭剂,4 ℃振荡下孵育2 h。再次洗膜后,将膜封于含辣根过氧化物酶标记羊抗小鼠IgG的封闭液中。封袋后,室温振荡孵育2 h。室温洗膜10 min。最后将膜置于显色液(4-氯奈酚10 mg,甲醇3 ml,10 mmol/L pH 7.6 Tris.cl 17ml,3%双氧水15 μl)显色30 min,照相记录。
, 百拇医药
1.7 培养软骨细胞pro α1(Ⅰ)、α1(Ⅱ)、α1(Ⅲ)基因表达的检测
含Ⅰ、Ⅱ、Ⅲ型胶原cDNA片段重组质粒经转化、鉴定后,大量扩增,经碱裂解法抽提,限制性酶切消化后低熔点琼脂糖凝胶电泳回收特定cDNA片段。探针标记按地高辛标记试剂盒说明进行。取不同传代次数的髁突软骨细胞(2×106),提取细胞总RNA。取各样品总RNA 2 μg,与等体积RNA稀释液(20×SSC,37%甲醛,体积比3∶2),68℃变性15 min。将样品点样于预先用10×SSC浸泡10 min尼龙膜,80℃烤膜2 h。分别与地高辛标记的Ⅰ、Ⅱ、Ⅲ型胶原的cDNA探针进行预杂交、杂交、显色及灰度扫描。
2 结 果
2.1 传代软骨细胞形态及生长变化
, http://www.100md.com 在传代过程中软骨细胞形态改变显著,原代细胞多数为圆形或多角形(图1),自第3代开始出现长梭形细胞,到第6代以后长梭形的成纤维细胞样细胞可占90%以上。细胞重叠生长,呈漩涡状,长满单层时细胞数大于原代培养的细胞(图2)。传代软骨细胞生长速度较原代快,细胞倍增时间缩短,通常长满单层的时间为4~6 d(图3)。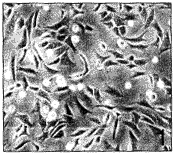
图1 原代培养的人髁突软骨细胞多数为多角形或圆形×100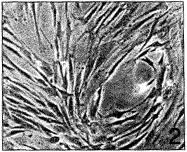
图2 第5代人髁突软骨细胞多数为长梭形×100
图3 不同代的人髁突软骨细胞生长曲线
, 百拇医药
2.2 传代细胞Ⅱ型胶原及蛋白多糖的合成
随传代次数增加,Ⅱ型胶原合成逐渐减少。至第7代免疫印迹方法已不能检测出细胞裂解液中Ⅱ型胶原(图4)。甲苯胺蓝染色原代细胞着色深,传代后的细胞染色逐渐变浅,说明软骨细胞合成硫酸软骨素蛋白多糖有减少趋势。
图4 传代人髁突软骨细胞Ⅱ型胶原的免疫印迹
2.3 传代软骨细胞Ⅰ、Ⅱ、Ⅲ型胶原mRNA水平的变化
采用斑点杂交的方法,检测了不同传代细胞总RNA中pro α1(Ⅰ)、α1(Ⅱ)、α1(Ⅲ)的相对水平。结果表明:pro α1(Ⅱ) mRNA水平随传代逐渐降低,第7代软骨细胞几乎不能表达pro α1(Ⅱ)。与之相反pro α1(Ⅰ)、α1(Ⅲ)随传代次数增加均有显著增加(图 5,6)。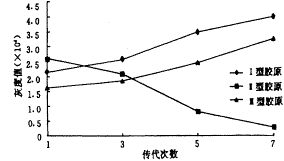
, 百拇医药
图5 传代过程中软骨细胞胶原基因表达的变化
图6 传代人髁突软骨细胞前胶原基因表达的变化
3 讨 论
软骨来源于未分化的间充质细胞,胚胎时期间充质的中胚层及神经嵴均具有向软骨细胞分化的能力,但只有在特定的条件下,这些细胞才能向软骨细胞分化。目前软骨的分化诱导机制尚不清楚。本研究结果显示出在反复传代过程中髁突软骨细胞由多角形占多数转变为长梭形细胞占优势。并且细胞合成特异性Ⅱ型胶原及蛋白多糖的功能逐渐降低,Ⅰ、Ⅲ型胶原的表达逐渐升高。形态改变的软骨细胞伴有其表型特征的丧失,这个转化过程与大关节软骨细胞反分化现象是一致的[4]。
反分化是体外培养软骨细胞发生的一种表型特征的丧失。其发生机理及影响因素目前尚不清楚,但研究显示可能与培养环境的变化及传代次数有关[5]。通常认为只有圆形及多角形的软骨细胞可表达分化的软骨细胞表型,体外反复传代过程中细胞形态发生变化,形状类似于成纤维细胞。这可能因为体外贴壁培养软骨细胞的细胞骨架发生改变,而这种变化可传递到细胞核基质,导致染色质结构的改变,从而影响相应基因的转录[6]。近来研究表明,许多因素可以调节体外培养软骨细胞的表型特征,如改进培养方法,悬浮或半固体琼脂培养方法[7],加入某些因子如BMP2、IGF-Ⅰ等均能够达到稳定软骨细胞表型、促进其分化的作用。
, 百拇医药
髁突软骨有别于其它关节透明软骨,研究表明髁突软骨细胞能够同时表达Ⅰ型及Ⅱ型胶原。而透明软骨细胞只合成Ⅱ型胶原。因而不能单以出现Ⅰ型胶原的合成作为软骨细胞反分化的标准。应结合Ⅱ型胶原、蛋白多糖合成及细胞形态变化作综合评价[8]。
在骨关节病及软骨损伤异常修复中也可伴有软骨细胞合成胶原类型的改变,并失去合成蛋白多糖基质的功能。因反分化的软骨细胞与之相似,因而可作为骨关节病的体外研究模型,用作探索骨关节病的发病机制,并寻找预防和控制软骨细胞反分化的措施,以治疗骨关节病[9]。
本课题为国家自然科学基金资助项目(编号 39500164)
4 参考文献
1 Von Der Mark K,Conrad G. Cartilage cell differentiation.Clin Orthop Relat Res,1979,139(3):185~205
, 百拇医药
2 焦岩涛,王大章,田卫东,等.人胚颞颌关节软骨细胞培养及生物学特性研究.华西口腔医学杂志,1997,15(3):187~189
3 Takigawa M,Okada M,Taakano T,et al. Studies on chondrocytes from mandibular condylar cartilage,nasal septal cartilage and sphenooccipital synchonclosis in culture. J Dent Res,1984,63(1):19
4 曲绵域,陈慧会,齐剑刚,等.软骨细胞培养过程中细胞反分化的研究.北京医科大学学报,1992,24(4):330~332
5 Gospodarowicz D,Greenburg G,Birdwell CR.Determination of cellular shape by the extracellular matrix and its correction with the control of cellular growth. Cancer Res,1978,38(11):4155~4171
, 百拇医药
6 Folkman J,Moscona A.Role of cell shape in growth control.Nature,1978,273(5661):345~347
7 Benya PD,Shaffer JD.Dedifferentiated chondrocytes reexpress the differentiated collagen phenotype when cultured in agarose gels.Cell,1982,30(1):215~224
8 Milam SB, Klebe RL,Triplett RG,et al.Characterization of the extracellular matrix of the primate temporomandibular joint.J Oral Maxillofac Surg,1991,49(2):381~391
9 AignerT,Dudhia J.Phenotypic modulation of chondrocytes as a potential therapeutic target in ostearthriths:a hypothesis.Ann Rheum Dis,1997,56(3):287~291
(1999-03-16收稿,1999-07-07修回), 百拇医药
单位:610041 华西医科大学口腔医学院口腔颌面外科学教研室
关键词:髁状突;软骨细胞;培养;表型
华西口腔学杂志990419 摘要 目的:观察体外培养及传代对人髁突软骨细胞生物学特性的影响。方法:采用体外细胞培养、免疫生化及分子生物学方法观察传代过程中人髁突软骨细胞形态、Ⅱ型胶原及蛋白多糖合成及Ⅰ、Ⅱ、Ⅲ型前胶原的mRNA水平变化。结果:传代过程中人髁突软骨细胞Ⅱ型胶原合成及其mRNA水平逐渐降低,至第7代已基本丧失。而Ⅰ、Ⅲ型胶原的mRNA水平随传代逐渐升高,同时伴有细胞蛋白多糖合成的减少,细胞壁形态由圆形或多角形转变为长梭形占优势。结论:体外培养及反复传代可影响软骨细胞的表型特征。髁突软骨细胞的反分化标准应从胶原、蛋白多糖合成及细胞形态等方面综合评价。
Phenotypic Changes of Mandibular Condylar Cartilage Cells During Subculture
, 百拇医药
Jiao Yantao, Wang Dazhang, Han Wenli, et al
College of Stomatology, West China University of Medical Sciences
Abstract
Objective: To demonstrate the phenotypic changes of mandibular condylar cartilage(MCC) cells during subculture in vitro. Methods: MCC cells were harvested from human fetus by digestion of collagenase and cultured in DMEM supplemented with 10% newborn calf serum, then they were passaged when reached confluence.Morphological changes were observed under phase-contrast microscope. Type Ⅱ collagen, proteoglycan synthesis and type Ⅰ,Ⅱ and Ⅲ procollagen mRNA levels were also studied in serial monolayer cultures. Results: During subculture,type Ⅱ collagen and proteoglycan synthesis were decreased, being accompanied by a lower type Ⅱ collagen mRNA level. In contrast, type Ⅰ and Ⅲ procollagen mRNA levels were elevated progressively. The morphology of polygonal-shaped chondrocytes was lost to the bipolar fibroblastic cells. Conclusion: Passage and culture can affect the phenotypic property of MCC cells.
, http://www.100md.com
Key words: mandibular condyle cartilage cell culture phenotype
软骨细胞的分化状态直接影响着软骨的生物学性能,软骨细胞分化异常是常见关节疾患——骨关节病的一个重要表现。研究体外环境中细胞分化状态的变化,可为寻找骨关节病有效防治手段及建立性状稳定的软骨细胞库奠定基础。以往研究[1]多为大关节软骨细胞。本研究采用形态学、生物化学及分子生物学方法对体外培养人髁突软骨细胞在传代过程中的生物学行为变化进行了观察。
1 材料和方法
1.1 材料和试剂
Ⅱ型胶原酶(Sigma,USA),DMEM培养基(Gibco,USA),小牛血清(华西医科大学分子生物学实验室),Ⅱ型胶原单克隆抗体(Oncogene Research Products,USA),含Ⅰ、Ⅱ型胶原cDNA片段质粒(北京医科大学运动医学研究所曲绵域教授惠赠),含Ⅲ型胶原及β-Actin cDNA片段的质粒(华西医科大学章锦才教授惠赠),细胞总RNA分离纯化试剂盒及低熔点琼脂糖(Gene Co Ltd,USA),限制性内切酶EcoR I,Hind Ⅲ(Gibco,USA),地高辛标记检测试剂盒及尼龙膜(Boehringer Mannheim,Germany),其它试剂均为国产分析纯。
, http://www.100md.com
1.2 髁突软骨细胞的分离、培养、传代
参照文献[2]方法,下颌骨髁突软骨取自因健康原因需终止妊娠的4~6月水囊引产人胚胎,经机械分离及胰蛋白酶、胶原酶消化,获得高成活率、均一的软骨细胞。接种于含10%小牛血清的DMEM培养基(青霉素100 u/ml,链霉素100 μg/ml,抗坏血酸50 μg/ml),于 CO2孵箱内,37℃,5%CO2饱和湿度下培养。待细胞长满汇合成单层后开始传代,本实验传代7次。
1.3 髁突软骨细胞形态学观察
在原代及传代培养过程中定期进行相差显微镜观察及摄影。
1.4 生长曲线绘制
将不同传代髁突软骨细胞按2×104/孔接种于24孔板。从接种后第1天起,随机取孔,以0.25%胰蛋白酶消化后记数,取均数描记生长曲线。
, 百拇医药
1.5 甲苯胺蓝染色
培养软骨细胞甲苯胺蓝染色参照Takigawa等人[3]的方法。
1.6 培养软骨细胞合成Ⅱ型胶原的免疫检测
取不同传代软骨细胞1瓶(25 ml培养瓶)。用0.25%胰蛋白酶消化获得细胞,用PBS洗涤两次,离心弃上清,加入1×SDS样品缓冲液(50 mmol/L Tris.cl pH 6.8,100 mmol/L二硫苏糖醇,2%SDS,10%甘油)充分混匀,置100 ℃煮沸10 min,移入冰浴,离心取上清,-20 ℃保存备用。
分别取各传代细胞提取物4 μl点样于硝酸纤维素膜上,平行点样不同稀释浓度的成骨细胞(Mc-3T3E1)提取物,室温干燥后装入塑料袋,加入5 ml封闭液(5%脱脂奶粉,0.02%叠氮钠,0.05%吐温-20的PBS),封袋,4 ℃过夜。PBS洗膜后,将膜封于含Ⅱ型胶原单克隆抗体的(1∶20稀释)封闭剂,4 ℃振荡下孵育2 h。再次洗膜后,将膜封于含辣根过氧化物酶标记羊抗小鼠IgG的封闭液中。封袋后,室温振荡孵育2 h。室温洗膜10 min。最后将膜置于显色液(4-氯奈酚10 mg,甲醇3 ml,10 mmol/L pH 7.6 Tris.cl 17ml,3%双氧水15 μl)显色30 min,照相记录。
, 百拇医药
1.7 培养软骨细胞pro α1(Ⅰ)、α1(Ⅱ)、α1(Ⅲ)基因表达的检测
含Ⅰ、Ⅱ、Ⅲ型胶原cDNA片段重组质粒经转化、鉴定后,大量扩增,经碱裂解法抽提,限制性酶切消化后低熔点琼脂糖凝胶电泳回收特定cDNA片段。探针标记按地高辛标记试剂盒说明进行。取不同传代次数的髁突软骨细胞(2×106),提取细胞总RNA。取各样品总RNA 2 μg,与等体积RNA稀释液(20×SSC,37%甲醛,体积比3∶2),68℃变性15 min。将样品点样于预先用10×SSC浸泡10 min尼龙膜,80℃烤膜2 h。分别与地高辛标记的Ⅰ、Ⅱ、Ⅲ型胶原的cDNA探针进行预杂交、杂交、显色及灰度扫描。
2 结 果
2.1 传代软骨细胞形态及生长变化
, http://www.100md.com 在传代过程中软骨细胞形态改变显著,原代细胞多数为圆形或多角形(图1),自第3代开始出现长梭形细胞,到第6代以后长梭形的成纤维细胞样细胞可占90%以上。细胞重叠生长,呈漩涡状,长满单层时细胞数大于原代培养的细胞(图2)。传代软骨细胞生长速度较原代快,细胞倍增时间缩短,通常长满单层的时间为4~6 d(图3)。

图1 原代培养的人髁突软骨细胞多数为多角形或圆形×100

图2 第5代人髁突软骨细胞多数为长梭形×100

图3 不同代的人髁突软骨细胞生长曲线
, 百拇医药
2.2 传代细胞Ⅱ型胶原及蛋白多糖的合成
随传代次数增加,Ⅱ型胶原合成逐渐减少。至第7代免疫印迹方法已不能检测出细胞裂解液中Ⅱ型胶原(图4)。甲苯胺蓝染色原代细胞着色深,传代后的细胞染色逐渐变浅,说明软骨细胞合成硫酸软骨素蛋白多糖有减少趋势。

图4 传代人髁突软骨细胞Ⅱ型胶原的免疫印迹
2.3 传代软骨细胞Ⅰ、Ⅱ、Ⅲ型胶原mRNA水平的变化
采用斑点杂交的方法,检测了不同传代细胞总RNA中pro α1(Ⅰ)、α1(Ⅱ)、α1(Ⅲ)的相对水平。结果表明:pro α1(Ⅱ) mRNA水平随传代逐渐降低,第7代软骨细胞几乎不能表达pro α1(Ⅱ)。与之相反pro α1(Ⅰ)、α1(Ⅲ)随传代次数增加均有显著增加(图 5,6)。

, 百拇医药
图5 传代过程中软骨细胞胶原基因表达的变化

图6 传代人髁突软骨细胞前胶原基因表达的变化
3 讨 论
软骨来源于未分化的间充质细胞,胚胎时期间充质的中胚层及神经嵴均具有向软骨细胞分化的能力,但只有在特定的条件下,这些细胞才能向软骨细胞分化。目前软骨的分化诱导机制尚不清楚。本研究结果显示出在反复传代过程中髁突软骨细胞由多角形占多数转变为长梭形细胞占优势。并且细胞合成特异性Ⅱ型胶原及蛋白多糖的功能逐渐降低,Ⅰ、Ⅲ型胶原的表达逐渐升高。形态改变的软骨细胞伴有其表型特征的丧失,这个转化过程与大关节软骨细胞反分化现象是一致的[4]。
反分化是体外培养软骨细胞发生的一种表型特征的丧失。其发生机理及影响因素目前尚不清楚,但研究显示可能与培养环境的变化及传代次数有关[5]。通常认为只有圆形及多角形的软骨细胞可表达分化的软骨细胞表型,体外反复传代过程中细胞形态发生变化,形状类似于成纤维细胞。这可能因为体外贴壁培养软骨细胞的细胞骨架发生改变,而这种变化可传递到细胞核基质,导致染色质结构的改变,从而影响相应基因的转录[6]。近来研究表明,许多因素可以调节体外培养软骨细胞的表型特征,如改进培养方法,悬浮或半固体琼脂培养方法[7],加入某些因子如BMP2、IGF-Ⅰ等均能够达到稳定软骨细胞表型、促进其分化的作用。
, 百拇医药
髁突软骨有别于其它关节透明软骨,研究表明髁突软骨细胞能够同时表达Ⅰ型及Ⅱ型胶原。而透明软骨细胞只合成Ⅱ型胶原。因而不能单以出现Ⅰ型胶原的合成作为软骨细胞反分化的标准。应结合Ⅱ型胶原、蛋白多糖合成及细胞形态变化作综合评价[8]。
在骨关节病及软骨损伤异常修复中也可伴有软骨细胞合成胶原类型的改变,并失去合成蛋白多糖基质的功能。因反分化的软骨细胞与之相似,因而可作为骨关节病的体外研究模型,用作探索骨关节病的发病机制,并寻找预防和控制软骨细胞反分化的措施,以治疗骨关节病[9]。
本课题为国家自然科学基金资助项目(编号 39500164)
4 参考文献
1 Von Der Mark K,Conrad G. Cartilage cell differentiation.Clin Orthop Relat Res,1979,139(3):185~205
, 百拇医药
2 焦岩涛,王大章,田卫东,等.人胚颞颌关节软骨细胞培养及生物学特性研究.华西口腔医学杂志,1997,15(3):187~189
3 Takigawa M,Okada M,Taakano T,et al. Studies on chondrocytes from mandibular condylar cartilage,nasal septal cartilage and sphenooccipital synchonclosis in culture. J Dent Res,1984,63(1):19
4 曲绵域,陈慧会,齐剑刚,等.软骨细胞培养过程中细胞反分化的研究.北京医科大学学报,1992,24(4):330~332
5 Gospodarowicz D,Greenburg G,Birdwell CR.Determination of cellular shape by the extracellular matrix and its correction with the control of cellular growth. Cancer Res,1978,38(11):4155~4171
, 百拇医药
6 Folkman J,Moscona A.Role of cell shape in growth control.Nature,1978,273(5661):345~347
7 Benya PD,Shaffer JD.Dedifferentiated chondrocytes reexpress the differentiated collagen phenotype when cultured in agarose gels.Cell,1982,30(1):215~224
8 Milam SB, Klebe RL,Triplett RG,et al.Characterization of the extracellular matrix of the primate temporomandibular joint.J Oral Maxillofac Surg,1991,49(2):381~391
9 AignerT,Dudhia J.Phenotypic modulation of chondrocytes as a potential therapeutic target in ostearthriths:a hypothesis.Ann Rheum Dis,1997,56(3):287~291
(1999-03-16收稿,1999-07-07修回), 百拇医药