生长因子对培养的肺泡Ⅱ型细胞分泌功能及形态的影响
作者:曾庆富 蒋海鹰 钱仲 孙去病
单位:曾庆富 蒋海鹰 钱仲 孙去病(湖南医科大学肿瘤研究所,长沙 410078)
关键词:表皮生长因子-尿抑胃素;转化生长因子α;转化生长因子β;肺泡Ⅱ型细胞;肺表面活性剂
生长因子对培养的肺泡
摘要 目的:探讨表皮生长因子(EGF)、转化生长因子α和β1(TGF α,TGF β1)对肺泡Ⅱ型细胞(ATⅡ)磷脂分泌功能及细胞形态(肥大)的影响。方法:原代培养的成年大鼠ATⅡ中,加入生长因子作用48 h,应用化学测定法测定培养介质中总磷脂含量,采用图像分析技术测量细胞体积参数。结果:EGF、TGFα均可使总磷脂含量增加,而TGF β1则使总磷脂含量降低;随EGF、TGF α浓度增加,ATⅡ平均直径(DQ)、体积(VQ)和表面积(SQ)均逐渐增大,TGF β1对细胞体积变化无明显影响;TGF α和TGF β1同时加入培养体系中,总磷脂含量及细胞体积均无明显改变。结论:EGF、TGF α能促进ATⅡ磷脂分泌和细胞肥大;TGF β1对TGF α的作用有抑制效应。
, http://www.100md.com
分类号 R349.3;R392.11 文献标识码 A
文章编号 1001-7399(1999)05-0432-02
The effect of growth factors on secretion function and morphology in cultured alveolar type Ⅱ cells
Zeng Qingfu, Jiang Haiying, Qian Zhongfei et al
(Dept of Pathol, Hunan Medical University, Changsha 410078)
ABSTRACT Purpose To study the effect of growth factors including epidermal growth factor (EGF), transforming growth factor α and β1(TGF α,TGF β1) on phospholipid secretion and morphology in cultured alveolar type Ⅱ cells (ATⅡs) isolated from adult rats. Methods Chemical assay was used to detect total phospholipid level in the culture medium, and cell morphometry for mesurement of volume of ATⅡs. Results (1) Both EGF and TGF α increased the total phospholipid in culture medium, while TGF β1 decreased it; (2) The average diameter, average volume, and average surface area of ATⅡs consistantly increased with the increase of concentration of EGF and TGF α; (3) The phospholipid level and cell size were unaffected by the addition of TGF α and TGF β1 simulatanously in the culture system. Conclusion Both EGF and TGF α may enhance the functional differentiation and increase phospholipid secretion, and stimulate hypertrophy of ATⅡs in vitro. TGF β1 inhibits the effect of TGF α in ATⅡs.
, 百拇医药
KEY WORDS epidermal growth factor-urogastrone; transforming growth factor alpha; transforming growth factor beta; alveolar type Ⅱ cell; pulmonary surfactants
肺泡Ⅱ型细胞(AT Ⅱ)参与肺损伤后肺泡上皮的修复,并合成分泌表面活性物质(PS)。我室新近研究证实,大鼠吸入石英粉尘或有机粉尘可致ATⅡ增生、肥大、PS合成和分泌增多〔1,2〕。生长因子是多种细胞增殖和分化的重要调节因子,但对ATⅡ功能分化的影响,特别是对成年动物PS的合成与分泌的调节作用,知之甚少〔3,4〕。本实验有:(1)用培养的成年大鼠ATⅡ,观察表皮生长因子(EGF)、转化生长因子α和β1(TGF α, TGF β1)对培养介质中磷脂(PS的主要成分)含量的影响,探讨生长因子对ATⅡ功能分化的作用;(2)形态计量测定生长因子作用后的ATⅡ体积变化,了解ATⅡ形态与功能的相互关系。
, 百拇医药
1 材料与方法
1.1 动物与试剂 实验动物体重140~180 g,♂SD大鼠(清洁级)共9只,由湘雅医院动物科提供。rhEGF、rhTGF α、natural TGF β1(Promega公司),胰蛋白酶(Difico公司),DMEM(Gibco公司),DNase(华美公司),FCS(杭州四季青生物材料研究所),大鼠IgG(中国军事医学科学院)。
1.2 ATⅡ分离纯化及原代培养 按我室建立的方法〔5〕进行。实验分3次进行,每次同时分离3只大鼠的肺细胞,经大鼠IgG粘附纯化后碱性磷酸酶(AKP)染色,ATⅡ纯度在90%以上。用含20%FCS DMEM调节细胞浓度至7×105/ml,按4×105细胞/cm2密度接种于24孔培养板中(相当每孔1 ml细胞悬液)。置5%CO2培养箱培养24 h,去除未贴壁细胞更换含10%FCS的DMEM新鲜培养基。
, 百拇医药
1.3 总磷脂测定 换液后的细胞分为对照组和实验组,后者分别加不同剂量(0.1 ng.ml-1,1 mg.ml-1,10 ng.ml-1,100 ng.ml-1)的EGF或TGF α或TGF β1,每一种生长因子的每一剂量设3个复平孔,继续培养48 h后收集培养介质。用总磷脂化学测定法测定其磷脂含量,具体步骤参照文献〔6〕进行。上述实验重复2次。
1.4 细胞形态计量 用0.06%胰蛋白酶/0.01% EDTA消化收集细胞、涂片,HE染色。用AST-PC机加Vision 85 plus (USA)图像分析系统,每一剂量组随机选择3张涂片中的150个以上细胞,分别测量细胞平均直径(DQ)、体积(VQ)和表面积(SQ)。上述三个指标作为反映ATⅡ大小的参数。
, 百拇医药
1.5 统计分析 磷脂含量及细胞形态计量分析结果的数据以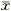 ±s表示,t检验。
±s表示,t检验。
2 结果
2.1 不同剂量生长因子对总磷脂含量的影响 表1所示,EGF、TGF α均可使ATⅡ培养介质中磷脂含量增加。EGF、TGF α 1 ng.ml-1即可使磷脂含量增加,100 ng.ml-1时使磷脂增加近1.3倍(P<0.05)。而TGF β1则使磷脂含量降低,TGF β1 1 ng.ml-1时磷脂减少26.7%(P<0.05),10 ng.ml-1时减少39.7%(P<0.01)。
, 百拇医药
表1 不同剂量的生长因子对ATⅡ培养
介质总磷脂含量的影响 (μg.ml-1)
分 组
EGF
TGF α
TGF β1
对照组
50.67±4.97
50.67±4.97
50.67±4.97
0.1 ng.ml-1组
, http://www.100md.com
—
—
49.15±6.02
1.0 ng.ml-1组
53.10±7.77
58.44±6.02
37.16±6.57*
10 ng.ml-1组
59.08±10.63
59.07±4.48
, http://www.100md.com 30.57±1.64**
100 ng.ml-1组
63.97±10.57*
65.73±6.57*
—
n=9,t检验,与对照组比较:*P<0.05,**P<0.01
2.2 不同剂量生长因子对ATⅡ体积的影响 表2所示,随EGF或TGF α浓度增加,ATⅡ的DQ,VQ和SQ均逐渐增大(P<0.05~0.01),TGF β1对ATⅡ体积变化无明显影响(P>0.05)。
, 百拇医药
表2 不同剂量的生长因子对ATⅡ体积的影响
分 组
EGF
TGF α
TGF β1
DQ(μm)
VQ(μm3)
SQ(μm2)
DQ(μm)
VQ(μm3)
SQ(μm2)
, http://www.100md.com
DQ(μm)
VQ(μm3)
SQ(μm2)
对照组
15.06 ±0.94
2348.6
±661.9
833.8
±109.3
15.06
±0.94
2348.6
, 百拇医药
±661.9
833.8
±109.3
15.06
±0.94
2348.6
±661.9
833.8
±109.3
0.1 ng.ml-1组
—
—
, 百拇医药
—
—
—
—
15.53
±0.09
2643.3
±74.5
878.6
±19.2
1.0 ng.ml-1
15.21
, 百拇医药
±0.26
2313.9
±155.6
912.1
±46.1
15.94
±1.52
2805.1
±838.5
1041.7
±227.6
15.39
±2.95
, 百拇医药
2389.8
±1388.9
887.4
±349.3
10 ng.ml-1组
15.94
±1.81
2760.8
±1006.5
1019.4
±261.5
17.47
, 百拇医药
±0.35*
3308.0
±263.7*
1135.2
±70.9*
15.91
±2.63
2633.4
±1227.5
961.3
±321.53
100 ng.ml-1组
, 百拇医药
16.91
±1.66**
3098.5
±1139.2*
1132.3
±315.3*
18.83
±1.64**
4223.6
±1082.8**
1332.7
, 百拇医药
±227.8**
—
—
—
n=9,t检验,与对照组比较:*P<0.05,**P<0.01
2.3 TGF α、TGF β1共同作用对ATⅡ磷脂分泌和形态的影响 表3所示TGF α(50 ng.ml-1)和TGF β1 (5 ng.ml-1)同时加入培养体系中,其磷脂含量和细胞体积均无明显改变(P>0.05),表明TGF β1阻抑了TGF α的刺激作用。
, 百拇医药 表3 TGF α、TGF β1协同作用对ATⅡ的影响
分 组
磷脂含量(μg.ml-1)
DQ(μm)
VQ(μm3)
SQ(μm2)
对照组
50.67±4.97
15.06±0.94
2548.6±661.9
, 百拇医药
833.8±109.3
TGF α+TGF β1
54.17±20.95
15.64±2.79
2480.9±1253.2
911.9±332.8
n=9,t检验,与对照组比较:P均>0.05 3 讨论
体内研究ATⅡ的PS合成和分泌功能时,通常采用支气管肺泡灌洗获得PS。Dobbs等〔7〕对ATⅡ培养介质中的分泌物进行了研究,发现有大量板层小体、部分管样髓磷脂以及Apo-蛋白,其磷脂组分与灌洗液中PS十分相似。本研究测定ATⅡ培养介质中总磷脂含量,以其作为衡量ATⅡ合成分泌PS的一种指标,具有较好的代表性。
, http://www.100md.com
本研究用体外培养的成年大鼠ATⅡ,发现EGF、TGF α均能促进其培养介质中总磷脂含量升高,而TGF β1则导致磷脂含量降低。与文献报道EFG、TGF β对兔及罗猴胎肺的PS影响结果相似〔8~10〕。我们推测,生长因子致培养介质中磷脂含量的变化可能与下列因素有关:(1)通过增强磷脂酰胆碱(PC)合成的关键酶—磷酸胆碱胞苷转移酶活性,调节ATⅡ的S合成增加。Mallampalli等〔11〕报道,EGF作用于ATⅡ后,磷酸胆碱胞苷转移酶含量无明显变化,但活性增加58%。TGF α与EGF共用EGF受体(EGFR),TGF α可能也有EGF相似的作用。(2)与培养体系中细胞数量变化有关。我们另有研究结果显示,EGF、TGF α能明显刺激成年大鼠ATⅡ增生,细胞数量增多,TGF β1则抑制ATⅡ增生(另文报道)。因此,培养体系中的细胞数量也可能是影响培养介质中磷脂含量的因素之一。但我们也发现体内的ATⅡ胞浆内板层小体数量与ATⅡ增生的程度一致,增生的ATⅡ合成和分泌PS功能亢进〔1〕。国外最近研究报道,角质细胞生长因子(KGF)不仅能促进培养的ATⅡ增生,同时也能促进ATⅡ的分化、刺激表面活性蛋白A和D(SP-A,SP-D)mRNA和蛋白质的表达,磷脂合成增加〔3〕;EGF促进孕猴体内胎肺的ATⅡ分化和PS的合成〔9〕。因此,我们认为EGF、TGF α和TGF β1除能调控成年肺ATⅡ增生外,同时也调节ATⅡ功能分化,影响PS合成和分泌。
, 百拇医药
本研究用形态计量技术,首次测定了体外培养的ATⅡ在生长因子作用后细胞体积的变化,发现EGF、TGF α能使ATⅡ的DQ、VQ、SQ增大,有明显的量效关系。而且EGF、TGF α所致细胞体积变化与培养介质中总磷脂含量变化呈一致性,显示EGF、TGF α作用于ATⅡ后,可引起细胞增生、肥大及磷脂合成与分泌增多等多重生物效应。至于TGF β1对ATⅡ的作用,一方面抑制ATⅡ增生;另一方面,尽管对ATⅡ体积无明显影响,但却使培养介质中磷脂含量降低,可能的解释是:因为生长和分化的调控在上皮细胞是完整相联的,所以由TGF β1引起的增生抑制常与细胞分化终止相联。
基金项目:国家自然科学基金资助课题(No 39400048)
作者简介:曾庆富,男,36岁,博士,教授。研究方向:肺脏病理
参考文献
, 百拇医药
1,钱仲 ,郭晓璇,戚以谟. 吸入石英粉尘对大鼠肺泡Ⅱ型上皮细胞的影响. 湖南医科大学学报,1995;20(1):13~15
,郭晓璇,戚以谟. 吸入石英粉尘对大鼠肺泡Ⅱ型上皮细胞的影响. 湖南医科大学学报,1995;20(1):13~15
2,郭晓璇,钱仲 . 实验性过敏性肺泡炎Ⅱ型肺泡上皮细胞的改变. 中华病理学杂志,1992;21(4):241~243
. 实验性过敏性肺泡炎Ⅱ型肺泡上皮细胞的改变. 中华病理学杂志,1992;21(4):241~243
3,Xu XS, Mc Shannon K, Voelker DR et al. KGF increase SP-A and SP-D mRNA levels and secretion in cultured rat alveolar type Ⅱ cells. Am J Respir Cell Mol Biol,1998;18(2):168~178
, 百拇医药
4,Bry K, Lappalainen V, Hallman M. Intraamniotic interleukin-1 accelerates surfactant protein synthesis in fetal rabbits and improves lung stability after premature birth. J Clin Invest,1997;99(12):2992~2999
5,曾庆富,蒋海鹰,钱仲 等. 肺泡Ⅱ型上皮细胞分离纯化及原代培养. 中华病理学杂志,1998;27(4):384~385
等. 肺泡Ⅱ型上皮细胞分离纯化及原代培养. 中华病理学杂志,1998;27(4):384~385
6,李影林主编. 中华医学检验全书. 北京:人民卫生出版社,1996:737~738
, 百拇医药
7,Dobbs LG, Masson RJ, Williams MC et al. Secretion of surfactant by primary cultures of alveolar type Ⅱ cells isolated from rats. Biochem Biophy Acta,1982;713(1):118~127
8,Higuchi M, Hirao H, Maki M. Effect of human epidermal growth factor on lung surfactant production in fetal rabbit. J Exp Med,1989;159(1):15~22
9,Plopper CG, ST George JA, Read LC et al. Aceeleration of alveolar type Ⅱ cell differentiation in fetal rhesus monkey lung by administration of EGF. Am J Physiol,1992;262(3ptl):L313~319
, 百拇医药
10,Nielsen HC, Martin A, Volpe MV et al. Growth factor control of growth and epithelial differentiation in embryonic lungs. Biochem Mol Med,1997;60(1):38~48
11,Mallampalli PK, Salome RG, Hunninghake GW. Epidermal growth factor is a positive in vitro regulator of CTP: cholinephosphate cytidyltransferase. Exp Lung Res,1994;20(1):1~11
收稿日期:1998-12-07
修回日期:1999-06-30, 百拇医药
单位:曾庆富 蒋海鹰 钱仲 孙去病(湖南医科大学肿瘤研究所,长沙 410078)
关键词:表皮生长因子-尿抑胃素;转化生长因子α;转化生长因子β;肺泡Ⅱ型细胞;肺表面活性剂
生长因子对培养的肺泡
摘要 目的:探讨表皮生长因子(EGF)、转化生长因子α和β1(TGF α,TGF β1)对肺泡Ⅱ型细胞(ATⅡ)磷脂分泌功能及细胞形态(肥大)的影响。方法:原代培养的成年大鼠ATⅡ中,加入生长因子作用48 h,应用化学测定法测定培养介质中总磷脂含量,采用图像分析技术测量细胞体积参数。结果:EGF、TGFα均可使总磷脂含量增加,而TGF β1则使总磷脂含量降低;随EGF、TGF α浓度增加,ATⅡ平均直径(DQ)、体积(VQ)和表面积(SQ)均逐渐增大,TGF β1对细胞体积变化无明显影响;TGF α和TGF β1同时加入培养体系中,总磷脂含量及细胞体积均无明显改变。结论:EGF、TGF α能促进ATⅡ磷脂分泌和细胞肥大;TGF β1对TGF α的作用有抑制效应。
, http://www.100md.com
分类号 R349.3;R392.11 文献标识码 A
文章编号 1001-7399(1999)05-0432-02
The effect of growth factors on secretion function and morphology in cultured alveolar type Ⅱ cells
Zeng Qingfu, Jiang Haiying, Qian Zhongfei et al
(Dept of Pathol, Hunan Medical University, Changsha 410078)
ABSTRACT Purpose To study the effect of growth factors including epidermal growth factor (EGF), transforming growth factor α and β1(TGF α,TGF β1) on phospholipid secretion and morphology in cultured alveolar type Ⅱ cells (ATⅡs) isolated from adult rats. Methods Chemical assay was used to detect total phospholipid level in the culture medium, and cell morphometry for mesurement of volume of ATⅡs. Results (1) Both EGF and TGF α increased the total phospholipid in culture medium, while TGF β1 decreased it; (2) The average diameter, average volume, and average surface area of ATⅡs consistantly increased with the increase of concentration of EGF and TGF α; (3) The phospholipid level and cell size were unaffected by the addition of TGF α and TGF β1 simulatanously in the culture system. Conclusion Both EGF and TGF α may enhance the functional differentiation and increase phospholipid secretion, and stimulate hypertrophy of ATⅡs in vitro. TGF β1 inhibits the effect of TGF α in ATⅡs.
, 百拇医药
KEY WORDS epidermal growth factor-urogastrone; transforming growth factor alpha; transforming growth factor beta; alveolar type Ⅱ cell; pulmonary surfactants
肺泡Ⅱ型细胞(AT Ⅱ)参与肺损伤后肺泡上皮的修复,并合成分泌表面活性物质(PS)。我室新近研究证实,大鼠吸入石英粉尘或有机粉尘可致ATⅡ增生、肥大、PS合成和分泌增多〔1,2〕。生长因子是多种细胞增殖和分化的重要调节因子,但对ATⅡ功能分化的影响,特别是对成年动物PS的合成与分泌的调节作用,知之甚少〔3,4〕。本实验有:(1)用培养的成年大鼠ATⅡ,观察表皮生长因子(EGF)、转化生长因子α和β1(TGF α, TGF β1)对培养介质中磷脂(PS的主要成分)含量的影响,探讨生长因子对ATⅡ功能分化的作用;(2)形态计量测定生长因子作用后的ATⅡ体积变化,了解ATⅡ形态与功能的相互关系。
, 百拇医药
1 材料与方法
1.1 动物与试剂 实验动物体重140~180 g,♂SD大鼠(清洁级)共9只,由湘雅医院动物科提供。rhEGF、rhTGF α、natural TGF β1(Promega公司),胰蛋白酶(Difico公司),DMEM(Gibco公司),DNase(华美公司),FCS(杭州四季青生物材料研究所),大鼠IgG(中国军事医学科学院)。
1.2 ATⅡ分离纯化及原代培养 按我室建立的方法〔5〕进行。实验分3次进行,每次同时分离3只大鼠的肺细胞,经大鼠IgG粘附纯化后碱性磷酸酶(AKP)染色,ATⅡ纯度在90%以上。用含20%FCS DMEM调节细胞浓度至7×105/ml,按4×105细胞/cm2密度接种于24孔培养板中(相当每孔1 ml细胞悬液)。置5%CO2培养箱培养24 h,去除未贴壁细胞更换含10%FCS的DMEM新鲜培养基。
, 百拇医药
1.3 总磷脂测定 换液后的细胞分为对照组和实验组,后者分别加不同剂量(0.1 ng.ml-1,1 mg.ml-1,10 ng.ml-1,100 ng.ml-1)的EGF或TGF α或TGF β1,每一种生长因子的每一剂量设3个复平孔,继续培养48 h后收集培养介质。用总磷脂化学测定法测定其磷脂含量,具体步骤参照文献〔6〕进行。上述实验重复2次。
1.4 细胞形态计量 用0.06%胰蛋白酶/0.01% EDTA消化收集细胞、涂片,HE染色。用AST-PC机加Vision 85 plus (USA)图像分析系统,每一剂量组随机选择3张涂片中的150个以上细胞,分别测量细胞平均直径(DQ)、体积(VQ)和表面积(SQ)。上述三个指标作为反映ATⅡ大小的参数。
, 百拇医药
1.5 统计分析 磷脂含量及细胞形态计量分析结果的数据以
2 结果
2.1 不同剂量生长因子对总磷脂含量的影响 表1所示,EGF、TGF α均可使ATⅡ培养介质中磷脂含量增加。EGF、TGF α 1 ng.ml-1即可使磷脂含量增加,100 ng.ml-1时使磷脂增加近1.3倍(P<0.05)。而TGF β1则使磷脂含量降低,TGF β1 1 ng.ml-1时磷脂减少26.7%(P<0.05),10 ng.ml-1时减少39.7%(P<0.01)。
, 百拇医药
表1 不同剂量的生长因子对ATⅡ培养
介质总磷脂含量的影响 (μg.ml-1)
分 组
EGF
TGF α
TGF β1
对照组
50.67±4.97
50.67±4.97
50.67±4.97
0.1 ng.ml-1组
, http://www.100md.com
—
—
49.15±6.02
1.0 ng.ml-1组
53.10±7.77
58.44±6.02
37.16±6.57*
10 ng.ml-1组
59.08±10.63
59.07±4.48
, http://www.100md.com 30.57±1.64**
100 ng.ml-1组
63.97±10.57*
65.73±6.57*
—
n=9,t检验,与对照组比较:*P<0.05,**P<0.01
2.2 不同剂量生长因子对ATⅡ体积的影响 表2所示,随EGF或TGF α浓度增加,ATⅡ的DQ,VQ和SQ均逐渐增大(P<0.05~0.01),TGF β1对ATⅡ体积变化无明显影响(P>0.05)。
, 百拇医药
表2 不同剂量的生长因子对ATⅡ体积的影响
分 组
EGF
TGF α
TGF β1
DQ(μm)
VQ(μm3)
SQ(μm2)
DQ(μm)
VQ(μm3)
SQ(μm2)
, http://www.100md.com
DQ(μm)
VQ(μm3)
SQ(μm2)
对照组
15.06 ±0.94
2348.6
±661.9
833.8
±109.3
15.06
±0.94
2348.6
, 百拇医药
±661.9
833.8
±109.3
15.06
±0.94
2348.6
±661.9
833.8
±109.3
0.1 ng.ml-1组
—
—
, 百拇医药
—
—
—
—
15.53
±0.09
2643.3
±74.5
878.6
±19.2
1.0 ng.ml-1
15.21
, 百拇医药
±0.26
2313.9
±155.6
912.1
±46.1
15.94
±1.52
2805.1
±838.5
1041.7
±227.6
15.39
±2.95
, 百拇医药
2389.8
±1388.9
887.4
±349.3
10 ng.ml-1组
15.94
±1.81
2760.8
±1006.5
1019.4
±261.5
17.47
, 百拇医药
±0.35*
3308.0
±263.7*
1135.2
±70.9*
15.91
±2.63
2633.4
±1227.5
961.3
±321.53
100 ng.ml-1组
, 百拇医药
16.91
±1.66**
3098.5
±1139.2*
1132.3
±315.3*
18.83
±1.64**
4223.6
±1082.8**
1332.7
, 百拇医药
±227.8**
—
—
—
n=9,t检验,与对照组比较:*P<0.05,**P<0.01
2.3 TGF α、TGF β1共同作用对ATⅡ磷脂分泌和形态的影响 表3所示TGF α(50 ng.ml-1)和TGF β1 (5 ng.ml-1)同时加入培养体系中,其磷脂含量和细胞体积均无明显改变(P>0.05),表明TGF β1阻抑了TGF α的刺激作用。
, 百拇医药 表3 TGF α、TGF β1协同作用对ATⅡ的影响
分 组
磷脂含量(μg.ml-1)
DQ(μm)
VQ(μm3)
SQ(μm2)
对照组
50.67±4.97
15.06±0.94
2548.6±661.9
, 百拇医药
833.8±109.3
TGF α+TGF β1
54.17±20.95
15.64±2.79
2480.9±1253.2
911.9±332.8
n=9,t检验,与对照组比较:P均>0.05 3 讨论
体内研究ATⅡ的PS合成和分泌功能时,通常采用支气管肺泡灌洗获得PS。Dobbs等〔7〕对ATⅡ培养介质中的分泌物进行了研究,发现有大量板层小体、部分管样髓磷脂以及Apo-蛋白,其磷脂组分与灌洗液中PS十分相似。本研究测定ATⅡ培养介质中总磷脂含量,以其作为衡量ATⅡ合成分泌PS的一种指标,具有较好的代表性。
, http://www.100md.com
本研究用体外培养的成年大鼠ATⅡ,发现EGF、TGF α均能促进其培养介质中总磷脂含量升高,而TGF β1则导致磷脂含量降低。与文献报道EFG、TGF β对兔及罗猴胎肺的PS影响结果相似〔8~10〕。我们推测,生长因子致培养介质中磷脂含量的变化可能与下列因素有关:(1)通过增强磷脂酰胆碱(PC)合成的关键酶—磷酸胆碱胞苷转移酶活性,调节ATⅡ的S合成增加。Mallampalli等〔11〕报道,EGF作用于ATⅡ后,磷酸胆碱胞苷转移酶含量无明显变化,但活性增加58%。TGF α与EGF共用EGF受体(EGFR),TGF α可能也有EGF相似的作用。(2)与培养体系中细胞数量变化有关。我们另有研究结果显示,EGF、TGF α能明显刺激成年大鼠ATⅡ增生,细胞数量增多,TGF β1则抑制ATⅡ增生(另文报道)。因此,培养体系中的细胞数量也可能是影响培养介质中磷脂含量的因素之一。但我们也发现体内的ATⅡ胞浆内板层小体数量与ATⅡ增生的程度一致,增生的ATⅡ合成和分泌PS功能亢进〔1〕。国外最近研究报道,角质细胞生长因子(KGF)不仅能促进培养的ATⅡ增生,同时也能促进ATⅡ的分化、刺激表面活性蛋白A和D(SP-A,SP-D)mRNA和蛋白质的表达,磷脂合成增加〔3〕;EGF促进孕猴体内胎肺的ATⅡ分化和PS的合成〔9〕。因此,我们认为EGF、TGF α和TGF β1除能调控成年肺ATⅡ增生外,同时也调节ATⅡ功能分化,影响PS合成和分泌。
, 百拇医药
本研究用形态计量技术,首次测定了体外培养的ATⅡ在生长因子作用后细胞体积的变化,发现EGF、TGF α能使ATⅡ的DQ、VQ、SQ增大,有明显的量效关系。而且EGF、TGF α所致细胞体积变化与培养介质中总磷脂含量变化呈一致性,显示EGF、TGF α作用于ATⅡ后,可引起细胞增生、肥大及磷脂合成与分泌增多等多重生物效应。至于TGF β1对ATⅡ的作用,一方面抑制ATⅡ增生;另一方面,尽管对ATⅡ体积无明显影响,但却使培养介质中磷脂含量降低,可能的解释是:因为生长和分化的调控在上皮细胞是完整相联的,所以由TGF β1引起的增生抑制常与细胞分化终止相联。
基金项目:国家自然科学基金资助课题(No 39400048)
作者简介:曾庆富,男,36岁,博士,教授。研究方向:肺脏病理
参考文献
, 百拇医药
1,钱仲
2,郭晓璇,钱仲
3,Xu XS, Mc Shannon K, Voelker DR et al. KGF increase SP-A and SP-D mRNA levels and secretion in cultured rat alveolar type Ⅱ cells. Am J Respir Cell Mol Biol,1998;18(2):168~178
, 百拇医药
4,Bry K, Lappalainen V, Hallman M. Intraamniotic interleukin-1 accelerates surfactant protein synthesis in fetal rabbits and improves lung stability after premature birth. J Clin Invest,1997;99(12):2992~2999
5,曾庆富,蒋海鹰,钱仲
6,李影林主编. 中华医学检验全书. 北京:人民卫生出版社,1996:737~738
, 百拇医药
7,Dobbs LG, Masson RJ, Williams MC et al. Secretion of surfactant by primary cultures of alveolar type Ⅱ cells isolated from rats. Biochem Biophy Acta,1982;713(1):118~127
8,Higuchi M, Hirao H, Maki M. Effect of human epidermal growth factor on lung surfactant production in fetal rabbit. J Exp Med,1989;159(1):15~22
9,Plopper CG, ST George JA, Read LC et al. Aceeleration of alveolar type Ⅱ cell differentiation in fetal rhesus monkey lung by administration of EGF. Am J Physiol,1992;262(3ptl):L313~319
, 百拇医药
10,Nielsen HC, Martin A, Volpe MV et al. Growth factor control of growth and epithelial differentiation in embryonic lungs. Biochem Mol Med,1997;60(1):38~48
11,Mallampalli PK, Salome RG, Hunninghake GW. Epidermal growth factor is a positive in vitro regulator of CTP: cholinephosphate cytidyltransferase. Exp Lung Res,1994;20(1):1~11
收稿日期:1998-12-07
修回日期:1999-06-30, 百拇医药