人Fas抗原死亡表位分析
作者:宋建勋 朱锡华 陈克敏
单位:宋建勋 朱锡华 第三军医大学基础医学部免疫学教研室、全军免疫学研究所 重庆,400038陈克敏 美国哥伦比亚大学
关键词:Fas抗原表位;细胞凋亡;死亡信号
第三军医大学学报990505 提 要 目的:分析确定人Fas(H-Fas)抗原具有死亡效应的表位区域。方法:采用可及性方
案、可塑性方案,结合抗原性方案、二级结构方案预测H-Fas抗原B细胞表位。Fmoc固相合成法合成
部分预测表位肽段并鉴定后,经固相ELISA确定是否与具有诱导细胞凋亡(PCD)的抗人Fas mAb
2Al、DX2、CH-11反应。结果:H-Fas抗原胞外区的B细胞表位可能位于N-末端氨基酸(AA)残基51~
, 百拇医药
78,102~110,145~157等区域内或它们附近。用Fmoc固相合成法合成N-末端AA残基2~15,50~
83肽段,毛细管电泳鉴定合成效率,AA序列分析仪检测合成序列组成正确后,经固相ELISA法检
测,抗人Fas mAb 2A1、DX2、CH-11均不识别N-末端100个AA内肽段。结论:H-Fas抗原死亡表位可
能界定在100~157区域。
中图法分类号 R392.11
Analysis of the death epitope in human Fas antigen
Song Jianxun, Zhu Xihua, Chen Kemin (Institute of Immunology PLA, Third Military Medical University,Chongqing,400038)
, 百拇医药
Abstract Objective:To study the death epitope of human Fas (H-Fas) antigen extracellular
domain.Methods:B cell epitopes of H-Fas antigen were predicted with accessibility and flexibility schemes
associated with antigenicity,secondary structures and epitope analysis scheme.H-Fas antigen N-terminal residues 2
~15 and 50~83,designated B14 and P34 peptides,were synthesized with peptide synthesizer and observed
, http://www.100md.com
whether they could be recognized by anti-H-Fas mAb 2A1,DX2 and CH-11 which could induce apoptosis of
Fas-sensitive cells.Results:B cell epitopes were likely at or adjacent to H-Fas antigen N-terminal residues 51~
78,102~110 and 145~157.H-Fas antigen N-terminal residues 1~100 could not be bound to anti-H-Fas mAb
2A1,DX2 and CH-11.Conclusion:The death epitope of H-Fas antigen is probably localized in the Fas N-terminal
, 百拇医药
residues 100~157.
Key words Fas antigen; epitope; apoptosis/PCD;analysis
Fas抗原是现今已知的细胞膜表面具有诱导细胞凋亡能力最重要的分子之一,又称“死亡分
子”,与“存活分子”Bcl-2相互拮抗,成为近年细胞凋亡领域研究的一对热点[1]。抗Fas单克隆
抗体(mAb)或Fas配体(FasL)与Fas抗原结合可以诱导Fas+敏感细胞的凋亡。Fas抗原与抗Fas mAb或
FasL结合后引起Fas抗原胞内区死亡域交联,启动死亡信号的传导,其传导可能与蛋白激酶、蛋白
, 百拇医药 酶、神经酰胺、Ca2+等有关[2]。传导途径与肿瘤坏死因子受体(TNFR)不同,受到多方面调控,包
括:①蛋白激酶及蛋白磷酸酶的磷酸化、去磷酸化调节;②Fas抗原死亡信号中的蛋白酶调控,又
包括转录水平调节、翻译后修饰及其它调变剂的相互作用;③Bcl-2、Bcl-XL等的拮抗凋亡作用等
[3]。Fas抗原表位与信号传导关系密切,不同的表位启动的信号传导效果有差异,其中有的表位
是启动死亡信号传导所必需[4]。抗人Fas mAb 2A1、DX2、CH-11能诱导Fas+敏感细胞凋亡,那
么,其所识别的H-Fas抗原胞外区表位与死亡信号传导必定相关。明确能诱导Fas+敏感细胞凋亡的
, http://www.100md.com
Fas抗原表位对于Fas抗原信号传导机制的研究,尤其是死亡信号传导的早期事件具有重要意义。
1 材料与方法
1.1 材料
1.1.1 多肽合成用试剂 Fmoc-氨基酸、HMP-树脂、哌啶等均为PE公司产品。
1.1.2 抗体 鼠抗人Fas mAb 2A1(自制,IgG1),鼠抗人Fas mAb CH-11(Kamiya,IgM,我室访美
学者郑力新赠送),鼠抗人Fas mAb DX2(PharMingen,IgG1),HRP-羊抗鼠IgG(华美),小鼠IgG、IgM
对照(华美)。
, http://www.100md.com
1.1.3 抗原 可溶性重组人Fas标准蛋白(SrFas,Phar-Mingen)。
1.1.4 主要仪器 多肽合成仪:ABI 431A(Applied Biosystems);毛细管电泳仪:CE300
(Bio-Rad);氨基酸序列分析仪:121MB型(Beckman);酶联检测仪:Model 3550(Bio-Rad)。
1.2 方法
1.2.1H-Fas抗原胞外区AA序列 根据Itoh等[5](1991)及Oehm等[6](1992)克隆的人细胞表面
Fas抗原cDNA基因序列推导得知。
Sequence:H-FAS(extracellular domain)
, http://www.100md.com
Sequence length 157 Residues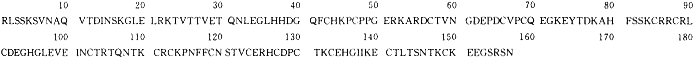
图1 H-Fas抗原胞外区AA序列
Fig 1 AA sequence of human Fas extracellular domain
1.2.2 可及性方案和可塑性方案的预测方法 采用Goldkey软件(北京军事医学科学院吴加金等
编制),把H-Fas抗原胞外区AA序列输入第一工作区,用7个AA这一组的分析参数。两种方案的各残
基指数参照文献全部在计算机上进行,高于阈值的峰为预测出的位点。
1.2.3 H-Fas多肽的顺序选择及化学合成 根据对H-Fas抗原B细胞表位的预测结果,选择H-Fas
, 百拇医药
抗原N-末端AA残基2~15,50~83作为合成肽序列,并命名为P14,P34,序列如下:
P14:NH2-LSSKSVNAQVTDIN-COOH
P34:NH2-GERKARDCTVNGDEPDCVPCQEGKEYTD
KAHFSS-COOH
P14主要是作为P34合成的对照。用Fmoc固相合成法在Applied Biosystems 431A多肽合成仪上
进行。成肽反应用DCC/HOBt法,肽链从C端向N端延伸。经保护肽树脂合成,切割与脱保护,分离与
纯化获得P14,P34合成产物。
, http://www.100md.com
1.2.4 H-Fas多肽合成产物鉴定 取少量多肽样品行毛细管区带电泳(CZE),电泳条件为:电泳
缓冲液为0.1mol/L磷酸钠缓冲液,pH4.5,毛细管规格为48cm×50μm,真空进样1.0s(20Psi),电压
10kV,电流10μA,整合波长200nm,电泳方向从正极到负极。另取少量多肽样品经6mol/L HCl酸解
后,用Beckman 121MB型AA序列分析仪进行AA组成分析。
1.2.5 酶联免疫吸附测定(ELISA) 按常规固相ELISA方法。简言之,用包被缓冲液
(0.85mol/L、pH7.6碳酸钠缓冲液)将合成肽P14、P34稀释至40μg/ml,包被96孔酶联检测板
, 百拇医药
(Corning),100μl/孔,37℃,水浴1h。弃去孔内液体,用洗涤缓冲液(pH7.4PBS)洗涤,拍干。等
量SrFas包被酶联板作为对照。分别加入鼠抗人Fas mAb 2A1、DX2、CH-11及正常小鼠Ig对照
100μl/孔(1∶40稀释),37℃,水浴1h,同上洗涤、拍干。加HRP酶标第二抗体100μl/孔(1∶50稀
释),置37℃,水浴1h,同上洗涤、拍干。加新鲜配制的0-邻苯二胺(OPD)-H2O2底物液,显示。于
酶联检测仪上测定各孔490nm处的Dλ值。
2 结果
2.1 可及性方案和可塑性方案的预测结果
, 百拇医药
N-末端AA残基第4~38,45~55,58~62,68~81,93~94,102~108,142~154为可及性区
域,以50、75、105、155残基附近可及性程度为高,可能位于H-Fas抗原表面,见图2。N-末端AA残
基4~5,14~18,22~34,47~54,60~63,69~74,81~82,102~11,14~154为可性区域,以
50、10、155残基附近可塑性程度为高,可能具有一定柔韧性,见图3。
2.4 固相ELISA鉴定
虽然抗人Fas mAb 2A1、DX2、CH-11均识别SrFas蛋白,但它们均不与合成肽P14、P34反应,IgG、IgM对照均为阴性结果,见图5。说明抗人Fas mAb 2A1、DX2、CH-11所识别的Fas表位均不P34
, http://www.100md.com
肽段内。
图2 人Fas抗原可及性预测
Fig 2 Accessibility prediction of H-Fas
图3 人Fas抗原可塑性预测
Fig 3 Flexibility prediction of H-Fas
2.2 H-Fas B细胞表位预测结果
综合上述2个方案的预测结果,结合抗原性预测、二级结构预测及表位预测方法结果,得出
, 百拇医药
H-Fas抗原的B细胞表位可能位于N-末端AA残基51~78,102~110,145~157区域或它们附近(未考
虑糖链的影响)。
2.3 P14、P34多肽合成
两种多肽合成产物经AA序列分析仪测定后,其序列组成与选择顺序相同。毛细管电泳后经微积
分显示其合成效率P14为30.13%,P34为83.26%,见图4。

图4 合成肽毛细管区带电泳分析结果 A. P14 B. P34
Fig 4 Analysis of synthetic peptides by capillary zone electrophoresis A. P14 B. P34
, 百拇医药
图5 P14、P34的ELISA分析结果
Fig 5 Analysis of P14,P34 by Elisa
A. P14 B. P34 C. SrFas
1. CH-11 2. DX2 3. 2A1 4. IgG control 5. IgM control
3 讨论
B细胞识别蛋白抗原时,是以其表面的B细胞抗原受体(BCR)与蛋白抗原表位(抗原决定簇)结
合,此过程与抗原抗体的结合相同。B细胞蛋白抗原表位的预测自从80年代Hopp & Woods提出亲水
性参数对抗原表位预测的方法以来,已有许多参数、算法发表,对B细胞蛋白抗原表位研究起到巨
, 百拇医药
大的推动作用。现今已被大众认可并具有较好预测效果的方法,主要有6种:①亲水性方案
(Hydrophilicity),尤以Hopp &Woods方案最为有名。认为蛋白抗原各AA残基可分为亲水残基和疏
水残基两类。在机体内,疏水性残基一般埋在蛋白内部,而亲水性残基位于表面,因此蛋白的亲水
部位与蛋白的抗原位点有密切的联系。Hopp&Woods方案是以残基由有机相环境转移到水相环境的自
由能为依据计算各个AA的亲水性。现已明确,亲水性部位与表位并无很好的一致性,即高亲水部位
不一定是表位,表位也不一定是亲水性部位[7]。②可及性方案(Accessibility),指蛋白抗原中
, 百拇医药
AA残基被溶剂分子接触的可能性,它反映了蛋白抗原内、外各层各残基的分布组成。③抗原性方案
(Antigenicity)。认为除亲水性AA残基外,疏水性AA残基也经常出现在表位中,各残基在蛋白抗原
位点中的相对出现率对抗原表位的定位预测有一定意义。许多蛋白抗原表位研究已证实,疏水性AA
残基对表位形成亦有贡献。④可塑性方案(Flexibility)。指蛋白抗原构象不是刚性不变的,其多
肽骨架有一定程度的活动性。⑤电荷分布方案(Charge distribution)。认为对碱性抗原特异的抗
体多趋于酸性,对酸性抗原特异的抗体多趋于碱性。但现在理解电荷作用引起的只是非特异性结
, http://www.100md.com 合。⑥二级结构预测(Secondary structure)。认为β转角结构为凸出结构,多出现在蛋白抗原表
面,利于与抗体嵌合,较可能成为抗原表位。α螺旋、β片层结构规则,不易变形,较难嵌合抗
体,一般不作为抗原位点[8,9]。预测B细胞蛋白抗原表位一般以上述多种方案综合考虑,尤以可
及性方案、可塑性方案、抗原性方案及二级结构预测为重要。概括而言,作为B细胞蛋白抗原的表
位首先应易于位于或移动于蛋白抗原表面,有利于与B细胞抗原受体或抗体结合,另外,要有一定
柔韧性,因为抗原与抗原受体或抗体结合有一个嵌合的过程。
Fas抗原能引起免疫应答的表位(功能性表位)位于其胞外区,其跨膜区和胞内区因存在空间位
, 百拇医药
阻,不能成为其功能性表位。H-Fas抗原胞外区157个AA,分子量为(17.573+8)×103u(8×103u为存在
的潜在的糖链分子量),理论上应存在4~6个功能性表位,即能被B细胞识别,或与抗体结合。经过
可及性方案、可塑性方案以及抗原性方案、二级结构预测、表位分析预测等综合考虑可能位于N-末
端AA残基51~78,102~110,145~157等区域内或它们附近。这是一个比较粗的预测结果,只是排
除了一些不易成为H-Fas抗原表位的肽段。至于其精细表位(4~9个AA残基)的确定可以在明确表位
所在区域后,进一步采用交叠肽合成方法分析,并随分析的进行,合成的交叠肽逐渐缩短,以至最
, 百拇医药
后确定H-Fas抗原的精细表位[10]。
从实验结果看,抗人Fas mAb均不识别P14和P34合成肽段,说明具有诱导PCD的抗人Fas mAb所
作用的H-Fas抗原表位不在靠近N末端的100个AA内。已有实验证实,H-Fas抗原N-末端49个AA与Fas
抗原三聚化(Trimerization)有关,是特异性FasL与Fas抗原结合并诱导PCD的部位[11]。即能起生
物学功能作用的抗人Fas mAb识别的H-Fas抗原表位在靠近胞膜区的50个AA左右的区域内。这50个AA
左右区域内的某些表位是具有诱导PCD的抗人Fas mAb作用域,根据其MW估计,可能有1~3个功能性
, 百拇医药
表位。精确分析、明确这1~3个表位,对H-Fas抗原死亡信号传导具有重要意义。
H-Fas抗原靠近胞膜区的50个AA左右的区域根据上述预测方案分析,可能有2个表位形成区,即
N-末端AA残基102~110,145~157,但由于这一区域有2个潜在的N-糖基化位点
(Asn-X-Ser/Thr,102位和120位),对表位形成有一定影响,可能会改变或形成新的表位。因此,具
有诱导PCD的抗人Fas mAb所作用的H-Fas抗原表位在N-末端AA残基100~157区域内。这与已证实抗
人Fas mAb CH-11所作用的表位在N-末端AA残基126~135部位相一致[12]。能够诱导细胞凋亡的抗
, 百拇医药
人Fas mAb所作用的H-Fas抗原表位可以界定在N-末端AA残基100~157区域内,至于其作用的精细表
位还待进一步研究。
全军“九五”重点项目,No.96Z038
作者简介:宋建勋,男,32岁,讲师,博士
参考文献
1 Nagata S, Golstein P. The Fas death factor. Science,1995,267(5023):1449
2 Ju S T, Panka D J, Cui H, et al. Fas (CD95)/FasL interactions required for programmed cell death after
, 百拇医药
T-cell activation. Nature,1995,373(6513):444
3 朱锡华.Fas系统研究进展.中华微生物学与免疫学杂志,1996,16(2):77
4 宋建勋,朱锡华.Fas抗原表位与死亡信号传导的关系.免疫学杂志,1997,13(3):206
5 Itoh N, Yonehara S, Ishil A, et al. The polypeptide encoded by the cDNA for human cell surface antigen
Fas can mediate apoptosis. Cell,1991,66(4):233
6 Oehm A, Behrmann I, Falk W, et al. Purification and molecular cloning of the Apo-1 cell surface antigen, a
, http://www.100md.com
member of the tumor necrosis factor/nerve growth factor receptor superfamily. J Biol Chem,1992,267(15):10709
7 吴玉章,朱锡华.蛋白质抗原表位的研究.科学,1994,185(1):93
8 Shih D T, Boettiger D, Buck C A. Epitopes of adhesion-perturbing monoclonal antibodies map within a
predicted alpha-helical domain of the integrin beta 1 subunit. J Cell Sci,1997,110(20):2619
9 Barlow D J, Edwards M S, Thornton J M, et al. Continuous and discontinuous protein antigenic
, 百拇医药
determinants. Nature,1986,322(6081):747
10 Gershoni J M, Stem B, Venisova G. Combinatorial libraries, epitope structure and the prediction of protein
conformations. Immunol Today,1997,18(3):108
11 Papoff G, Cascino I, Eramo A, et al. An N-terminal domain shared by Fas/Apo-1 (CD95) soluble variants
prevents cell death in vitro. J Immunol,1996,156(3):4623
12 Fadeel B, Thorpe C J, Chrodi F, et al. Mapping of the linear site on the Fas/Apo-1 molecule targeted by
the prototype anti-Fas mAb. Int Immunol,1995,7(10):1967
(收稿:1998-06-27;修回:1990-01-11), 百拇医药
单位:宋建勋 朱锡华 第三军医大学基础医学部免疫学教研室、全军免疫学研究所 重庆,400038陈克敏 美国哥伦比亚大学
关键词:Fas抗原表位;细胞凋亡;死亡信号
第三军医大学学报990505 提 要 目的:分析确定人Fas(H-Fas)抗原具有死亡效应的表位区域。方法:采用可及性方
案、可塑性方案,结合抗原性方案、二级结构方案预测H-Fas抗原B细胞表位。Fmoc固相合成法合成
部分预测表位肽段并鉴定后,经固相ELISA确定是否与具有诱导细胞凋亡(PCD)的抗人Fas mAb
2Al、DX2、CH-11反应。结果:H-Fas抗原胞外区的B细胞表位可能位于N-末端氨基酸(AA)残基51~
, 百拇医药
78,102~110,145~157等区域内或它们附近。用Fmoc固相合成法合成N-末端AA残基2~15,50~
83肽段,毛细管电泳鉴定合成效率,AA序列分析仪检测合成序列组成正确后,经固相ELISA法检
测,抗人Fas mAb 2A1、DX2、CH-11均不识别N-末端100个AA内肽段。结论:H-Fas抗原死亡表位可
能界定在100~157区域。
中图法分类号 R392.11
Analysis of the death epitope in human Fas antigen
Song Jianxun, Zhu Xihua, Chen Kemin (Institute of Immunology PLA, Third Military Medical University,Chongqing,400038)
, 百拇医药
Abstract Objective:To study the death epitope of human Fas (H-Fas) antigen extracellular
domain.Methods:B cell epitopes of H-Fas antigen were predicted with accessibility and flexibility schemes
associated with antigenicity,secondary structures and epitope analysis scheme.H-Fas antigen N-terminal residues 2
~15 and 50~83,designated B14 and P34 peptides,were synthesized with peptide synthesizer and observed
, http://www.100md.com
whether they could be recognized by anti-H-Fas mAb 2A1,DX2 and CH-11 which could induce apoptosis of
Fas-sensitive cells.Results:B cell epitopes were likely at or adjacent to H-Fas antigen N-terminal residues 51~
78,102~110 and 145~157.H-Fas antigen N-terminal residues 1~100 could not be bound to anti-H-Fas mAb
2A1,DX2 and CH-11.Conclusion:The death epitope of H-Fas antigen is probably localized in the Fas N-terminal
, 百拇医药
residues 100~157.
Key words Fas antigen; epitope; apoptosis/PCD;analysis
Fas抗原是现今已知的细胞膜表面具有诱导细胞凋亡能力最重要的分子之一,又称“死亡分
子”,与“存活分子”Bcl-2相互拮抗,成为近年细胞凋亡领域研究的一对热点[1]。抗Fas单克隆
抗体(mAb)或Fas配体(FasL)与Fas抗原结合可以诱导Fas+敏感细胞的凋亡。Fas抗原与抗Fas mAb或
FasL结合后引起Fas抗原胞内区死亡域交联,启动死亡信号的传导,其传导可能与蛋白激酶、蛋白
, 百拇医药 酶、神经酰胺、Ca2+等有关[2]。传导途径与肿瘤坏死因子受体(TNFR)不同,受到多方面调控,包
括:①蛋白激酶及蛋白磷酸酶的磷酸化、去磷酸化调节;②Fas抗原死亡信号中的蛋白酶调控,又
包括转录水平调节、翻译后修饰及其它调变剂的相互作用;③Bcl-2、Bcl-XL等的拮抗凋亡作用等
[3]。Fas抗原表位与信号传导关系密切,不同的表位启动的信号传导效果有差异,其中有的表位
是启动死亡信号传导所必需[4]。抗人Fas mAb 2A1、DX2、CH-11能诱导Fas+敏感细胞凋亡,那
么,其所识别的H-Fas抗原胞外区表位与死亡信号传导必定相关。明确能诱导Fas+敏感细胞凋亡的
, http://www.100md.com
Fas抗原表位对于Fas抗原信号传导机制的研究,尤其是死亡信号传导的早期事件具有重要意义。
1 材料与方法
1.1 材料
1.1.1 多肽合成用试剂 Fmoc-氨基酸、HMP-树脂、哌啶等均为PE公司产品。
1.1.2 抗体 鼠抗人Fas mAb 2A1(自制,IgG1),鼠抗人Fas mAb CH-11(Kamiya,IgM,我室访美
学者郑力新赠送),鼠抗人Fas mAb DX2(PharMingen,IgG1),HRP-羊抗鼠IgG(华美),小鼠IgG、IgM
对照(华美)。
, http://www.100md.com
1.1.3 抗原 可溶性重组人Fas标准蛋白(SrFas,Phar-Mingen)。
1.1.4 主要仪器 多肽合成仪:ABI 431A(Applied Biosystems);毛细管电泳仪:CE300
(Bio-Rad);氨基酸序列分析仪:121MB型(Beckman);酶联检测仪:Model 3550(Bio-Rad)。
1.2 方法
1.2.1H-Fas抗原胞外区AA序列 根据Itoh等[5](1991)及Oehm等[6](1992)克隆的人细胞表面
Fas抗原cDNA基因序列推导得知。
Sequence:H-FAS(extracellular domain)
, http://www.100md.com
Sequence length 157 Residues
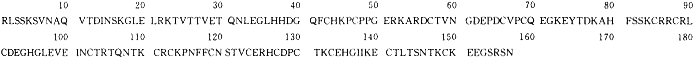
图1 H-Fas抗原胞外区AA序列
Fig 1 AA sequence of human Fas extracellular domain
1.2.2 可及性方案和可塑性方案的预测方法 采用Goldkey软件(北京军事医学科学院吴加金等
编制),把H-Fas抗原胞外区AA序列输入第一工作区,用7个AA这一组的分析参数。两种方案的各残
基指数参照文献全部在计算机上进行,高于阈值的峰为预测出的位点。
1.2.3 H-Fas多肽的顺序选择及化学合成 根据对H-Fas抗原B细胞表位的预测结果,选择H-Fas
, 百拇医药
抗原N-末端AA残基2~15,50~83作为合成肽序列,并命名为P14,P34,序列如下:
P14:NH2-LSSKSVNAQVTDIN-COOH
P34:NH2-GERKARDCTVNGDEPDCVPCQEGKEYTD
KAHFSS-COOH
P14主要是作为P34合成的对照。用Fmoc固相合成法在Applied Biosystems 431A多肽合成仪上
进行。成肽反应用DCC/HOBt法,肽链从C端向N端延伸。经保护肽树脂合成,切割与脱保护,分离与
纯化获得P14,P34合成产物。
, http://www.100md.com
1.2.4 H-Fas多肽合成产物鉴定 取少量多肽样品行毛细管区带电泳(CZE),电泳条件为:电泳
缓冲液为0.1mol/L磷酸钠缓冲液,pH4.5,毛细管规格为48cm×50μm,真空进样1.0s(20Psi),电压
10kV,电流10μA,整合波长200nm,电泳方向从正极到负极。另取少量多肽样品经6mol/L HCl酸解
后,用Beckman 121MB型AA序列分析仪进行AA组成分析。
1.2.5 酶联免疫吸附测定(ELISA) 按常规固相ELISA方法。简言之,用包被缓冲液
(0.85mol/L、pH7.6碳酸钠缓冲液)将合成肽P14、P34稀释至40μg/ml,包被96孔酶联检测板
, 百拇医药
(Corning),100μl/孔,37℃,水浴1h。弃去孔内液体,用洗涤缓冲液(pH7.4PBS)洗涤,拍干。等
量SrFas包被酶联板作为对照。分别加入鼠抗人Fas mAb 2A1、DX2、CH-11及正常小鼠Ig对照
100μl/孔(1∶40稀释),37℃,水浴1h,同上洗涤、拍干。加HRP酶标第二抗体100μl/孔(1∶50稀
释),置37℃,水浴1h,同上洗涤、拍干。加新鲜配制的0-邻苯二胺(OPD)-H2O2底物液,显示。于
酶联检测仪上测定各孔490nm处的Dλ值。
2 结果
2.1 可及性方案和可塑性方案的预测结果
, 百拇医药
N-末端AA残基第4~38,45~55,58~62,68~81,93~94,102~108,142~154为可及性区
域,以50、75、105、155残基附近可及性程度为高,可能位于H-Fas抗原表面,见图2。N-末端AA残
基4~5,14~18,22~34,47~54,60~63,69~74,81~82,102~11,14~154为可性区域,以
50、10、155残基附近可塑性程度为高,可能具有一定柔韧性,见图3。
2.4 固相ELISA鉴定
虽然抗人Fas mAb 2A1、DX2、CH-11均识别SrFas蛋白,但它们均不与合成肽P14、P34反应,IgG、IgM对照均为阴性结果,见图5。说明抗人Fas mAb 2A1、DX2、CH-11所识别的Fas表位均不P34
, http://www.100md.com
肽段内。

图2 人Fas抗原可及性预测
Fig 2 Accessibility prediction of H-Fas

图3 人Fas抗原可塑性预测
Fig 3 Flexibility prediction of H-Fas
2.2 H-Fas B细胞表位预测结果
综合上述2个方案的预测结果,结合抗原性预测、二级结构预测及表位预测方法结果,得出
, 百拇医药
H-Fas抗原的B细胞表位可能位于N-末端AA残基51~78,102~110,145~157区域或它们附近(未考
虑糖链的影响)。
2.3 P14、P34多肽合成
两种多肽合成产物经AA序列分析仪测定后,其序列组成与选择顺序相同。毛细管电泳后经微积
分显示其合成效率P14为30.13%,P34为83.26%,见图4。


图4 合成肽毛细管区带电泳分析结果 A. P14 B. P34
Fig 4 Analysis of synthetic peptides by capillary zone electrophoresis A. P14 B. P34

, 百拇医药
图5 P14、P34的ELISA分析结果
Fig 5 Analysis of P14,P34 by Elisa
A. P14 B. P34 C. SrFas
1. CH-11 2. DX2 3. 2A1 4. IgG control 5. IgM control
3 讨论
B细胞识别蛋白抗原时,是以其表面的B细胞抗原受体(BCR)与蛋白抗原表位(抗原决定簇)结
合,此过程与抗原抗体的结合相同。B细胞蛋白抗原表位的预测自从80年代Hopp & Woods提出亲水
性参数对抗原表位预测的方法以来,已有许多参数、算法发表,对B细胞蛋白抗原表位研究起到巨
, 百拇医药
大的推动作用。现今已被大众认可并具有较好预测效果的方法,主要有6种:①亲水性方案
(Hydrophilicity),尤以Hopp &Woods方案最为有名。认为蛋白抗原各AA残基可分为亲水残基和疏
水残基两类。在机体内,疏水性残基一般埋在蛋白内部,而亲水性残基位于表面,因此蛋白的亲水
部位与蛋白的抗原位点有密切的联系。Hopp&Woods方案是以残基由有机相环境转移到水相环境的自
由能为依据计算各个AA的亲水性。现已明确,亲水性部位与表位并无很好的一致性,即高亲水部位
不一定是表位,表位也不一定是亲水性部位[7]。②可及性方案(Accessibility),指蛋白抗原中
, 百拇医药
AA残基被溶剂分子接触的可能性,它反映了蛋白抗原内、外各层各残基的分布组成。③抗原性方案
(Antigenicity)。认为除亲水性AA残基外,疏水性AA残基也经常出现在表位中,各残基在蛋白抗原
位点中的相对出现率对抗原表位的定位预测有一定意义。许多蛋白抗原表位研究已证实,疏水性AA
残基对表位形成亦有贡献。④可塑性方案(Flexibility)。指蛋白抗原构象不是刚性不变的,其多
肽骨架有一定程度的活动性。⑤电荷分布方案(Charge distribution)。认为对碱性抗原特异的抗
体多趋于酸性,对酸性抗原特异的抗体多趋于碱性。但现在理解电荷作用引起的只是非特异性结
, http://www.100md.com 合。⑥二级结构预测(Secondary structure)。认为β转角结构为凸出结构,多出现在蛋白抗原表
面,利于与抗体嵌合,较可能成为抗原表位。α螺旋、β片层结构规则,不易变形,较难嵌合抗
体,一般不作为抗原位点[8,9]。预测B细胞蛋白抗原表位一般以上述多种方案综合考虑,尤以可
及性方案、可塑性方案、抗原性方案及二级结构预测为重要。概括而言,作为B细胞蛋白抗原的表
位首先应易于位于或移动于蛋白抗原表面,有利于与B细胞抗原受体或抗体结合,另外,要有一定
柔韧性,因为抗原与抗原受体或抗体结合有一个嵌合的过程。
Fas抗原能引起免疫应答的表位(功能性表位)位于其胞外区,其跨膜区和胞内区因存在空间位
, 百拇医药
阻,不能成为其功能性表位。H-Fas抗原胞外区157个AA,分子量为(17.573+8)×103u(8×103u为存在
的潜在的糖链分子量),理论上应存在4~6个功能性表位,即能被B细胞识别,或与抗体结合。经过
可及性方案、可塑性方案以及抗原性方案、二级结构预测、表位分析预测等综合考虑可能位于N-末
端AA残基51~78,102~110,145~157等区域内或它们附近。这是一个比较粗的预测结果,只是排
除了一些不易成为H-Fas抗原表位的肽段。至于其精细表位(4~9个AA残基)的确定可以在明确表位
所在区域后,进一步采用交叠肽合成方法分析,并随分析的进行,合成的交叠肽逐渐缩短,以至最
, 百拇医药
后确定H-Fas抗原的精细表位[10]。
从实验结果看,抗人Fas mAb均不识别P14和P34合成肽段,说明具有诱导PCD的抗人Fas mAb所
作用的H-Fas抗原表位不在靠近N末端的100个AA内。已有实验证实,H-Fas抗原N-末端49个AA与Fas
抗原三聚化(Trimerization)有关,是特异性FasL与Fas抗原结合并诱导PCD的部位[11]。即能起生
物学功能作用的抗人Fas mAb识别的H-Fas抗原表位在靠近胞膜区的50个AA左右的区域内。这50个AA
左右区域内的某些表位是具有诱导PCD的抗人Fas mAb作用域,根据其MW估计,可能有1~3个功能性
, 百拇医药
表位。精确分析、明确这1~3个表位,对H-Fas抗原死亡信号传导具有重要意义。
H-Fas抗原靠近胞膜区的50个AA左右的区域根据上述预测方案分析,可能有2个表位形成区,即
N-末端AA残基102~110,145~157,但由于这一区域有2个潜在的N-糖基化位点
(Asn-X-Ser/Thr,102位和120位),对表位形成有一定影响,可能会改变或形成新的表位。因此,具
有诱导PCD的抗人Fas mAb所作用的H-Fas抗原表位在N-末端AA残基100~157区域内。这与已证实抗
人Fas mAb CH-11所作用的表位在N-末端AA残基126~135部位相一致[12]。能够诱导细胞凋亡的抗
, 百拇医药
人Fas mAb所作用的H-Fas抗原表位可以界定在N-末端AA残基100~157区域内,至于其作用的精细表
位还待进一步研究。
全军“九五”重点项目,No.96Z038
作者简介:宋建勋,男,32岁,讲师,博士
参考文献
1 Nagata S, Golstein P. The Fas death factor. Science,1995,267(5023):1449
2 Ju S T, Panka D J, Cui H, et al. Fas (CD95)/FasL interactions required for programmed cell death after
, 百拇医药
T-cell activation. Nature,1995,373(6513):444
3 朱锡华.Fas系统研究进展.中华微生物学与免疫学杂志,1996,16(2):77
4 宋建勋,朱锡华.Fas抗原表位与死亡信号传导的关系.免疫学杂志,1997,13(3):206
5 Itoh N, Yonehara S, Ishil A, et al. The polypeptide encoded by the cDNA for human cell surface antigen
Fas can mediate apoptosis. Cell,1991,66(4):233
6 Oehm A, Behrmann I, Falk W, et al. Purification and molecular cloning of the Apo-1 cell surface antigen, a
, http://www.100md.com
member of the tumor necrosis factor/nerve growth factor receptor superfamily. J Biol Chem,1992,267(15):10709
7 吴玉章,朱锡华.蛋白质抗原表位的研究.科学,1994,185(1):93
8 Shih D T, Boettiger D, Buck C A. Epitopes of adhesion-perturbing monoclonal antibodies map within a
predicted alpha-helical domain of the integrin beta 1 subunit. J Cell Sci,1997,110(20):2619
9 Barlow D J, Edwards M S, Thornton J M, et al. Continuous and discontinuous protein antigenic
, 百拇医药
determinants. Nature,1986,322(6081):747
10 Gershoni J M, Stem B, Venisova G. Combinatorial libraries, epitope structure and the prediction of protein
conformations. Immunol Today,1997,18(3):108
11 Papoff G, Cascino I, Eramo A, et al. An N-terminal domain shared by Fas/Apo-1 (CD95) soluble variants
prevents cell death in vitro. J Immunol,1996,156(3):4623
12 Fadeel B, Thorpe C J, Chrodi F, et al. Mapping of the linear site on the Fas/Apo-1 molecule targeted by
the prototype anti-Fas mAb. Int Immunol,1995,7(10):1967
(收稿:1998-06-27;修回:1990-01-11), 百拇医药