诱导性一氧化氮合酶抑制药对感染性休克犬生化影响的观察
作者:宋冰冰 王俊科 盛卓人 崔涌 孙新艳
单位:中国医科大学第一临床学院麻醉科,沈阳 110001
关键词:休克,感染性;氨基胍;肝脏;肾脏;组织灌注
摘要 目的 摘要 目的:研究诱导性一氧化氮合酶抑制药氨基胍(AG)对感染性休克犬生化的影响。方法:杂种犬在2 h输注内毒素(LPS, 1 mg/kg),在血压下降至基础值60% 2 h后随机分为LPS(组Ⅰ)组,LPS+L-NAME(组Ⅱ)组和LPS+AG(组Ⅲ)组,分别给予生理盐水,L-NAME(30 mg/kg)和AG(20 mg/kg)。分别监测血中NO、血乳酸、丙氨酸转氨酶(LAT)、门冬氨酸转氨酶、尿素氮和血糖。观察到给予治疗后4 h。结果:平均动脉压下降2 h后,3组的血NO、乳酸、尿素氮、门冬氨酸转氨酶和丙氨酸转氨酶明显增加,血糖明显减少。给予治疗后,组Ⅱ乳酸、尿素氮、门冬氨酸转氨酶和丙氨酸转氨酶均明显高于其它两组(P<0.05);血糖在各时间段均明显减少。组Ⅲ乳酸、尿素氮、丙氨酸转氨酶明显低于其它两组(P<0.05);血糖明显增高(P<0.05)。结论:选择性地抑制iNOS减少NO的产生对感染休克的治疗效果好于非选择性地抑制NOS。
, 百拇医药
The Study of Inducible Nitric Oxide Synthase Inhibitor on Biochemistry of Dogs in Septic Shock
Song Bingbing, Wang Junke, Sheng Zhuoren, et al
Department of Anesthesiology,The First Clinical College, China Medical University, Shenyang, 110001
ABSTRACT Objective:This paper was designed to investigate the effects of Aminoguanidine (AG), an inducible nitric oxide synthase (iNOS) inhibitor, on biochemistry aspect of dogs in septic shock. Method:The dogs were infused with lipopolysaccharide (LPS, 1 mg/kg) in 2 hours after intravenous and intraartery intubation. After the mean artery pressure (MAP) decreased to 60% of the baseline for 2 hours, the dogs were randomely divided into LPS (n=6, group Ⅰ),LPS+L-NAME (n=6,groupⅡ) and LPS+AG (n=6,group Ⅲ) group, which were injected with normal saline, L-NAME (30 mg/kg) and AG (20 mg/kg), respectively. Artery blood was drawn for detecting NO, lactate, blood urine nitrogen (BUN), ALT, AST, and glucose. Results: As MAP decreased to 60% of the baseline, NO increased, the lactate, BUN, ALT and AST also increased, but glucose decreased which occurred 2 hours later following administration. The lactate, BUN, ALT and AST continued to increase, and were much higher than the other two groups (P<0.05), but glucose continued to decrease after injection of L-NAME, The lactate, BUN and ALT which decreased after injection of AG in the group Ⅲ, were much lower than that in the two other groups. Conclusion:Selectively inhibiting iNOS with AG to reduce the output of NO had better effect in the treatment of septic shock.
, 百拇医药
KEY WORDS septic shock; aminoguanidine; liver; renal; tissue perfusion
细菌及其毒素侵袭人体导致感染性休克发生时常常表现为低血压、低外周血管阻力、组织灌注不良,而这与毒素激活一氧化氮合酶(nitric oxide synthase, NOS)引起一氧化氮(nitric oxide, NO)释放增多有密切关系。但研究发现使用非选择性NOS抑制药L-N-位硝基精氨甲酯(L-N-nitro argininemethyl ester, L-NAME)可引起血管的过度收缩,影响受试动物的生存率和肝肾功能。本实验研究选择性的诱导性NOS(inducible nitric oxide, iNOS)抑制药氨基胍(aminoguanidine, AG)对感染性休克动物生化指标的影响。
1 材料与方法
1.1 试剂 内毒素(lipopolysaccharide, LPS,上海第二军医大学微生物教研室)、L-NAME(Sigma)、AG(Sigma)。
, http://www.100md.com
1.2 实验步骤 杂种犬18只(8~12 kg),异戊巴比妥钠麻醉后行股动静脉插管分别监测动脉压和输液(8ml/kg.h-1 输乳酸钠林格液)。稳定30min后(0h)在2h内给予LPS(1mg/kg),以平均动脉压(mean artery pressure, MAP)下降至基础的60%作为休克的标准。达到休克标准2h(3h,给予LPS后3h)后将受试动物随机分为3组:LPS组(n=6,组Ⅰ):仍按8ml/kg输乳酸钠林格液;LPS+L-NAME(n=6,组Ⅱ)和LPS+AG(n=6, 组Ⅲ)组分别于10 min内静注L—NAME(30mg/kg)和AG(20mg/kg)。在 0h、3h及治疗后每2h(5h和7h)抽血测量血中NO含量,血乳酸、丙氨酸转氨酶(LAT)、门冬氨酸转氨酶(AST)、尿素氮(BUN)和血糖。
2 结果
给予LPS后 1h MAP即下降到基础值的60%,NO明显升高。MAP下降2h后(即给予LPS后3 h),3组的血乳酸、BUN、AST和ALT明显增加,血糖明显减少。
, 百拇医药
给予L-NAME后,组Ⅱ乳酸、AST、ALT呈进行性恶化趋势,明显高于其它两组;BUN在5h时略有减少,在7h时增加;血糖在各时间段均明显减少。
给予AG后,组Ⅲ乳酸、BUN、ALT有明显减少,且明显低于组Ⅰ和组Ⅱ;AST有减少的趋势,但无明显差异。血糖的升高虽无统计学差异,但明显高于其它两组。治疗后除血糖外的各值均高于基础值。
组Ⅰ各生化指标在各时间段均呈恶化趋势(见表1)。
表1 组Ⅰ、组Ⅱ、组Ⅲ血中NO、乳酸、尿素氮、血糖、AST、ALT值(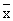 ±s)
±s)
时间(h)
, 百拇医药
分组
NO(μg/L)
乳酸(mmol/L)
尿量(ml/kg.h-1)
尿素氮(mmol/L)
血糖(mmol/L)
AST(u/L)
ALT(u/L)
0
Ⅰ
35.28±10.28
, http://www.100md.com 1.05±0.28
3.84±2.12
6.1±2.67
5.17±0.67
34.50±16.68
35.52±1092
Ⅱ
29.65±8.14
0.95±0.23
3.17±1.0
5.4±1.52
5.43±0.8
, http://www.100md.com
39.71±9.92
33.12±11.81
Ⅲ
42.25±9.87
1.10±0.27
3.35±0.8
6.4±2.63
5.71±0.55
45.73±13.71
41.78±23.24
Ⅰ
125.10±18.99*
, http://www.100md.com
4.49±1.15*
1.18±0.26*
22.2±3.17*
3.40±0.78*
99.43±32.29*
109.60±23.19*
3
Ⅱ
145.33±19.56*
4.60±0.34*
, http://www.100md.com
1.25±0.19*
22.7±4.48*
3.83±0.77*
127.23±35.58*
116.51±15.45*
Ⅲ
130.65±20.65*
4.97±1.33*
1.36±0.16*
, 百拇医药 24.2±5.55*
3.29±0.49*
112.87±32.51*
121.69±42.03*
Ⅰ
225.23±40.98*▲#
6.01±1.25*
1.48±0.74*
5.46±0.64*#
, 百拇医药 2.49±0.53
126.38±49.75
134.81±20.95*
5
Ⅱ
45.69±18.78*
5.46±0.64*▲
1.33±0.98*
21.45±3.56
2.66±0.48#▲
, 百拇医药 220.28±80.98*#▲
141.37±35.98▲
Ⅲ
87.29±36.98*#
3.43±1.33*#▲
3.22±1.28*#▲
14.54±3.56▲
4.19±0.23▲
87.16±26.30
97.34±14.50*#▲
, 百拇医药
Ⅰ
88.54±21.74▲
6.88±1.17*▲
1.06±0.68*
33.78±4.12*
1.77±0.77
150.07±59.59
182.15±15.29*
7
Ⅱ
41.66±20.71*
, 百拇医药
6.50±0.73*▲
0.87±0.38*
24.43±8.7#
1.73±0.27▲
237.70±74.70
197.12±18.10▲*#
Ⅲ
55.85±22.91*
3.91±1.36*#▲
3.80±1.08*#▲
, http://www.100md.com
15.82±6.12*▲#
3.19±0.11*#
84.58±31.81*#
112.25±22.25*
*与给予LPS前比较,P<0.05▲与给予处理因素前比较,P<0.05#相同时点各组间比较,P<0.05
3 讨论
感染性休克时细菌内毒素可引起肿瘤坏死因子、白细胞介素等炎症介质的释放,进而激活NOS,导致NO的大量合成。NO可通过激活cGMP合成酶合成cGMP,引起血管扩张,血压下降[1]。在人血管内皮细胞中有两种NOS,一种为结构性(constitutive nitric oxide synthase, cNOS),在正常情况下即有活性,产生一定量的NO,维持正常的血管张力、血压和组织灌注。在感染性休克早期cNOS即被激活,NO合成增加,导致程度较轻的血压下降。另一种NOS为iNOS,在生理状态下不具有活性,在机体受内毒素侵袭3~4 h后才被激活,引起NO大量产生,导致延迟的严重的血压下降[2,3]。L-NAME是合成NO前体物质L-精氨酸的同型物,它可同时抑制cNOS和iNOS,明显减少NO的产生,收缩血管,同时升高体循环血压和肺动脉压,减少心输出量。AG是特异的iNOS抑制药,仅抑制iNOS的活性,而对cNOS无明显影响,因此它虽也可明显减少NO的产生,但程度明显小于L-NAME,在升高血压的同时对肺动脉压无明显影响,不影响心输出量[4,5]。组织灌注的好坏、脏器功能的维持不仅与血压有关,更重要的是有一良好的心输出量和适宜的血管张力。否则即使血压正常,但血管过度收缩、心输出量减少,仍可引起组织乏氧,不能满足氧耗,造成无氧代谢增加。动脉血乳酸值是反映器官乏氧的敏感指标,其高低代表组织灌注不足的程度。而肾脏功能与心输出量和血管的状态关系更密切,研究发现肾局部使用10-5mmol/L的L-NAME,近曲小动脉直径减少了17%,皮质出球小动脉直径减少了13%~16%,使肾皮质和近球小动脉的血流减少[6]。阻滞NO的合成可损害肾脏的排泄功能,肾小球滤过率和尿量均明显减少[7]。本研究中Ⅱ组乳酸值和BUN较给予L-NAME前进一步增加,尿量减少,较Ⅰ组无明显改善,就是L-NAME在减少NO的同时也引起血管明显收缩,造成组织灌注不良引起的。给予AG后乳酸和BUN值均降低,尿量增加,与AG只抑制iNOS,保留cNOS的功能,不引起血管的过度收缩和心输出量的减少,对组织灌注影响较小有关。
, 百拇医药
研究表明L-NAME可使因NO增加所扩张的肝动脉、门静脉明显收缩,造成动脉壁增厚,管腔变小,肝血管窦狭窄[8],这均减少了肝脏的血液供应。Harbrecht报道L-NAME可加重LPS引起的肝脏功能的损伤,而L-精氨酸可使之减轻[9]。另有研究发现NO虽一方面引起血管扩张,动静脉短路开放,造成组织供氧不足;另一方面它还可防止血小板的聚集和中性粒细胞脱颗粒,防止血液淤滞和某些炎症介质的释放[10]。我们的另一研究发现L-NAME明显减慢肠系膜微动脉血流速度,使动脉收缩甚至细于基础值[11];而AG虽收缩肠系膜微动脉,但不引起血管的明显收缩,不减慢血流速度,肝细胞结构较组Ⅰ有明显改善[11]。从本研究可见组ⅡALT、AST、血糖进一步恶化,甚至差于组Ⅰ,而组Ⅲ肝脏功能有明显好转,这与L-NAME可明显减少肝脏的血液供应,AG影响较少有关。因此AG对改善肝脏功能有重要作用,而此作用主要与AG不影响cNOS的活性,不导致血管的过度收缩,血流速度明显减慢有关。
, 百拇医药
总之,在感染休克中NO释放明显增加,选择性iNOS抑制药氨基胍因不抑制cNOS不引起血管的过度收缩和心输出量的明显减少,可改善肝肾功能和组织灌注。cNOS介导的NO对维持良好的脏器功能具有重要作用。
卫生部科研基金资助项目,3202100016
参考文献
1 Palmer RMJ. The discovery of nitric oxide in the vessel wall. A unifying concept on the pathogenesis of sepsis. Arch Surg, 1993, 128: 396-402
2 Moncada S, Higgs EA. The L-Arginine nitric oxide pathway. New Eng J Med, 1993, 329: 2002-2003
, 百拇医药
3 Moncada S, Palmer PRJ, Higgs EA. Nitric oxide: physiology, pathophysiology and pharmacology. Pharmacol Rev, 1991, 43: 109-115
4 宋冰冰,王俊科,盛卓人,等.诱导性一氧化氮合酶抑制药对感染性休克治疗的观察.中华麻醉学杂志,1998, 18: 91—93
5 Griffiths MD, Messent M, Curzen NP, et al. Aminoguanidine selectively decrease cyclic GMP levels produced by inducible nitric oxide synthase. Am J Respir Crit Care Med, 1995, 1600_1607
6 Hoffend H, Cavarape A, Endlich K, et al. Influence of endothelium-derived relaxing factor on renal microvessels and pressure-dependent vasodilation. Am J Physiol, 1993, 265: F285-289
, 百拇医药
7 Granger JP, Alberola AM, Salazar FJ, et al. Control of renal hemodynamics during intrarenal and systemic blockade of nitric oxide synthesis in conscious dogs. J Cardiovasc Pharmacol, 1992, 20(Suppl 12): S160-165
8 Ayuse T, Brienza N, Revelly JP, et al. Role of nitric oxide in porcine liver circulation under normal and endotoxemic condition. J Apply Physiol, 1995, 78: 1319-1325
9 Harbrecht BG, Billiar TR, Stadler J, et al. Nitric oxide synthesis serves to reduce hepatic damage during acute murine endotoxemis. Crit Care Med, 1992, 20: 1568-1572
10 Radomski MW, Palmer RMJ, Moncada S. Endogenous nitric oxide inhibits human platelet adhesion to vascular endothelium. Lancet, 1987, Ⅱ: 1057—1063
11 宋冰冰,王俊科,盛卓人,等.诱导性一氧化氮合酶抑制药对感染性休克兔肠系膜微循环的影响.中华麻醉学杂志,1998,18: 286—288
1998-12-09收稿, 百拇医药
单位:中国医科大学第一临床学院麻醉科,沈阳 110001
关键词:休克,感染性;氨基胍;肝脏;肾脏;组织灌注
摘要 目的 摘要 目的:研究诱导性一氧化氮合酶抑制药氨基胍(AG)对感染性休克犬生化的影响。方法:杂种犬在2 h输注内毒素(LPS, 1 mg/kg),在血压下降至基础值60% 2 h后随机分为LPS(组Ⅰ)组,LPS+L-NAME(组Ⅱ)组和LPS+AG(组Ⅲ)组,分别给予生理盐水,L-NAME(30 mg/kg)和AG(20 mg/kg)。分别监测血中NO、血乳酸、丙氨酸转氨酶(LAT)、门冬氨酸转氨酶、尿素氮和血糖。观察到给予治疗后4 h。结果:平均动脉压下降2 h后,3组的血NO、乳酸、尿素氮、门冬氨酸转氨酶和丙氨酸转氨酶明显增加,血糖明显减少。给予治疗后,组Ⅱ乳酸、尿素氮、门冬氨酸转氨酶和丙氨酸转氨酶均明显高于其它两组(P<0.05);血糖在各时间段均明显减少。组Ⅲ乳酸、尿素氮、丙氨酸转氨酶明显低于其它两组(P<0.05);血糖明显增高(P<0.05)。结论:选择性地抑制iNOS减少NO的产生对感染休克的治疗效果好于非选择性地抑制NOS。
, 百拇医药
The Study of Inducible Nitric Oxide Synthase Inhibitor on Biochemistry of Dogs in Septic Shock
Song Bingbing, Wang Junke, Sheng Zhuoren, et al
Department of Anesthesiology,The First Clinical College, China Medical University, Shenyang, 110001
ABSTRACT Objective:This paper was designed to investigate the effects of Aminoguanidine (AG), an inducible nitric oxide synthase (iNOS) inhibitor, on biochemistry aspect of dogs in septic shock. Method:The dogs were infused with lipopolysaccharide (LPS, 1 mg/kg) in 2 hours after intravenous and intraartery intubation. After the mean artery pressure (MAP) decreased to 60% of the baseline for 2 hours, the dogs were randomely divided into LPS (n=6, group Ⅰ),LPS+L-NAME (n=6,groupⅡ) and LPS+AG (n=6,group Ⅲ) group, which were injected with normal saline, L-NAME (30 mg/kg) and AG (20 mg/kg), respectively. Artery blood was drawn for detecting NO, lactate, blood urine nitrogen (BUN), ALT, AST, and glucose. Results: As MAP decreased to 60% of the baseline, NO increased, the lactate, BUN, ALT and AST also increased, but glucose decreased which occurred 2 hours later following administration. The lactate, BUN, ALT and AST continued to increase, and were much higher than the other two groups (P<0.05), but glucose continued to decrease after injection of L-NAME, The lactate, BUN and ALT which decreased after injection of AG in the group Ⅲ, were much lower than that in the two other groups. Conclusion:Selectively inhibiting iNOS with AG to reduce the output of NO had better effect in the treatment of septic shock.
, 百拇医药
KEY WORDS septic shock; aminoguanidine; liver; renal; tissue perfusion
细菌及其毒素侵袭人体导致感染性休克发生时常常表现为低血压、低外周血管阻力、组织灌注不良,而这与毒素激活一氧化氮合酶(nitric oxide synthase, NOS)引起一氧化氮(nitric oxide, NO)释放增多有密切关系。但研究发现使用非选择性NOS抑制药L-N-位硝基精氨甲酯(L-N-nitro argininemethyl ester, L-NAME)可引起血管的过度收缩,影响受试动物的生存率和肝肾功能。本实验研究选择性的诱导性NOS(inducible nitric oxide, iNOS)抑制药氨基胍(aminoguanidine, AG)对感染性休克动物生化指标的影响。
1 材料与方法
1.1 试剂 内毒素(lipopolysaccharide, LPS,上海第二军医大学微生物教研室)、L-NAME(Sigma)、AG(Sigma)。
, http://www.100md.com
1.2 实验步骤 杂种犬18只(8~12 kg),异戊巴比妥钠麻醉后行股动静脉插管分别监测动脉压和输液(8ml/kg.h-1 输乳酸钠林格液)。稳定30min后(0h)在2h内给予LPS(1mg/kg),以平均动脉压(mean artery pressure, MAP)下降至基础的60%作为休克的标准。达到休克标准2h(3h,给予LPS后3h)后将受试动物随机分为3组:LPS组(n=6,组Ⅰ):仍按8ml/kg输乳酸钠林格液;LPS+L-NAME(n=6,组Ⅱ)和LPS+AG(n=6, 组Ⅲ)组分别于10 min内静注L—NAME(30mg/kg)和AG(20mg/kg)。在 0h、3h及治疗后每2h(5h和7h)抽血测量血中NO含量,血乳酸、丙氨酸转氨酶(LAT)、门冬氨酸转氨酶(AST)、尿素氮(BUN)和血糖。
2 结果
给予LPS后 1h MAP即下降到基础值的60%,NO明显升高。MAP下降2h后(即给予LPS后3 h),3组的血乳酸、BUN、AST和ALT明显增加,血糖明显减少。
, 百拇医药
给予L-NAME后,组Ⅱ乳酸、AST、ALT呈进行性恶化趋势,明显高于其它两组;BUN在5h时略有减少,在7h时增加;血糖在各时间段均明显减少。
给予AG后,组Ⅲ乳酸、BUN、ALT有明显减少,且明显低于组Ⅰ和组Ⅱ;AST有减少的趋势,但无明显差异。血糖的升高虽无统计学差异,但明显高于其它两组。治疗后除血糖外的各值均高于基础值。
组Ⅰ各生化指标在各时间段均呈恶化趋势(见表1)。
表1 组Ⅰ、组Ⅱ、组Ⅲ血中NO、乳酸、尿素氮、血糖、AST、ALT值(
时间(h)
, 百拇医药
分组
NO(μg/L)
乳酸(mmol/L)
尿量(ml/kg.h-1)
尿素氮(mmol/L)
血糖(mmol/L)
AST(u/L)
ALT(u/L)
0
Ⅰ
35.28±10.28
, http://www.100md.com 1.05±0.28
3.84±2.12
6.1±2.67
5.17±0.67
34.50±16.68
35.52±1092
Ⅱ
29.65±8.14
0.95±0.23
3.17±1.0
5.4±1.52
5.43±0.8
, http://www.100md.com
39.71±9.92
33.12±11.81
Ⅲ
42.25±9.87
1.10±0.27
3.35±0.8
6.4±2.63
5.71±0.55
45.73±13.71
41.78±23.24
Ⅰ
125.10±18.99*
, http://www.100md.com
4.49±1.15*
1.18±0.26*
22.2±3.17*
3.40±0.78*
99.43±32.29*
109.60±23.19*
3
Ⅱ
145.33±19.56*
4.60±0.34*
, http://www.100md.com
1.25±0.19*
22.7±4.48*
3.83±0.77*
127.23±35.58*
116.51±15.45*
Ⅲ
130.65±20.65*
4.97±1.33*
1.36±0.16*
, 百拇医药 24.2±5.55*
3.29±0.49*
112.87±32.51*
121.69±42.03*
Ⅰ
225.23±40.98*▲#
6.01±1.25*
1.48±0.74*
5.46±0.64*#
, 百拇医药 2.49±0.53
126.38±49.75
134.81±20.95*
5
Ⅱ
45.69±18.78*
5.46±0.64*▲
1.33±0.98*
21.45±3.56
2.66±0.48#▲
, 百拇医药 220.28±80.98*#▲
141.37±35.98▲
Ⅲ
87.29±36.98*#
3.43±1.33*#▲
3.22±1.28*#▲
14.54±3.56▲
4.19±0.23▲
87.16±26.30
97.34±14.50*#▲
, 百拇医药
Ⅰ
88.54±21.74▲
6.88±1.17*▲
1.06±0.68*
33.78±4.12*
1.77±0.77
150.07±59.59
182.15±15.29*
7
Ⅱ
41.66±20.71*
, 百拇医药
6.50±0.73*▲
0.87±0.38*
24.43±8.7#
1.73±0.27▲
237.70±74.70
197.12±18.10▲*#
Ⅲ
55.85±22.91*
3.91±1.36*#▲
3.80±1.08*#▲
, http://www.100md.com
15.82±6.12*▲#
3.19±0.11*#
84.58±31.81*#
112.25±22.25*
*与给予LPS前比较,P<0.05▲与给予处理因素前比较,P<0.05#相同时点各组间比较,P<0.05
3 讨论
感染性休克时细菌内毒素可引起肿瘤坏死因子、白细胞介素等炎症介质的释放,进而激活NOS,导致NO的大量合成。NO可通过激活cGMP合成酶合成cGMP,引起血管扩张,血压下降[1]。在人血管内皮细胞中有两种NOS,一种为结构性(constitutive nitric oxide synthase, cNOS),在正常情况下即有活性,产生一定量的NO,维持正常的血管张力、血压和组织灌注。在感染性休克早期cNOS即被激活,NO合成增加,导致程度较轻的血压下降。另一种NOS为iNOS,在生理状态下不具有活性,在机体受内毒素侵袭3~4 h后才被激活,引起NO大量产生,导致延迟的严重的血压下降[2,3]。L-NAME是合成NO前体物质L-精氨酸的同型物,它可同时抑制cNOS和iNOS,明显减少NO的产生,收缩血管,同时升高体循环血压和肺动脉压,减少心输出量。AG是特异的iNOS抑制药,仅抑制iNOS的活性,而对cNOS无明显影响,因此它虽也可明显减少NO的产生,但程度明显小于L-NAME,在升高血压的同时对肺动脉压无明显影响,不影响心输出量[4,5]。组织灌注的好坏、脏器功能的维持不仅与血压有关,更重要的是有一良好的心输出量和适宜的血管张力。否则即使血压正常,但血管过度收缩、心输出量减少,仍可引起组织乏氧,不能满足氧耗,造成无氧代谢增加。动脉血乳酸值是反映器官乏氧的敏感指标,其高低代表组织灌注不足的程度。而肾脏功能与心输出量和血管的状态关系更密切,研究发现肾局部使用10-5mmol/L的L-NAME,近曲小动脉直径减少了17%,皮质出球小动脉直径减少了13%~16%,使肾皮质和近球小动脉的血流减少[6]。阻滞NO的合成可损害肾脏的排泄功能,肾小球滤过率和尿量均明显减少[7]。本研究中Ⅱ组乳酸值和BUN较给予L-NAME前进一步增加,尿量减少,较Ⅰ组无明显改善,就是L-NAME在减少NO的同时也引起血管明显收缩,造成组织灌注不良引起的。给予AG后乳酸和BUN值均降低,尿量增加,与AG只抑制iNOS,保留cNOS的功能,不引起血管的过度收缩和心输出量的减少,对组织灌注影响较小有关。
, 百拇医药
研究表明L-NAME可使因NO增加所扩张的肝动脉、门静脉明显收缩,造成动脉壁增厚,管腔变小,肝血管窦狭窄[8],这均减少了肝脏的血液供应。Harbrecht报道L-NAME可加重LPS引起的肝脏功能的损伤,而L-精氨酸可使之减轻[9]。另有研究发现NO虽一方面引起血管扩张,动静脉短路开放,造成组织供氧不足;另一方面它还可防止血小板的聚集和中性粒细胞脱颗粒,防止血液淤滞和某些炎症介质的释放[10]。我们的另一研究发现L-NAME明显减慢肠系膜微动脉血流速度,使动脉收缩甚至细于基础值[11];而AG虽收缩肠系膜微动脉,但不引起血管的明显收缩,不减慢血流速度,肝细胞结构较组Ⅰ有明显改善[11]。从本研究可见组ⅡALT、AST、血糖进一步恶化,甚至差于组Ⅰ,而组Ⅲ肝脏功能有明显好转,这与L-NAME可明显减少肝脏的血液供应,AG影响较少有关。因此AG对改善肝脏功能有重要作用,而此作用主要与AG不影响cNOS的活性,不导致血管的过度收缩,血流速度明显减慢有关。
, 百拇医药
总之,在感染休克中NO释放明显增加,选择性iNOS抑制药氨基胍因不抑制cNOS不引起血管的过度收缩和心输出量的明显减少,可改善肝肾功能和组织灌注。cNOS介导的NO对维持良好的脏器功能具有重要作用。
卫生部科研基金资助项目,3202100016
参考文献
1 Palmer RMJ. The discovery of nitric oxide in the vessel wall. A unifying concept on the pathogenesis of sepsis. Arch Surg, 1993, 128: 396-402
2 Moncada S, Higgs EA. The L-Arginine nitric oxide pathway. New Eng J Med, 1993, 329: 2002-2003
, 百拇医药
3 Moncada S, Palmer PRJ, Higgs EA. Nitric oxide: physiology, pathophysiology and pharmacology. Pharmacol Rev, 1991, 43: 109-115
4 宋冰冰,王俊科,盛卓人,等.诱导性一氧化氮合酶抑制药对感染性休克治疗的观察.中华麻醉学杂志,1998, 18: 91—93
5 Griffiths MD, Messent M, Curzen NP, et al. Aminoguanidine selectively decrease cyclic GMP levels produced by inducible nitric oxide synthase. Am J Respir Crit Care Med, 1995, 1600_1607
6 Hoffend H, Cavarape A, Endlich K, et al. Influence of endothelium-derived relaxing factor on renal microvessels and pressure-dependent vasodilation. Am J Physiol, 1993, 265: F285-289
, 百拇医药
7 Granger JP, Alberola AM, Salazar FJ, et al. Control of renal hemodynamics during intrarenal and systemic blockade of nitric oxide synthesis in conscious dogs. J Cardiovasc Pharmacol, 1992, 20(Suppl 12): S160-165
8 Ayuse T, Brienza N, Revelly JP, et al. Role of nitric oxide in porcine liver circulation under normal and endotoxemic condition. J Apply Physiol, 1995, 78: 1319-1325
9 Harbrecht BG, Billiar TR, Stadler J, et al. Nitric oxide synthesis serves to reduce hepatic damage during acute murine endotoxemis. Crit Care Med, 1992, 20: 1568-1572
10 Radomski MW, Palmer RMJ, Moncada S. Endogenous nitric oxide inhibits human platelet adhesion to vascular endothelium. Lancet, 1987, Ⅱ: 1057—1063
11 宋冰冰,王俊科,盛卓人,等.诱导性一氧化氮合酶抑制药对感染性休克兔肠系膜微循环的影响.中华麻醉学杂志,1998,18: 286—288
1998-12-09收稿, 百拇医药