溴化乙啶-端粒重复扩增法检测端粒酶活性
作者:伍勇 陈正炎 唐银
单位:湖南医科大学附属湘雅医院检验科
关键词:端粒酶;溴化乙啶;聚合酶链反应;肿瘤
临床检验杂志990506 摘要 为了建立一种能够适合于临床需要的检测端粒酶活性的方法,我们以溴化乙啶染色来显示PCR产物的电泳结果,并将对结果有显著影响的实验条件进行优化。确定了本法的最佳实验条件为:37°C的延伸温度,PCR循环数为40次,样品所含蛋白浓度为0.75 g/L。实验结果表明本法特异性好(90%)、灵敏度高(87%)、时间短、费用低、易操作、无放射性危害,便于广泛开展。
端粒(telomere)是由一段重复DNA序列组成的一种特殊结构,它位于真核细胞染色体末端[1]。端粒酶(telomerase)是一种以自身RNA为模板,在染色体3末端合成端粒DNA的寡核苷酸蛋白复合物[2]。本文介绍的溴化乙啶-端粒重复扩增法(Ethidium bromide-telomeric repeat amplification protocol,EB-TRAP)克服了上述不足,便于各级医院开展,能直接为临床服务。
, 百拇医药
1 材料
1.1 雄性昆明小鼠睾丸(湖南医科大学动物学部)。
1.2 43例胃粘膜活检标本(湖南医科大学附三医院和湖南省肿瘤医院提供)。
1.3 主要试剂 洗涤液[10 mmol/L HEPES-KOH(pH 7.5),1.0 mmol/L DTT,1.0 mmol/L MgCl2,10 mmol/L KCl];溶解液[10 mmol/L Tris-HCl(pH 7.5),1.0 mmol/L MgCl2,1.0 mmol/L EGTA,0.1 mmol/L PMSF,5.0 mmol/L BME,0.5% CHAPS,10%甘油(重蒸馏)];10×TRAP buffer[20 mmol/L Tris-HCl(pH 8.3),1.5mmol/L MgCl2,63 mmol/L KCl,0.005% Tween-20,1.0 mmol/L EGTA];TS引物(5'-AATCCGTG AGCAGAGTT-3')和CX引物(5'-(CCCTTA)3CCCTAA-3'][3];0.5 μg/ml溴化乙啶(ethidium bromide,EB)。
, 百拇医药
1.4 主要仪器 ZHP-2B型PCR扩增仪;ZF-3型紫外透射反射分析仪;CS-930型双波长薄层扫描仪。
2 方法
2.1 初步建立EB-TRAP法
2.1.1 细胞提取物的制备[3] 选择日龄超过60天的性成熟雄性昆明小鼠,取其双侧睾丸,用冰冷的0.1 mmol/L PBS洗一次,在4°C条件下,3 500 r/min离心10 min,去上清液。沉淀物用冰冷的洗涤液重新悬起,再次清洗,并在上次清洗的同样条件下弃去上清液,将所得沉淀物置于-40°C冰箱中保存。将冰冻的沉淀物放入玻璃匀浆器中,在冰浴中匀浆10 min后,按5 μl/mg睾丸组织加入冰冷的溶解液,继续匀浆10 min,再冰浴30 min。在4°C条件下,以3 500 r/min离心30 min,取上清液(此即细胞提取物)。用酚试剂法测定其所含蛋白质浓度,提取物仍可再贮存于-40°C冰箱中。
, 百拇医药
2.1.2 端粒酶延伸TS引物及PCR扩增[4] 于冰箱中取出提取物,以冰冷的1×TRAP buffer稀释至其所含蛋白质浓度为3 g/L,此为待检样品。在10μl待检样品中加入1μg RNaseA,将其置于23°C孵育30 min,此为待检样品的阴性对照。在0.5 ml的塑料离心管中加入10×TRAP buffer 5 μl,四种0.5 mmol/L dNTP各5μl,A260=1.0的TS引物3 μl,0.1g/dl BSA 5μL,待检样品(或阴性对照)2μl,重蒸馏水11μl,石蜡油30 μl。于23°C延伸30 min后,再加入A260=1.0的CX引物3 μl,2 U/μl Taq DNA聚合酶1 μl,以94°C 30 s、50°C 30 s、72°C 1 min 30 s的参数循环27次,再72°C保温5 min后终止反应。
2.1.3 聚丙烯酰胺凝胶电泳[4] 制作0.9 mm厚度的15 g/dl聚丙烯酰胺凝胶,点样20 μl PCR产物,电泳缓冲液为0.5×TBE,电压恒为120 V,电泳6小时后取下胶膜,于0.5 μg/ml EB液中染色45 min后,于紫外透射仪上观察结果并记录。
, 百拇医药
2.2 EB-TRAP法的优化 试验中需要优化7个因素,每因素设2个水平:dNTP浓度(150/50 μmol/L);MgCl2终浓度(1.5/3.0 mmol/L);TS延伸的溶液pH(8.3/7.2);TS延伸时温度(23/37°C);待检样品蛋白质浓度(3.0/0.3g/L);TS(CX)用量(6/3μl);KCl终浓度(50/63 mmol/L);循环次数(35/27次)。根据各试验因素及水平,选择L16(215)正交表设计试验。将试验结果摄影后,于扫描仪上测定各区带吸光度值。在此基础上,再行待检样品稀释度(即样品蛋白质浓度)和循环数的进一步优化。
2.3 以EB-TRAP法检测43例胃粘膜活检标本的端粒酶活性。
3 结果
3.1 以EB-TRAP法检测端粒酶的阳性结果,为电泳后出现一系列的等距离条带,阴性结果无条带。见图1。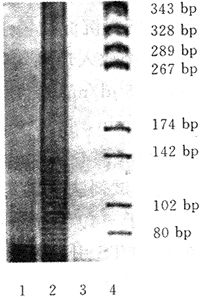
, 百拇医药
1.优化前的阳性结果;2.优化后的阳性结果
3.阴性对照;4.pGEM-7Zf(+)/HaeⅢ Markers
图1 EB-TRAP法检测端粒酶活性
3.2 将所测得的吸光度值分别作方差分析(F检验和配对t检验),发现端粒酶延伸TS的温度,待检样品蛋白质浓度,PCR的循环数对结果有显著影响(P<0.05或P<0.01)。进一步分析可知该方法最佳反应条件为:延伸温度37°C,循环数40次,样品蛋白浓度0.75 g/L。
3.3 以EB-TRAP法检测出43例胃粘膜活检标本的端粒酶活性的结果为:23例胃癌标本中,有20例呈阳性,阳性率为87%;7例胃癌前病变标本中,有2例呈阳性,阳性率为28.6%;10例浅表性胃炎和3例胃癌前疾病标本中无一例阳性,假阳性率为10%,经x2检验,显示胃癌标本端粒酶阳性率(87%)明显高于其它胃粘膜病变(P<0.005)。
, 百拇医药
4 讨论
用EB染色PCR产物的电泳结果来检测端粒酶活性的方法,通过设计一对独特的引物TS和CX,保证了检测的高度特异性;通过PCR反应,显著地增加了端粒酶延伸TS产物的量,极大地提高了检测端粒酶活性的灵敏度;采用去污剂溶解和物理破碎相结合来处理标本[5],能使端粒酶更充分地从细胞核中释放出来。
对试验的部分重要因素进行优化的结果表明:端粒酶延伸TS的温度、提取液蛋白质的浓度(即标本稀释度)、PCR循环数都对结果有显著影响。37°C既最适合TS延伸,又较易控制。循环数越大,扩增产物越多,但一般不能超过40次,否则,较易出现非特异性扩增。细胞提取物中的某些蛋白质能够抑制Taq DNA聚合酶的活性[6],所以,蛋白质浓度过高的标本,可能显示假阴性结果。但过度稀释待检样品,也将因端粒酶含量极低而同样出现假阴性结果。所以,确定标本中端粒酶检测的最适蛋白浓度很有必要。
, 百拇医药
小鼠与人类染色体端粒重复序列相同,均为TTAGGG,且性成熟的小鼠睾丸有较高的端粒酶活性[7],故本文将其作为阳性对照。要优化试验条件,其结果必须为量化指标。为解决这一问题,在进行优化试验的过程中,除需要优化的因素外,其它各试验因素在同一次试验的各管之间应尽量保持完全一致。这样,再通过在同一张照片上扫描试验结果而得到的吸光度值就可作为相对定量的指标。
参考文献
1 Blackburn E H.Structure and function of telomeres.Nature,1991,350:569
2 Greider C W,Blackbure E H.A telomeric sequence in the RNA of Tetrahymena telomerase required for telomere repeat synthesis.Nature,1989,337:331
, 百拇医药
3 Kim N W,Piatyszek M A,Prowse K R,et al.Specific association of human telomerase activity with immortal cells and cancer.Science 1994,266:2011
4 金冬雁,黎孟枫,等译.分子克隆实验指南.第2版.北京:科学出版社,1992.304
5 Counter C W,Avilion A A,LeFeuvre C E,et al.Telomere shortening associated with chromosome instability is arrested in immortal cells which express telomerase activity.EMBO J,1992,11:1921
6 Wright W E,Shay J W,Piatyszek M A.Modifications of the telomeric repeat amplification protocol(TRAP)result in increased reliability,lineaity and sensitivity,Nucleic Acids Res,1995,23:3794
7 Prowse K R,Greider C W.Developmental and tissue-specific regulation of mouse telomerase and ttlomere length.Proc Natl Acad Sci,USA,1995,92:4818
8 杨仕明,房殿春,罗光辉,等.胃粘膜活检标本端粒酶活性的检测.中华消化内镜杂志,1997,14:298
(1998-09-07收稿,1999-05-28修回), http://www.100md.com
单位:湖南医科大学附属湘雅医院检验科
关键词:端粒酶;溴化乙啶;聚合酶链反应;肿瘤
临床检验杂志990506 摘要 为了建立一种能够适合于临床需要的检测端粒酶活性的方法,我们以溴化乙啶染色来显示PCR产物的电泳结果,并将对结果有显著影响的实验条件进行优化。确定了本法的最佳实验条件为:37°C的延伸温度,PCR循环数为40次,样品所含蛋白浓度为0.75 g/L。实验结果表明本法特异性好(90%)、灵敏度高(87%)、时间短、费用低、易操作、无放射性危害,便于广泛开展。
端粒(telomere)是由一段重复DNA序列组成的一种特殊结构,它位于真核细胞染色体末端[1]。端粒酶(telomerase)是一种以自身RNA为模板,在染色体3末端合成端粒DNA的寡核苷酸蛋白复合物[2]。本文介绍的溴化乙啶-端粒重复扩增法(Ethidium bromide-telomeric repeat amplification protocol,EB-TRAP)克服了上述不足,便于各级医院开展,能直接为临床服务。
, 百拇医药
1 材料
1.1 雄性昆明小鼠睾丸(湖南医科大学动物学部)。
1.2 43例胃粘膜活检标本(湖南医科大学附三医院和湖南省肿瘤医院提供)。
1.3 主要试剂 洗涤液[10 mmol/L HEPES-KOH(pH 7.5),1.0 mmol/L DTT,1.0 mmol/L MgCl2,10 mmol/L KCl];溶解液[10 mmol/L Tris-HCl(pH 7.5),1.0 mmol/L MgCl2,1.0 mmol/L EGTA,0.1 mmol/L PMSF,5.0 mmol/L BME,0.5% CHAPS,10%甘油(重蒸馏)];10×TRAP buffer[20 mmol/L Tris-HCl(pH 8.3),1.5mmol/L MgCl2,63 mmol/L KCl,0.005% Tween-20,1.0 mmol/L EGTA];TS引物(5'-AATCCGTG AGCAGAGTT-3')和CX引物(5'-(CCCTTA)3CCCTAA-3'][3];0.5 μg/ml溴化乙啶(ethidium bromide,EB)。
, 百拇医药
1.4 主要仪器 ZHP-2B型PCR扩增仪;ZF-3型紫外透射反射分析仪;CS-930型双波长薄层扫描仪。
2 方法
2.1 初步建立EB-TRAP法
2.1.1 细胞提取物的制备[3] 选择日龄超过60天的性成熟雄性昆明小鼠,取其双侧睾丸,用冰冷的0.1 mmol/L PBS洗一次,在4°C条件下,3 500 r/min离心10 min,去上清液。沉淀物用冰冷的洗涤液重新悬起,再次清洗,并在上次清洗的同样条件下弃去上清液,将所得沉淀物置于-40°C冰箱中保存。将冰冻的沉淀物放入玻璃匀浆器中,在冰浴中匀浆10 min后,按5 μl/mg睾丸组织加入冰冷的溶解液,继续匀浆10 min,再冰浴30 min。在4°C条件下,以3 500 r/min离心30 min,取上清液(此即细胞提取物)。用酚试剂法测定其所含蛋白质浓度,提取物仍可再贮存于-40°C冰箱中。
, 百拇医药
2.1.2 端粒酶延伸TS引物及PCR扩增[4] 于冰箱中取出提取物,以冰冷的1×TRAP buffer稀释至其所含蛋白质浓度为3 g/L,此为待检样品。在10μl待检样品中加入1μg RNaseA,将其置于23°C孵育30 min,此为待检样品的阴性对照。在0.5 ml的塑料离心管中加入10×TRAP buffer 5 μl,四种0.5 mmol/L dNTP各5μl,A260=1.0的TS引物3 μl,0.1g/dl BSA 5μL,待检样品(或阴性对照)2μl,重蒸馏水11μl,石蜡油30 μl。于23°C延伸30 min后,再加入A260=1.0的CX引物3 μl,2 U/μl Taq DNA聚合酶1 μl,以94°C 30 s、50°C 30 s、72°C 1 min 30 s的参数循环27次,再72°C保温5 min后终止反应。
2.1.3 聚丙烯酰胺凝胶电泳[4] 制作0.9 mm厚度的15 g/dl聚丙烯酰胺凝胶,点样20 μl PCR产物,电泳缓冲液为0.5×TBE,电压恒为120 V,电泳6小时后取下胶膜,于0.5 μg/ml EB液中染色45 min后,于紫外透射仪上观察结果并记录。
, 百拇医药
2.2 EB-TRAP法的优化 试验中需要优化7个因素,每因素设2个水平:dNTP浓度(150/50 μmol/L);MgCl2终浓度(1.5/3.0 mmol/L);TS延伸的溶液pH(8.3/7.2);TS延伸时温度(23/37°C);待检样品蛋白质浓度(3.0/0.3g/L);TS(CX)用量(6/3μl);KCl终浓度(50/63 mmol/L);循环次数(35/27次)。根据各试验因素及水平,选择L16(215)正交表设计试验。将试验结果摄影后,于扫描仪上测定各区带吸光度值。在此基础上,再行待检样品稀释度(即样品蛋白质浓度)和循环数的进一步优化。
2.3 以EB-TRAP法检测43例胃粘膜活检标本的端粒酶活性。
3 结果
3.1 以EB-TRAP法检测端粒酶的阳性结果,为电泳后出现一系列的等距离条带,阴性结果无条带。见图1。

, 百拇医药
1.优化前的阳性结果;2.优化后的阳性结果
3.阴性对照;4.pGEM-7Zf(+)/HaeⅢ Markers
图1 EB-TRAP法检测端粒酶活性
3.2 将所测得的吸光度值分别作方差分析(F检验和配对t检验),发现端粒酶延伸TS的温度,待检样品蛋白质浓度,PCR的循环数对结果有显著影响(P<0.05或P<0.01)。进一步分析可知该方法最佳反应条件为:延伸温度37°C,循环数40次,样品蛋白浓度0.75 g/L。
3.3 以EB-TRAP法检测出43例胃粘膜活检标本的端粒酶活性的结果为:23例胃癌标本中,有20例呈阳性,阳性率为87%;7例胃癌前病变标本中,有2例呈阳性,阳性率为28.6%;10例浅表性胃炎和3例胃癌前疾病标本中无一例阳性,假阳性率为10%,经x2检验,显示胃癌标本端粒酶阳性率(87%)明显高于其它胃粘膜病变(P<0.005)。
, 百拇医药
4 讨论
用EB染色PCR产物的电泳结果来检测端粒酶活性的方法,通过设计一对独特的引物TS和CX,保证了检测的高度特异性;通过PCR反应,显著地增加了端粒酶延伸TS产物的量,极大地提高了检测端粒酶活性的灵敏度;采用去污剂溶解和物理破碎相结合来处理标本[5],能使端粒酶更充分地从细胞核中释放出来。
对试验的部分重要因素进行优化的结果表明:端粒酶延伸TS的温度、提取液蛋白质的浓度(即标本稀释度)、PCR循环数都对结果有显著影响。37°C既最适合TS延伸,又较易控制。循环数越大,扩增产物越多,但一般不能超过40次,否则,较易出现非特异性扩增。细胞提取物中的某些蛋白质能够抑制Taq DNA聚合酶的活性[6],所以,蛋白质浓度过高的标本,可能显示假阴性结果。但过度稀释待检样品,也将因端粒酶含量极低而同样出现假阴性结果。所以,确定标本中端粒酶检测的最适蛋白浓度很有必要。
, 百拇医药
小鼠与人类染色体端粒重复序列相同,均为TTAGGG,且性成熟的小鼠睾丸有较高的端粒酶活性[7],故本文将其作为阳性对照。要优化试验条件,其结果必须为量化指标。为解决这一问题,在进行优化试验的过程中,除需要优化的因素外,其它各试验因素在同一次试验的各管之间应尽量保持完全一致。这样,再通过在同一张照片上扫描试验结果而得到的吸光度值就可作为相对定量的指标。
参考文献
1 Blackburn E H.Structure and function of telomeres.Nature,1991,350:569
2 Greider C W,Blackbure E H.A telomeric sequence in the RNA of Tetrahymena telomerase required for telomere repeat synthesis.Nature,1989,337:331
, 百拇医药
3 Kim N W,Piatyszek M A,Prowse K R,et al.Specific association of human telomerase activity with immortal cells and cancer.Science 1994,266:2011
4 金冬雁,黎孟枫,等译.分子克隆实验指南.第2版.北京:科学出版社,1992.304
5 Counter C W,Avilion A A,LeFeuvre C E,et al.Telomere shortening associated with chromosome instability is arrested in immortal cells which express telomerase activity.EMBO J,1992,11:1921
6 Wright W E,Shay J W,Piatyszek M A.Modifications of the telomeric repeat amplification protocol(TRAP)result in increased reliability,lineaity and sensitivity,Nucleic Acids Res,1995,23:3794
7 Prowse K R,Greider C W.Developmental and tissue-specific regulation of mouse telomerase and ttlomere length.Proc Natl Acad Sci,USA,1995,92:4818
8 杨仕明,房殿春,罗光辉,等.胃粘膜活检标本端粒酶活性的检测.中华消化内镜杂志,1997,14:298
(1998-09-07收稿,1999-05-28修回), http://www.100md.com