人牙本质磷蛋白对小型猪修复性牙本质形成作用的实验研究
作者:欧阳勇 李玉晶 刘晓勇 邓惠 葛丽华
单位:100050首都医科大学附属北京口腔医院(欧阳勇现在中山医科大学口腔医学院,510060)
关键词:磷蛋白类;牙髓覆盖术;牙本质;继发性;猪;雏型
New Page 1 【摘要】 目的 观察人牙本质磷蛋白(dentin phosphoprotein,DPP)对修复性牙本质形成的诱导作用,进一步研究DPP的功能。方法 用人DPP粉作盖髓剂,对小型猪健康恒牙进行盖髓实验,对照组采用氢氧化钙和空白对照(氧化锌丁香油糊剂盖髓),通过组织病理学观察牙本质桥的形成。结果DPP盖髓术后2周,穿髓孔下固有牙髓细胞分化为类造牙本质细胞,分布在已形成的修复性牙本质团块周围;术后1个月有完整的修复性牙本质桥形成;术后3个月修复性牙本质桥增厚且结构致密,主要是管样牙本质,其下方排列分化好的造牙本质细胞。氢氧化钙盖髓组,术后2周界面有炎症坏死区,只有少量的钙质团块形成,1~3个月逐渐形成完整的修复性牙本质桥,但较DPP盖髓后形成修复性牙本质的速度慢且量较少。结论 人DPP对牙髓刺激性小,可以直接诱导牙髓细胞分化及修复性牙本质形成,提示DPP在牙本质发育和修复的生物矿化中起重要作用。
, http://www.100md.com
Experimental study on the effect of restorative dentin formation with human dentin phosphoprotein in immature permanent teeth of minipig
OUYANG Yong, LI Yujing, LIU Xiaoyong, et al.
School of Stomatology, Sun Yat-Sen University of Medical Sciences, Guangzhou 510060
【Abstract】 Objective To investigate the function of human dentin phosphoprotein(DPP) on dentine mineralization in vivo. Methods Pulp capping with human DPP was made in the permanent teeth of minipigs with calcium hydroxide and zinc oxide eugenol cement as controls. The minipigs were sacrificed at intervals of 14,30,90 days respectively after operation.Results The histopathological results revealed that pulp cells had developed into odontoblastoid cells around the major restorative dentin body after two weeks. There was complete restorative dentin bridge a month later. The bridge became thick and dense, and mainly was tubular dentin in 3 month. There were well developed odontoblasts under the bridge. In the calcium hydroxide capping group, inflammatory cytonecrosis zone was found in the surface of dental pulp and only a little calcial bodies formed in two weeks. Complete restorative dentin bridge was formed in 1 to 3 months, the speed of dentin bridge formation was not as quick as that of DPP group. Conclusion DPP can induce pulp cells to develop into odontoblasts and formation of dentin bridge with little stimulation to the dental pulp. This study suggests that DPP plays an important role in the biomineralization of dentin development and restoration.
, 百拇医药
【Key words】 Phosphoproteins Dental pulp capping Dentin,secondary Swine,miniature
牙本质磷蛋白(dentinphos phoprotein,DPP)是非胶原蛋白的重要成分,它在牙本质形成过程中的生物诱导作用已被许多研究所证实[1,2]。体外实验表明,DPP与Ca2+有很高的亲和力[3];在饱和磷酸钙溶液中能够诱导羟磷灰石晶体的形成,尤其是当其与固相支持物结合后能够明显诱导矿物形成[1],但对其在体内的研究却很少。我们在完成对人DPP的提取、纯化及对其性质分析的基础上,通过动物实验观察DPP对修复性牙本质的诱导作用,进一步探讨DPP的功能。
材料与方法
, 百拇医药 1.牙本质磷蛋白的提取与纯化:将经过充分洗涤的人牙本质粉用0.6mol/LHCl脱矿,使用DEAE-SepharoseCL6B离子交换层析柱分离纯化DPP,并冻干成粉。
2.实验动物:选择健康1周岁龄中国实验用小型猪5只,体重14~26kg,雄性3只,雌性2只,由北京农业大学提供。实验选择上、下颌第一恒磨牙,共20颗,双侧下颌侧切牙共10颗。实验分组:按盖髓术后观察时间不同分为2周组(2只)、1个月组(2只)及3个月组(1只)。将每只小型猪的4颗第一恒磨牙随机分配,2颗牙做DPP盖髓,1颗牙做氢氧化钙盖髓,1颗牙做对照(氧化锌丁香油糊剂盖髓)。同时随机选择下颌侧切牙分别做DPP或氢氧化钙盖髓。
3.其他试剂:①氢氧化钙(化学纯,北京市朝阳区旭东化工厂);②复方噻胺酮(军事医学科学院毒物药物研究所提供);③氧化锌(分析纯,上海化学试剂厂);④丁香油(化学纯,北京化学试剂公司);⑤磷酸锌水门汀(上海齿科材料厂)。
, 百拇医药
4.实验步骤:
(1)实验用小型猪用复方噻胺酮按1ml/10kg耳后肌肉注射麻醉,充分清洁口周及口腔。2%碘酊消毒实验牙及牙周组织,用带有完善冷却装置的高速涡轮机裂钻在实验磨牙面备洞,下颌侧切牙分别备Ⅴ类洞,谨慎穿髓,穿髓孔2~3mm,生理盐水反复冲洗,充分止血。
(2)盖髓处理:①每只小型猪随机选2颗恒磨牙,用冻干的DPP粉覆盖于穿髓孔,其上用氧化锌丁香油糊剂垫底,磷酸锌水门汀充填。②选1颗恒磨牙,用氢氧化钙糊剂盖髓,氧化锌丁香油糊剂垫底,磷酸锌水门汀充填。③选1颗恒磨牙直接用氧化锌丁香油糊剂盖髓,磷酸锌水门汀充填。④下颌侧切牙随机分别用氢氧化钙和DPP覆盖,氧化锌水门汀垫底,磷酸锌水门汀充填。术中严格无菌操作。
(3)分别于术后2周、4周及3个月处死动物,迅速取下实验用牙和对照牙、编号、10%福尔马林固定。固定前去除充填物,或远离手术区、侧向穿髓。
, http://www.100md.com
(4)组织病理学观察:盐酸、甲酸、氯化钠混合脱钙液微波脱钙,梯度酒精脱水,常规石蜡包埋连续切片,片厚5μm。HE染色,光镜下观察。
结果
1.DDP盖髓2周组:盖髓剂下方牙髓纤维细胞增生,有修复性牙本质形成,呈粉染团块状,相互连接,部分团块基质较致密,部分团块中有少数细胞,呈骨样牙本质。团块周围有整齐排列的单层方形或矮柱状的类造牙本质细胞。修复性牙本质下方及根髓内毛细血管扩张充血,并有少量炎症细胞(图1)。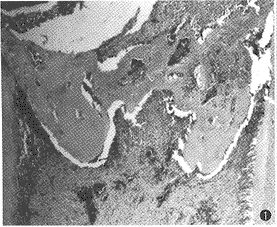
图1 DPP盖髓术后2周,有不完整的修复性牙本质形成(HE ×13)
2.DPP盖髓1个月组:可见大量修复性牙本质团块,呈桥形分布,部分牙齿已形成完整的修复性牙本质桥封闭穿髓孔。其修复性牙本质基质均匀、致密,并可见牙本质小管,个别牙修复性牙本质内可见少量细胞埋入。修复性牙本质周围有排列整齐的柱状造牙本质细胞,其下方可见牙髓除有纤维母细胞及毛细血管增生外基本正常。个别穿髓孔未完全封闭,有明显的修复性牙本质从两侧向中心生长的趋势,修复性牙本质与牙本质结合部连接紧密。
, http://www.100md.com
3.DPP盖髓3个月组:均有完整的修复性牙本质桥形成,将穿髓孔封闭;牙本质桥结构致密,大部分为管状牙本质,桥下方可见排列整齐的造牙本质细胞,其下牙髓正常,偶见轻度毛细血管扩张(图2)。
图2 DPP盖髓术后3个月,牙本质桥髓侧造牙本质细胞排列整齐,修复性牙本质内牙本质小管较规则(HE ×33)
4.氢氧化钙盖髓术后2周牙齿,穿髓孔下方可见薄层牙髓坏死,其下纤维母细胞增生,偶见少量钙化团块形成,周围有方形类造牙本质细胞,牙髓内炎症细胞浸润明显,组织内有少量血管增生、充血。盖髓术后1个月的牙齿,可见修复性牙本质团块形成,结构较致密,呈管样牙本质,周围有柱状造牙本质细胞,但无完整的牙本质桥形成,修复性牙本质下方牙髓充血,有少量炎症细胞。盖髓术后3个月,可见完整的修复性牙本质桥形成,形态不规则,呈管样牙本质,与原发性牙本质结合紧密,牙髓正常。
, 百拇医药
5.对照组:术后2周的牙齿,穿髓孔下方炎症细胞浸润明显,血管扩张,部分牙髓坏死,无修复性牙本质形成;术后1个月,髓腔内可见少量不规则钙化团块,周围有类造牙本质细胞,无完整牙本质桥形成;术后3个月,修复性牙本质形成,形态不规则,周围有造牙本质细胞,仍未完全封闭穿髓孔。
讨论
修复性牙本质与原发性牙本质形成过程相似,包括细胞分化、造牙本质细胞分泌胶原基质及生物矿化[4]。目前认为这一过程有很多因素参与调控,如特异性蛋白、BMP及多种生长因子。近年来许多研究表明,牙本质非胶原蛋白(尤其是DPP)与牙本质的形成有密切关系。DPP作为牙本质非胶原蛋白的最重要组成成分,占非胶原蛋白的50%左右,是牙本质中最具矿化活性的基质蛋白质之一,在牙本质矿化过程中起重要作用[5]。本研究结果显示,2周时DPP盖髓牙就出现了大片钙化组织基质团块,形成不完整的修复性牙本质桥,术后1个月,DPP组即出现了完整的修复性牙本质桥,封闭穿髓孔。术后3个月所形成的修复性牙本质桥完整,结构致密,且形成大量的管样牙本质,并与原发性牙本质结合紧密,周围造牙本质细胞排列整齐。其诱导修复性牙本质形成的速度超过氢氧化钙及对照组。这表明DPP有显著的诱导牙本质细胞分化及诱导修复性牙本质形成的能力。
, http://www.100md.com
很多研究已证明,牙髓创伤或切除后,在无菌条件下会形成牙本质桥[4]。氢氧化钙本身具有诱导或加速修复性牙本质桥形成的作用,是目前所公认并已广泛在临床上应用的良好盖髓剂之一。但本研究结果充分说明,DPP与氢氧化钙比较,更具有组织不良刺激性小,促进细胞迅速分化和胶原分泌及较强的诱导矿化作用。
国外一些研究认为,DPP可诱导固有牙髓细胞分化为造牙本质细胞并参与牙髓细胞代谢,促进基质分泌及矿化过程[6]。DPP富含磷酸化丝氨酸和天门冬氨酸,与Ca2+的结合能力很强[3]。在体外实验中,当DPP与胶原基质结合后,能诱导羟磷灰石晶体的形成,并促进矿物晶体的生长,从而诱导矿化形成[7,8]。另外,Lussi及Linde[9]将DPP与AH-Sepharose结合后,植入小型猪皮下观察,发现DPP能诱导矿物形成;vandenBos和Beertsen[10]将鼠牙DPP与脱钙牛皮质骨胶原片结合后植于Wistar鼠的颅骨皮下,发现结合DPP的脱钙骨胶原片诱导矿化的速度较未结合DPP的快许多,且面积广泛。从本研究DPP盖髓的组织学变化也可以看出,穿髓孔下牙髓细胞在DPP诱导下较早分化为类造牙本质细胞,后逐渐分化为造牙本质细胞,胶原基质分泌逐渐增加,矿化时先形成骨样牙本质,再逐渐形成管样修复性牙本质。在此过程中,DPP不象Ca(OH)2有较明显的炎症、坏死过程,而是在接触牙髓后直接发挥诱导作用。
, 百拇医药
因此,DPP诱导修复性牙本质形成的作用可能是多方面的,其确切机制目前尚待进一步探讨。本研究将有助于我们深入了解和认识DPP在牙本质乃至整个牙齿生长发育过程中的作用,以及在预防、治疗龋病和牙髓病,尤其是在活髓保存方面的意义。
北京市自然科学基金资助课题
参考文献
1 Linde A, Lussi A, Crenshaw MA. Mineral induction by immobilized polyanionic proteins. Calcif Tissue Int, 1989,44:286-295.
2 Lussi A, Crenshaw MA, Linde A. Induction and inhibition of hydroxyapatite formation by rat dentine phosphoprotein in vitro. Arch Oral Biol, 1988,33:685-691.
, http://www.100md.com
3 Lee SL, Veis A ,Glonek T. Dentin phosphoprotein: an extracellular Calcium-binding protein. Biochemistry, 1977,16:2971-2979.
4 吴海珍. 牙本质桥的研究概况. 国外医学口腔医学分册, 1991,18:86-90.
5 Linde A. Dentin matrix proteins: composition and possible function in calcification. Anat Rec, 1989,224:154-166.
6 Robey PG. Vertebrate mineralized matrix proteins: structure and function. Connect Tissue Res,1996,35(1-4):131-136.
, 百拇医药
7 Satoyoshi M, Koizumi T, Teranaka T, et al. Extracellular processing of dentin matrix protein in the mineralizing odontoblast culture. Calcif Tissue Int, 1995,57:237-241.
8 Hunter GK, Hanschka PV, Poole AR, et al .Nucleation and inhibition of hydroxyapatite formation by mineralized tissue proteins. Biochem J, 1996,317(Pt 1):59-64.
9 Lussi A, Linde A. Mineral induction in vivo by dentine proteins. Caries Res,1993,27:241-248.
10 van den Bos T, Beertsen W. Bound phosphoproteins enhance mineralization of alkaline phosphatase-collagen complexes in vivo. J Bone Miner Res, 1994,9:1205-1209.
(收稿:1998-08-13 修回:1998-11-24), 百拇医药
单位:100050首都医科大学附属北京口腔医院(欧阳勇现在中山医科大学口腔医学院,510060)
关键词:磷蛋白类;牙髓覆盖术;牙本质;继发性;猪;雏型
New Page 1 【摘要】 目的 观察人牙本质磷蛋白(dentin phosphoprotein,DPP)对修复性牙本质形成的诱导作用,进一步研究DPP的功能。方法 用人DPP粉作盖髓剂,对小型猪健康恒牙进行盖髓实验,对照组采用氢氧化钙和空白对照(氧化锌丁香油糊剂盖髓),通过组织病理学观察牙本质桥的形成。结果DPP盖髓术后2周,穿髓孔下固有牙髓细胞分化为类造牙本质细胞,分布在已形成的修复性牙本质团块周围;术后1个月有完整的修复性牙本质桥形成;术后3个月修复性牙本质桥增厚且结构致密,主要是管样牙本质,其下方排列分化好的造牙本质细胞。氢氧化钙盖髓组,术后2周界面有炎症坏死区,只有少量的钙质团块形成,1~3个月逐渐形成完整的修复性牙本质桥,但较DPP盖髓后形成修复性牙本质的速度慢且量较少。结论 人DPP对牙髓刺激性小,可以直接诱导牙髓细胞分化及修复性牙本质形成,提示DPP在牙本质发育和修复的生物矿化中起重要作用。
, http://www.100md.com
Experimental study on the effect of restorative dentin formation with human dentin phosphoprotein in immature permanent teeth of minipig
OUYANG Yong, LI Yujing, LIU Xiaoyong, et al.
School of Stomatology, Sun Yat-Sen University of Medical Sciences, Guangzhou 510060
【Abstract】 Objective To investigate the function of human dentin phosphoprotein(DPP) on dentine mineralization in vivo. Methods Pulp capping with human DPP was made in the permanent teeth of minipigs with calcium hydroxide and zinc oxide eugenol cement as controls. The minipigs were sacrificed at intervals of 14,30,90 days respectively after operation.Results The histopathological results revealed that pulp cells had developed into odontoblastoid cells around the major restorative dentin body after two weeks. There was complete restorative dentin bridge a month later. The bridge became thick and dense, and mainly was tubular dentin in 3 month. There were well developed odontoblasts under the bridge. In the calcium hydroxide capping group, inflammatory cytonecrosis zone was found in the surface of dental pulp and only a little calcial bodies formed in two weeks. Complete restorative dentin bridge was formed in 1 to 3 months, the speed of dentin bridge formation was not as quick as that of DPP group. Conclusion DPP can induce pulp cells to develop into odontoblasts and formation of dentin bridge with little stimulation to the dental pulp. This study suggests that DPP plays an important role in the biomineralization of dentin development and restoration.
, 百拇医药
【Key words】 Phosphoproteins Dental pulp capping Dentin,secondary Swine,miniature
牙本质磷蛋白(dentinphos phoprotein,DPP)是非胶原蛋白的重要成分,它在牙本质形成过程中的生物诱导作用已被许多研究所证实[1,2]。体外实验表明,DPP与Ca2+有很高的亲和力[3];在饱和磷酸钙溶液中能够诱导羟磷灰石晶体的形成,尤其是当其与固相支持物结合后能够明显诱导矿物形成[1],但对其在体内的研究却很少。我们在完成对人DPP的提取、纯化及对其性质分析的基础上,通过动物实验观察DPP对修复性牙本质的诱导作用,进一步探讨DPP的功能。
材料与方法
, 百拇医药 1.牙本质磷蛋白的提取与纯化:将经过充分洗涤的人牙本质粉用0.6mol/LHCl脱矿,使用DEAE-SepharoseCL6B离子交换层析柱分离纯化DPP,并冻干成粉。
2.实验动物:选择健康1周岁龄中国实验用小型猪5只,体重14~26kg,雄性3只,雌性2只,由北京农业大学提供。实验选择上、下颌第一恒磨牙,共20颗,双侧下颌侧切牙共10颗。实验分组:按盖髓术后观察时间不同分为2周组(2只)、1个月组(2只)及3个月组(1只)。将每只小型猪的4颗第一恒磨牙随机分配,2颗牙做DPP盖髓,1颗牙做氢氧化钙盖髓,1颗牙做对照(氧化锌丁香油糊剂盖髓)。同时随机选择下颌侧切牙分别做DPP或氢氧化钙盖髓。
3.其他试剂:①氢氧化钙(化学纯,北京市朝阳区旭东化工厂);②复方噻胺酮(军事医学科学院毒物药物研究所提供);③氧化锌(分析纯,上海化学试剂厂);④丁香油(化学纯,北京化学试剂公司);⑤磷酸锌水门汀(上海齿科材料厂)。
, 百拇医药
4.实验步骤:
(1)实验用小型猪用复方噻胺酮按1ml/10kg耳后肌肉注射麻醉,充分清洁口周及口腔。2%碘酊消毒实验牙及牙周组织,用带有完善冷却装置的高速涡轮机裂钻在实验磨牙面备洞,下颌侧切牙分别备Ⅴ类洞,谨慎穿髓,穿髓孔2~3mm,生理盐水反复冲洗,充分止血。
(2)盖髓处理:①每只小型猪随机选2颗恒磨牙,用冻干的DPP粉覆盖于穿髓孔,其上用氧化锌丁香油糊剂垫底,磷酸锌水门汀充填。②选1颗恒磨牙,用氢氧化钙糊剂盖髓,氧化锌丁香油糊剂垫底,磷酸锌水门汀充填。③选1颗恒磨牙直接用氧化锌丁香油糊剂盖髓,磷酸锌水门汀充填。④下颌侧切牙随机分别用氢氧化钙和DPP覆盖,氧化锌水门汀垫底,磷酸锌水门汀充填。术中严格无菌操作。
(3)分别于术后2周、4周及3个月处死动物,迅速取下实验用牙和对照牙、编号、10%福尔马林固定。固定前去除充填物,或远离手术区、侧向穿髓。
, http://www.100md.com
(4)组织病理学观察:盐酸、甲酸、氯化钠混合脱钙液微波脱钙,梯度酒精脱水,常规石蜡包埋连续切片,片厚5μm。HE染色,光镜下观察。
结果
1.DDP盖髓2周组:盖髓剂下方牙髓纤维细胞增生,有修复性牙本质形成,呈粉染团块状,相互连接,部分团块基质较致密,部分团块中有少数细胞,呈骨样牙本质。团块周围有整齐排列的单层方形或矮柱状的类造牙本质细胞。修复性牙本质下方及根髓内毛细血管扩张充血,并有少量炎症细胞(图1)。

图1 DPP盖髓术后2周,有不完整的修复性牙本质形成(HE ×13)
2.DPP盖髓1个月组:可见大量修复性牙本质团块,呈桥形分布,部分牙齿已形成完整的修复性牙本质桥封闭穿髓孔。其修复性牙本质基质均匀、致密,并可见牙本质小管,个别牙修复性牙本质内可见少量细胞埋入。修复性牙本质周围有排列整齐的柱状造牙本质细胞,其下方可见牙髓除有纤维母细胞及毛细血管增生外基本正常。个别穿髓孔未完全封闭,有明显的修复性牙本质从两侧向中心生长的趋势,修复性牙本质与牙本质结合部连接紧密。
, http://www.100md.com
3.DPP盖髓3个月组:均有完整的修复性牙本质桥形成,将穿髓孔封闭;牙本质桥结构致密,大部分为管状牙本质,桥下方可见排列整齐的造牙本质细胞,其下牙髓正常,偶见轻度毛细血管扩张(图2)。

图2 DPP盖髓术后3个月,牙本质桥髓侧造牙本质细胞排列整齐,修复性牙本质内牙本质小管较规则(HE ×33)
4.氢氧化钙盖髓术后2周牙齿,穿髓孔下方可见薄层牙髓坏死,其下纤维母细胞增生,偶见少量钙化团块形成,周围有方形类造牙本质细胞,牙髓内炎症细胞浸润明显,组织内有少量血管增生、充血。盖髓术后1个月的牙齿,可见修复性牙本质团块形成,结构较致密,呈管样牙本质,周围有柱状造牙本质细胞,但无完整的牙本质桥形成,修复性牙本质下方牙髓充血,有少量炎症细胞。盖髓术后3个月,可见完整的修复性牙本质桥形成,形态不规则,呈管样牙本质,与原发性牙本质结合紧密,牙髓正常。
, 百拇医药
5.对照组:术后2周的牙齿,穿髓孔下方炎症细胞浸润明显,血管扩张,部分牙髓坏死,无修复性牙本质形成;术后1个月,髓腔内可见少量不规则钙化团块,周围有类造牙本质细胞,无完整牙本质桥形成;术后3个月,修复性牙本质形成,形态不规则,周围有造牙本质细胞,仍未完全封闭穿髓孔。
讨论
修复性牙本质与原发性牙本质形成过程相似,包括细胞分化、造牙本质细胞分泌胶原基质及生物矿化[4]。目前认为这一过程有很多因素参与调控,如特异性蛋白、BMP及多种生长因子。近年来许多研究表明,牙本质非胶原蛋白(尤其是DPP)与牙本质的形成有密切关系。DPP作为牙本质非胶原蛋白的最重要组成成分,占非胶原蛋白的50%左右,是牙本质中最具矿化活性的基质蛋白质之一,在牙本质矿化过程中起重要作用[5]。本研究结果显示,2周时DPP盖髓牙就出现了大片钙化组织基质团块,形成不完整的修复性牙本质桥,术后1个月,DPP组即出现了完整的修复性牙本质桥,封闭穿髓孔。术后3个月所形成的修复性牙本质桥完整,结构致密,且形成大量的管样牙本质,并与原发性牙本质结合紧密,周围造牙本质细胞排列整齐。其诱导修复性牙本质形成的速度超过氢氧化钙及对照组。这表明DPP有显著的诱导牙本质细胞分化及诱导修复性牙本质形成的能力。
, http://www.100md.com
很多研究已证明,牙髓创伤或切除后,在无菌条件下会形成牙本质桥[4]。氢氧化钙本身具有诱导或加速修复性牙本质桥形成的作用,是目前所公认并已广泛在临床上应用的良好盖髓剂之一。但本研究结果充分说明,DPP与氢氧化钙比较,更具有组织不良刺激性小,促进细胞迅速分化和胶原分泌及较强的诱导矿化作用。
国外一些研究认为,DPP可诱导固有牙髓细胞分化为造牙本质细胞并参与牙髓细胞代谢,促进基质分泌及矿化过程[6]。DPP富含磷酸化丝氨酸和天门冬氨酸,与Ca2+的结合能力很强[3]。在体外实验中,当DPP与胶原基质结合后,能诱导羟磷灰石晶体的形成,并促进矿物晶体的生长,从而诱导矿化形成[7,8]。另外,Lussi及Linde[9]将DPP与AH-Sepharose结合后,植入小型猪皮下观察,发现DPP能诱导矿物形成;vandenBos和Beertsen[10]将鼠牙DPP与脱钙牛皮质骨胶原片结合后植于Wistar鼠的颅骨皮下,发现结合DPP的脱钙骨胶原片诱导矿化的速度较未结合DPP的快许多,且面积广泛。从本研究DPP盖髓的组织学变化也可以看出,穿髓孔下牙髓细胞在DPP诱导下较早分化为类造牙本质细胞,后逐渐分化为造牙本质细胞,胶原基质分泌逐渐增加,矿化时先形成骨样牙本质,再逐渐形成管样修复性牙本质。在此过程中,DPP不象Ca(OH)2有较明显的炎症、坏死过程,而是在接触牙髓后直接发挥诱导作用。
, 百拇医药
因此,DPP诱导修复性牙本质形成的作用可能是多方面的,其确切机制目前尚待进一步探讨。本研究将有助于我们深入了解和认识DPP在牙本质乃至整个牙齿生长发育过程中的作用,以及在预防、治疗龋病和牙髓病,尤其是在活髓保存方面的意义。
北京市自然科学基金资助课题
参考文献
1 Linde A, Lussi A, Crenshaw MA. Mineral induction by immobilized polyanionic proteins. Calcif Tissue Int, 1989,44:286-295.
2 Lussi A, Crenshaw MA, Linde A. Induction and inhibition of hydroxyapatite formation by rat dentine phosphoprotein in vitro. Arch Oral Biol, 1988,33:685-691.
, http://www.100md.com
3 Lee SL, Veis A ,Glonek T. Dentin phosphoprotein: an extracellular Calcium-binding protein. Biochemistry, 1977,16:2971-2979.
4 吴海珍. 牙本质桥的研究概况. 国外医学口腔医学分册, 1991,18:86-90.
5 Linde A. Dentin matrix proteins: composition and possible function in calcification. Anat Rec, 1989,224:154-166.
6 Robey PG. Vertebrate mineralized matrix proteins: structure and function. Connect Tissue Res,1996,35(1-4):131-136.
, 百拇医药
7 Satoyoshi M, Koizumi T, Teranaka T, et al. Extracellular processing of dentin matrix protein in the mineralizing odontoblast culture. Calcif Tissue Int, 1995,57:237-241.
8 Hunter GK, Hanschka PV, Poole AR, et al .Nucleation and inhibition of hydroxyapatite formation by mineralized tissue proteins. Biochem J, 1996,317(Pt 1):59-64.
9 Lussi A, Linde A. Mineral induction in vivo by dentine proteins. Caries Res,1993,27:241-248.
10 van den Bos T, Beertsen W. Bound phosphoproteins enhance mineralization of alkaline phosphatase-collagen complexes in vivo. J Bone Miner Res, 1994,9:1205-1209.
(收稿:1998-08-13 修回:1998-11-24), 百拇医药