移植免疫中Th1/Th2的作用
作者:胡可斌 杨俊伟
单位:杨俊伟 南京军区南京总医院 解放军肾脏病研究所(南京,210002);胡可斌 南京大学医学院博士研究生
关键词:移植免疫;Th1/Th2细胞;免疫应答
肾脏病与透析肾移值杂志990517
1986年Mosmann与Coffman根据分泌细胞因子的差别,将小鼠CD4+T细胞进一步分为Th1与Th2细胞亚群[1]。Th1细胞亚群主要涉及细胞免疫,Th2细胞亚群多与体液免疫有关。在一定条件下,Th2型的细胞因子对Th1细胞亚群的发育与功能起拮抗作用,而Th1型的细胞因子亦可抑制Th2反应。本文将对Th1与Th2之间的这种矛盾关系及其在移植免疫,免疫耐受中的作用综述如下。
1 Th1与Th2轴(见附图)
, http://www.100md.com
Th1与Th2细胞亚群均来源于共同的Th0前体细胞,抗原呈递细胞(APC)可活化Th0细胞。遗传因素、抗原类型、剂量、有无佐剂以及抗原进入体内的途径,均可影响APC活化Th0细胞时的微环境,而微环境中细胞因子的类型决定Th0细胞是否分化为Th1细胞或Th2细胞。
在Th1细胞分化的早期阶段,巨噬细胞及树突状细胞在抗原或感染直接刺激下分泌IL-12的过程中起重要作用。分化的Th1细胞分泌IL-2,IFN-γ及淋巴毒素。这些细胞因子能促进细胞毒T细胞的发育成熟。细胞毒T细胞可通过迟发型超敏反应(DTH)及抗体依赖的细胞毒效应(ADCC)清除细胞内致病原或介导移植排斥反应。
初始型CD4+T细胞,在IL-4存在下被T细胞受体的配体活化而分化为Th2细胞。除初始型T细胞外,IL-4最初还来源于肥大细胞及NK1.1.+CD4+T细胞。分化的Th2细胞分泌IL-3,4,5,6,9,10及13并调节免疫球蛋白亚型的转化。在小鼠,Th2型免疫反应可刺激B细胞分泌IgE,IgG1并活化嗜酸细胞,从而促进抗蠕虫免疫反应及过敏反应。
, 百拇医药
研究表明,以Th1为主的免疫应答可抑制Th2为主的免疫应答,反之亦然。如Th1型细胞因子IFN-γ可阻断抗原诱导的Th2细胞的增殖,抑制IL-4,IL-5依赖的B细胞的分化。而IL-4通过拮抗IFN-γ的作用而抑制Th1细胞的发育。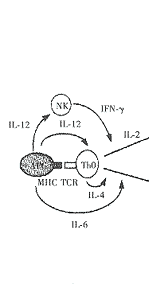

附图 Th1与Th2轴
Th0,Th1,Th2:T辅助细胞亚群;APC:抗原呈递细胞;NK:自然杀伤细胞;MΦ:巨噬细胞;B:B细胞;Ba:嗜碱细胞/肥大细胞;E:嗜酸细胞
2 Th1Th2与移植免疫
, http://www.100md.com 移植排斥反应据认为主要与Th1效应有关,而Th2效应却诱导移植免疫耐受。宿主对移植物的耐受可以通过将CD4+T细胞分化为Th2细胞而达到。事实上,采用经典的诱导免疫耐受的方法,即向出生不满24h的小鼠腹腔内注射抗原与福氏不全佐剂,可促发强烈的Th2型免疫应答[2]。但如在诱导期给小鼠应用抗IL-4单克隆抗体则可逆转免疫耐受。也有研究表明,小鼠移植免疫耐受是通过T抑制细胞介导的。此外,上述研究表明,移植免疫耐受是通过特定的T抑制细胞迁移至靶器官并在局部分泌Th2型细胞因子实现的。
既然Th1为主的免疫应答介导移植排斥反应,那么在无Th2型细胞因子排斥的移植物内应能检测到Th1型细胞因子。有报道,小鼠胰岛移植排斥反应的特征是移植物内有IL-2与IFN-γ的表达,而无IL-4mRNA的表达[3]。但未发现人移植肾的排斥与IL-2有关。然而有研究在已排斥或正在排斥的移植肾中检测到IL-4,在存活的小鼠移植肝中发现Th1(IL-2,IFN-γ)型与Th2(IL-4,IL-10)型细胞因子同时上调。但另一项研究只在正发生排斥的移植物中检测到这些细胞因子。
, 百拇医药
对于移植物中细胞因子表达模式的解释应慎重。免疫组化及细胞因子mRNA的检测,未考虑移植物中大多数产生细胞因子的浸润细胞并非抗原特异性细胞。而且,免疫组化检测到的细胞因子,除了能与分泌细胞因子的细胞结合,还可与受体阳性却不分泌细胞因子的细胞结合。尽管在用供体特异性的输血所致耐受的大鼠移植肾中可检测到IL-2mRNA,但移植物浸润细胞再受刺激时并不能分泌IL-2。最近的研究发现,特定的CD4+T细胞亚群表达特定的细胞因子受体:如Th2细胞表达C-C亚家族趋化因子受体3(CCR3)却不表达CCR5,Th1细胞则高表达CCR5[4,5]。利用这些细胞表面标志可更精确的对Th1与Th2细胞进行分析。
3 器官移植中Th1∶Th2平衡的调控
通过诱导Th2型免疫反应可促进移植物存活的假说,是以Th2型细胞因子能抑制Th1细胞亚群的分化与功能为基础的。IL-10是在移植中研究较广泛的一种Th2型细胞因子。有研究表明,经病毒IL-10基因转导的尚未血管化的新生小鼠心脏移植的生存期延长[6]。但用嵌有IL-10的蛋白处理小鼠却加速胰岛细胞的移植排斥。其可能的解释是IL-10不仅有免疫抑制作用,还可促进IL-2所致的CD8+T细胞的增殖及IL-2诱导的CD8+T细胞的细胞毒作用。另一种促进Th2型免疫应答的细胞因子为IL-4。但是IL-4基因转染肿瘤可导致T细胞依赖的肿瘤排斥反应,甚至发生在肿瘤移植的同时。而且IL-4也有一定的促炎症效应,如增加B细胞表面MHC Ⅱ类分子及B7的表达,内皮细胞表达细胞间粘附分子-1(ICAM-1)的表达及增强巨噬细胞的趋化作用。另外Th2型免疫应答促进慢性血管排斥。
, http://www.100md.com
那么典型Th1型细胞因子的缺乏与移植物存活期的延长确实有关吗?研究表明,将异源的胰岛细胞移植入IL-2基因敲除(knock out)的小鼠体内,所有IL-2基因敲除的小鼠均发生排斥反应,只是发生的速度较正常小鼠略慢[7]。另外,接受心脏,皮肤及胰岛移植的IFN-γ或IFN-γ受体基因敲除的小鼠均发生剧烈的排斥反应。
相反,通过阻断协同刺激信号途径却能获得移植物的存活。CD28-B7相互作用产生协同刺激信号是T细胞活化所必需,CD40-CD40L则可协同活化B细胞,巨噬细胞,内皮细胞及T细胞。同时阻断CD28与CD40协同刺激信号途径能有效抑制T细胞的克隆增殖,这一作用与小鼠皮肤或心脏移植的长期存活有关[8]。而且,这一手段能有效的阻止和逆转灵长类移植肾的急性排斥反应[9]。有趣的是,这两条协同刺激信号途径的阻断同时抑制了Th1型(IL-1,IFN-γ)与Th2型(IL-4,IL-10)细胞因子的表达[8]。
, http://www.100md.com
结论 Th1与Th2型的免疫应答代表了细胞因子功能向两个极端的分化。各细胞因子可介导多种生物学效应,既可促进炎症反应,也可拮抗炎症反应。这取决于细胞因子的浓度,效应细胞的类型,以及细胞因子在免疫应答过程中发挥作用的时间。另外,除细胞因子外,其它一些因素如APC及它们发出的协同刺激信号均可影响免疫应答的类型。近期研究表明,利用能同时阻断Th1与Th2型的免疫应答而非调控免疫应答向Th2型转化的免疫抑制治疗,能够延长移植物的存活期。
参考文献
1 Mosmann TR,Cherwinski HM,Bond MW et al.Two types of murine helper T cell clone.I.Definition according to profi les of lymphokine activities and secreted proteins.J Immunol,1986,136:2348
, http://www.100md.com
2 Forsthuber T,Yip HC,Lehmann PV.Inducti on of Th1 and Th2 immunity in neonatal m ice.Science,1996,271:1728
3 OConnel PJ,Pacheco-Silva A,Nickerson PW et al.Unmodified pancreatic islet a llograft rejection results in the prefer ential expression of certain T cell acti vation transcripts.J Immunol,1993,150:10 93
4 Sallusto F,Mackay CR,Lanzaveccia A.Sel ective eopression of the eotaxin recepto r CCR3 by human T helper 2 cells.Science ,1997,277:2005
, http://www.100md.com
5 Loetscher P,Uguccioni M,Bordoli L et al.CCR5 is characteristic of Th1 lympho cytes.Nature,1998,391:344
6 Qin L,Chavin KD,Ding Y et al.Retrovi rus-mediated transfer of viral IL-10 gen e prolongs murine cardiac allograft surv ival.J Immunol,1996,156:2316
7 Steiger J,Nickerson PW,Steurer W et a l.IL-2 knockout recipient mice reject i slet cell allografts.J Immunol,1995,155: 489
8 Larsen CP,Elwood ET,Alexander DZ et a l.Long-term acceptance of skin and card iac allografts after blocking CD40 and C D28 pathways.Nature,1996,381:434
9 Kirk AD,Harlan DM,Armstron NN et al. CDTLA-Ig and anti-CD40 ligand prevent re nal allograft rejection in primates.Proc Natl Acad Sci USA,1997,94:8789
(本文编辑 蒋 群)
(1999-08-14收稿), 百拇医药
单位:杨俊伟 南京军区南京总医院 解放军肾脏病研究所(南京,210002);胡可斌 南京大学医学院博士研究生
关键词:移植免疫;Th1/Th2细胞;免疫应答
肾脏病与透析肾移值杂志990517
1986年Mosmann与Coffman根据分泌细胞因子的差别,将小鼠CD4+T细胞进一步分为Th1与Th2细胞亚群[1]。Th1细胞亚群主要涉及细胞免疫,Th2细胞亚群多与体液免疫有关。在一定条件下,Th2型的细胞因子对Th1细胞亚群的发育与功能起拮抗作用,而Th1型的细胞因子亦可抑制Th2反应。本文将对Th1与Th2之间的这种矛盾关系及其在移植免疫,免疫耐受中的作用综述如下。
1 Th1与Th2轴(见附图)
, http://www.100md.com
Th1与Th2细胞亚群均来源于共同的Th0前体细胞,抗原呈递细胞(APC)可活化Th0细胞。遗传因素、抗原类型、剂量、有无佐剂以及抗原进入体内的途径,均可影响APC活化Th0细胞时的微环境,而微环境中细胞因子的类型决定Th0细胞是否分化为Th1细胞或Th2细胞。
在Th1细胞分化的早期阶段,巨噬细胞及树突状细胞在抗原或感染直接刺激下分泌IL-12的过程中起重要作用。分化的Th1细胞分泌IL-2,IFN-γ及淋巴毒素。这些细胞因子能促进细胞毒T细胞的发育成熟。细胞毒T细胞可通过迟发型超敏反应(DTH)及抗体依赖的细胞毒效应(ADCC)清除细胞内致病原或介导移植排斥反应。
初始型CD4+T细胞,在IL-4存在下被T细胞受体的配体活化而分化为Th2细胞。除初始型T细胞外,IL-4最初还来源于肥大细胞及NK1.1.+CD4+T细胞。分化的Th2细胞分泌IL-3,4,5,6,9,10及13并调节免疫球蛋白亚型的转化。在小鼠,Th2型免疫反应可刺激B细胞分泌IgE,IgG1并活化嗜酸细胞,从而促进抗蠕虫免疫反应及过敏反应。
, 百拇医药
研究表明,以Th1为主的免疫应答可抑制Th2为主的免疫应答,反之亦然。如Th1型细胞因子IFN-γ可阻断抗原诱导的Th2细胞的增殖,抑制IL-4,IL-5依赖的B细胞的分化。而IL-4通过拮抗IFN-γ的作用而抑制Th1细胞的发育。



附图 Th1与Th2轴
Th0,Th1,Th2:T辅助细胞亚群;APC:抗原呈递细胞;NK:自然杀伤细胞;MΦ:巨噬细胞;B:B细胞;Ba:嗜碱细胞/肥大细胞;E:嗜酸细胞
2 Th1Th2与移植免疫
, http://www.100md.com 移植排斥反应据认为主要与Th1效应有关,而Th2效应却诱导移植免疫耐受。宿主对移植物的耐受可以通过将CD4+T细胞分化为Th2细胞而达到。事实上,采用经典的诱导免疫耐受的方法,即向出生不满24h的小鼠腹腔内注射抗原与福氏不全佐剂,可促发强烈的Th2型免疫应答[2]。但如在诱导期给小鼠应用抗IL-4单克隆抗体则可逆转免疫耐受。也有研究表明,小鼠移植免疫耐受是通过T抑制细胞介导的。此外,上述研究表明,移植免疫耐受是通过特定的T抑制细胞迁移至靶器官并在局部分泌Th2型细胞因子实现的。
既然Th1为主的免疫应答介导移植排斥反应,那么在无Th2型细胞因子排斥的移植物内应能检测到Th1型细胞因子。有报道,小鼠胰岛移植排斥反应的特征是移植物内有IL-2与IFN-γ的表达,而无IL-4mRNA的表达[3]。但未发现人移植肾的排斥与IL-2有关。然而有研究在已排斥或正在排斥的移植肾中检测到IL-4,在存活的小鼠移植肝中发现Th1(IL-2,IFN-γ)型与Th2(IL-4,IL-10)型细胞因子同时上调。但另一项研究只在正发生排斥的移植物中检测到这些细胞因子。
, 百拇医药
对于移植物中细胞因子表达模式的解释应慎重。免疫组化及细胞因子mRNA的检测,未考虑移植物中大多数产生细胞因子的浸润细胞并非抗原特异性细胞。而且,免疫组化检测到的细胞因子,除了能与分泌细胞因子的细胞结合,还可与受体阳性却不分泌细胞因子的细胞结合。尽管在用供体特异性的输血所致耐受的大鼠移植肾中可检测到IL-2mRNA,但移植物浸润细胞再受刺激时并不能分泌IL-2。最近的研究发现,特定的CD4+T细胞亚群表达特定的细胞因子受体:如Th2细胞表达C-C亚家族趋化因子受体3(CCR3)却不表达CCR5,Th1细胞则高表达CCR5[4,5]。利用这些细胞表面标志可更精确的对Th1与Th2细胞进行分析。
3 器官移植中Th1∶Th2平衡的调控
通过诱导Th2型免疫反应可促进移植物存活的假说,是以Th2型细胞因子能抑制Th1细胞亚群的分化与功能为基础的。IL-10是在移植中研究较广泛的一种Th2型细胞因子。有研究表明,经病毒IL-10基因转导的尚未血管化的新生小鼠心脏移植的生存期延长[6]。但用嵌有IL-10的蛋白处理小鼠却加速胰岛细胞的移植排斥。其可能的解释是IL-10不仅有免疫抑制作用,还可促进IL-2所致的CD8+T细胞的增殖及IL-2诱导的CD8+T细胞的细胞毒作用。另一种促进Th2型免疫应答的细胞因子为IL-4。但是IL-4基因转染肿瘤可导致T细胞依赖的肿瘤排斥反应,甚至发生在肿瘤移植的同时。而且IL-4也有一定的促炎症效应,如增加B细胞表面MHC Ⅱ类分子及B7的表达,内皮细胞表达细胞间粘附分子-1(ICAM-1)的表达及增强巨噬细胞的趋化作用。另外Th2型免疫应答促进慢性血管排斥。
, http://www.100md.com
那么典型Th1型细胞因子的缺乏与移植物存活期的延长确实有关吗?研究表明,将异源的胰岛细胞移植入IL-2基因敲除(knock out)的小鼠体内,所有IL-2基因敲除的小鼠均发生排斥反应,只是发生的速度较正常小鼠略慢[7]。另外,接受心脏,皮肤及胰岛移植的IFN-γ或IFN-γ受体基因敲除的小鼠均发生剧烈的排斥反应。
相反,通过阻断协同刺激信号途径却能获得移植物的存活。CD28-B7相互作用产生协同刺激信号是T细胞活化所必需,CD40-CD40L则可协同活化B细胞,巨噬细胞,内皮细胞及T细胞。同时阻断CD28与CD40协同刺激信号途径能有效抑制T细胞的克隆增殖,这一作用与小鼠皮肤或心脏移植的长期存活有关[8]。而且,这一手段能有效的阻止和逆转灵长类移植肾的急性排斥反应[9]。有趣的是,这两条协同刺激信号途径的阻断同时抑制了Th1型(IL-1,IFN-γ)与Th2型(IL-4,IL-10)细胞因子的表达[8]。
, http://www.100md.com
结论 Th1与Th2型的免疫应答代表了细胞因子功能向两个极端的分化。各细胞因子可介导多种生物学效应,既可促进炎症反应,也可拮抗炎症反应。这取决于细胞因子的浓度,效应细胞的类型,以及细胞因子在免疫应答过程中发挥作用的时间。另外,除细胞因子外,其它一些因素如APC及它们发出的协同刺激信号均可影响免疫应答的类型。近期研究表明,利用能同时阻断Th1与Th2型的免疫应答而非调控免疫应答向Th2型转化的免疫抑制治疗,能够延长移植物的存活期。
参考文献
1 Mosmann TR,Cherwinski HM,Bond MW et al.Two types of murine helper T cell clone.I.Definition according to profi les of lymphokine activities and secreted proteins.J Immunol,1986,136:2348
, http://www.100md.com
2 Forsthuber T,Yip HC,Lehmann PV.Inducti on of Th1 and Th2 immunity in neonatal m ice.Science,1996,271:1728
3 OConnel PJ,Pacheco-Silva A,Nickerson PW et al.Unmodified pancreatic islet a llograft rejection results in the prefer ential expression of certain T cell acti vation transcripts.J Immunol,1993,150:10 93
4 Sallusto F,Mackay CR,Lanzaveccia A.Sel ective eopression of the eotaxin recepto r CCR3 by human T helper 2 cells.Science ,1997,277:2005
, http://www.100md.com
5 Loetscher P,Uguccioni M,Bordoli L et al.CCR5 is characteristic of Th1 lympho cytes.Nature,1998,391:344
6 Qin L,Chavin KD,Ding Y et al.Retrovi rus-mediated transfer of viral IL-10 gen e prolongs murine cardiac allograft surv ival.J Immunol,1996,156:2316
7 Steiger J,Nickerson PW,Steurer W et a l.IL-2 knockout recipient mice reject i slet cell allografts.J Immunol,1995,155: 489
8 Larsen CP,Elwood ET,Alexander DZ et a l.Long-term acceptance of skin and card iac allografts after blocking CD40 and C D28 pathways.Nature,1996,381:434
9 Kirk AD,Harlan DM,Armstron NN et al. CDTLA-Ig and anti-CD40 ligand prevent re nal allograft rejection in primates.Proc Natl Acad Sci USA,1997,94:8789
(本文编辑 蒋 群)
(1999-08-14收稿), 百拇医药