热双蒸水联用生理盐水及右旋糖酐-40预防腹腔内肿瘤种植 转移的实验研究
作者:皮执民 王心见 刘国清 周建平 李铁钢
单位:(第二附属医院普通外科 长沙 410011)
关键词:肿瘤种植;肿瘤;实验性;肿瘤细胞;培养的;右旋糖酐;小鼠
湖南医科大学学报990609
提要 联合应用热双蒸水、生理盐水、右旋糖酐-40序贯腹腔冲洗的方法,行体外试验与动物试验。发现45℃双蒸水浸泡腹腔20min后能完全杀灭体外培养的B6-F10细胞;右旋糖酐-40部分抑制B16-F10细胞对胶化培养板孔壁的粘附。小鼠腹腔注入B16-F10细胞后,按上述三联合液序贯冲洗可预防70%的C57BL/6j小鼠 发生腹膜癌病,未见毒副作用。在此冲洗的基础上,腹腔内保留氯氨铂, 疗效高达88.9%,但毒性也增加。
, http://www.100md.com
中国图书分类号 R730.5
Experimental studies on hyperthermic distilled water combining
with saline and dextran for preventing intraperitoneal cancer
recurrence dueton eoplasm seeding
Pi Zhimin Wang Xinjian Liu Guoqing Zhou Jianping Li Tiegang
(Department of Surgery, The Second Affiliated Hospital, Hunan Medical University, Changsha 410011)
, 百拇医药
In order to know the efficacy of hyperthermic distilled water combining with saline and dextran(DSD) to prevent intraperitoneal cancer from recurrence due to neoplasm seeding, we carried out the experimental studies, including an observation on inhibiting cancer cells from implantation in vivo by abdominal cavity lavation, cytotoxic test and attachment test in vitro. The results of the tests in vitro showed no viable tumor cell exposed to 45℃ distilled water for 20 minutes in the tissue culture wells, meanwhile, dextran-40 partially blocked at tachment of B16-F10 cells to gelatinized wells. In vivo test, DSD e ffectively prevented neoplasm seeding of B16-F10 viable melanoma ce lls in C57BL/6j mouse abdominal cavity and had no obvious toxicity. The efficiency was 70%; when cisplatin was added, the efficiency was enhanced to 88.9% with slight toxicity. These data indicate that the local application of hyperth ermic distilled water combined with saline and DSD may prevent intraperitoneal n eoplasm from recurring.
, 百拇医药
Key words neoplasm seeding; neoplasm transplantation; disease model,animal; neoplasms,experimental; tumor cells,cultured; dextran-40; mice
腹腔内恶性肿瘤切除术后发生的种植转移是临床常见的并发症,尤其多见于大肠癌、胃癌、肝癌切除术后。如何有效地降低腹腔肿瘤术后种植的转移率,是肿瘤外科的重要课题。有关的研究国内外报道不少,但疗效不一。腹腔内超体温化学治疗(化疗)是近年来推广的有效方法[1,2],但大多需专门设备,操作时间太长。肝素局部应用抑制肿瘤细胞着床也有一定疗效[3]。作者在上述基础上采用热双蒸水(DDW)、生理盐水(NS)、右旋糖酐-40序贯腹腔内冲洗的方法,通过体外试验和动物试验,观察术后腹腔内肿瘤种植转移的情况,旨在评价该方法预防肿瘤种植转移的效果。
1 材料与方法
, 百拇医药
1.1 材料 温热DDW(45℃)系本院自制,灭菌后置4℃冰箱内保存。临用前置45℃恒温水浴箱内30min。NS系本院自制。10%右旋糖酐-40注射液为天津华津制药厂生产。温热顺铂溶液(45℃DDP)为齐鲁制药厂生产,每瓶10mg,临用前以NS稀释至0.56mg%浓度。将盛该药液玻瓶置于45℃恒温水浴箱内30min待用。与B16-F10鼠黑色素瘤细胞同基因的C57BL/6j正常健康小鼠由本校附二院动物试验室提供,雌雄各半,体重22~25g,8~12周龄。
1.2 方法
1.2.1 肿瘤细胞培养与传代 将B16-F10恶性黑色素瘤细胞系接 种于250ml无菌塑料培养瓶中(美国Linbro Flow Laboratories公司生产),加培养液30ml,置于5% CO237℃恒温细胞培养箱中培养,1~2d更换培养液(按美国GIBCO Life Fechnologies公司生产的DMEM粉剂配方),2~3d后将细胞传代。传代方法:弃培养液后,以pH7.4的10mM磷酸盐缓冲液(PBS)洗一遍,加0.05%胰蛋白酶和0.02%EDTA混合液2ml,轻涮细胞后立即弃去消化液,然后重复前一步骤。培养瓶室温下放置2~3min,再加2~4ml培养液(不含小牛血清),用吸管吹打细胞制成细胞悬液后,放入2~4个新的无菌培养瓶中,各加30ml培养液,最后置于37℃含5%CO2细胞培养箱内继续培养。
, 百拇医药
1.2.2 细胞冻存与解冻 将培养瓶内的细胞悬液离心5min后去上清液,按2×106个细胞加冻存液1.5ml的比例分装于塑料冻存管(Linbro公司)内。冻存液的配制:二甲基亚砜(Sigma公司)1份、优质小牛血清(美国GIB60公司)2份,含青霉素100U.ml-1,链枚素100U.ml-1,左旋谷氨酰胺29.4mg.ml-1的DMEM溶液7份,混合摇匀,混合液置-75℃冰箱内冻存备用。动物试验前,取出冻存管,迅速泡入37℃温水内解冻,再次离心5min后去上清液100μl与1%固绿染色液100μl混匀。取1~2滴混匀液置血球计数板上计数及判断细胞死活。根据计数情况,加入适量PBS稀释细胞悬液调整至所需细胞浓度,暂置4℃冰箱内保存。此悬液须于2h内用完,以免细胞死亡。
1.2.3 动物模型与动物试验 取40只C57BL/6j小鼠,每鼠注入0.2ml(含细胞2×106个)B16-F10细胞悬液于左下腹,4h后麻醉。开腹前随机分成4组,每组10只。A组为对照组,注入NS2ml至腹腔,每隔5min更换等体积液体,30min后用纱布蘸尽液体。同法重复一次,最后腹腔内保留NS2ml。B组注入45℃DDW2ml,每隔5min更换等体积液体,持续浸泡30min,再注入NS2ml,随即蘸尽,最后注入右旋糖酐-402ml关腹。C组小鼠注入45℃DDP1.5~2ml,操作程序同B组。D组小鼠先按B组方式处理,关腹前再注入DDP2.5mg.kg-1。术后将实验小鼠放回笼内,任其自醒进食。每天观察进食、活动、伤口、腹围。3周后处死各组动物,大体解剖观察后,取每鼠的大网膜、肠系膜、后腹膜、切口部位的腹膜与肌肉、肺等病理切片待检,以确定小鼠的致瘤数和肿瘤侵袭情况。
, 百拇医药
1.2.4 体外细胞毒性试验 取对数生长期的B16-F10细胞。用0.05%胰蛋白酶和0.02%EDTA混合液消化收集细胞,经PBS洗一次后计数,制成每毫升含0.7×105的细胞悬液。以每孔每0.2ml含14×104个细胞的悬液接种0.2ml于24孔细胞培养板中,随机分成3组,每组4孔。第一组为NS对照组;第二组为45℃DDW组;第三组为45℃DDP组。然后分别将3组置5%CO237℃培养箱中培养,按实验操作,使温度维持在42℃。以处理过的无菌死鸭红细胞作为死细胞的参照标志,用1%固绿溶液染色进行各孔活细胞计数。在光学显微镜下观察和摄影。每组细胞计数后各留一孔继续培养,观察细胞能否继续增殖传代。
1.2.5 抗瘤细胞粘附试验 ①培养皿预处理,仿Vlodavsky所介绍的方法[4]进行。②右旋糖酐-40抗粘附试验,分成试验组与PBS对照组,每组4孔。收集各孔细胞行活细胞计数。
, 百拇医药
1.3 观察指标及统计学处理 (1)体外试验:观察经各组药物处理后的存活细胞数,细胞形态学变化,对细胞传代的影响及粘附细胞数。(2)动物试验:观察经各组药物处理后的病理学改变和致瘤率。(3)统计学处 理:均数的显著性用t检验或t′检验;结果用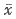 ±s表示。
±s表示。
2 结 果
2.1 动物腹膜癌病理模型 10只小鼠全部发生腹膜癌。肿瘤侵袭部位包括大小网膜、肠系膜、脏壁层腹膜及部分腹膜外肌层、横膈、切口所在部位等。10只动物中4只尚可见肺转移。
2.2 体外细胞毒性试验 经各组药液浸泡10min后继续培养24h,残存活细胞数结果见表1。DDP与DDW组活细胞数均较NS组显著减少(P<0.01);浸泡20min后继续培养24h,上二组均未发现任何存活细胞;而NS组各孔细胞生长旺盛,活细胞数达(23.50±2.86)万.ml-1(表1)。
, 百拇医药
表1 45℃ DDW和45℃ DDP对细胞数的影响(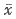 ±s) 组别
±s) 组别
培养24h活细胞数(104.ml -1)
P
NS组
23.50±2.86
45℃ DDW组
1.38±0.48①
<0.01
45℃ DDP组
, http://www.100md.com 0.62±0.25①
<0.01
①与NS对照组比
2.3 细胞形态学变化 NS浸泡的细胞生长旺盛,排列紧密,可见重叠生长。45℃DDW浸泡的细胞数量稀少,胞体圆,核浓缩或核碎裂、崩解,未见明显核分裂相。45℃DDP浸泡的细胞数量也明显稀少,细胞排列疏松紊乱,多见核浓缩及细胞崩解现象。
2.4 细胞传代观察 经NS浸泡的细胞继续生长,每3d传代。经45℃DDW与45℃DDP浸泡,10min和20min的细胞虽每隔3d换液一次,但均不能继续生长传代,且15d后细胞全部脱落死亡。
2.5 右旋糖酐-40对B16-F10细胞异质性粘附的影响 与PBS对照组相比,右旋糖酐-40组粘附孔壁的活细胞数明显减少(P<0.01)(表2)。
, 百拇医药
表2 右旋糖酐-40抗瘤细胞粘附的效果(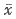 ±s) 组别
±s) 组别
孔壁粘附细胞数(104.ml -1)
P
右旋糖酐-40组
PBS对照组
5.38±0.85
8.50±0.91
<0.01
2.6 45℃ DDW结合NS与右旋糖酐-40序贯腹腔冲洗预防B16-F10细胞腹腔种植的效果 C组与D组各有1鼠分别于术后第7和8d死于肾小管上皮细胞明显 脂肪变性,未纳入统计分析。A组2鼠分别于术后第14和16d死于肿瘤广泛浸润、转移(1鼠 肺转移);该组其它小鼠于术后21d均呈濒死状态,故全部处死(表3)。表3 腹腔注入2×106瘤细胞后4种不同冲 洗方法对小鼠致瘤数的影响 分组
, 百拇医药
n
早期死
亡鼠数
致瘤
鼠数
致瘤率
(%)
P
A组(NS+NS+NS)
10
0
10
100.0
, http://www.100md.com
B组(DDW+NS+右旋糖酐-40)
10
0
3
30.0
<0.01①
C组(DDP+NS+NS)
10
1
3
33.3
<0.01①
, http://www.100md.com
D组(DDW+AS+dextran-40+DDP)
10
1
1
11.1
<0.01①
①均为与A组比较(早期死亡小鼠未纳入统计分析)
3 讨 论
脱落肿瘤细胞在恶性肿瘤切除术后的创面或体腔内有很高的检出率,甚至达93.4%[5]。脱落瘤细胞的种植是导致复发的主要因素之一[6]。早在1907年Ryall已提出预防术后肿瘤种植应更换手套、手术衣及器械等;自50年代末开始,普遍使用各种药物行腹腔、切口或肠腔冲洗[7];60年代Turnbull等提倡使用“不接触”隔离技术。虽然采取了上述措施,但术后肿瘤的局部复发或腹腔种植率仍未大幅度降低[8]。故该问题成为外科医师亟待解决的重要课题。
, 百拇医药
通常采用高温、低渗、化疗等破坏脱落肿瘤细胞。一般认为高温的效果较肯定。最佳治疗温度为42.5~45℃;低于41℃无明显效果,超过45℃可能导致正常组织的不可逆损伤。高温的治疗机制是:①瘤细胞表面的酶复合体遭破坏,致使膜的能量转换、物质运输、信息传递等机能发生障碍[9];②瘤细胞的DNA结构改变,导致双链断裂。低渗治癌研究始于60年代,但单纯应用蒸馏水冲洗腹腔预防肿瘤的种植效果不确定,多年来一直争论不休。
笔者应用高温与低渗相结合的方式处理,体外培养的B16-F10细胞经10min浸泡即可使大部分细胞死亡;浸泡20min细胞全部死亡。经上述处理的细胞均不能继续传代。此结果与陈峻青等报道相符[10]。研究还发现,45℃DDW与DDP浸泡B16-F10细胞20min,其细胞存活数(均为零)或形态学变化二者均相仿。
在肿瘤侵袭转移的粘附、酶分泌、运动三步法则中,首要步骤是瘤细胞对宿主组织的粘附。右旋糖酐-40是一种非营养性物质,腹膜对其吸收清除的速度较慢,可较长时间地停留在腹腔内脏的表面,从而阻碍了游离瘤细胞的游走与粘附。本研究还发现:在模拟人体细胞外基质的24孔培养板孔内加入右旋糖酐-40可抑制部份B16-F10细胞对孔壁的粘附(P<0.01)。
, 百拇医药
采用B16-F10鼠瘤细胞接种于同基因的C57BL/6j小鼠腹腔作为模型,乃由于该系瘤细胞具有对同系小鼠组织很强的粘附力,即使将该细胞接种于创面后立即用生理盐水冲洗也不能阻止其致瘤[11]。因其极恶的生物学特性很可能类似人类的未分化型胃癌、大肠癌和肝癌等,故本研究小组选用之。
本资料显示,应用45℃DDW+NS+右旋糖酐-40序贯冲洗接种有B16-F10瘤细胞的C57BL/6j鼠腹腔,可预防70%的小鼠发生腹膜癌病(与NS冲洗组比较P<0.01),且未见任何毒副反应。与45℃DDP冲洗组相比,无论是致瘤率还是致小鼠的病理解剖学改变均相仿。此法未用对机体有毒性的药物。故认为临床应用的优越性大于45℃DDP冲洗法(1鼠因DDP毒性导致肾衰死亡)。该序贯冲洗法不能起到100%的预防作用,究其原因可能是45℃DDW作用于B16-F10细胞的时间过短(30min),温度也不能恒定于45℃。从D组结果可见,在该序贯冲洗法的基础上腹腔内注入抗癌药物(DDP),可进一步提高预防腹腔内肿瘤种植的效果(致瘤率降至11.1%),但增加了对机体的毒性。
, 百拇医药
综上所述,本研究设计45℃双蒸水+NS+右旋糖酐-40序贯冲洗模拟人体肿瘤切除术后的小鼠腹腔,利用高温效应和蒸馏水的低渗作用,最大限度地杀伤腹腔内肿瘤细胞;利用NS腹腔内机械冲洗减少腹腔残存游离细胞的数量并清除手术创面渗血中的细胞因子;利用右旋糖酐-40留置腹腔进一步阻止继续残存的游离肿瘤细胞对腹膜间皮及间皮细胞外基质的粘附和侵袭。故认为该序贯疗法对预防术后肿瘤细胞种植转移有一定效果。
参 考 文 献
1 Loggie BW, Fieming RA, Gesinger KR, et al. Cytologic ass essment before and after intraperitoneal hyperthermic chemotherapy for peritonea lcarcinomatosis. Acta Cytol, 1996,40(6):1154~1158
2 陈志新,彭德恕,谭建三,等.腹腔内热低渗化疗对腹膜种植性癌转移防治效果的实验研究.中华肿瘤杂志,1995,17(3):214~216
, 百拇医药
3 Godlstein DS. Inhibition of peritoneal trmor cell implantation: model for lap aroscopic cancer surgery. J Endourol, 1993,7(3):237~241
4 Vlodavsky I. Tumor cell attachment to the vascular endothelium and subsequent degradation of the subendothelial extracellular matrix. Exp Cell Res, 1982,140: 149
5 Hansen E, Wolff N, Knuechel R, et al. Tumor cells in blood shed from the surgical field. Arch Surg, 1995,130:387~393
, 百拇医药
6 Demetrick JS. The development of a novel intraperitoneal tumoreseeding prophy lactic. Am J Surg, 1997,173:403~406
7 Docherty JG, Mcgregor JR, Purdke CA, et al. Efficacy of tumoricidal agents in vitro and in vivo. Br J Surg, 1995,82:1050~1052
8 Reilly WT, Nelson H, Schroeder G, et al. Wound recurrence following conventional treatment of colorectal cancer. Dis Colon Rectum, 1996,39(2):200~207
, 百拇医药 9 Wachsherger PR. Effect of hyperthermia on the cytoskeleton and cell survival in G1 and S phase Chinese hamster ovary cells. Int J Hyperthermia, 1990,6:78~83
10 陈峻青,张忠彪,董明,等.低渗液热对体外培养胃癌细胞系MGC-803杀伤效应的评价.中国医科大学学报,1990,19(4):269~271
11 Sweitzer KL. Irrigation does not dislodge or destroy tumor cells adherent to the tumor bed. J Surg Oncol, 1993,53:184~190, 百拇医药
单位:(第二附属医院普通外科 长沙 410011)
关键词:肿瘤种植;肿瘤;实验性;肿瘤细胞;培养的;右旋糖酐;小鼠
湖南医科大学学报990609
提要 联合应用热双蒸水、生理盐水、右旋糖酐-40序贯腹腔冲洗的方法,行体外试验与动物试验。发现45℃双蒸水浸泡腹腔20min后能完全杀灭体外培养的B6-F10细胞;右旋糖酐-40部分抑制B16-F10细胞对胶化培养板孔壁的粘附。小鼠腹腔注入B16-F10细胞后,按上述三联合液序贯冲洗可预防70%的C57BL/6j小鼠 发生腹膜癌病,未见毒副作用。在此冲洗的基础上,腹腔内保留氯氨铂, 疗效高达88.9%,但毒性也增加。
, http://www.100md.com
中国图书分类号 R730.5
Experimental studies on hyperthermic distilled water combining
with saline and dextran for preventing intraperitoneal cancer
recurrence dueton eoplasm seeding
Pi Zhimin Wang Xinjian Liu Guoqing Zhou Jianping Li Tiegang
(Department of Surgery, The Second Affiliated Hospital, Hunan Medical University, Changsha 410011)
, 百拇医药
In order to know the efficacy of hyperthermic distilled water combining with saline and dextran(DSD) to prevent intraperitoneal cancer from recurrence due to neoplasm seeding, we carried out the experimental studies, including an observation on inhibiting cancer cells from implantation in vivo by abdominal cavity lavation, cytotoxic test and attachment test in vitro. The results of the tests in vitro showed no viable tumor cell exposed to 45℃ distilled water for 20 minutes in the tissue culture wells, meanwhile, dextran-40 partially blocked at tachment of B16-F10 cells to gelatinized wells. In vivo test, DSD e ffectively prevented neoplasm seeding of B16-F10 viable melanoma ce lls in C57BL/6j mouse abdominal cavity and had no obvious toxicity. The efficiency was 70%; when cisplatin was added, the efficiency was enhanced to 88.9% with slight toxicity. These data indicate that the local application of hyperth ermic distilled water combined with saline and DSD may prevent intraperitoneal n eoplasm from recurring.
, 百拇医药
Key words neoplasm seeding; neoplasm transplantation; disease model,animal; neoplasms,experimental; tumor cells,cultured; dextran-40; mice
腹腔内恶性肿瘤切除术后发生的种植转移是临床常见的并发症,尤其多见于大肠癌、胃癌、肝癌切除术后。如何有效地降低腹腔肿瘤术后种植的转移率,是肿瘤外科的重要课题。有关的研究国内外报道不少,但疗效不一。腹腔内超体温化学治疗(化疗)是近年来推广的有效方法[1,2],但大多需专门设备,操作时间太长。肝素局部应用抑制肿瘤细胞着床也有一定疗效[3]。作者在上述基础上采用热双蒸水(DDW)、生理盐水(NS)、右旋糖酐-40序贯腹腔内冲洗的方法,通过体外试验和动物试验,观察术后腹腔内肿瘤种植转移的情况,旨在评价该方法预防肿瘤种植转移的效果。
1 材料与方法
, 百拇医药
1.1 材料 温热DDW(45℃)系本院自制,灭菌后置4℃冰箱内保存。临用前置45℃恒温水浴箱内30min。NS系本院自制。10%右旋糖酐-40注射液为天津华津制药厂生产。温热顺铂溶液(45℃DDP)为齐鲁制药厂生产,每瓶10mg,临用前以NS稀释至0.56mg%浓度。将盛该药液玻瓶置于45℃恒温水浴箱内30min待用。与B16-F10鼠黑色素瘤细胞同基因的C57BL/6j正常健康小鼠由本校附二院动物试验室提供,雌雄各半,体重22~25g,8~12周龄。
1.2 方法
1.2.1 肿瘤细胞培养与传代 将B16-F10恶性黑色素瘤细胞系接 种于250ml无菌塑料培养瓶中(美国Linbro Flow Laboratories公司生产),加培养液30ml,置于5% CO237℃恒温细胞培养箱中培养,1~2d更换培养液(按美国GIBCO Life Fechnologies公司生产的DMEM粉剂配方),2~3d后将细胞传代。传代方法:弃培养液后,以pH7.4的10mM磷酸盐缓冲液(PBS)洗一遍,加0.05%胰蛋白酶和0.02%EDTA混合液2ml,轻涮细胞后立即弃去消化液,然后重复前一步骤。培养瓶室温下放置2~3min,再加2~4ml培养液(不含小牛血清),用吸管吹打细胞制成细胞悬液后,放入2~4个新的无菌培养瓶中,各加30ml培养液,最后置于37℃含5%CO2细胞培养箱内继续培养。
, 百拇医药
1.2.2 细胞冻存与解冻 将培养瓶内的细胞悬液离心5min后去上清液,按2×106个细胞加冻存液1.5ml的比例分装于塑料冻存管(Linbro公司)内。冻存液的配制:二甲基亚砜(Sigma公司)1份、优质小牛血清(美国GIB60公司)2份,含青霉素100U.ml-1,链枚素100U.ml-1,左旋谷氨酰胺29.4mg.ml-1的DMEM溶液7份,混合摇匀,混合液置-75℃冰箱内冻存备用。动物试验前,取出冻存管,迅速泡入37℃温水内解冻,再次离心5min后去上清液100μl与1%固绿染色液100μl混匀。取1~2滴混匀液置血球计数板上计数及判断细胞死活。根据计数情况,加入适量PBS稀释细胞悬液调整至所需细胞浓度,暂置4℃冰箱内保存。此悬液须于2h内用完,以免细胞死亡。
1.2.3 动物模型与动物试验 取40只C57BL/6j小鼠,每鼠注入0.2ml(含细胞2×106个)B16-F10细胞悬液于左下腹,4h后麻醉。开腹前随机分成4组,每组10只。A组为对照组,注入NS2ml至腹腔,每隔5min更换等体积液体,30min后用纱布蘸尽液体。同法重复一次,最后腹腔内保留NS2ml。B组注入45℃DDW2ml,每隔5min更换等体积液体,持续浸泡30min,再注入NS2ml,随即蘸尽,最后注入右旋糖酐-402ml关腹。C组小鼠注入45℃DDP1.5~2ml,操作程序同B组。D组小鼠先按B组方式处理,关腹前再注入DDP2.5mg.kg-1。术后将实验小鼠放回笼内,任其自醒进食。每天观察进食、活动、伤口、腹围。3周后处死各组动物,大体解剖观察后,取每鼠的大网膜、肠系膜、后腹膜、切口部位的腹膜与肌肉、肺等病理切片待检,以确定小鼠的致瘤数和肿瘤侵袭情况。
, 百拇医药
1.2.4 体外细胞毒性试验 取对数生长期的B16-F10细胞。用0.05%胰蛋白酶和0.02%EDTA混合液消化收集细胞,经PBS洗一次后计数,制成每毫升含0.7×105的细胞悬液。以每孔每0.2ml含14×104个细胞的悬液接种0.2ml于24孔细胞培养板中,随机分成3组,每组4孔。第一组为NS对照组;第二组为45℃DDW组;第三组为45℃DDP组。然后分别将3组置5%CO237℃培养箱中培养,按实验操作,使温度维持在42℃。以处理过的无菌死鸭红细胞作为死细胞的参照标志,用1%固绿溶液染色进行各孔活细胞计数。在光学显微镜下观察和摄影。每组细胞计数后各留一孔继续培养,观察细胞能否继续增殖传代。
1.2.5 抗瘤细胞粘附试验 ①培养皿预处理,仿Vlodavsky所介绍的方法[4]进行。②右旋糖酐-40抗粘附试验,分成试验组与PBS对照组,每组4孔。收集各孔细胞行活细胞计数。
, 百拇医药
1.3 观察指标及统计学处理 (1)体外试验:观察经各组药物处理后的存活细胞数,细胞形态学变化,对细胞传代的影响及粘附细胞数。(2)动物试验:观察经各组药物处理后的病理学改变和致瘤率。(3)统计学处 理:均数的显著性用t检验或t′检验;结果用
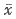 ±s表示。
±s表示。2 结 果
2.1 动物腹膜癌病理模型 10只小鼠全部发生腹膜癌。肿瘤侵袭部位包括大小网膜、肠系膜、脏壁层腹膜及部分腹膜外肌层、横膈、切口所在部位等。10只动物中4只尚可见肺转移。
2.2 体外细胞毒性试验 经各组药液浸泡10min后继续培养24h,残存活细胞数结果见表1。DDP与DDW组活细胞数均较NS组显著减少(P<0.01);浸泡20min后继续培养24h,上二组均未发现任何存活细胞;而NS组各孔细胞生长旺盛,活细胞数达(23.50±2.86)万.ml-1(表1)。
, 百拇医药
表1 45℃ DDW和45℃ DDP对细胞数的影响(
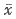 ±s) 组别
±s) 组别培养24h活细胞数(104.ml -1)
P
NS组
23.50±2.86
45℃ DDW组
1.38±0.48①
<0.01
45℃ DDP组
, http://www.100md.com 0.62±0.25①
<0.01
①与NS对照组比
2.3 细胞形态学变化 NS浸泡的细胞生长旺盛,排列紧密,可见重叠生长。45℃DDW浸泡的细胞数量稀少,胞体圆,核浓缩或核碎裂、崩解,未见明显核分裂相。45℃DDP浸泡的细胞数量也明显稀少,细胞排列疏松紊乱,多见核浓缩及细胞崩解现象。
2.4 细胞传代观察 经NS浸泡的细胞继续生长,每3d传代。经45℃DDW与45℃DDP浸泡,10min和20min的细胞虽每隔3d换液一次,但均不能继续生长传代,且15d后细胞全部脱落死亡。
2.5 右旋糖酐-40对B16-F10细胞异质性粘附的影响 与PBS对照组相比,右旋糖酐-40组粘附孔壁的活细胞数明显减少(P<0.01)(表2)。
, 百拇医药
表2 右旋糖酐-40抗瘤细胞粘附的效果(
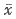 ±s) 组别
±s) 组别孔壁粘附细胞数(104.ml -1)
P
右旋糖酐-40组
PBS对照组
5.38±0.85
8.50±0.91
<0.01
2.6 45℃ DDW结合NS与右旋糖酐-40序贯腹腔冲洗预防B16-F10细胞腹腔种植的效果 C组与D组各有1鼠分别于术后第7和8d死于肾小管上皮细胞明显 脂肪变性,未纳入统计分析。A组2鼠分别于术后第14和16d死于肿瘤广泛浸润、转移(1鼠 肺转移);该组其它小鼠于术后21d均呈濒死状态,故全部处死(表3)。表3 腹腔注入2×106瘤细胞后4种不同冲 洗方法对小鼠致瘤数的影响 分组
, 百拇医药
n
早期死
亡鼠数
致瘤
鼠数
致瘤率
(%)
P
A组(NS+NS+NS)
10
0
10
100.0
, http://www.100md.com
B组(DDW+NS+右旋糖酐-40)
10
0
3
30.0
<0.01①
C组(DDP+NS+NS)
10
1
3
33.3
<0.01①
, http://www.100md.com
D组(DDW+AS+dextran-40+DDP)
10
1
1
11.1
<0.01①
①均为与A组比较(早期死亡小鼠未纳入统计分析)
3 讨 论
脱落肿瘤细胞在恶性肿瘤切除术后的创面或体腔内有很高的检出率,甚至达93.4%[5]。脱落瘤细胞的种植是导致复发的主要因素之一[6]。早在1907年Ryall已提出预防术后肿瘤种植应更换手套、手术衣及器械等;自50年代末开始,普遍使用各种药物行腹腔、切口或肠腔冲洗[7];60年代Turnbull等提倡使用“不接触”隔离技术。虽然采取了上述措施,但术后肿瘤的局部复发或腹腔种植率仍未大幅度降低[8]。故该问题成为外科医师亟待解决的重要课题。
, 百拇医药
通常采用高温、低渗、化疗等破坏脱落肿瘤细胞。一般认为高温的效果较肯定。最佳治疗温度为42.5~45℃;低于41℃无明显效果,超过45℃可能导致正常组织的不可逆损伤。高温的治疗机制是:①瘤细胞表面的酶复合体遭破坏,致使膜的能量转换、物质运输、信息传递等机能发生障碍[9];②瘤细胞的DNA结构改变,导致双链断裂。低渗治癌研究始于60年代,但单纯应用蒸馏水冲洗腹腔预防肿瘤的种植效果不确定,多年来一直争论不休。
笔者应用高温与低渗相结合的方式处理,体外培养的B16-F10细胞经10min浸泡即可使大部分细胞死亡;浸泡20min细胞全部死亡。经上述处理的细胞均不能继续传代。此结果与陈峻青等报道相符[10]。研究还发现,45℃DDW与DDP浸泡B16-F10细胞20min,其细胞存活数(均为零)或形态学变化二者均相仿。
在肿瘤侵袭转移的粘附、酶分泌、运动三步法则中,首要步骤是瘤细胞对宿主组织的粘附。右旋糖酐-40是一种非营养性物质,腹膜对其吸收清除的速度较慢,可较长时间地停留在腹腔内脏的表面,从而阻碍了游离瘤细胞的游走与粘附。本研究还发现:在模拟人体细胞外基质的24孔培养板孔内加入右旋糖酐-40可抑制部份B16-F10细胞对孔壁的粘附(P<0.01)。
, 百拇医药
采用B16-F10鼠瘤细胞接种于同基因的C57BL/6j小鼠腹腔作为模型,乃由于该系瘤细胞具有对同系小鼠组织很强的粘附力,即使将该细胞接种于创面后立即用生理盐水冲洗也不能阻止其致瘤[11]。因其极恶的生物学特性很可能类似人类的未分化型胃癌、大肠癌和肝癌等,故本研究小组选用之。
本资料显示,应用45℃DDW+NS+右旋糖酐-40序贯冲洗接种有B16-F10瘤细胞的C57BL/6j鼠腹腔,可预防70%的小鼠发生腹膜癌病(与NS冲洗组比较P<0.01),且未见任何毒副反应。与45℃DDP冲洗组相比,无论是致瘤率还是致小鼠的病理解剖学改变均相仿。此法未用对机体有毒性的药物。故认为临床应用的优越性大于45℃DDP冲洗法(1鼠因DDP毒性导致肾衰死亡)。该序贯冲洗法不能起到100%的预防作用,究其原因可能是45℃DDW作用于B16-F10细胞的时间过短(30min),温度也不能恒定于45℃。从D组结果可见,在该序贯冲洗法的基础上腹腔内注入抗癌药物(DDP),可进一步提高预防腹腔内肿瘤种植的效果(致瘤率降至11.1%),但增加了对机体的毒性。
, 百拇医药
综上所述,本研究设计45℃双蒸水+NS+右旋糖酐-40序贯冲洗模拟人体肿瘤切除术后的小鼠腹腔,利用高温效应和蒸馏水的低渗作用,最大限度地杀伤腹腔内肿瘤细胞;利用NS腹腔内机械冲洗减少腹腔残存游离细胞的数量并清除手术创面渗血中的细胞因子;利用右旋糖酐-40留置腹腔进一步阻止继续残存的游离肿瘤细胞对腹膜间皮及间皮细胞外基质的粘附和侵袭。故认为该序贯疗法对预防术后肿瘤细胞种植转移有一定效果。
参 考 文 献
1 Loggie BW, Fieming RA, Gesinger KR, et al. Cytologic ass essment before and after intraperitoneal hyperthermic chemotherapy for peritonea lcarcinomatosis. Acta Cytol, 1996,40(6):1154~1158
2 陈志新,彭德恕,谭建三,等.腹腔内热低渗化疗对腹膜种植性癌转移防治效果的实验研究.中华肿瘤杂志,1995,17(3):214~216
, 百拇医药
3 Godlstein DS. Inhibition of peritoneal trmor cell implantation: model for lap aroscopic cancer surgery. J Endourol, 1993,7(3):237~241
4 Vlodavsky I. Tumor cell attachment to the vascular endothelium and subsequent degradation of the subendothelial extracellular matrix. Exp Cell Res, 1982,140: 149
5 Hansen E, Wolff N, Knuechel R, et al. Tumor cells in blood shed from the surgical field. Arch Surg, 1995,130:387~393
, 百拇医药
6 Demetrick JS. The development of a novel intraperitoneal tumoreseeding prophy lactic. Am J Surg, 1997,173:403~406
7 Docherty JG, Mcgregor JR, Purdke CA, et al. Efficacy of tumoricidal agents in vitro and in vivo. Br J Surg, 1995,82:1050~1052
8 Reilly WT, Nelson H, Schroeder G, et al. Wound recurrence following conventional treatment of colorectal cancer. Dis Colon Rectum, 1996,39(2):200~207
, 百拇医药 9 Wachsherger PR. Effect of hyperthermia on the cytoskeleton and cell survival in G1 and S phase Chinese hamster ovary cells. Int J Hyperthermia, 1990,6:78~83
10 陈峻青,张忠彪,董明,等.低渗液热对体外培养胃癌细胞系MGC-803杀伤效应的评价.中国医科大学学报,1990,19(4):269~271
11 Sweitzer KL. Irrigation does not dislodge or destroy tumor cells adherent to the tumor bed. J Surg Oncol, 1993,53:184~190, 百拇医药