灵芝复方剂对K562白血病细胞增殖、分化的影响①
作者:钟 理 蒋德昭 王绮如
单位:(血液生理研究室 长沙 410078)
关键词:灵芝方*;阿糖胞苷*;粒单系祖细胞;K562细胞;增殖;分化;药物作用
湖南医科大学学报990608
提要 用细胞培养、细胞形态学及联苯胺染色法观察中药灵芝复方对K562白血病细胞的增殖抑制及分化 诱导作用。结果显示:灵芝复方在一定浓度范围内对正常人骨髓CFU-GM生长有促 进作用(P<0.05),而对白血病细胞系K562细胞增殖表现出剂量和时间依赖性抑制(P<0.05);在诱导分化剂量下,灵芝复方可促进K562细胞向红系分化。可见,灵芝复方有望成为一种抗白血病中药。
中国图书分类号 R282.71 R733.7
, http://www.100md.com
Effects of Ganoderma lucidum(Leyss ex Fr) Karst compound on
the proliferation and differentiation of K562 leukemic cells
Zhong Li Jiang Dezhao Wang Qiru
(Research Laboratory of Blood Physiology, Hunan Medical University, Chang sha 410078)
A series of experiments including cell culture and benzidine staining test were undertaken to investigate the effects of Ganoderma lucidum(Leyss ex Fr) Karst Compound(GLC) on the proliferation and differentiation of K562 leukem ic cells. The results showed that different concentrations of GLC(from 4mg.ml-1 to 12mg.ml-1) could promote human bone marrow granulocyte-mac rophage colony forming unit(CFU-GM) proliferation, but suppressed the growth of K562 leukemic cell colonies, and IC50 was 9.2mg.ml-1. The data from liquid culture demonstrated that GLC could suppress K562 cells proliferation in a dose-dependent(from 4mg.ml-1 to 20mg.ml-1) and time-dependent(from 1~5 days) manner. K562 cells could be induced to differentiate into more mature erythrocytic cells by 4mg.ml-1 and 8mg.ml-1 GLC. It is concluded that GLC may be a good medicine for leukemia therapy.
, 百拇医药
Key words Ganoderma lucidum(Leyss ex Fr) Karst*; cytarabine*; granulocyte-macrophage colony forming unit; K562 cells; proliferation; differentiation; drug effects
癌细胞的增殖抑制和分化诱导已成为肿瘤治疗的一个重要手段。自从Leo Sachs于1978年报道恶性肿瘤细胞可以转化为较成熟或较良性的细胞以来,有关分化诱导剂的研究及其应用已引起人们的广泛注意。用中药成分作为白血病细胞分化诱导剂也有了不少报道。本室发现由灵芝、黄芪、党参、当归、甘草等中草药配伍组方而成的灵芝复方[Ganoderma lucidum (Leyss ex Fr) Karst compound, GLC] ,在一定浓度范围内能促进正常小鼠骨髓粒-单系祖细胞(粒-单系集落形成单位,CFU-GM)增殖,并对小鼠白血病细胞系WEHI-3细胞集落生长呈剂量依赖性抑制。为进一步了解灵芝复方的骨髓保护及抗白血病作用,为其临床应用提供依据,本研究以人白血病细胞系K562细胞为模型,旨在探索GLC对白血病细胞增殖、分化的影响,以阐明其抗白血病的有关机制。
, 百拇医药
1 材料与方法
1.1 材料
1.1.1 骨髓标本 来自湖南医科大学附属湘雅医院、附二院胸外科手术非血液 病患者的肋骨。
1.1.2 细胞系 K562细胞系由本校免疫研究室惠赠。以1×105个.ml-1浓度加入到含10%新生牛血清(NBS)的RPMI-1640培养基中,置37℃,5% CO2,饱 和湿度的培养箱中培养,每3~4d传代1次。
1.1.3 药物 灵芝复方各组药由湘雅医院中药房提供,经水泡、煮沸、过滤提取、醇沉、蒸馏,用双蒸水稀释,使含生药0.8g.ml-1,过滤除菌,4℃保存,使用前调pH7.4。阿糖胞苷盐酸盐(Ara-C hydrochloride)(美国Sigma Co),用三蒸水 配成1.0mol.L-1贮存液,置-20℃备用。
, 百拇医药
1.1.4 试剂 DMEM(Dubecco's modified Eagle's medium,美国Sigma Co),RPMI-1640(美国Gibco BRL)按说明配制。新生牛血清(杭州四季青生物工程材料研究所),马血清(HS)(北京军事医学科学院),56℃ 30min灭活,分装,-20℃冻存备用。重组人粒单系集落刺激因子(rhGM-CSF,Genzyme Co)。联苯胺盐酸盐(benzidine dihydrochlo ride)(美国Sigma Co),用0.5%乙酸配成浓度为2mg.ml-1,避光4℃保存备用 。
1.2 方法
1.2.1 人骨髓单个核细胞的制备[1] 将胸外科手术取下的肋骨用DMEM培养液清洗,用骨钳挤出骨髓,加适量DMEM培养液混悬,弃去上层脂肪,过6号、4号针头各两次,制成单细胞悬液,用比重为1.077的淋巴细胞分离液分离,收集单个核细胞,经DMEM培养液洗涤,调整到所需细胞浓度。
, http://www.100md.com
1.2.2 人骨髓细胞CFU-GM体外培养[1]将20×104个.ml -1人骨髓单个核细胞加入到体外半固体琼脂培养体系(含28% HS,10%人AB血清,50U.ml-1 rhGM-CSF,0.3%琼脂)中,实验组加不同浓度的GLC(4~20mg.ml -1),并按GLC浓度分成5组,对照组加等量DMEM培养液,种植培养体系1ml于直径30mm的培养皿中,每 组平行3皿,置37℃,5% CO2,饱和湿度的培养箱中培养14d后取出,倒置显微镜下观察,以大于40个细胞组成的集落计数为一个CFU-GM。
1.2.3 K562细胞集落培养 取指数生长期K562细胞1×303个.ml-1,加入到含25%NBS,0.3%琼脂的培养体系中,实验组加不同浓度的GLC(4~20mg.ml-1),并按GLC浓度分为五组,对照组加等量培养液,种植培养体系1ml于直径30mm的玻璃培养皿中,每组平行3皿,置37℃,5% CO2,饱和湿度的培养箱中培养7d,倒置显微镜下计数集落(大于50个细胞的细胞团为一个集落)。
, http://www.100md.com
1.2.4 K562细胞液体培养 取指数生长期K562细胞1×105个.ml-1,加入培养体系,对照组不加药物,加等量培养液,实验组Ⅰ加不同浓度的GLC(4~20 mg.ml-1)共5小组,实验组Ⅱ加不同浓度的Ara-C(10-9~10-5mol.L -1)共5小组,种植培养体系0.5ml于24孔培养板,每组平行3孔,培养1~5d ,每天计数K562活细胞数目。
1.2.5 形态学观察(Wright-Giemsa染色) 根据GLC对K562细胞的抑制程度,选用4mg.ml-1与8mg.ml-1作为GLC诱导分化用浓度。在含RPMI-1640,10%NBS,1×105个.ml-1的K562细胞培养体系中,加入不同浓度的GLC,置37℃,5%CO2,饱和湿度的培养箱中培养5d,将细胞涂片,Wright-Giemsa染色,油镜下观察细胞形态并摄影。
, 百拇医药
1.2.6 联苯胺染色[2] 将4mg.ml-1与8mg.ml-1GLC处理(用10-5mol.L-1 Ara-C作阳性对照)的K562细胞置37℃,5%CO2,饱和湿度的培养箱中培养1~5d,每天取2mg.ml-1联苯胺溶液与30% H 2O2(5μl.ml-1)混合,等量加入细胞培养体系中,反应5min,在光学显微镜 下(40×)观察200个细胞。联苯胺阳性细胞胞浆染成蓝色,阴性细胞为黄色或无色。计数联苯胺阳性细胞百分率。
1.3 统计学处理 实验结果以 ±s表示,各组间差异采用 F检验,若F>F0.05,则两两比较用Student-Newman-Keuls q检验。IC50的计算用概率单位法。
±s表示,各组间差异采用 F检验,若F>F0.05,则两两比较用Student-Newman-Keuls q检验。IC50的计算用概率单位法。
, http://www.100md.com
2 结 果
2.1 GLC对人骨髓CFU-GM增殖的影响 如图1所示,与对照组比较,GLC为4 mg.ml-1时,CFU-GM数明显增加(P<0.01),8mg.ml-1,12mg.ml-1 时仍有明显增加(P<0.05),各浓度间无显著性差异(P>0.05 )。GLC达 20mg.ml-1时,对CFU-GM增殖出现抑制作用(P<0.01)。
2.2 GLC对K562细胞集落产率的影响 由图1可见,GLC(4~20mg.ml -1)对K562细胞集落生长均呈剂量依赖性抑制(P<0.01)。IC50为9.2mg.ml -1。
, 百拇医药
2.3 GLC和Ara-C对K562细胞计数的影响 加入GLC(4~20mg.ml-1),在培养的1~5d内,K562细胞生长均呈剂量与时间依赖性抑制(P<0.05)(图2A), 第3d和第5d K562细胞IC50分别为8.1mg.ml-1和6.3mg.ml-1;加 入Ara-C(10-9~10-5mol.L-1),培养1~5d,K562细胞生长同样呈剂量和时间依赖性抑制(P<0.05)(图2B),第3d和第5d K562细胞IC50分别为2.1×10-7mol.L-1和2.1×10-8mol.L-1。
, http://www.100md.com
图1 灵芝复方对人骨髓CFU-GM及K562细胞集落生成的影响与对照组比①P<0.05;②P<0.01
Fig. 1 Effect of GLC on the colo ny growth of CFU-GM derived from human bone marrow and K562 leukemic cells resp ectively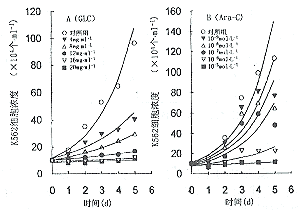
图2 不同浓度灵芝复方(A)和Ara-C(B)对K562细胞生长曲线的影响
Fig. 2 Effects of GLC(A) and Ara-C(B) on the growth curve of K562 leukemic cells
, 百拇医药
图3 对照组K562细胞培养5d形 态。Wright-Giemsa染色(×330)
Fig. 3 Morphology of K562 leukemic c ells cultured for 5 days, stained with Wright-Giemsa(×330)
图4 经8mg.ml-1 GLC处理的K562细胞培养5d,部分细胞向红系分化(↑) Wright-Giemsa染色(×330)
Fig. 4 K562 cells induced to differenti ate into mature erythrocytic cells (↑) by 8mg.ml-1 GLC for 5 days, sta ined with Wright-Giemsa (×330)
, 百拇医药
2.4 GLC对K562细胞的诱导分化作用 形态学观察结果显示:对照组K562细胞体积大,外形不规则;核大,呈圆或椭圆形,染色质疏松细致,可见2~5个核仁,核浆比例大;胞浆深蓝色,有空泡,有的可见伪足(图3)。经GLC处理的K562细胞形态产生明显变化,细胞体积变小,核染色质浓缩,核浆比例变小,胞浆呈灰蓝色,原始细胞减少,中、晚幼红细胞明显增多(图4)。
联苯胺染色结果显示,4mg.ml-1与8mg.ml-1 GLC处理的K562细胞联苯胺 阳性率呈时间依赖性增高,并与剂量有关(P<0.05)。4mg.ml-1与8mg.ml-1 GLC处理5d的K562细胞联苯胺阳性率分别为25.8%和31.0%,10-5mol.L-1 Ara-C处理组为79.3%,均明显高于对照组(P<0.01),且8mg.ml- 1 GLC组联苯胺阳性率明显高于4mg.ml-1 GLC组(P<0.01)(附表)。
, 百拇医药
附表 灵芝复方与Ara-C对K562细胞联苯胺阳性率的影响(n =3; ±s) 组 别
±s) 组 别
联苯胺阳性率(%)
1d
2d
3d
4d
5d
对照组
5.3±1.0
4. 3±0.8
5.8±1.3
, 百拇医药
7.5±1.5
8.3±1.6
10-5mol.L-1 Ara-C组
19.0±2.3②
28.3±2 .3②
47.7±3.5②
67.8±2.3②
79.3±2.3②
4mg.ml-1 GLC组
, 百拇医药
8.5±0.5①
11.3±0.8 ②
14.2±1.5②
21.0±3.0②
25.8±1.8②
8mg.ml-1 GLC组
11.3±0.8②③
15.2±1.8②③
19.5±2.5②③
, 百拇医药
26.2±1.5②③
31.0±1.8②③
与对照组比①P<0.05;②P<0.01;与4mg.ml-1 GLC组比③P<0.05 ;④P<0.01
3 讨 论
迄今用于白血病临床的化疗药物包括烷化剂、抗代谢药、抗生素及激素等,这些药物副作用 较强,对骨髓造血细胞的破坏较大。某些中药及天然药物不但可以杀灭肿瘤细胞,且副作用较小。灵芝为灵芝属真菌,中医临床药用主要为赤芝[Ganoderma lucidum(Leyss ex Fr Karst]和紫芝[Gjaponicum(Fr) Leoyd],是滋补强壮、扶正固本的珍贵药物。现代医学证明,灵芝具有促进细胞免疫和骨髓造血机能[3,4]。同时有研究表明,灵芝中各成分对多种肿瘤有抑制作用,如灵芝菌丝体提取物对S-180实体瘤有明显的抑制作用[5,6]。从赤芝中分离的三萜类成分灵芝酸对离体培养的肝肉瘤具细胞毒性。有人认为,灵芝的抗瘤活性与其高含量的碳水化合物有关[7,8]。本研究的结果显示,GLC在一定浓度范围内(4~12mg*ml-1)能促进正常骨髓粒系造血,而对K562细胞增殖却表现出明显的抑制作用,且与作用时间和剂量有关。说明GLC对白血病细胞有选择性杀伤作用。
, http://www.100md.com
许多药理活性物质如Ara-C,维甲酸,佛波酯(TPA),维生素D3等能诱导多种癌细胞分化,其中包括白血病和某些实体瘤细胞。中药成分对白血病细胞的分化诱导作用,目前亦有不少报道。研究表明,三尖杉酯碱、人参皂甙、苦参等可诱导HL-60细胞向单核-巨噬细胞系分化;三七皂甙、鹿精等可诱导HL-60细胞向成熟中性粒细胞分化;人参皂甙还可诱导K562细胞向红系分化。Lieu-CW等[9]发现从灵芝中提取的多糖能刺激人外周血单个核细胞分泌细胞因子,如IL-1β,TNF-α等,从而诱导白血病细胞系U937细胞向单核系分化。可见,许多中药通过诱导白血病细胞分化来发挥抗白血病作用。
在分化诱导剂作用下,K562细胞可向红系分化,其主要标志是Hb合成,表现为联苯胺反应阳性[10]。本研究结果显示,在体外培养中,4mg*ml-1与8mg*ml-1GLC能使K562细胞形态发生改变,中、晚幼红细胞明显增加;联苯胺阳性率也明显增高,且呈时间与剂量依赖关系。这表明在诱导分化剂量下,GLC可促使K562细胞向红系分化。但其诱导分化作用弱于常用的化疗药物Ara-C。由于GLC成分比较复杂,其诱导分化的机制有待进一步阐明。
, 百拇医药
恶性肿瘤的发生与肿瘤细胞增殖和分化之间的平衡失调有关,表现为增殖失控而分化受阻。GLC可通过诱导白血病细胞向成熟阶段分化,从而抑制其增殖。这可能是GLC抗白血病作用的机理之一。GLC能促进骨髓正常粒系造血,同时对白血病细胞有选择性杀伤及分化诱导作用,因此有望成为一种较理想的白血病治疗药物。
参 考 文 献
1 王承龙,王绮如.人纤维母细胞条件培养液对CFU-GM生长的影响. 湖南医科大学学报,1995,20(5):409~411
2 Rowley PT, Ohlsson-Wilhelm BM, Farley BA, et al. Inducers of erythroid d ifferentiation in K562 human leukemia cells. Exp Hematol, 1981,9(1):32~37
, 百拇医药
3 林志彬.灵芝多糖的免疫学药理学研究及其意义.北京医科大学学报,1992,(4):271~273
4 李晓玉.灵芝多糖免疫增强作用.中国医药杂志,1990,(6):542~544
5 Sone Y, Okuda R, Wada N, et al. Structure and antitumor activity of polys accharides isolated from fruiting body and growing culture of mycelium of Ganode rma Lucidum. Agric Biol Chem, 1985,49(9):2841~2846
6 Miyazaki T, Nishijima M. Studies on fungal polysacharides XXⅦ: Structuralex amination of a water-soluble antitumor polysaccharide of Ganoderma Lucidum. Chem Pharm Bull, 1981,29(12):3611~3616
, http://www.100md.com
7 Maruyama H, Yamazaki K, Murofushi S, et al. Antitumor activity of Sarcodon aspratus(Berk.) Ito and Ganoderma Lucidum(Fr.) Karst. J Pharmacobiodyn, 1989 ,12:118~123
8 Hwang SF, Liu KJ, Kuan YH, et al. The inhibitory effect on artificial pul monary metasis of murine S-180 sarcoma cells by orally administered Ganoderma Lucidum culture broth. J Chinese Onco Soc, 1989,5:10~15
9 Lieu CW, Lee SS, Wang SY. The effect of Ganoderma Lucidum on induction of dif ferentiation on leukemic U937 cells. Anticancer Res, 1992,12(4):12111~1215
10 Rowley PT. K562 human erythroleukemia cells demonstrate commitment. Blood, 1985,65(4):862~866, http://www.100md.com
单位:(血液生理研究室 长沙 410078)
关键词:灵芝方*;阿糖胞苷*;粒单系祖细胞;K562细胞;增殖;分化;药物作用
湖南医科大学学报990608
提要 用细胞培养、细胞形态学及联苯胺染色法观察中药灵芝复方对K562白血病细胞的增殖抑制及分化 诱导作用。结果显示:灵芝复方在一定浓度范围内对正常人骨髓CFU-GM生长有促 进作用(P<0.05),而对白血病细胞系K562细胞增殖表现出剂量和时间依赖性抑制(P<0.05);在诱导分化剂量下,灵芝复方可促进K562细胞向红系分化。可见,灵芝复方有望成为一种抗白血病中药。
中国图书分类号 R282.71 R733.7
, http://www.100md.com
Effects of Ganoderma lucidum(Leyss ex Fr) Karst compound on
the proliferation and differentiation of K562 leukemic cells
Zhong Li Jiang Dezhao Wang Qiru
(Research Laboratory of Blood Physiology, Hunan Medical University, Chang sha 410078)
A series of experiments including cell culture and benzidine staining test were undertaken to investigate the effects of Ganoderma lucidum(Leyss ex Fr) Karst Compound(GLC) on the proliferation and differentiation of K562 leukem ic cells. The results showed that different concentrations of GLC(from 4mg.ml-1 to 12mg.ml-1) could promote human bone marrow granulocyte-mac rophage colony forming unit(CFU-GM) proliferation, but suppressed the growth of K562 leukemic cell colonies, and IC50 was 9.2mg.ml-1. The data from liquid culture demonstrated that GLC could suppress K562 cells proliferation in a dose-dependent(from 4mg.ml-1 to 20mg.ml-1) and time-dependent(from 1~5 days) manner. K562 cells could be induced to differentiate into more mature erythrocytic cells by 4mg.ml-1 and 8mg.ml-1 GLC. It is concluded that GLC may be a good medicine for leukemia therapy.
, 百拇医药
Key words Ganoderma lucidum(Leyss ex Fr) Karst*; cytarabine*; granulocyte-macrophage colony forming unit; K562 cells; proliferation; differentiation; drug effects
癌细胞的增殖抑制和分化诱导已成为肿瘤治疗的一个重要手段。自从Leo Sachs于1978年报道恶性肿瘤细胞可以转化为较成熟或较良性的细胞以来,有关分化诱导剂的研究及其应用已引起人们的广泛注意。用中药成分作为白血病细胞分化诱导剂也有了不少报道。本室发现由灵芝、黄芪、党参、当归、甘草等中草药配伍组方而成的灵芝复方[Ganoderma lucidum (Leyss ex Fr) Karst compound, GLC] ,在一定浓度范围内能促进正常小鼠骨髓粒-单系祖细胞(粒-单系集落形成单位,CFU-GM)增殖,并对小鼠白血病细胞系WEHI-3细胞集落生长呈剂量依赖性抑制。为进一步了解灵芝复方的骨髓保护及抗白血病作用,为其临床应用提供依据,本研究以人白血病细胞系K562细胞为模型,旨在探索GLC对白血病细胞增殖、分化的影响,以阐明其抗白血病的有关机制。
, 百拇医药
1 材料与方法
1.1 材料
1.1.1 骨髓标本 来自湖南医科大学附属湘雅医院、附二院胸外科手术非血液 病患者的肋骨。
1.1.2 细胞系 K562细胞系由本校免疫研究室惠赠。以1×105个.ml-1浓度加入到含10%新生牛血清(NBS)的RPMI-1640培养基中,置37℃,5% CO2,饱 和湿度的培养箱中培养,每3~4d传代1次。
1.1.3 药物 灵芝复方各组药由湘雅医院中药房提供,经水泡、煮沸、过滤提取、醇沉、蒸馏,用双蒸水稀释,使含生药0.8g.ml-1,过滤除菌,4℃保存,使用前调pH7.4。阿糖胞苷盐酸盐(Ara-C hydrochloride)(美国Sigma Co),用三蒸水 配成1.0mol.L-1贮存液,置-20℃备用。
, 百拇医药
1.1.4 试剂 DMEM(Dubecco's modified Eagle's medium,美国Sigma Co),RPMI-1640(美国Gibco BRL)按说明配制。新生牛血清(杭州四季青生物工程材料研究所),马血清(HS)(北京军事医学科学院),56℃ 30min灭活,分装,-20℃冻存备用。重组人粒单系集落刺激因子(rhGM-CSF,Genzyme Co)。联苯胺盐酸盐(benzidine dihydrochlo ride)(美国Sigma Co),用0.5%乙酸配成浓度为2mg.ml-1,避光4℃保存备用 。
1.2 方法
1.2.1 人骨髓单个核细胞的制备[1] 将胸外科手术取下的肋骨用DMEM培养液清洗,用骨钳挤出骨髓,加适量DMEM培养液混悬,弃去上层脂肪,过6号、4号针头各两次,制成单细胞悬液,用比重为1.077的淋巴细胞分离液分离,收集单个核细胞,经DMEM培养液洗涤,调整到所需细胞浓度。
, http://www.100md.com
1.2.2 人骨髓细胞CFU-GM体外培养[1]将20×104个.ml -1人骨髓单个核细胞加入到体外半固体琼脂培养体系(含28% HS,10%人AB血清,50U.ml-1 rhGM-CSF,0.3%琼脂)中,实验组加不同浓度的GLC(4~20mg.ml -1),并按GLC浓度分成5组,对照组加等量DMEM培养液,种植培养体系1ml于直径30mm的培养皿中,每 组平行3皿,置37℃,5% CO2,饱和湿度的培养箱中培养14d后取出,倒置显微镜下观察,以大于40个细胞组成的集落计数为一个CFU-GM。
1.2.3 K562细胞集落培养 取指数生长期K562细胞1×303个.ml-1,加入到含25%NBS,0.3%琼脂的培养体系中,实验组加不同浓度的GLC(4~20mg.ml-1),并按GLC浓度分为五组,对照组加等量培养液,种植培养体系1ml于直径30mm的玻璃培养皿中,每组平行3皿,置37℃,5% CO2,饱和湿度的培养箱中培养7d,倒置显微镜下计数集落(大于50个细胞的细胞团为一个集落)。
, http://www.100md.com
1.2.4 K562细胞液体培养 取指数生长期K562细胞1×105个.ml-1,加入培养体系,对照组不加药物,加等量培养液,实验组Ⅰ加不同浓度的GLC(4~20 mg.ml-1)共5小组,实验组Ⅱ加不同浓度的Ara-C(10-9~10-5mol.L -1)共5小组,种植培养体系0.5ml于24孔培养板,每组平行3孔,培养1~5d ,每天计数K562活细胞数目。
1.2.5 形态学观察(Wright-Giemsa染色) 根据GLC对K562细胞的抑制程度,选用4mg.ml-1与8mg.ml-1作为GLC诱导分化用浓度。在含RPMI-1640,10%NBS,1×105个.ml-1的K562细胞培养体系中,加入不同浓度的GLC,置37℃,5%CO2,饱和湿度的培养箱中培养5d,将细胞涂片,Wright-Giemsa染色,油镜下观察细胞形态并摄影。
, 百拇医药
1.2.6 联苯胺染色[2] 将4mg.ml-1与8mg.ml-1GLC处理(用10-5mol.L-1 Ara-C作阳性对照)的K562细胞置37℃,5%CO2,饱和湿度的培养箱中培养1~5d,每天取2mg.ml-1联苯胺溶液与30% H 2O2(5μl.ml-1)混合,等量加入细胞培养体系中,反应5min,在光学显微镜 下(40×)观察200个细胞。联苯胺阳性细胞胞浆染成蓝色,阴性细胞为黄色或无色。计数联苯胺阳性细胞百分率。
1.3 统计学处理 实验结果以
 ±s表示,各组间差异采用 F检验,若F>F0.05,则两两比较用Student-Newman-Keuls q检验。IC50的计算用概率单位法。
±s表示,各组间差异采用 F检验,若F>F0.05,则两两比较用Student-Newman-Keuls q检验。IC50的计算用概率单位法。, http://www.100md.com
2 结 果
2.1 GLC对人骨髓CFU-GM增殖的影响 如图1所示,与对照组比较,GLC为4 mg.ml-1时,CFU-GM数明显增加(P<0.01),8mg.ml-1,12mg.ml-1 时仍有明显增加(P<0.05),各浓度间无显著性差异(P>0.05 )。GLC达 20mg.ml-1时,对CFU-GM增殖出现抑制作用(P<0.01)。
2.2 GLC对K562细胞集落产率的影响 由图1可见,GLC(4~20mg.ml -1)对K562细胞集落生长均呈剂量依赖性抑制(P<0.01)。IC50为9.2mg.ml -1。
, 百拇医药
2.3 GLC和Ara-C对K562细胞计数的影响 加入GLC(4~20mg.ml-1),在培养的1~5d内,K562细胞生长均呈剂量与时间依赖性抑制(P<0.05)(图2A), 第3d和第5d K562细胞IC50分别为8.1mg.ml-1和6.3mg.ml-1;加 入Ara-C(10-9~10-5mol.L-1),培养1~5d,K562细胞生长同样呈剂量和时间依赖性抑制(P<0.05)(图2B),第3d和第5d K562细胞IC50分别为2.1×10-7mol.L-1和2.1×10-8mol.L-1。

, http://www.100md.com
图1 灵芝复方对人骨髓CFU-GM及K562细胞集落生成的影响与对照组比①P<0.05;②P<0.01
Fig. 1 Effect of GLC on the colo ny growth of CFU-GM derived from human bone marrow and K562 leukemic cells resp ectively

图2 不同浓度灵芝复方(A)和Ara-C(B)对K562细胞生长曲线的影响
Fig. 2 Effects of GLC(A) and Ara-C(B) on the growth curve of K562 leukemic cells

, 百拇医药
图3 对照组K562细胞培养5d形 态。Wright-Giemsa染色(×330)
Fig. 3 Morphology of K562 leukemic c ells cultured for 5 days, stained with Wright-Giemsa(×330)

图4 经8mg.ml-1 GLC处理的K562细胞培养5d,部分细胞向红系分化(↑) Wright-Giemsa染色(×330)
Fig. 4 K562 cells induced to differenti ate into mature erythrocytic cells (↑) by 8mg.ml-1 GLC for 5 days, sta ined with Wright-Giemsa (×330)
, 百拇医药
2.4 GLC对K562细胞的诱导分化作用 形态学观察结果显示:对照组K562细胞体积大,外形不规则;核大,呈圆或椭圆形,染色质疏松细致,可见2~5个核仁,核浆比例大;胞浆深蓝色,有空泡,有的可见伪足(图3)。经GLC处理的K562细胞形态产生明显变化,细胞体积变小,核染色质浓缩,核浆比例变小,胞浆呈灰蓝色,原始细胞减少,中、晚幼红细胞明显增多(图4)。
联苯胺染色结果显示,4mg.ml-1与8mg.ml-1 GLC处理的K562细胞联苯胺 阳性率呈时间依赖性增高,并与剂量有关(P<0.05)。4mg.ml-1与8mg.ml-1 GLC处理5d的K562细胞联苯胺阳性率分别为25.8%和31.0%,10-5mol.L-1 Ara-C处理组为79.3%,均明显高于对照组(P<0.01),且8mg.ml- 1 GLC组联苯胺阳性率明显高于4mg.ml-1 GLC组(P<0.01)(附表)。
, 百拇医药
附表 灵芝复方与Ara-C对K562细胞联苯胺阳性率的影响(n =3;
 ±s) 组 别
±s) 组 别联苯胺阳性率(%)
1d
2d
3d
4d
5d
对照组
5.3±1.0
4. 3±0.8
5.8±1.3
, 百拇医药
7.5±1.5
8.3±1.6
10-5mol.L-1 Ara-C组
19.0±2.3②
28.3±2 .3②
47.7±3.5②
67.8±2.3②
79.3±2.3②
4mg.ml-1 GLC组
, 百拇医药
8.5±0.5①
11.3±0.8 ②
14.2±1.5②
21.0±3.0②
25.8±1.8②
8mg.ml-1 GLC组
11.3±0.8②③
15.2±1.8②③
19.5±2.5②③
, 百拇医药
26.2±1.5②③
31.0±1.8②③
与对照组比①P<0.05;②P<0.01;与4mg.ml-1 GLC组比③P<0.05 ;④P<0.01
3 讨 论
迄今用于白血病临床的化疗药物包括烷化剂、抗代谢药、抗生素及激素等,这些药物副作用 较强,对骨髓造血细胞的破坏较大。某些中药及天然药物不但可以杀灭肿瘤细胞,且副作用较小。灵芝为灵芝属真菌,中医临床药用主要为赤芝[Ganoderma lucidum(Leyss ex Fr Karst]和紫芝[Gjaponicum(Fr) Leoyd],是滋补强壮、扶正固本的珍贵药物。现代医学证明,灵芝具有促进细胞免疫和骨髓造血机能[3,4]。同时有研究表明,灵芝中各成分对多种肿瘤有抑制作用,如灵芝菌丝体提取物对S-180实体瘤有明显的抑制作用[5,6]。从赤芝中分离的三萜类成分灵芝酸对离体培养的肝肉瘤具细胞毒性。有人认为,灵芝的抗瘤活性与其高含量的碳水化合物有关[7,8]。本研究的结果显示,GLC在一定浓度范围内(4~12mg*ml-1)能促进正常骨髓粒系造血,而对K562细胞增殖却表现出明显的抑制作用,且与作用时间和剂量有关。说明GLC对白血病细胞有选择性杀伤作用。
, http://www.100md.com
许多药理活性物质如Ara-C,维甲酸,佛波酯(TPA),维生素D3等能诱导多种癌细胞分化,其中包括白血病和某些实体瘤细胞。中药成分对白血病细胞的分化诱导作用,目前亦有不少报道。研究表明,三尖杉酯碱、人参皂甙、苦参等可诱导HL-60细胞向单核-巨噬细胞系分化;三七皂甙、鹿精等可诱导HL-60细胞向成熟中性粒细胞分化;人参皂甙还可诱导K562细胞向红系分化。Lieu-CW等[9]发现从灵芝中提取的多糖能刺激人外周血单个核细胞分泌细胞因子,如IL-1β,TNF-α等,从而诱导白血病细胞系U937细胞向单核系分化。可见,许多中药通过诱导白血病细胞分化来发挥抗白血病作用。
在分化诱导剂作用下,K562细胞可向红系分化,其主要标志是Hb合成,表现为联苯胺反应阳性[10]。本研究结果显示,在体外培养中,4mg*ml-1与8mg*ml-1GLC能使K562细胞形态发生改变,中、晚幼红细胞明显增加;联苯胺阳性率也明显增高,且呈时间与剂量依赖关系。这表明在诱导分化剂量下,GLC可促使K562细胞向红系分化。但其诱导分化作用弱于常用的化疗药物Ara-C。由于GLC成分比较复杂,其诱导分化的机制有待进一步阐明。
, 百拇医药
恶性肿瘤的发生与肿瘤细胞增殖和分化之间的平衡失调有关,表现为增殖失控而分化受阻。GLC可通过诱导白血病细胞向成熟阶段分化,从而抑制其增殖。这可能是GLC抗白血病作用的机理之一。GLC能促进骨髓正常粒系造血,同时对白血病细胞有选择性杀伤及分化诱导作用,因此有望成为一种较理想的白血病治疗药物。
参 考 文 献
1 王承龙,王绮如.人纤维母细胞条件培养液对CFU-GM生长的影响. 湖南医科大学学报,1995,20(5):409~411
2 Rowley PT, Ohlsson-Wilhelm BM, Farley BA, et al. Inducers of erythroid d ifferentiation in K562 human leukemia cells. Exp Hematol, 1981,9(1):32~37
, 百拇医药
3 林志彬.灵芝多糖的免疫学药理学研究及其意义.北京医科大学学报,1992,(4):271~273
4 李晓玉.灵芝多糖免疫增强作用.中国医药杂志,1990,(6):542~544
5 Sone Y, Okuda R, Wada N, et al. Structure and antitumor activity of polys accharides isolated from fruiting body and growing culture of mycelium of Ganode rma Lucidum. Agric Biol Chem, 1985,49(9):2841~2846
6 Miyazaki T, Nishijima M. Studies on fungal polysacharides XXⅦ: Structuralex amination of a water-soluble antitumor polysaccharide of Ganoderma Lucidum. Chem Pharm Bull, 1981,29(12):3611~3616
, http://www.100md.com
7 Maruyama H, Yamazaki K, Murofushi S, et al. Antitumor activity of Sarcodon aspratus(Berk.) Ito and Ganoderma Lucidum(Fr.) Karst. J Pharmacobiodyn, 1989 ,12:118~123
8 Hwang SF, Liu KJ, Kuan YH, et al. The inhibitory effect on artificial pul monary metasis of murine S-180 sarcoma cells by orally administered Ganoderma Lucidum culture broth. J Chinese Onco Soc, 1989,5:10~15
9 Lieu CW, Lee SS, Wang SY. The effect of Ganoderma Lucidum on induction of dif ferentiation on leukemic U937 cells. Anticancer Res, 1992,12(4):12111~1215
10 Rowley PT. K562 human erythroleukemia cells demonstrate commitment. Blood, 1985,65(4):862~866, http://www.100md.com