Fas抗原在超抗原诱导T细胞凋亡中的作用*
作者:宋建勋** 朱锡华 陈克敏
单位:第三军医大学基础医学部免疫学教研室、全军免疫学研究所 重庆,400038
关键词:Fas抗原;T细胞;细胞凋亡;Ca2+;超抗原
第三军医大学学报990604 提 要 目的:研究Fas抗原介导的死亡效应在超抗原诱导T细胞凋亡中的作用。方法:SEA诱导从人外周血建立的短期SEA反应T细胞系凋亡,1.8%琼脂凝胶DNA电泳观察凋亡的特征条带;FCM检测Fas、FasL的表达量变化,Fura-2/AM荧光指示剂检测胞浆[Ca2+]i的变化。结果:使用FCM特异性检测凋亡亚G0/G1峰大小及1.8%琼脂糖凝胶电泳检测凋亡DNA梯状图谱证明,SEA能诱导短期SEA反应T细胞凋亡,其凋亡的时间与程度与SEA的使用剂量有关。SEA 1 μg/ml建立的短期SEA反应T细胞对SEA 1 μg/ml的再次刺激,凋亡量随作用时间的延长而增多,在作用的第16 h最高,达58%。FCM间接荧光染色法检测发现,Fas及FasL亦随SEA作用时间的延长而表达增多,16 h时表达最多,分别为92%和60%。用Fura-2/AM荧光指示剂检测此时细胞胞浆[Ca2+]i已从刺激前的(290±33)nmol/L上升到(680±16)nmol/L。结论:Fas抗原与SEA诱导的T细胞凋亡密切相关,换言之,Fas抗原在超抗原诱导T细胞凋亡中起作用,而胞浆[Ca2+]i升高与SEA诱导的凋亡T细胞DNA断裂及其它凋亡形态变化有关。
, http://www.100md.com
中图法分类号 R329.25;R392.1
The role of Fas antigen in superantigen-induced apoptosis of T-cells*
Song Jianxun, Zhu Xihua, Chen Kemin (Institute of Immunology, Third Military Medical University, Chongqing,400038)
Abstract Objective: To study the role of Fas antigen-mediated killing effect in the superantigen-induced T-cell apoptosis. Methods: T-cell apoptosis was induced by SEA in the SEA-reactive T-cell line established from human peripheral blood mononuclear cells (PBMC). The features of apoptosis were observed with optical microscope, flow cytometry (FCM) and DNA electrophoresis. The Fa/FasL ratio and cytosolic Ca2+ concentration were measured with FCM and fluorescent probe Fura-2/AM. Results: A short term SEA reactive T-cell line was established by stimulating PBMC 106 with 1 μg/ml SEA for 3 days and expanding the cells in rIL-2(200 U/ml). The cells were maintained in rIL-2 for 2 weeks before use. Both FCM and DNA electrophoresis could demonstrate that apoptosis appeared obviously by second stimulation of the SEA-reactive T-cells with SEA 1 μg/ml. Fas/FasL was substantially upregulated with an increase of cytosolic free Ca2+. Conclusion: These findings suggest that Fas antigen plays an important role in the superantigen-induced T-cell apoptosis and the increase of cytosolic Ca2+ was related to DNA fragmentation and morphological changes of T-cell apoptosis.
, 百拇医药
Key words Fas antigen; T cell; apoptosis Ca2+; superantigen
许多研究发现,超抗原(Superantigen,SAg)在激活大量特异性T细胞后,可导致激活诱导的细胞死亡(Activation-induced cell death,AICD),即T细胞凋亡,与SAg诱导的T细胞克隆缺失有关。SAg诱导T细胞凋亡的机制比较复杂,影响因素比较多,如抗原递呈细胞(Antigen-presenting cells, APC)存在与否,细胞因子是否缺乏,T细胞所处的生长时期等等。有研究显示,Fas抗原在SAg诱导的T细胞凋亡中起重要作用[1];也有相反的观点,认为SAg诱导体内T细胞凋亡与环境中的某些细胞因子有关(如γ-INF,IL-2),Fas抗原在其中不起作用[2];也有折中观点,认为Fas抗原在其中起作用,但不是唯一因素[3,4]。但无论如何,Fas抗原作为“死亡分子”在其中的作用正日益受到重视。本研究采用SAg中的金黄色葡萄球菌A型肠毒素(Staphylococcal enterotoxin A, SEA)诱导人外周血中特异性T细胞凋亡,研究Fas抗原在其中的作用,并对此凋亡过程中[Ca2+]i的变化进行了观察。
, 百拇医药
1 材料与方法
1.1 材料
1.1.1 主要试剂 SEA(1 mg,军事医科院产品),白细胞成份血液标本(重庆西南医院输血科,批号971124~1538)。碘化丙啶(PI,Sigma),非离子去污剂Triton X-100(Sigma)。荧光指示剂Fura-2/AM(BM)。DNA Marker:λDNA/EcoRI+HindⅢ(华美)。酶:蛋白酶K、RNase A(华美)。抗体:鼠抗人Fas mAb DX2、鼠抗人FasL mAb(PharMingen),异硫氰酸荧光素(FITC)标记羊抗鼠IgG(华美)。
1.1.2 细胞培养液 10% NCS的RPMI 1640培养液(Gib-co),其中含100 U/ml青霉素,100μg/ml链霉素,10 mmol/L HEPES, 2 mmol/L-Gln。
, 百拇医药
1.1.3 主要仪器 FACStar plus FCM(Becton-Dickinson);MPF-4荧光分光光度计(Hitachi)。
1.2 方法
1.2.1短期人外周血SEA反应T细胞系的建立 参照文献[5]进行。
1.2.2 SEA诱导短期人外周血SEA反应T细胞系凋亡收集 短期人外周血SEA反应T细胞,Hanks溶液洗涤离心,细胞用含10% NCS的RPMI1640完全培养液悬浮,调整密度为5×105/ml,加入24孔平底细胞培养板(Costar),1 ml/孔,37°C,5% CO2的饱和湿度条件下培养2 h。细胞培养液中加入SEA 1μg/ml,继续培养。
1.2.3 短期人外周血SEA反应T细胞凋亡检测 于培养的不同时间(0、2、4、8、16、24、32 h)收集细胞检测。①用PI低渗荧光染色液染色(PI 50 μg/ml,枸椽酸钠0.1%,Triton X-100 0.1%),参照文献[6],FCM检测亚G0/G1峰大小(Ao),反映已固缩和降解核DNA的细胞数,即凋亡细胞比率。实验2次,取平均值。②常规方法提取细胞DNA[7],1.8%琼脂糖凝胶电泳,观察凋亡细胞DNA梯状电泳带。
, 百拇医药
1.2.4 SEA反应T细胞凋亡过程中Fas、FasL表达量检测 采用间接免疫荧光染色法。即于培养的不同时间(同上)收集培养细胞(5×105/孔),用冷染色溶液PBA(PBS+2%BSA+0.1%NaN3)离心洗涤2次后加入第一抗体——鼠抗人Fas mAb或鼠抗人FasL mAb 200μl(1∶50 PBS稀释),以等量正常小鼠IgG为对照,4°C孵育30 min。冷PBA离心洗涤2次后,加入荧光素标记的第二抗体——羊抗小鼠IgG-FITC 200μl(1∶50 PBA稀释),4°C避光孵育30 min。冷PBS离心洗涤2次,将细胞重悬于200μl PBS中,混匀,置FACS测试管,上机FCM检测。实验2次,取平均值。
1.2.5 SEA诱导SEA反应T细胞凋亡过程中胞浆游离[Ca2+]i的变化 SEA 1μg/ml诱导SEA反应T细胞(SEA 1μg/ml刺激后建立)凋亡,于0、2、4、8、16、24、32 h,收集细胞,参照文献[7]进行Fura-2/AM负载及[Ca2+]i测定。实验2次,取平均值。
, 百拇医药
2 结果
2.1 SEA诱导人外周血短期SEA反应T细胞凋亡
短期SEA反应T细胞聚集生长,母细胞化现象多见,见图1A,SEA1μg/ml诱导同样剂量刺激建立的短期SEA反应T细胞凋亡非常明显。光镜下,作用8h可观察到部分细胞死亡,见图1B,作用16 h则出现比较明显的凋亡细胞特征,见图1C。FCM分析亚G0-G1峰(A0)显示,随着诱导时间的延长,凋亡量逐步升高,至作用的第16 h,细胞凋亡量可达52%,见图2A。SEA反应T细胞(SEA 1μg/ml使用剂量诱导建立)凋亡量随SEA再次刺激浓度(0.5~6μg/ml)的升高而增加,见图2B。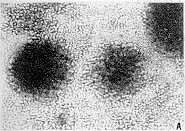


, 百拇医药
图1 SEA诱导SEA反应T细胞凋亡的形态 (LM×100)
A:SEA反应T细胞系 B:SEA 1 μg/ml再次作用8 h C:SEA 1 μg/ml再次作用16 h
Fig 1 Morphology of apoptosis induced by SEA in SEA-reactive T cells (LM×100)
A:SEA-reactive T cell line B: 8 h treated again by SEA 1 μg/ml C:16 h treated again by SEA 1 μg/ml

图2 FCM分析SEA诱导SEA反应T细胞凋亡
, 百拇医药
A:SEA作用剂量与凋亡量的关系 B:SEA 1 μg/ml作用时间与凋亡量的关系
Fig 2 Analysis of apoptosis induced by SEA in SEA-reactive T cells by flow cytometry
A:Dose response of SEA-reactive T cells to addition of SEA for 16 h B:Kinetics of apoptosis induced by SEA 1 μg/ml in SEA-reactive T cells
1.8%琼脂糖凝胶细胞DNA电泳显示,SEA 1μg/ml诱导同样剂量刺激建立的短期SEA反应T细胞于作用的第16 h,DNA电泳成较明显梯形泳带。至作用的第24 h和32 h时,由于死亡细胞增多,DNA梯形渐弱,而近呈模糊的片状条带,见图3。
, http://www.100md.com
图3 DNA琼脂糖凝胶电泳分析SEA诱导SEA反应T细胞凋亡
1. DNA标准(λ DNA/EcoRI+HindⅢ), 2.0 h, 3.16 h, 4.12 h, 5.8 h
Fig 3 Analysis of apoptosis induced by SEA in SEA-reactive
T cells by DNA electrophoresis with 1.8% agarose gel
1. DNA Marker (λ DNA/EcoRI+HindⅢ), 2.0 h,3.16 h,4.12 h, 5. 8 h
2.2 SEA反应T细胞凋亡过程中Fas、FasL表达量变化
, http://www.100md.com
短期SEA反应T细胞Fas抗原已有较高表达,荧光密度强度(MFI)已达到近85%,当受SEA再次作用后,Fas抗原表达继续升高,至作用的第16 h时达到最高值92%,见图4A。
FasL在未受到SEA再次作用前,荧光密度强度为8%,以后逐步升高,但速度较慢,至作用的第16 h,达60%,见图4B。
2.3 SEA诱导SEA反应T细胞凋亡与Fas、FasL表达相关
SEA再次作用的第16 h,细胞凋亡量达58%的最高值,此时Fas与FasL表达亦最高,分别为92%、60%,说明Fas、FasL表达与SEA反应T细胞凋亡相关。

, 百拇医药 图4 SEA诱导SEA反应T细胞Fas、FasL表达情况
A:SEA 1 μg/ml诱导SEA反应T细胞Fas表达的动态观察 B:SEA 1 μg/ml诱导SEA反应T细胞FasL表达的动态观察
Fig 4 Functional expression of Fas, FasL induced by SEA in SEA-reactive T cells
A:Kinetics of Fas expression induced by SEA 1 μg/ml in SEA-reactive T cells B:Kinetics of FasL expression induced by SEA 1 μg/ml in SEA-reactive T cells
2.4 SEA诱导SEA反应T细胞凋亡过程中胞浆游离[Ca2+]i的变化
, http://www.100md.com
SEA反应T细胞在SEA 1 μg/ml再次刺激前胞浆游离[Ca2+]i为(290±8)nmol/L,至刺激后8 h和16 h,[Ca2+]i则明显升高,分别达(330±21)nmol/L和(680±16)nmol/L,以后[Ca2+]i又下降,见图5。
图5 SEA(1 μg/ml)诱导SEA反应T细胞凋亡过程中胞浆游离[Ca2+]i的变化
Fig 5 Changes of cytosolic free [Ca2+]i during apoptosis induced by SEA (1 μg/ml) in SEA-reactive T cells
3 讨论
, 百拇医药
SAg诱导T细胞凋亡常使机体产生免疫耐受或相关细胞克隆缺失,而对再次刺激出现无反应性,现今虽然对其作用机制的理解尚有分歧,但许多研究显示,Fas抗原可能在SAg诱导T细胞凋亡中起重要作用。体内实验发现,金黄色葡萄球菌B型肠毒素(Staphylococcal enterotoxin B, SEB)10μg注入小鼠体内后,优先激活Vβ8+ T细胞,使之数量迅速增高,随后逐渐降低,最后降至比SAg注入前还低的水平。使用FCM技术检测发现,SEB激活的Vβ8+ T细胞Fas与FasL呈高效表达。可能由于二者结合介导Vβ8+ T细胞凋亡而使Vβ8+ T细胞数量下降所致。而在FasL缺陷的gld小鼠体内,体内注射SEB并未使Vβ8+ T细胞数量明显降低。从正常小鼠外周血分离的CD4+T细胞受到SEB诱导可发生AICD,加入可溶性Fas-IgG融合蛋白则可阻止AICD,细胞数量并不减少,提示Fas/FasL的相互作用导致了SEB诱导的AICD[8,9]。而从Fas抗原缺陷的Lpr小鼠和FasL缺陷的gld小鼠外周血分离的CD4+ T细胞受到SEB同样诱导下,并不发生AICD,细胞处于增殖状态。同样,利用基因敲除技术获得的Fas抗原阴性小鼠,受到内源性SAg作用时,外周血特异性T细胞并不发生克隆缺失,而是持续大量增生,伴随淋巴细胞在肝、肺浸润[10];SEA和小鼠腺肿瘤病毒(MMTV)编码的内源性超抗原Mtv-7-SAG在诱导外周血T细胞克隆缺失中,Fas系统亦起重要的作用[4,5]。从我们检测SEA诱导短期SEA反应T细胞凋亡过程中Fas与FasL的表达情况看,发生T细胞凋亡的最高点是 Fas与FasL表达的最多之时(SEA作用的第16 h),此时,T细胞胞浆游离[Ca2+]i亦最高。因此,认为SAg在无APC或相关辅助分子存在情况下,刺激T细胞高效表达Fas、FasL,Fas/FasL相互交联,传导死亡信号入胞内,激活相关酶类,引起胞浆游离[Ca+]i升高,再激活Ca2+依赖的核酸内切酶等,发生T细胞凋亡。
, 百拇医药
在有APC存在情况下,APC表面的B7分子与T细胞表面的CD28分子相互作用,提供一个共刺激信号,使SAg作用的特异性T细胞上调Bcl-2或Bcl-XL等基因,反式抑制FasL表达,从而绕过了Fas抗原死亡信号途径,T细胞增殖而不是凋亡[11]。辅助分子抗CD28 mAb可模拟APC表面上的B7分子与T细胞上CD28分子结合,而促使T细胞增殖。高浓度IL-2本身对T细胞就起增殖作用,在体内能诱导SAg作用的特异性T细胞bcl-2基因表达,拮抗Fas抗原介导的T细胞凋亡。这是移植IL-2泵能抑制SAg诱导T细胞凋亡的原因,至于SAg在体内激活大量T细胞之后出现的IL-2缺乏的原因尚不清楚[12]。PMA协助SAg诱导T细胞增殖是通过激活PKC途径而促进IL-2的高效表达来实现的。
因此,SAg在APC存在的情况下,特异性T细胞接受两个信号刺激,起始信号是通过TCR-CD3复合分子,即SAg一端与T细胞表面TCRVβ链结合和(或无)另一端与MHCⅡ类分子的非多态区结合所产生。协同刺激信号来自APC上的B7分子与T细胞上的辅助分子CD28分子相互作用。在这两信号刺激下,特异性T细胞大量增殖。而当无APC和辅助分子存在时,SAg诱导特异性 T细胞高效表达Fas与FasL,二者交联,传导死亡信号入胞内,而引起T细胞凋亡。高浓度IL-2能抑制SAg在无APC及辅助分子存在下所诱导的T细胞凋亡,而促使其增殖,原因是上调T细胞Bcl-2基因表达,抑制了Fas抗原介导的凋亡。
, 百拇医药
*全军“九五”重点项目,No.96Z038
**宋建勋,男,31岁,讲师,博士
*This project was supported by the "Ninth five" obligatory budget of PLA,No.96L038
参考文献
1 Wang J K M, Zhu B, Ju S T, et al. CD4+ T cells reactivated with superantigen are both more sensitive to FasL-mediated killing and express a higher level of FasL. Cell Immunol,1997,179(2):153
, 百拇医药
2 Cauley L S, Cauley K A, Shub F, et al. Transferable anergy:superantigen treatment induces CD4+ T cell tolerance that is reversible and requires CD4-CD8- cells and interferon gamma. J Exp Med, 1997,186(1):71
3 Mountz J D, Wu J, Zhou T, et al. Cell death and longevity: implications of Fas-mediated apoptosis in T-cell senescence. Immunol Rev,1997,60(1):19
4 Papiernik M, Pontoux C, Golstein P. Non-exclusive Fas control and age dependence of viral superantigen-induced clonal deletion in lupus-prone mice. Eur J Immunol,1995,25(6):1517
, 百拇医药
5 Alderson M, Tough T W, Davis-Smith T, et al. Fas ligand mediates activation-induced cell death in human T lymphocytes. J Exp Med,1995,181(1):71
6 Nicoletti I, Migliorati G, Pagliacci M C, et al. A rapid and simple method for measuring thymocyte apoptosis by propidium iodide staining and flow cytometry. J Immunol Methods,1991,139(2):271
7 Malgaroli A, Milani d, Meldolesi J, et al. Fura-2 measurement of cytosolic free Ca2+ in monolayers and suspensions of various types of animal cells. J Cell Biol,1987,105(5):2145
, 百拇医药
8 Boshell M, Mcleod J, Walker L, et al. Effects of antigen presentation on superantigen-induced apoptosis mediated by Fas/Fas ligand interactions in human T cells. Immunology,1996,87(4):586
9 Renno T, Hahne M, Tschopp J, et al. Peripheral T cells undergoing superantigen-induced apoptosis in vivo express B220 and upregulate Fas and Fas ligand. J Exp Med,1996,183(2):431
10 Adachi M, Suematsu S, Suda T, et al. Enhanced and accelerated lymphoproliferation in Fas-null mice. Proc Natl Acad Sci USA, 1996,93(5):2131
, 百拇医药
11 Boise L H, Minn A J, Noel P J, et al. CD28 costimulation can promote T cell survival by enhancing expression of Bcl-XL. Immunity,1995,3(1):87
12 Kuroda K, Yagi J, Imanishi K, et al. Implantation of IL-2-containing osmotic pump prolongs the survival of superantingen-reactive T cells expanded in mice injected the bacterial superantigen. J Immunol,1996,157(4):1422
收稿:1998-10-30;修回:1999-01-25, 百拇医药(宋建勋** 朱锡华 陈克敏)
单位:第三军医大学基础医学部免疫学教研室、全军免疫学研究所 重庆,400038
关键词:Fas抗原;T细胞;细胞凋亡;Ca2+;超抗原
第三军医大学学报990604 提 要 目的:研究Fas抗原介导的死亡效应在超抗原诱导T细胞凋亡中的作用。方法:SEA诱导从人外周血建立的短期SEA反应T细胞系凋亡,1.8%琼脂凝胶DNA电泳观察凋亡的特征条带;FCM检测Fas、FasL的表达量变化,Fura-2/AM荧光指示剂检测胞浆[Ca2+]i的变化。结果:使用FCM特异性检测凋亡亚G0/G1峰大小及1.8%琼脂糖凝胶电泳检测凋亡DNA梯状图谱证明,SEA能诱导短期SEA反应T细胞凋亡,其凋亡的时间与程度与SEA的使用剂量有关。SEA 1 μg/ml建立的短期SEA反应T细胞对SEA 1 μg/ml的再次刺激,凋亡量随作用时间的延长而增多,在作用的第16 h最高,达58%。FCM间接荧光染色法检测发现,Fas及FasL亦随SEA作用时间的延长而表达增多,16 h时表达最多,分别为92%和60%。用Fura-2/AM荧光指示剂检测此时细胞胞浆[Ca2+]i已从刺激前的(290±33)nmol/L上升到(680±16)nmol/L。结论:Fas抗原与SEA诱导的T细胞凋亡密切相关,换言之,Fas抗原在超抗原诱导T细胞凋亡中起作用,而胞浆[Ca2+]i升高与SEA诱导的凋亡T细胞DNA断裂及其它凋亡形态变化有关。
, http://www.100md.com
中图法分类号 R329.25;R392.1
The role of Fas antigen in superantigen-induced apoptosis of T-cells*
Song Jianxun, Zhu Xihua, Chen Kemin (Institute of Immunology, Third Military Medical University, Chongqing,400038)
Abstract Objective: To study the role of Fas antigen-mediated killing effect in the superantigen-induced T-cell apoptosis. Methods: T-cell apoptosis was induced by SEA in the SEA-reactive T-cell line established from human peripheral blood mononuclear cells (PBMC). The features of apoptosis were observed with optical microscope, flow cytometry (FCM) and DNA electrophoresis. The Fa/FasL ratio and cytosolic Ca2+ concentration were measured with FCM and fluorescent probe Fura-2/AM. Results: A short term SEA reactive T-cell line was established by stimulating PBMC 106 with 1 μg/ml SEA for 3 days and expanding the cells in rIL-2(200 U/ml). The cells were maintained in rIL-2 for 2 weeks before use. Both FCM and DNA electrophoresis could demonstrate that apoptosis appeared obviously by second stimulation of the SEA-reactive T-cells with SEA 1 μg/ml. Fas/FasL was substantially upregulated with an increase of cytosolic free Ca2+. Conclusion: These findings suggest that Fas antigen plays an important role in the superantigen-induced T-cell apoptosis and the increase of cytosolic Ca2+ was related to DNA fragmentation and morphological changes of T-cell apoptosis.
, 百拇医药
Key words Fas antigen; T cell; apoptosis Ca2+; superantigen
许多研究发现,超抗原(Superantigen,SAg)在激活大量特异性T细胞后,可导致激活诱导的细胞死亡(Activation-induced cell death,AICD),即T细胞凋亡,与SAg诱导的T细胞克隆缺失有关。SAg诱导T细胞凋亡的机制比较复杂,影响因素比较多,如抗原递呈细胞(Antigen-presenting cells, APC)存在与否,细胞因子是否缺乏,T细胞所处的生长时期等等。有研究显示,Fas抗原在SAg诱导的T细胞凋亡中起重要作用[1];也有相反的观点,认为SAg诱导体内T细胞凋亡与环境中的某些细胞因子有关(如γ-INF,IL-2),Fas抗原在其中不起作用[2];也有折中观点,认为Fas抗原在其中起作用,但不是唯一因素[3,4]。但无论如何,Fas抗原作为“死亡分子”在其中的作用正日益受到重视。本研究采用SAg中的金黄色葡萄球菌A型肠毒素(Staphylococcal enterotoxin A, SEA)诱导人外周血中特异性T细胞凋亡,研究Fas抗原在其中的作用,并对此凋亡过程中[Ca2+]i的变化进行了观察。
, 百拇医药
1 材料与方法
1.1 材料
1.1.1 主要试剂 SEA(1 mg,军事医科院产品),白细胞成份血液标本(重庆西南医院输血科,批号971124~1538)。碘化丙啶(PI,Sigma),非离子去污剂Triton X-100(Sigma)。荧光指示剂Fura-2/AM(BM)。DNA Marker:λDNA/EcoRI+HindⅢ(华美)。酶:蛋白酶K、RNase A(华美)。抗体:鼠抗人Fas mAb DX2、鼠抗人FasL mAb(PharMingen),异硫氰酸荧光素(FITC)标记羊抗鼠IgG(华美)。
1.1.2 细胞培养液 10% NCS的RPMI 1640培养液(Gib-co),其中含100 U/ml青霉素,100μg/ml链霉素,10 mmol/L HEPES, 2 mmol/L-Gln。
, 百拇医药
1.1.3 主要仪器 FACStar plus FCM(Becton-Dickinson);MPF-4荧光分光光度计(Hitachi)。
1.2 方法
1.2.1短期人外周血SEA反应T细胞系的建立 参照文献[5]进行。
1.2.2 SEA诱导短期人外周血SEA反应T细胞系凋亡收集 短期人外周血SEA反应T细胞,Hanks溶液洗涤离心,细胞用含10% NCS的RPMI1640完全培养液悬浮,调整密度为5×105/ml,加入24孔平底细胞培养板(Costar),1 ml/孔,37°C,5% CO2的饱和湿度条件下培养2 h。细胞培养液中加入SEA 1μg/ml,继续培养。
1.2.3 短期人外周血SEA反应T细胞凋亡检测 于培养的不同时间(0、2、4、8、16、24、32 h)收集细胞检测。①用PI低渗荧光染色液染色(PI 50 μg/ml,枸椽酸钠0.1%,Triton X-100 0.1%),参照文献[6],FCM检测亚G0/G1峰大小(Ao),反映已固缩和降解核DNA的细胞数,即凋亡细胞比率。实验2次,取平均值。②常规方法提取细胞DNA[7],1.8%琼脂糖凝胶电泳,观察凋亡细胞DNA梯状电泳带。
, 百拇医药
1.2.4 SEA反应T细胞凋亡过程中Fas、FasL表达量检测 采用间接免疫荧光染色法。即于培养的不同时间(同上)收集培养细胞(5×105/孔),用冷染色溶液PBA(PBS+2%BSA+0.1%NaN3)离心洗涤2次后加入第一抗体——鼠抗人Fas mAb或鼠抗人FasL mAb 200μl(1∶50 PBS稀释),以等量正常小鼠IgG为对照,4°C孵育30 min。冷PBA离心洗涤2次后,加入荧光素标记的第二抗体——羊抗小鼠IgG-FITC 200μl(1∶50 PBA稀释),4°C避光孵育30 min。冷PBS离心洗涤2次,将细胞重悬于200μl PBS中,混匀,置FACS测试管,上机FCM检测。实验2次,取平均值。
1.2.5 SEA诱导SEA反应T细胞凋亡过程中胞浆游离[Ca2+]i的变化 SEA 1μg/ml诱导SEA反应T细胞(SEA 1μg/ml刺激后建立)凋亡,于0、2、4、8、16、24、32 h,收集细胞,参照文献[7]进行Fura-2/AM负载及[Ca2+]i测定。实验2次,取平均值。
, 百拇医药
2 结果
2.1 SEA诱导人外周血短期SEA反应T细胞凋亡
短期SEA反应T细胞聚集生长,母细胞化现象多见,见图1A,SEA1μg/ml诱导同样剂量刺激建立的短期SEA反应T细胞凋亡非常明显。光镜下,作用8h可观察到部分细胞死亡,见图1B,作用16 h则出现比较明显的凋亡细胞特征,见图1C。FCM分析亚G0-G1峰(A0)显示,随着诱导时间的延长,凋亡量逐步升高,至作用的第16 h,细胞凋亡量可达52%,见图2A。SEA反应T细胞(SEA 1μg/ml使用剂量诱导建立)凋亡量随SEA再次刺激浓度(0.5~6μg/ml)的升高而增加,见图2B。



, 百拇医药
图1 SEA诱导SEA反应T细胞凋亡的形态 (LM×100)
A:SEA反应T细胞系 B:SEA 1 μg/ml再次作用8 h C:SEA 1 μg/ml再次作用16 h
Fig 1 Morphology of apoptosis induced by SEA in SEA-reactive T cells (LM×100)
A:SEA-reactive T cell line B: 8 h treated again by SEA 1 μg/ml C:16 h treated again by SEA 1 μg/ml


图2 FCM分析SEA诱导SEA反应T细胞凋亡
, 百拇医药
A:SEA作用剂量与凋亡量的关系 B:SEA 1 μg/ml作用时间与凋亡量的关系
Fig 2 Analysis of apoptosis induced by SEA in SEA-reactive T cells by flow cytometry
A:Dose response of SEA-reactive T cells to addition of SEA for 16 h B:Kinetics of apoptosis induced by SEA 1 μg/ml in SEA-reactive T cells
1.8%琼脂糖凝胶细胞DNA电泳显示,SEA 1μg/ml诱导同样剂量刺激建立的短期SEA反应T细胞于作用的第16 h,DNA电泳成较明显梯形泳带。至作用的第24 h和32 h时,由于死亡细胞增多,DNA梯形渐弱,而近呈模糊的片状条带,见图3。

, http://www.100md.com
图3 DNA琼脂糖凝胶电泳分析SEA诱导SEA反应T细胞凋亡
1. DNA标准(λ DNA/EcoRI+HindⅢ), 2.0 h, 3.16 h, 4.12 h, 5.8 h
Fig 3 Analysis of apoptosis induced by SEA in SEA-reactive
T cells by DNA electrophoresis with 1.8% agarose gel
1. DNA Marker (λ DNA/EcoRI+HindⅢ), 2.0 h,3.16 h,4.12 h, 5. 8 h
2.2 SEA反应T细胞凋亡过程中Fas、FasL表达量变化
, http://www.100md.com
短期SEA反应T细胞Fas抗原已有较高表达,荧光密度强度(MFI)已达到近85%,当受SEA再次作用后,Fas抗原表达继续升高,至作用的第16 h时达到最高值92%,见图4A。
FasL在未受到SEA再次作用前,荧光密度强度为8%,以后逐步升高,但速度较慢,至作用的第16 h,达60%,见图4B。
2.3 SEA诱导SEA反应T细胞凋亡与Fas、FasL表达相关
SEA再次作用的第16 h,细胞凋亡量达58%的最高值,此时Fas与FasL表达亦最高,分别为92%、60%,说明Fas、FasL表达与SEA反应T细胞凋亡相关。


, 百拇医药 图4 SEA诱导SEA反应T细胞Fas、FasL表达情况
A:SEA 1 μg/ml诱导SEA反应T细胞Fas表达的动态观察 B:SEA 1 μg/ml诱导SEA反应T细胞FasL表达的动态观察
Fig 4 Functional expression of Fas, FasL induced by SEA in SEA-reactive T cells
A:Kinetics of Fas expression induced by SEA 1 μg/ml in SEA-reactive T cells B:Kinetics of FasL expression induced by SEA 1 μg/ml in SEA-reactive T cells
2.4 SEA诱导SEA反应T细胞凋亡过程中胞浆游离[Ca2+]i的变化
, http://www.100md.com
SEA反应T细胞在SEA 1 μg/ml再次刺激前胞浆游离[Ca2+]i为(290±8)nmol/L,至刺激后8 h和16 h,[Ca2+]i则明显升高,分别达(330±21)nmol/L和(680±16)nmol/L,以后[Ca2+]i又下降,见图5。

图5 SEA(1 μg/ml)诱导SEA反应T细胞凋亡过程中胞浆游离[Ca2+]i的变化
Fig 5 Changes of cytosolic free [Ca2+]i during apoptosis induced by SEA (1 μg/ml) in SEA-reactive T cells
3 讨论
, 百拇医药
SAg诱导T细胞凋亡常使机体产生免疫耐受或相关细胞克隆缺失,而对再次刺激出现无反应性,现今虽然对其作用机制的理解尚有分歧,但许多研究显示,Fas抗原可能在SAg诱导T细胞凋亡中起重要作用。体内实验发现,金黄色葡萄球菌B型肠毒素(Staphylococcal enterotoxin B, SEB)10μg注入小鼠体内后,优先激活Vβ8+ T细胞,使之数量迅速增高,随后逐渐降低,最后降至比SAg注入前还低的水平。使用FCM技术检测发现,SEB激活的Vβ8+ T细胞Fas与FasL呈高效表达。可能由于二者结合介导Vβ8+ T细胞凋亡而使Vβ8+ T细胞数量下降所致。而在FasL缺陷的gld小鼠体内,体内注射SEB并未使Vβ8+ T细胞数量明显降低。从正常小鼠外周血分离的CD4+T细胞受到SEB诱导可发生AICD,加入可溶性Fas-IgG融合蛋白则可阻止AICD,细胞数量并不减少,提示Fas/FasL的相互作用导致了SEB诱导的AICD[8,9]。而从Fas抗原缺陷的Lpr小鼠和FasL缺陷的gld小鼠外周血分离的CD4+ T细胞受到SEB同样诱导下,并不发生AICD,细胞处于增殖状态。同样,利用基因敲除技术获得的Fas抗原阴性小鼠,受到内源性SAg作用时,外周血特异性T细胞并不发生克隆缺失,而是持续大量增生,伴随淋巴细胞在肝、肺浸润[10];SEA和小鼠腺肿瘤病毒(MMTV)编码的内源性超抗原Mtv-7-SAG在诱导外周血T细胞克隆缺失中,Fas系统亦起重要的作用[4,5]。从我们检测SEA诱导短期SEA反应T细胞凋亡过程中Fas与FasL的表达情况看,发生T细胞凋亡的最高点是 Fas与FasL表达的最多之时(SEA作用的第16 h),此时,T细胞胞浆游离[Ca2+]i亦最高。因此,认为SAg在无APC或相关辅助分子存在情况下,刺激T细胞高效表达Fas、FasL,Fas/FasL相互交联,传导死亡信号入胞内,激活相关酶类,引起胞浆游离[Ca+]i升高,再激活Ca2+依赖的核酸内切酶等,发生T细胞凋亡。
, 百拇医药
在有APC存在情况下,APC表面的B7分子与T细胞表面的CD28分子相互作用,提供一个共刺激信号,使SAg作用的特异性T细胞上调Bcl-2或Bcl-XL等基因,反式抑制FasL表达,从而绕过了Fas抗原死亡信号途径,T细胞增殖而不是凋亡[11]。辅助分子抗CD28 mAb可模拟APC表面上的B7分子与T细胞上CD28分子结合,而促使T细胞增殖。高浓度IL-2本身对T细胞就起增殖作用,在体内能诱导SAg作用的特异性T细胞bcl-2基因表达,拮抗Fas抗原介导的T细胞凋亡。这是移植IL-2泵能抑制SAg诱导T细胞凋亡的原因,至于SAg在体内激活大量T细胞之后出现的IL-2缺乏的原因尚不清楚[12]。PMA协助SAg诱导T细胞增殖是通过激活PKC途径而促进IL-2的高效表达来实现的。
因此,SAg在APC存在的情况下,特异性T细胞接受两个信号刺激,起始信号是通过TCR-CD3复合分子,即SAg一端与T细胞表面TCRVβ链结合和(或无)另一端与MHCⅡ类分子的非多态区结合所产生。协同刺激信号来自APC上的B7分子与T细胞上的辅助分子CD28分子相互作用。在这两信号刺激下,特异性T细胞大量增殖。而当无APC和辅助分子存在时,SAg诱导特异性 T细胞高效表达Fas与FasL,二者交联,传导死亡信号入胞内,而引起T细胞凋亡。高浓度IL-2能抑制SAg在无APC及辅助分子存在下所诱导的T细胞凋亡,而促使其增殖,原因是上调T细胞Bcl-2基因表达,抑制了Fas抗原介导的凋亡。
, 百拇医药
*全军“九五”重点项目,No.96Z038
**宋建勋,男,31岁,讲师,博士
*This project was supported by the "Ninth five" obligatory budget of PLA,No.96L038
参考文献
1 Wang J K M, Zhu B, Ju S T, et al. CD4+ T cells reactivated with superantigen are both more sensitive to FasL-mediated killing and express a higher level of FasL. Cell Immunol,1997,179(2):153
, 百拇医药
2 Cauley L S, Cauley K A, Shub F, et al. Transferable anergy:superantigen treatment induces CD4+ T cell tolerance that is reversible and requires CD4-CD8- cells and interferon gamma. J Exp Med, 1997,186(1):71
3 Mountz J D, Wu J, Zhou T, et al. Cell death and longevity: implications of Fas-mediated apoptosis in T-cell senescence. Immunol Rev,1997,60(1):19
4 Papiernik M, Pontoux C, Golstein P. Non-exclusive Fas control and age dependence of viral superantigen-induced clonal deletion in lupus-prone mice. Eur J Immunol,1995,25(6):1517
, 百拇医药
5 Alderson M, Tough T W, Davis-Smith T, et al. Fas ligand mediates activation-induced cell death in human T lymphocytes. J Exp Med,1995,181(1):71
6 Nicoletti I, Migliorati G, Pagliacci M C, et al. A rapid and simple method for measuring thymocyte apoptosis by propidium iodide staining and flow cytometry. J Immunol Methods,1991,139(2):271
7 Malgaroli A, Milani d, Meldolesi J, et al. Fura-2 measurement of cytosolic free Ca2+ in monolayers and suspensions of various types of animal cells. J Cell Biol,1987,105(5):2145
, 百拇医药
8 Boshell M, Mcleod J, Walker L, et al. Effects of antigen presentation on superantigen-induced apoptosis mediated by Fas/Fas ligand interactions in human T cells. Immunology,1996,87(4):586
9 Renno T, Hahne M, Tschopp J, et al. Peripheral T cells undergoing superantigen-induced apoptosis in vivo express B220 and upregulate Fas and Fas ligand. J Exp Med,1996,183(2):431
10 Adachi M, Suematsu S, Suda T, et al. Enhanced and accelerated lymphoproliferation in Fas-null mice. Proc Natl Acad Sci USA, 1996,93(5):2131
, 百拇医药
11 Boise L H, Minn A J, Noel P J, et al. CD28 costimulation can promote T cell survival by enhancing expression of Bcl-XL. Immunity,1995,3(1):87
12 Kuroda K, Yagi J, Imanishi K, et al. Implantation of IL-2-containing osmotic pump prolongs the survival of superantingen-reactive T cells expanded in mice injected the bacterial superantigen. J Immunol,1996,157(4):1422
收稿:1998-10-30;修回:1999-01-25, 百拇医药(宋建勋** 朱锡华 陈克敏)