视网膜表面膜的超微结构特征
作者:王方 颜永碧 张皙 蔡文泉
单位:王方、张皙、蔡文泉 200080上海市第一人民医院眼科;颜永碧 第二军医大学生物物理所
关键词:视网膜;;显微镜检查;电子
视网膜表面膜的超微结构特征 【摘要】 目的 探讨视网膜表面收缩膜细胞与胶原作用的超微结构特征及细胞外间质的作用。方法 对16例孔源性视网膜脱离伴增殖性玻璃体视网膜病变(proliferative vitreoretinopathy,PVR)患者行玻璃体切除术,并应用免疫胶体金标记技术对术中获得的视网膜表面膜进行细胞外间质(extracellular matrix,ECM)——Ⅰ和Ⅲ型胶原及纤维粘连蛋白(fibronectin,FN)的免疫电镜观察。结果在9例视网膜表面膜标本中可见一种足突细胞,这些足突呈卷曲或树枝样,周围被Ⅰ和Ⅲ型胶原纤维包绕;其细胞外形不同、细胞器丰富、带有或不带有色素颗粒;在足突与胶原接触区FN标记明显。结论 PVR膜收缩很可能是上皮样细胞伸出足突介导胶原纤维作用的结果,且FN参与PVR膜收缩过程。
, 百拇医药
Ultrastructural characteristics of epiretinal membranes
WANG Fang*, YAN Yongbi, ZHANG Xi, et al.*Department of Ophthalmology, Shanghai First Hospital, Shanghai 200080
【Abstract】 Objective To investigate ultrastructural features and the correlation between the cell activation and extracellular matrix (ECM) expression of epiretinal membranes. Methods Immuno-electron-microscopy was done on the epiretinal membranes removed by vitrectomy from 16 patients with rhegmatogenous retinal detachment associated with proliferative vitreoretinopathy (PVR). The specimens were stained with antibodies to ECM proteins, including type Ⅰ collagen, type Ⅲ collagen and fibronectin (FN). Results A type of cells with a number of lamellipodia was found in membrane sections of 9 patients. The lamellipodia appeared to be either coiled or branched and were surrounded by abundant collagen fibers of type Ⅰ and Ⅲ. The cells with lamellipodia varied in their phenotypes and with or without pigment. There were dense gold particles of FN in contact regions of lamellipodia and collagen. Conclusions Our observations support that the contraction of epiretinal membranes is the result of an interaction between cells and collagen, and the cells extending lamellipodia may initiate contractile events. FN is responsible for this contractile action.
, 百拇医药
【Key words】 Retina Microscopy, electron
增殖性玻璃体视网膜病变(proliferative vitreoretinopathy, PVR)是导致孔源性视网膜脱离手术失败的主要原因[1]。研究PVR的发生及作用机制一直是眼科学者们关注的焦点[2,3],并已取得了许多令人鼓舞的结果[4-8]。Glaser等[4]应用定时显微电影摄影技术观察发现,视网膜色素上皮(retinal pigment epithelium, RPE)细胞以伸足突方式拽拉胶原纤维产生收缩。为了解PVR膜组织中足突细胞的分布以及与胶原纤维的关系,我们于1996年12月至1997年12月对直接在孔源性视网膜脱离伴PVR患者的视网膜表面膜组织进行3种抗细胞外间质(extracellular matrix,ECM)的免疫电镜观察,试图研究视网膜表面膜组织中细胞与胶原作用的超微结构特征及细胞外间质的作用。
, http://www.100md.com
材料和方法
1. 标本来源:取本院16例孔源性视网膜脱离伴有PVR患者的视网膜表面膜组织(星状皱襞膜和黄斑表面膜),均于玻璃体切除手术获得;术中应用组织镊剥离膜组织,经湿棉签迅速过渡到消毒的生理盐水中,随即用吸管转入专用固定液中固定备用。
2.免疫电镜标本制作:标本于新鲜配制的2%多聚甲醛+0.5%戊二醛(0.2 mol/L PBS缓冲液配制,pH=7.3)固定液中,置室温下固定0.5 h,PBS缓冲液漂洗数次后,加入一抗:包括抗Ⅰ型胶原(1∶50,兔抗牛IgG,上海医科大学病理解剖教研室提供)、抗Ⅲ型胶原(1∶50兔抗人IgG,来源同前)和抗纤维粘连蛋白(fibronectin, FN;1∶200,兔抗人,丹麦Dako公司),于4℃孵育,冰箱过夜;室温复温2 h,0.1 mol/L PBS缓冲液漂洗数次后,1∶3稀释胶体金标记物(10 nm)振荡、置35℃孵育2 h。阴性对照标本用PBS缓冲液代替第一抗体,其余处理相同。标本继续用PBS缓冲液漂洗后,均再经2%戊二醛微波固定5 s,室温放置30 min,继续漂洗,1%四氧化锇后固定2 h,再用双蒸馏水漂洗,逐级酒精脱水,Epon 812包埋标本,先制成0.2 μm的半薄切片,并在相差倒置显微镜下定位,最后制成500~700?超薄切片,铀铅双重染色,H-800透射电镜观察。
, http://www.100md.com
结果
1.足突细胞特征:16例标本中,9例患者的视网膜表面膜组织中可见一种细胞边缘伸出大量足突(lamellipodia)的细胞,这些足突长短不一,或卷曲或伸直,并和细胞外纤维状胶原接触(图1~3)。足突细胞的外形主要呈现两种类型:(1)肾形或不规则形,胞浆内常有丰富的色素颗粒;(2)为长肾形(梭形),基本不含色素颗粒。这两种类型的细胞胞浆内细胞器异常丰富,在梭形性细胞中微丝更明显。在有色素颗粒的细胞周围,可见纤维性胶原分布,但是在每个细胞周围的分布程度有差别,无色素颗粒细胞周围胶原分布无规律,可以很丰富,也可能缺乏。
图1~3 带有色素颗粒的肾形足突细胞,可见一长足突(箭头示)和短足突(▲),P示色素颗粒,N示细胞核 ×9 000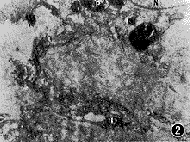
, http://www.100md.com
图2 示长足突放大,N示细胞核,P示色素颗粒,L示足突 ×14 000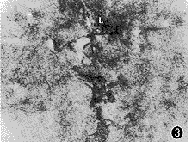
图3 示短足突末梢放大(L),周围有大量Ⅰ型胶体金颗粒 ×40 000
2.足突细胞周围胶原分布:在细胞足突与胶原接触区域可见大量抗Ⅰ和Ⅲ型胶原抗体的胶体金颗粒(图3),两者相比,Ⅰ型胶原的阳性标记较为显著。此外,在胞膜形成内褶的区域也可见丰富的胶体金颗粒(图4)。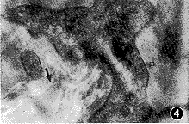
图4 细胞凹褶部位可见胶体金颗粒积聚(箭头示) ×40 000
, 百拇医药
3.FN标记特征:因受视网膜表面膜标本大小的限制,9例标本中仅4例可同时进行FN标记,结果发现在细胞足突与胶原接触区均有FN标记,且标记程度与胶原纤维分布疏密有关。此外,至少在两种形态以上的细胞——含色素上皮细胞和肾型胞浆有微丝的细胞旁有致密的FN胶体金颗粒出现,且由于一些部位的胞膜消失,使细胞内、外的胶体金颗粒融成一片(图5)。在阴性对照标本中,组织结构表现特征一致,但无免疫胶体金显示。
图5 细胞膜消失部位显示细胞内外的FN标记胶体金颗粒(箭头示)融成一片,N示细胞核 ×40 000
讨论
30年前许多学者就对视网膜表面膜的收缩特征进行了研究[2,9]。然而,在以后很长一段时间内一直认为膜收缩力源于细胞本身的收缩,即:象肌细胞一样的收缩[10,11]。1987年Glaser等[4]应用定时显微电影摄影技术成功地拍摄到RPE细胞与胶原纤维收缩的过程,提出PVR膜组织收缩方式同Lewis[12]所报道的一样,即:细胞拽拉其周围的胶原纤维发生收缩的过程,这一过程形如水手拉帆索绳一样“一把一把”(hand-over-hand)地进行。以后在人PVR膜的超微结构研究中描述了此类伸足突细胞的存在,但均未对此类细胞进行深入的研究[6,13]。为此,我们对这一类足突细胞的超微结构特征及其周围的细胞外间质分布进行观察。
, 百拇医药
1.足突细胞是一类功能活跃的上皮细胞。尽管每例膜标本中分布的足突细胞外形不同,但是它们具有一些共同的特征:微绒毛、基底膜或细胞连接,细胞体较大,胞浆呈现丰富的细胞器,大多数含有色素颗粒。除个别细胞外,细胞周围均可见胶原包绕,且在足突的游离端,胶原纤维密度明显增加。因考虑到PVR膜细胞的外形及中间丝蛋白(intermediate filament proteins)表达可受多种因素影响而变化[7,8],所以我们未对足突细胞进行免疫标记鉴定,故不能确切地定性这些足突细胞,但是从它们表现的较一致的结构特征,似乎可暗示此细胞是来源于上皮细胞。
2.Ⅰ型和Ⅲ型胶原是视网膜表面膜的胶原成分,二者在分布量上的差别和膜形成时间有关[14]。此外,收缩细胞本身可分泌胶原,且超微结构下的特征证明细胞膜凹褶处是胶原亚单位聚集装配的场所[15],也就是说,细胞产生的胶原蛋白首先分泌到细胞膜内褶处,在此完成装配,然后以胶原束形式分布于细胞外间质。
, http://www.100md.com
3.FN积极参与细胞介导胶原的收缩活动。早些时候,就有学者注意到I型胶原、细胞浆内肌动蛋白(actin)常常与FN共同分布的现象[5],认为许多不同类型的细胞与细胞外间质作用时需要有FN——附着因子的介导[4,5]。Robbins等[16]认为,在PVR膜收缩活动中,细胞与胶原作用时可能有两条途径介导:直接通过整和素(integrins)家族传递信号和必须通过FN的调节。细胞和胶原纤维接触部位FN胶体金颗粒的积聚暗示胶原此时与细胞处于附着状态,这种附着可能发挥的作用是参与细胞介导胶原的收缩和调控细胞的行为。此外,收缩细胞自身也分泌FN。
目前,直接观察鉴定视网膜表面膜的收缩活动尚不可能。本研究采用免疫组化与电镜相结合的方法研究足突细胞,试图间接了解膜收缩活动。研究证实伸到胶原纤维中的足突细胞是一类功能活跃的细胞,Ⅰ和Ⅲ型胶原密集分布于足突周围,且FN参与这样一个收缩过程。
参考文献
, 百拇医药
1 Cowley M, Conway BP, Campochiaro PA,et al. Clinical risk factors for proliferative vitreoretinopathy. Arch Ophthalmol, 1989,107:1147-1151.
2 Machemer R, Laqua H. Pigment epithelium proliferation in retinal detachment (massive periretinal proliferation). Am J Ophthalmol, 1975,80:1-23.
3 Campochiaro PA. Pathogenic mechanisms in proliferative vitreoretinopathy. Arch Ophthalmol, 1997,115:237-241.
, 百拇医药 4 Glaser BM, Cardin A, Biscoe B. Proliferative vitreoretinopathy:the mechanism of development of vitreoretinal traction. Ophthalmology, 1987,94:327-332.
5 Sramek SJ, Wallow IH, Stevens TS, et al. Immunostaining of perretinal membranes for actin, fibronectin and glial fibrillary acidic protein. Ophthalmology, 1989,96:835-841.
6 Casaroli Marano RP, Vilaro S. The role of fibronectin, laminin, vitronectin and their receptors on cellular adhesion in proliferative vitreoretinopathy. Invest Ophthalmol Vis Sci, 1994,35:2791-2803.
, 百拇医药
7 Grisanti S, Guidry C. Transdifferentiation of retinal pigment epithelial cells from epithelial to mesenchymal phenotype. Invest Ophthalmol Vis Sci, 1995,36:391-405.
8 Vinores SA, Van Niel E, Kim HJ, et al. Simultaneous expression of keratin and glial fibrillary acidic protein by the same cells in epiretinal membranes.Invest Ophthalmol Vis Sci, 1992,33:3361-3366.
9 Duck-Elder S. System of Ophthalmology. vol 10. London: Kimpton, 1967. 801-807.
, http://www.100md.com
10 Newsome DA, Rodrigues MM, Machemer R. Human massive periretinal proliferation: in vitro characteristics of cellular components. Arch Ophthalmol, 1981,99: 873-880.
11 Cleary PE, Minckler DS, Ryan SJ. Ultrastructure of traction retinal detachment in rhesus monkey eyes after a posterior penetrating ocular injury. Am J Ophthalmol, 1980,90:829-845.
12 Lewis J. Morphogenesis by fibroblast traction. Nature, 1984,307: 413-414.
, http://www.100md.com
13 Vinores SA, Campochiaro PA, Conway BP. Ultrastructural and electron-immunocytochemical characterization of cells in epiretinal membranes.Invest Ophthalmol Vis Sci, 1990,31:14-28.
14 Kirsner RS, Eaglstein WH. The wound healing process. Dermatol Clin. 1993,11:629-640.
15 Alberts B, Bray D, Lewis J, et al. Molecular biology of the cell. 3rd ed. New York: Garland Publishing, 1994.980-981.
16 Robbins SG, Brem RB, Wilson DJ, et al. Immunolocalization of integrins in proliferative retinal membranes. Invest Ophthalmol Vis Sci, 1994,35:3475-3485.
(收稿:1999-04-07 修回:1999-08-06), http://www.100md.com
单位:王方、张皙、蔡文泉 200080上海市第一人民医院眼科;颜永碧 第二军医大学生物物理所
关键词:视网膜;;显微镜检查;电子
视网膜表面膜的超微结构特征 【摘要】 目的 探讨视网膜表面收缩膜细胞与胶原作用的超微结构特征及细胞外间质的作用。方法 对16例孔源性视网膜脱离伴增殖性玻璃体视网膜病变(proliferative vitreoretinopathy,PVR)患者行玻璃体切除术,并应用免疫胶体金标记技术对术中获得的视网膜表面膜进行细胞外间质(extracellular matrix,ECM)——Ⅰ和Ⅲ型胶原及纤维粘连蛋白(fibronectin,FN)的免疫电镜观察。结果在9例视网膜表面膜标本中可见一种足突细胞,这些足突呈卷曲或树枝样,周围被Ⅰ和Ⅲ型胶原纤维包绕;其细胞外形不同、细胞器丰富、带有或不带有色素颗粒;在足突与胶原接触区FN标记明显。结论 PVR膜收缩很可能是上皮样细胞伸出足突介导胶原纤维作用的结果,且FN参与PVR膜收缩过程。
, 百拇医药
Ultrastructural characteristics of epiretinal membranes
WANG Fang*, YAN Yongbi, ZHANG Xi, et al.*Department of Ophthalmology, Shanghai First Hospital, Shanghai 200080
【Abstract】 Objective To investigate ultrastructural features and the correlation between the cell activation and extracellular matrix (ECM) expression of epiretinal membranes. Methods Immuno-electron-microscopy was done on the epiretinal membranes removed by vitrectomy from 16 patients with rhegmatogenous retinal detachment associated with proliferative vitreoretinopathy (PVR). The specimens were stained with antibodies to ECM proteins, including type Ⅰ collagen, type Ⅲ collagen and fibronectin (FN). Results A type of cells with a number of lamellipodia was found in membrane sections of 9 patients. The lamellipodia appeared to be either coiled or branched and were surrounded by abundant collagen fibers of type Ⅰ and Ⅲ. The cells with lamellipodia varied in their phenotypes and with or without pigment. There were dense gold particles of FN in contact regions of lamellipodia and collagen. Conclusions Our observations support that the contraction of epiretinal membranes is the result of an interaction between cells and collagen, and the cells extending lamellipodia may initiate contractile events. FN is responsible for this contractile action.
, 百拇医药
【Key words】 Retina Microscopy, electron
增殖性玻璃体视网膜病变(proliferative vitreoretinopathy, PVR)是导致孔源性视网膜脱离手术失败的主要原因[1]。研究PVR的发生及作用机制一直是眼科学者们关注的焦点[2,3],并已取得了许多令人鼓舞的结果[4-8]。Glaser等[4]应用定时显微电影摄影技术观察发现,视网膜色素上皮(retinal pigment epithelium, RPE)细胞以伸足突方式拽拉胶原纤维产生收缩。为了解PVR膜组织中足突细胞的分布以及与胶原纤维的关系,我们于1996年12月至1997年12月对直接在孔源性视网膜脱离伴PVR患者的视网膜表面膜组织进行3种抗细胞外间质(extracellular matrix,ECM)的免疫电镜观察,试图研究视网膜表面膜组织中细胞与胶原作用的超微结构特征及细胞外间质的作用。
, http://www.100md.com
材料和方法
1. 标本来源:取本院16例孔源性视网膜脱离伴有PVR患者的视网膜表面膜组织(星状皱襞膜和黄斑表面膜),均于玻璃体切除手术获得;术中应用组织镊剥离膜组织,经湿棉签迅速过渡到消毒的生理盐水中,随即用吸管转入专用固定液中固定备用。
2.免疫电镜标本制作:标本于新鲜配制的2%多聚甲醛+0.5%戊二醛(0.2 mol/L PBS缓冲液配制,pH=7.3)固定液中,置室温下固定0.5 h,PBS缓冲液漂洗数次后,加入一抗:包括抗Ⅰ型胶原(1∶50,兔抗牛IgG,上海医科大学病理解剖教研室提供)、抗Ⅲ型胶原(1∶50兔抗人IgG,来源同前)和抗纤维粘连蛋白(fibronectin, FN;1∶200,兔抗人,丹麦Dako公司),于4℃孵育,冰箱过夜;室温复温2 h,0.1 mol/L PBS缓冲液漂洗数次后,1∶3稀释胶体金标记物(10 nm)振荡、置35℃孵育2 h。阴性对照标本用PBS缓冲液代替第一抗体,其余处理相同。标本继续用PBS缓冲液漂洗后,均再经2%戊二醛微波固定5 s,室温放置30 min,继续漂洗,1%四氧化锇后固定2 h,再用双蒸馏水漂洗,逐级酒精脱水,Epon 812包埋标本,先制成0.2 μm的半薄切片,并在相差倒置显微镜下定位,最后制成500~700?超薄切片,铀铅双重染色,H-800透射电镜观察。
, http://www.100md.com
结果
1.足突细胞特征:16例标本中,9例患者的视网膜表面膜组织中可见一种细胞边缘伸出大量足突(lamellipodia)的细胞,这些足突长短不一,或卷曲或伸直,并和细胞外纤维状胶原接触(图1~3)。足突细胞的外形主要呈现两种类型:(1)肾形或不规则形,胞浆内常有丰富的色素颗粒;(2)为长肾形(梭形),基本不含色素颗粒。这两种类型的细胞胞浆内细胞器异常丰富,在梭形性细胞中微丝更明显。在有色素颗粒的细胞周围,可见纤维性胶原分布,但是在每个细胞周围的分布程度有差别,无色素颗粒细胞周围胶原分布无规律,可以很丰富,也可能缺乏。

图1~3 带有色素颗粒的肾形足突细胞,可见一长足突(箭头示)和短足突(▲),P示色素颗粒,N示细胞核 ×9 000
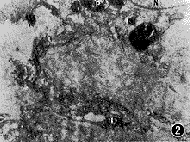
, http://www.100md.com
图2 示长足突放大,N示细胞核,P示色素颗粒,L示足突 ×14 000
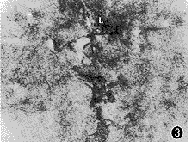
图3 示短足突末梢放大(L),周围有大量Ⅰ型胶体金颗粒 ×40 000
2.足突细胞周围胶原分布:在细胞足突与胶原接触区域可见大量抗Ⅰ和Ⅲ型胶原抗体的胶体金颗粒(图3),两者相比,Ⅰ型胶原的阳性标记较为显著。此外,在胞膜形成内褶的区域也可见丰富的胶体金颗粒(图4)。

图4 细胞凹褶部位可见胶体金颗粒积聚(箭头示) ×40 000
, 百拇医药
3.FN标记特征:因受视网膜表面膜标本大小的限制,9例标本中仅4例可同时进行FN标记,结果发现在细胞足突与胶原接触区均有FN标记,且标记程度与胶原纤维分布疏密有关。此外,至少在两种形态以上的细胞——含色素上皮细胞和肾型胞浆有微丝的细胞旁有致密的FN胶体金颗粒出现,且由于一些部位的胞膜消失,使细胞内、外的胶体金颗粒融成一片(图5)。在阴性对照标本中,组织结构表现特征一致,但无免疫胶体金显示。

图5 细胞膜消失部位显示细胞内外的FN标记胶体金颗粒(箭头示)融成一片,N示细胞核 ×40 000
讨论
30年前许多学者就对视网膜表面膜的收缩特征进行了研究[2,9]。然而,在以后很长一段时间内一直认为膜收缩力源于细胞本身的收缩,即:象肌细胞一样的收缩[10,11]。1987年Glaser等[4]应用定时显微电影摄影技术成功地拍摄到RPE细胞与胶原纤维收缩的过程,提出PVR膜组织收缩方式同Lewis[12]所报道的一样,即:细胞拽拉其周围的胶原纤维发生收缩的过程,这一过程形如水手拉帆索绳一样“一把一把”(hand-over-hand)地进行。以后在人PVR膜的超微结构研究中描述了此类伸足突细胞的存在,但均未对此类细胞进行深入的研究[6,13]。为此,我们对这一类足突细胞的超微结构特征及其周围的细胞外间质分布进行观察。
, 百拇医药
1.足突细胞是一类功能活跃的上皮细胞。尽管每例膜标本中分布的足突细胞外形不同,但是它们具有一些共同的特征:微绒毛、基底膜或细胞连接,细胞体较大,胞浆呈现丰富的细胞器,大多数含有色素颗粒。除个别细胞外,细胞周围均可见胶原包绕,且在足突的游离端,胶原纤维密度明显增加。因考虑到PVR膜细胞的外形及中间丝蛋白(intermediate filament proteins)表达可受多种因素影响而变化[7,8],所以我们未对足突细胞进行免疫标记鉴定,故不能确切地定性这些足突细胞,但是从它们表现的较一致的结构特征,似乎可暗示此细胞是来源于上皮细胞。
2.Ⅰ型和Ⅲ型胶原是视网膜表面膜的胶原成分,二者在分布量上的差别和膜形成时间有关[14]。此外,收缩细胞本身可分泌胶原,且超微结构下的特征证明细胞膜凹褶处是胶原亚单位聚集装配的场所[15],也就是说,细胞产生的胶原蛋白首先分泌到细胞膜内褶处,在此完成装配,然后以胶原束形式分布于细胞外间质。
, http://www.100md.com
3.FN积极参与细胞介导胶原的收缩活动。早些时候,就有学者注意到I型胶原、细胞浆内肌动蛋白(actin)常常与FN共同分布的现象[5],认为许多不同类型的细胞与细胞外间质作用时需要有FN——附着因子的介导[4,5]。Robbins等[16]认为,在PVR膜收缩活动中,细胞与胶原作用时可能有两条途径介导:直接通过整和素(integrins)家族传递信号和必须通过FN的调节。细胞和胶原纤维接触部位FN胶体金颗粒的积聚暗示胶原此时与细胞处于附着状态,这种附着可能发挥的作用是参与细胞介导胶原的收缩和调控细胞的行为。此外,收缩细胞自身也分泌FN。
目前,直接观察鉴定视网膜表面膜的收缩活动尚不可能。本研究采用免疫组化与电镜相结合的方法研究足突细胞,试图间接了解膜收缩活动。研究证实伸到胶原纤维中的足突细胞是一类功能活跃的细胞,Ⅰ和Ⅲ型胶原密集分布于足突周围,且FN参与这样一个收缩过程。
参考文献
, 百拇医药
1 Cowley M, Conway BP, Campochiaro PA,et al. Clinical risk factors for proliferative vitreoretinopathy. Arch Ophthalmol, 1989,107:1147-1151.
2 Machemer R, Laqua H. Pigment epithelium proliferation in retinal detachment (massive periretinal proliferation). Am J Ophthalmol, 1975,80:1-23.
3 Campochiaro PA. Pathogenic mechanisms in proliferative vitreoretinopathy. Arch Ophthalmol, 1997,115:237-241.
, 百拇医药 4 Glaser BM, Cardin A, Biscoe B. Proliferative vitreoretinopathy:the mechanism of development of vitreoretinal traction. Ophthalmology, 1987,94:327-332.
5 Sramek SJ, Wallow IH, Stevens TS, et al. Immunostaining of perretinal membranes for actin, fibronectin and glial fibrillary acidic protein. Ophthalmology, 1989,96:835-841.
6 Casaroli Marano RP, Vilaro S. The role of fibronectin, laminin, vitronectin and their receptors on cellular adhesion in proliferative vitreoretinopathy. Invest Ophthalmol Vis Sci, 1994,35:2791-2803.
, 百拇医药
7 Grisanti S, Guidry C. Transdifferentiation of retinal pigment epithelial cells from epithelial to mesenchymal phenotype. Invest Ophthalmol Vis Sci, 1995,36:391-405.
8 Vinores SA, Van Niel E, Kim HJ, et al. Simultaneous expression of keratin and glial fibrillary acidic protein by the same cells in epiretinal membranes.Invest Ophthalmol Vis Sci, 1992,33:3361-3366.
9 Duck-Elder S. System of Ophthalmology. vol 10. London: Kimpton, 1967. 801-807.
, http://www.100md.com
10 Newsome DA, Rodrigues MM, Machemer R. Human massive periretinal proliferation: in vitro characteristics of cellular components. Arch Ophthalmol, 1981,99: 873-880.
11 Cleary PE, Minckler DS, Ryan SJ. Ultrastructure of traction retinal detachment in rhesus monkey eyes after a posterior penetrating ocular injury. Am J Ophthalmol, 1980,90:829-845.
12 Lewis J. Morphogenesis by fibroblast traction. Nature, 1984,307: 413-414.
, http://www.100md.com
13 Vinores SA, Campochiaro PA, Conway BP. Ultrastructural and electron-immunocytochemical characterization of cells in epiretinal membranes.Invest Ophthalmol Vis Sci, 1990,31:14-28.
14 Kirsner RS, Eaglstein WH. The wound healing process. Dermatol Clin. 1993,11:629-640.
15 Alberts B, Bray D, Lewis J, et al. Molecular biology of the cell. 3rd ed. New York: Garland Publishing, 1994.980-981.
16 Robbins SG, Brem RB, Wilson DJ, et al. Immunolocalization of integrins in proliferative retinal membranes. Invest Ophthalmol Vis Sci, 1994,35:3475-3485.
(收稿:1999-04-07 修回:1999-08-06), http://www.100md.com