人巨细胞病毒体内外先天性感染胎鼠脑神经元的研究
作者:王明丽 唐久来 史百芬 胡勇 李京培 毕克菊 胡闻 黄升海 吴建军
单位:
(王明丽 史百芬 胡勇 李京培 毕克菊 黄升海)安徽医科大学微生物学教研室,安徽合肥 230032;(唐久来)安徽医科大学附属医院,安徽合肥 230022;胡闻)安徽省立医院病理科,安徽合肥 230001;(吴建军)安徽医科大学临床医学系九四级本科生,安徽合肥 230032
关键词:巨细胞病毒;大脑皮质神经元;胎鼠;先天性感染
现代康复990920 摘要 目的:研究确定人巨细胞病毒(HCMV)体内外先天性感染胎鼠大脑皮质神经元及其感染特征。方法:分别建立体内外模拟HCMV先天性感染小鼠脑神经元模型。采用病毒分离、病理学检测及核酸原位杂交技术等观察研究病毒的增殖,受染细胞的形态特征以及病毒核酸在细胞内的定位和分布。结果:体内模型显示:脑组织上清液中分离出HCMV;大脑皮质发生侵袭性脑膜脑炎性病理改变;神经元核内出现病毒特征性大的嗜碱性包涵体;病毒特异性核酸存在于受染神经元核内及胞浆内。体外模型亦证实:受染神经元胞体明显肿胀并可见核内嗜酸性包涵体;原位杂交法检出HCMV特异性核酸。结论:HCMV可在体内外致胎鼠大脑皮质神经元发生类似于人类先天性中枢神经系统感染的病理改变;建立的体内外感染模型可用于HCMV中枢神经系统先天性感染的发生机制研究。
, 百拇医药
Study on the neurons of fetal mice from the cerebral cortex
with the congenital human cytomegalovirus infection
WANG Ming-li TANG Jiu-lai Shi Bai-fen et al.
Department of Microbiology,Anhui Medical University,Hefei 230032 China
Abstract Objective:To investigate is to determine the infection of neurons that human cytomegalovirus AD169 strain(HCMV AD169)could cross the placenta of the Balb/cmice and initiate congenital infection of the developing fetus cerebral cortex invivo and that the neurons of the primary cultures from the cerebral cortex of Balb/c fetal mice could be infected by HCMV AD169 in vitro.Methods:HCMV(5.0 log TCID50 ml/mouse)was injected into the intraperitoneum of mice (half of mice are female)when they were about 8~ 12 weeks old.Then,these of mice were used for mating.Pregnancies were dated as day 0 when a copulation plug was found.Fetuses on day about to give birth of gestation were removed from the uteri and its cerebral cortex was removed from the skull and fixed with 4% paraformaldehyde,then cut into serial coronal sections 5 μ m thick,applied to slides coated with Histostik,and then stained with hematoxylin and eosin (HE).The supernatant of minced a fetal mouse cerebral cortex was used for virus isolates by HF cells.And viral DNA positive cells were examined by in situ hybridization using digoxigenin labelled HCMV DNA oligonucleotide probe in the acetone fixed imprint of the cerebral cortex.Meanwhile, The cerebral cortex neurons were prepared and cultured and HCMV infection model was made. 1~4 weeks after infection,the cultures was recorded and observed by photography under microscope, and the samples were taken for HE stainning.At the same time, the virus DNA and its intracellular location were analyzed in situhybridization~using digoxingenin labelled HCMV DNA oligonucleotide probes.Results: HCMV had been isolafed from the supernatant of fetal mice cerebral cortex.The pathological changes consisting of destructive meningoencephalitis and large、basophilic、intranuclear neuronal inclusions of viral type occurred in the fetal mouse cerebral cortex.The presence of virus sequences was confirmed by in situ hybridization,however, nothing was found in the normal controls.The neurons exhibited cytopathic effects at 2 weeks of postinfection,and the viral sequences was found when they were infected by HCMV AD169 in vitro. Conclusion:Development of the fetal mouse model of HCMV infection that mimics human congenital central nervous system(CNS)infection in vivo and in vitro will allow the study of the pathogenesis of HCMV congenital CNS infection and the development of therapeutic agents and vaccines.
, 百拇医药
Key Words human cytomegalovirus(HCMV);neuron of the cerebral cortex;a fetal mouse;congenital infection
人巨细胞病毒(Human Cytomegalovirus,HCMV)是最常见的宫内传播病毒之一。人类先天性HCMV感染可使多系统、多脏器受累,而中枢神经系统(CNS)受损后果最为严重,常见为脑积水,脊柱裂,小头畸形,脑内钙化(特别是脑室周围),非遗传性感觉神经性耳聋和四肢瘫痪等。每年仅就HCMV先天感染导致胎儿新生儿患神经系统疾病人数,Plotkin等[1]估计美国约有6000个婴儿为感染患者;按此估算,我国至少有3万多个婴儿成为患者。流行病学调查亦提示,先天畸形胎儿血清中HCMVIgM阳性率(20%)明显高于一般活产儿(1.65%~3.5%)[2];而在脑组织中HCMVDNA阳性率高达44%[3]。证实先天性HCMV感染中,CNS感染率较高,严重危害了胎儿的生长发育,导致的智力障碍给家庭和社会带来沉重负担。
, http://www.100md.com
为开展研究HCMV先天性CNS感染的病理过程,亟需建立合适的体内外实验模型。长期以来,一直沿用鼠巨细胞病毒(Murine Cytomegalovirus,MCMV)感染小鼠作为研究CMV感染与疾病的模型,但MCMV经自然途径感染小鼠后,不能像HCMV一样经胎盘致发育中的胚胎发生先天性感染[4],因此MCMV不适用于HCMV先天性感染的研究。本研究首次采用预先腹腔接种HCMV至生育龄Balb/c雌雄小鼠,然后配对喂养,在雌鼠临产时剖腹取出胎鼠及其母鼠双侧大脑皮质进行观察研究,建立了模拟人类HCMV先天性感染CNS的体内模型;同时在待产胎鼠双侧大脑皮质原代培养物上接种HCMV,连续4~5周细致地观察检测了HCMV致神经元感染的细胞病理学改变,建立了模拟人类HCMV先天性感染CNS的体外模型。现将结果报告如下。
1 材料和方法
1.1 病毒 HCMVAD169 株由上海医科大学微生物学教研室提供,用人胚成纤维细胞(HF)培养增殖。使用前,将病毒在HF细胞上传代,以增加病毒毒力;按Gibson[5]的病毒致细胞变异作用(CPE)终点稀释法以在24~48h内出现达+++~++++的病毒悬液在HF细胞上滴定TCID50;以6.0logTCID50/ml的病毒作为实验用毒种。
, http://www.100md.com
1.2 实验动物 纯系Balb/c小鼠,雌雄兼用,8~12周龄,体重(30±5)g,由本校实验动物中心提供(皖实验动物号:皖准01号)。感染病毒后饲养于本室专用感染动物柜内。
1.3 细胞 人成纤维细胞株(HF)及原代兔肾细胞均由本室自制。本研究采用的HF株为6~8代。
1.4 主要试剂 所用主要化学及分子生物学试剂分别购自Sigma公司、Promega公司和华美生物工程公司;地高辛DNA标记和检测试剂盒购自Boehringer Mannheim公司。
1.5 HCMV MIE和LA寡核苷酸探针序列合成与标记 HCMV DNA MIE(即刻早期抗原)和LA(晚期抗原)寡核苷酸探针片段序列位置参考文献[6]设计,MIE寡核苷酸探针序列:5′GAGGCTATTGTAG、CCTACACTT-TGG3′,序列位点为第900~925核苷酸;LA寡核苷酸针片段序列为5′GTCGCC、TGCACTGCCAGGTG、CTTCG3′,序列位点第2301~2325核苷酸。用DNA合成仪固相亚磷酸三酯法合成并纯化(中国科学院上海植物生理所植物分子遗传国家重点实验室)。上述两种Digoxigenin标记的探针制备及检测按Boehringer Mannheim公司说明书进行。
, http://www.100md.com
1.6 动物体内感染模型的建立 将HCMV AD169株悬液按0.5ml/只(5.0log TCID50)注射至雌雄小鼠腹腔内,然后按1∶1比例同笼饲养,此设定为试验组;与此同时,在设定为对照组的小鼠腹腔内分别注射正常HF细胞悬液05ml/只。逐日晨检查阴栓以确证其妊娠开始时间。待雌鼠临产(约为妊娠的第20d)剖腹取出胎鼠和相应母鼠大脑皮质,分别进行病毒分离、病理学检测及其病毒核酸原位杂交检测。
1.7 体外神经元感染模型的建立 实验用Balb/c临产胎鼠由本校实验动物中心提供。原代培养物的制备基本参照吴希如等[7]介绍的方法进行。将细胞接种至盛有已预先覆盖鼠尾胶原薄膜盖玻片的塑料培养皿内,最终细胞浓度1×106/ml。置37℃,50%CO2饱和湿度的CO2培养箱内培养,再经48h后,分别于相应孔内加入细胞分裂抑制剂5-氟-2′脱氧尿苷15μg/ml和尿苷35μg/ml以抑制非神经细胞的过度增殖。48h后,于每个试验孔内分别加入100TCID50病毒悬液0.1ml,同时以相同病毒量感染HF细胞作为阳性对照。观察和鉴定方法,每隔2~3d于例置显微镜下观察、摄影记录、换液;并在病毒感染后的第24h、48h、72h和第1~4周分别连续取样,用于病毒TCID50滴定,细胞病理学染色及原位杂交检测等。
, 百拇医药
1.8 病毒分离 基本方法参照文献[8]。常规无菌操作下取出胎鼠双侧大脑皮层,用细胞维持液制备10-1/ml脑细胞悬液,低速离心后,取上清分为两份,一份直接接种至HF细胞和原代兔肾细胞;另一份经56°30′灭活后再分别接种至上述两种细胞,同时设置正常细胞对照。对出现HCMV特征性CPE者,取培养上清做PCR,检测HCMV DNA。
1.9 50%组织培养感染剂量(TCID50)滴定 于HCMV感染后的第1、2、3和4周分别吸取培养上清,加50%山梨醇后,冻存于-70℃冰箱保存。在HF细胞上滴定病毒TCID50值的方法同前。
1.10 HE 染色 按常规方法进行。
1.11 原位杂交检测 经剖腹取出的胎鼠大脑皮质标本制备采用细胞压印片法。即常规冰盘操作下,将预涂有粘附剂的载玻片平置于工作台上,杀死动物立即取脑,选择一个较平整切面,用另一块玻片轻轻下压,尽快移去组织,尽量不拖动。将此玻片立即水平置于备好的冷丙酮中固定10min,空气干燥,备用。对载有单层神经元培养物的盖玻片用4%多聚甲醛固定后,经乙醇梯度脱水后备用。原位杂交检测时,先将细胞片置于PBS缓冲液中水化,5min×3;接着用PronaseK(20μg/ml)37℃作用10min;经含甘氨酸(2mg/ml)-PBS洗涤5min×2后,加RNaseA(100μg/ml)37℃作用30min,经甘氨酸-PBS洗涤后,按试剂盒说明书操作,进行HCMVDNA检测。出现颜色反应后,常规50%甘油封片,照像记录。每次实验均设如下对照,阴性对照:第1正常对照组胎鼠脑组织压印片和正常HF细胞培养物滴片;第2无标记探针的试验组胎鼠脑组织压印片和无标记探针的HCMV感染的胎鼠脑神经元培养物。阳性对照:HCMV感染的HF细胞培养物滴片。
, 百拇医药
2 结果
2.1 临产剖腹胎鼠大脑皮质病毒分离 见表1。
表1 胎鼠脑组织悬液HCMV分离结果 接种方法
样本数
HF细胞
原代兔肾细胞
CPE阳性数/样本数
CPE阳性数/标本数
直接接种
10
7/10
0/10
, http://www.100md.com
56°30′灭活后接种
10
0/10
1/10
对照组脑悬液上
清直接接种
10
0/10
0/10
对接种至HF细胞单层分离培养CPE阳性者,取此培养物反复冻融3次后,15000rpm离心后取上清,再用PCR法分别检测HCMV、HSV和VZV DNA,结果仅HCMV DNA为阳性,余为阴性。表明:HCMV确可经小鼠胎盘,垂直传播至胎鼠脑组织中。
, 百拇医药
2.2 50%组织培养感染剂量(TCID50)滴定 当所设HCMV感染的HF细胞培养物对照在感染后第1周出现约90%CPE时(TCID50滴度为1×104/ml),病毒感染的胎鼠大脑皮质神经元出现明显灶性病变,并可测出细胞上清液中的游离病毒TCID50滴度为2×103/ml;于感染后第2周,病毒效价迅速增高,TCID50达最高值,为2×104/ml,这与出现的CPE变化相吻合。表明感染后第2周是病毒大量形成时间,此后病毒效价平稳;但第4周开始,由于培养的脑细胞开始死亡,病毒效价下降。
2.3 病理学研究
2.3.1 临产剖腹胎鼠大脑皮质病理检测结果 试验组胎鼠及其母鼠剖检时可见脑膜血管明显充血;镜检发现:两者大脑皮质微血管均有不同程度的扩张充血,血管外周及邻近组织中有中性粒细胞和单个核细胞浸润,以及散在出血病灶尤以母鼠为甚。(图1A)。而胎鼠的病理改变较为显著的是细胞间隙水肿,部分神经元己明显变性坏死或细胞核消失,仅留有轮廓,并可见到软化灶(图1B);而且在受染的神经元核内见到HCMV特征性嗜碱性包涵体(图1C)。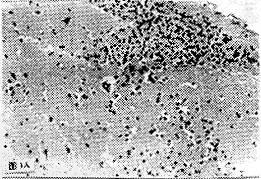
, 百拇医药
图1A 母鼠大脑皮质中的单个核细胞浸润(HE;100X)
图1B胎鼠大脑皮质中神经细胞变性坏死及软化灶(箭头)(HE;100X)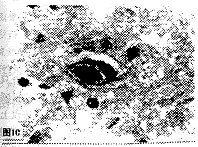
图1C胎鼠大脑皮质中的病毒特征性的大的核内嗜碱性色涵体(箭头)(HE;100X)
2.3.2 HCMV感染临产剖腹胎鼠大脑皮质神经元活体形态观察 在倒置显微镜下,HCMV感染的神经元形态明显改变发生在培养的第2周。镜下可见神经元胞核肿胀,胞浆颗粒增多,折光性减弱,突起断裂(图2A)。HE染色同时观察,可见受染神经细胞明显肿胀,胞浆及胞核均为嗜酸性,核内可见到嗜酸性包涵体(图2,B)。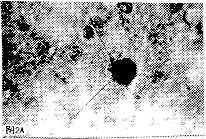
, 百拇医药
图2AHCMV感染的原代培养胎鼠大脑皮质神经元(200X)
图2BHCMV感染的原代培养胎鼠大脑皮质神经元,箭头示细胞肿胀,核内嗜酸性包涵体(HE,X400)
2.4 应用HCMVMIE和LA寡核苷酸探针检测胎鼠大脑皮质神经元中HCMV DNA。
2.4.1 检测临产胎鼠大脑皮质压印片中HCMVDNA用Dig标记的HCMVMIE和LA寡核苷酸探针与未感染的正常对照组胎鼠脑压印片中细胞进行原位杂交,没有发现杂交信号(图3A)。用上述同样探针与试验组胎鼠脑印片进行原位杂交,即可在镜下观察到与HCMV感染的HF细胞结果相一致的杂交阳性信号,即在大脑皮质神经元的核内及胞浆内出现深紫蓝色杂交阳性颗粒(图3B)。
MIE及LA探针检测不同感染时间的鼠脑神经元培养物,结果发现,MIE探针可在HCMV感染物培养的第1周(约5~7d)检出HCMVDNA;而LA探针则可稳定检出HCMV感染后第2~4周的HCMVDNA。因此,同时使用两种探针检测,可避免假阴性,提高准确性(图3C)。
, http://www.100md.com
图3A原位杂交检测正常对照胎鼠大脑皮质压印片中HCMVDNA,无杂交信号(400X)
图3BHCMV试验组胎鼠大脑皮质神经元HCMVDNA阳性信号(400X)
图3CHCMV感染胎鼠大脑皮质神经元原代培养物HCMVDNA杂交性信号(400X)
3 讨论
一般认为,HCMV感染的宿主范围和细胞范围均较狭窄,种属特异较高,即HCMV只能感染人及HCMV体外培养仅在人成纤维细胞中增殖。但HCMVAD169株作为HCMV标准毒株已在体外广泛传代并冷藏多年,已有实验证实,在实验动物体内HCMV可致家兔[9]全身感染和小白鼠[10]脑内感染;在体外,HCMVAD169株尚可在培养的人MΦ[11]、外周血单核细胞[12]、脑毛细血管内皮细胞[13]和神经细胞[14]中增殖复制。此表明,经过长期体外传代的AD169株宿主范围已变得相当广泛。
, http://www.100md.com
本文首次将HCMVAD169株接种至生育龄雌雄Balb/c小鼠腹腔内,虽导致了小鼠全身病毒血症(资料未示),但因此年龄段小鼠对HCMV有一定程度抵抗力而无发病、死亡情况发生。此种情形很类似于人类大多数孕妇原发感染(或激活)HCMV时,常无任何临床症状;但此时病毒可经胎盘传给胎儿,导致流产、死产、先天性畸形[15]本研究在整个实验过程中,亦发现试验组雌鼠在妊娠16~18d以后,常有流产、死产的情况,但由于雌鼠有产下病或死胎很快自己吃掉的习性,此给试验监测带来极大不便。抢下幸存的死胎鼠脑组织在剖检时均发现了波及范围广泛的严重侵袭性脑膜脑炎性病理改变;剖腹胎鼠脑组织经压印固定后,利用地高辛标记的HCMV MIE和LA寡核苷酸探针进行的原位杂交检测到了存在于神经元核内及胞浆内的病毒特异性核酸;同时进行的病毒分离亦从感染胎鼠脑组织悬液上清中分离出HCMV。结果证实,HCMV可经感染小鼠胎盘,垂直传播至胎鼠脑组织中,引起病毒特征性炎性病理改变;且感染组雌鼠所产子鼠的死胎率及出生后1周内死亡率均明显高于对照组(P<0.01);幸存者亦有出生体重较轻,睁眼期推迟,皮毛稀疏等异常表现(详细结果见另文)。
, http://www.100md.com
实验研究过程中还发现,感染组雌鼠接种病毒后一周内不易受孕;此可能与大剂量病毒作为感染源进入机体,干扰了体内正常生理功能有关。在进行正式实验之前,我们已进行了多次多方案的预实验,经历多次失败后,发现病毒毒力的强弱是确定实验成功与否的关键要素之一。当我们选用近期反复传代且病毒的CPE在24~48h内达+++~++++的病毒悬液以较大剂量给小鼠接种时,才出现明显宫内感染,产生了垂直传播的效果。
HCMV体外感染人脑神经元原代培养物的研究已有报道[14],但实验所需的人胚脑组织来源受限。本组在临产剖腹胎鼠大脑皮质制备的原代神经元培养物上试用HCMV感染,根据观察鉴定结果证明,HCMV确能感染临产剖腹胎鼠大脑皮质神经元,并能在胞内复制,有明显致细胞病变作用(CPE),且CPE主要特征与在人细胞来源的培养物上一致。由于胎鼠价廉,易得,取材方便,且其脑神经元可被HCMV感染,这将促进对HCMV致先天性CNS感染发生机制的更深入的基础研究;促进抗HCMV感染药物和疫苗研制的基础研究。
, http://www.100md.com
基金项目:安徽省科学技术委员会自然科学基金资助项目(95-医-018)和安徽省教育委员会自然科学基金资助项目。
作者简介:王明丽(1956-),女,副教授,医学硕士学位。研究方向:病毒与中枢神经系统感染。
参考文献
[1] Plotkin SA,Starr.SE,Friedman HM.Vaccines for the preven tion of human cytomegalovirus infection[J].Rev Infect Dis 1990, 12:827~ 838
[2] 刘佩莉.新生儿巨细胞病毒感染的流行病学〔J〕.实用内科杂志,1992,7(2):65~67
[3] 宋海静,谷志远,卢彦平,等.原位PCR技术检测石蜡包埋脑组织中人巨细胞病毒DNA.中华微生物学和免疫学杂志,1997, 17(6): 475~ 477
, http://www.100md.com
[4] Mocarski,Jr ES.Cytomegalovirus Biology and Replication[M].In:B Roizman RJ whitley,and C. Lopez ed.The Human Her pesvirues.New York:Raven press.~ Ltd~ ,1993,173~ 226
[5] Gibson W.Structural and nonstructural proteins of strain col burn cytomegalovirus[J]. Virology,1981,111:516~ 537
[6] Smith KL,Kulski JK,Cobain T. et al.Detection of cy tomegalovirus in blood donous by the polymerase chain reac tion[J].Transfusion,1993;33, 497~ 503
, http://www.100md.com
[7] 吴希如,张一,马守兴,等.胚鼠大脑皮层神经细胞的体外原代分离单层培养方法〔J〕.北京医学院学报,1983,15: 169~ 172
[8] 王明丽,曹惠,史百芬,等.特发性血小板减少性癜与HCMV活动感染〔J〕.安徽医科大学学报,1996,31(1): 16~18
[9] 高又新,杨占秋,文莉,等.巨细胞病毒AD169株家兔感染机制的动物模型研究〔J〕.中华微生物学和免疫学杂志,1992,12:324
[10] 李天宪,赵林,冯锋,等.人巨细胞病毒小鼠模型的建立[J].微生物学报,1996,36: 292~ 294
[11] Ibanez CE,Schrier R,Ghazal P. et al .Human cytomegalovir us productively infects primary differentiated macrophages[J]. J Virol,1991, 65:6 581~ 6 588
, 百拇医药
[12] SOderberg C, Larsson S,Bergstedt Lindqvist S.et al. Defi-nition of a subset of Human peripheral blood mononulcear cells that are permissive to human cytomegalovius infection.J Virol,1993, 67: 3166~ 3175
[13] Lathey JL. Wiley CA,Verity MA. et al.Cultured human brain capillary endothelial cells are permissive for by Human Cytomegalovirus.Virology,1990, 176:266~ 273
[14] McCarthy M,Resnick L,Taub F.et al.Infection of human neural cell aggregate cultures with a clinical isolate of cytom-egalovirus[J].J Neuropathol Experimental Neurol,1991, 50:441~ 450
[15] Alford CA.Britt WJ.Cytomegalovirus [M].In:B Roizman. R J.whitley,and C.lopez ed.The Human Herpesviruses. NewYork: Raven Press,Ltd,1993, 227~ 255
收稿日期:1999-04-30, 百拇医药
单位:
(王明丽 史百芬 胡勇 李京培 毕克菊 黄升海)安徽医科大学微生物学教研室,安徽合肥 230032;(唐久来)安徽医科大学附属医院,安徽合肥 230022;胡闻)安徽省立医院病理科,安徽合肥 230001;(吴建军)安徽医科大学临床医学系九四级本科生,安徽合肥 230032
关键词:巨细胞病毒;大脑皮质神经元;胎鼠;先天性感染
现代康复990920 摘要 目的:研究确定人巨细胞病毒(HCMV)体内外先天性感染胎鼠大脑皮质神经元及其感染特征。方法:分别建立体内外模拟HCMV先天性感染小鼠脑神经元模型。采用病毒分离、病理学检测及核酸原位杂交技术等观察研究病毒的增殖,受染细胞的形态特征以及病毒核酸在细胞内的定位和分布。结果:体内模型显示:脑组织上清液中分离出HCMV;大脑皮质发生侵袭性脑膜脑炎性病理改变;神经元核内出现病毒特征性大的嗜碱性包涵体;病毒特异性核酸存在于受染神经元核内及胞浆内。体外模型亦证实:受染神经元胞体明显肿胀并可见核内嗜酸性包涵体;原位杂交法检出HCMV特异性核酸。结论:HCMV可在体内外致胎鼠大脑皮质神经元发生类似于人类先天性中枢神经系统感染的病理改变;建立的体内外感染模型可用于HCMV中枢神经系统先天性感染的发生机制研究。
, 百拇医药
Study on the neurons of fetal mice from the cerebral cortex
with the congenital human cytomegalovirus infection
WANG Ming-li TANG Jiu-lai Shi Bai-fen et al.
Department of Microbiology,Anhui Medical University,Hefei 230032 China
Abstract Objective:To investigate is to determine the infection of neurons that human cytomegalovirus AD169 strain(HCMV AD169)could cross the placenta of the Balb/cmice and initiate congenital infection of the developing fetus cerebral cortex invivo and that the neurons of the primary cultures from the cerebral cortex of Balb/c fetal mice could be infected by HCMV AD169 in vitro.Methods:HCMV(5.0 log TCID50 ml/mouse)was injected into the intraperitoneum of mice (half of mice are female)when they were about 8~ 12 weeks old.Then,these of mice were used for mating.Pregnancies were dated as day 0 when a copulation plug was found.Fetuses on day about to give birth of gestation were removed from the uteri and its cerebral cortex was removed from the skull and fixed with 4% paraformaldehyde,then cut into serial coronal sections 5 μ m thick,applied to slides coated with Histostik,and then stained with hematoxylin and eosin (HE).The supernatant of minced a fetal mouse cerebral cortex was used for virus isolates by HF cells.And viral DNA positive cells were examined by in situ hybridization using digoxigenin labelled HCMV DNA oligonucleotide probe in the acetone fixed imprint of the cerebral cortex.Meanwhile, The cerebral cortex neurons were prepared and cultured and HCMV infection model was made. 1~4 weeks after infection,the cultures was recorded and observed by photography under microscope, and the samples were taken for HE stainning.At the same time, the virus DNA and its intracellular location were analyzed in situhybridization~using digoxingenin labelled HCMV DNA oligonucleotide probes.Results: HCMV had been isolafed from the supernatant of fetal mice cerebral cortex.The pathological changes consisting of destructive meningoencephalitis and large、basophilic、intranuclear neuronal inclusions of viral type occurred in the fetal mouse cerebral cortex.The presence of virus sequences was confirmed by in situ hybridization,however, nothing was found in the normal controls.The neurons exhibited cytopathic effects at 2 weeks of postinfection,and the viral sequences was found when they were infected by HCMV AD169 in vitro. Conclusion:Development of the fetal mouse model of HCMV infection that mimics human congenital central nervous system(CNS)infection in vivo and in vitro will allow the study of the pathogenesis of HCMV congenital CNS infection and the development of therapeutic agents and vaccines.
, 百拇医药
Key Words human cytomegalovirus(HCMV);neuron of the cerebral cortex;a fetal mouse;congenital infection
人巨细胞病毒(Human Cytomegalovirus,HCMV)是最常见的宫内传播病毒之一。人类先天性HCMV感染可使多系统、多脏器受累,而中枢神经系统(CNS)受损后果最为严重,常见为脑积水,脊柱裂,小头畸形,脑内钙化(特别是脑室周围),非遗传性感觉神经性耳聋和四肢瘫痪等。每年仅就HCMV先天感染导致胎儿新生儿患神经系统疾病人数,Plotkin等[1]估计美国约有6000个婴儿为感染患者;按此估算,我国至少有3万多个婴儿成为患者。流行病学调查亦提示,先天畸形胎儿血清中HCMVIgM阳性率(20%)明显高于一般活产儿(1.65%~3.5%)[2];而在脑组织中HCMVDNA阳性率高达44%[3]。证实先天性HCMV感染中,CNS感染率较高,严重危害了胎儿的生长发育,导致的智力障碍给家庭和社会带来沉重负担。
, http://www.100md.com
为开展研究HCMV先天性CNS感染的病理过程,亟需建立合适的体内外实验模型。长期以来,一直沿用鼠巨细胞病毒(Murine Cytomegalovirus,MCMV)感染小鼠作为研究CMV感染与疾病的模型,但MCMV经自然途径感染小鼠后,不能像HCMV一样经胎盘致发育中的胚胎发生先天性感染[4],因此MCMV不适用于HCMV先天性感染的研究。本研究首次采用预先腹腔接种HCMV至生育龄Balb/c雌雄小鼠,然后配对喂养,在雌鼠临产时剖腹取出胎鼠及其母鼠双侧大脑皮质进行观察研究,建立了模拟人类HCMV先天性感染CNS的体内模型;同时在待产胎鼠双侧大脑皮质原代培养物上接种HCMV,连续4~5周细致地观察检测了HCMV致神经元感染的细胞病理学改变,建立了模拟人类HCMV先天性感染CNS的体外模型。现将结果报告如下。
1 材料和方法
1.1 病毒 HCMVAD169 株由上海医科大学微生物学教研室提供,用人胚成纤维细胞(HF)培养增殖。使用前,将病毒在HF细胞上传代,以增加病毒毒力;按Gibson[5]的病毒致细胞变异作用(CPE)终点稀释法以在24~48h内出现达+++~++++的病毒悬液在HF细胞上滴定TCID50;以6.0logTCID50/ml的病毒作为实验用毒种。
, http://www.100md.com
1.2 实验动物 纯系Balb/c小鼠,雌雄兼用,8~12周龄,体重(30±5)g,由本校实验动物中心提供(皖实验动物号:皖准01号)。感染病毒后饲养于本室专用感染动物柜内。
1.3 细胞 人成纤维细胞株(HF)及原代兔肾细胞均由本室自制。本研究采用的HF株为6~8代。
1.4 主要试剂 所用主要化学及分子生物学试剂分别购自Sigma公司、Promega公司和华美生物工程公司;地高辛DNA标记和检测试剂盒购自Boehringer Mannheim公司。
1.5 HCMV MIE和LA寡核苷酸探针序列合成与标记 HCMV DNA MIE(即刻早期抗原)和LA(晚期抗原)寡核苷酸探针片段序列位置参考文献[6]设计,MIE寡核苷酸探针序列:5′GAGGCTATTGTAG、CCTACACTT-TGG3′,序列位点为第900~925核苷酸;LA寡核苷酸针片段序列为5′GTCGCC、TGCACTGCCAGGTG、CTTCG3′,序列位点第2301~2325核苷酸。用DNA合成仪固相亚磷酸三酯法合成并纯化(中国科学院上海植物生理所植物分子遗传国家重点实验室)。上述两种Digoxigenin标记的探针制备及检测按Boehringer Mannheim公司说明书进行。
, http://www.100md.com
1.6 动物体内感染模型的建立 将HCMV AD169株悬液按0.5ml/只(5.0log TCID50)注射至雌雄小鼠腹腔内,然后按1∶1比例同笼饲养,此设定为试验组;与此同时,在设定为对照组的小鼠腹腔内分别注射正常HF细胞悬液05ml/只。逐日晨检查阴栓以确证其妊娠开始时间。待雌鼠临产(约为妊娠的第20d)剖腹取出胎鼠和相应母鼠大脑皮质,分别进行病毒分离、病理学检测及其病毒核酸原位杂交检测。
1.7 体外神经元感染模型的建立 实验用Balb/c临产胎鼠由本校实验动物中心提供。原代培养物的制备基本参照吴希如等[7]介绍的方法进行。将细胞接种至盛有已预先覆盖鼠尾胶原薄膜盖玻片的塑料培养皿内,最终细胞浓度1×106/ml。置37℃,50%CO2饱和湿度的CO2培养箱内培养,再经48h后,分别于相应孔内加入细胞分裂抑制剂5-氟-2′脱氧尿苷15μg/ml和尿苷35μg/ml以抑制非神经细胞的过度增殖。48h后,于每个试验孔内分别加入100TCID50病毒悬液0.1ml,同时以相同病毒量感染HF细胞作为阳性对照。观察和鉴定方法,每隔2~3d于例置显微镜下观察、摄影记录、换液;并在病毒感染后的第24h、48h、72h和第1~4周分别连续取样,用于病毒TCID50滴定,细胞病理学染色及原位杂交检测等。
, 百拇医药
1.8 病毒分离 基本方法参照文献[8]。常规无菌操作下取出胎鼠双侧大脑皮层,用细胞维持液制备10-1/ml脑细胞悬液,低速离心后,取上清分为两份,一份直接接种至HF细胞和原代兔肾细胞;另一份经56°30′灭活后再分别接种至上述两种细胞,同时设置正常细胞对照。对出现HCMV特征性CPE者,取培养上清做PCR,检测HCMV DNA。
1.9 50%组织培养感染剂量(TCID50)滴定 于HCMV感染后的第1、2、3和4周分别吸取培养上清,加50%山梨醇后,冻存于-70℃冰箱保存。在HF细胞上滴定病毒TCID50值的方法同前。
1.10 HE 染色 按常规方法进行。
1.11 原位杂交检测 经剖腹取出的胎鼠大脑皮质标本制备采用细胞压印片法。即常规冰盘操作下,将预涂有粘附剂的载玻片平置于工作台上,杀死动物立即取脑,选择一个较平整切面,用另一块玻片轻轻下压,尽快移去组织,尽量不拖动。将此玻片立即水平置于备好的冷丙酮中固定10min,空气干燥,备用。对载有单层神经元培养物的盖玻片用4%多聚甲醛固定后,经乙醇梯度脱水后备用。原位杂交检测时,先将细胞片置于PBS缓冲液中水化,5min×3;接着用PronaseK(20μg/ml)37℃作用10min;经含甘氨酸(2mg/ml)-PBS洗涤5min×2后,加RNaseA(100μg/ml)37℃作用30min,经甘氨酸-PBS洗涤后,按试剂盒说明书操作,进行HCMVDNA检测。出现颜色反应后,常规50%甘油封片,照像记录。每次实验均设如下对照,阴性对照:第1正常对照组胎鼠脑组织压印片和正常HF细胞培养物滴片;第2无标记探针的试验组胎鼠脑组织压印片和无标记探针的HCMV感染的胎鼠脑神经元培养物。阳性对照:HCMV感染的HF细胞培养物滴片。
, 百拇医药
2 结果
2.1 临产剖腹胎鼠大脑皮质病毒分离 见表1。
表1 胎鼠脑组织悬液HCMV分离结果 接种方法
样本数
HF细胞
原代兔肾细胞
CPE阳性数/样本数
CPE阳性数/标本数
直接接种
10
7/10
0/10
, http://www.100md.com
56°30′灭活后接种
10
0/10
1/10
对照组脑悬液上
清直接接种
10
0/10
0/10
对接种至HF细胞单层分离培养CPE阳性者,取此培养物反复冻融3次后,15000rpm离心后取上清,再用PCR法分别检测HCMV、HSV和VZV DNA,结果仅HCMV DNA为阳性,余为阴性。表明:HCMV确可经小鼠胎盘,垂直传播至胎鼠脑组织中。
, 百拇医药
2.2 50%组织培养感染剂量(TCID50)滴定 当所设HCMV感染的HF细胞培养物对照在感染后第1周出现约90%CPE时(TCID50滴度为1×104/ml),病毒感染的胎鼠大脑皮质神经元出现明显灶性病变,并可测出细胞上清液中的游离病毒TCID50滴度为2×103/ml;于感染后第2周,病毒效价迅速增高,TCID50达最高值,为2×104/ml,这与出现的CPE变化相吻合。表明感染后第2周是病毒大量形成时间,此后病毒效价平稳;但第4周开始,由于培养的脑细胞开始死亡,病毒效价下降。
2.3 病理学研究
2.3.1 临产剖腹胎鼠大脑皮质病理检测结果 试验组胎鼠及其母鼠剖检时可见脑膜血管明显充血;镜检发现:两者大脑皮质微血管均有不同程度的扩张充血,血管外周及邻近组织中有中性粒细胞和单个核细胞浸润,以及散在出血病灶尤以母鼠为甚。(图1A)。而胎鼠的病理改变较为显著的是细胞间隙水肿,部分神经元己明显变性坏死或细胞核消失,仅留有轮廓,并可见到软化灶(图1B);而且在受染的神经元核内见到HCMV特征性嗜碱性包涵体(图1C)。

, 百拇医药
图1A 母鼠大脑皮质中的单个核细胞浸润(HE;100X)

图1B胎鼠大脑皮质中神经细胞变性坏死及软化灶(箭头)(HE;100X)

图1C胎鼠大脑皮质中的病毒特征性的大的核内嗜碱性色涵体(箭头)(HE;100X)
2.3.2 HCMV感染临产剖腹胎鼠大脑皮质神经元活体形态观察 在倒置显微镜下,HCMV感染的神经元形态明显改变发生在培养的第2周。镜下可见神经元胞核肿胀,胞浆颗粒增多,折光性减弱,突起断裂(图2A)。HE染色同时观察,可见受染神经细胞明显肿胀,胞浆及胞核均为嗜酸性,核内可见到嗜酸性包涵体(图2,B)。

, 百拇医药
图2AHCMV感染的原代培养胎鼠大脑皮质神经元(200X)

图2BHCMV感染的原代培养胎鼠大脑皮质神经元,箭头示细胞肿胀,核内嗜酸性包涵体(HE,X400)
2.4 应用HCMVMIE和LA寡核苷酸探针检测胎鼠大脑皮质神经元中HCMV DNA。
2.4.1 检测临产胎鼠大脑皮质压印片中HCMVDNA用Dig标记的HCMVMIE和LA寡核苷酸探针与未感染的正常对照组胎鼠脑压印片中细胞进行原位杂交,没有发现杂交信号(图3A)。用上述同样探针与试验组胎鼠脑印片进行原位杂交,即可在镜下观察到与HCMV感染的HF细胞结果相一致的杂交阳性信号,即在大脑皮质神经元的核内及胞浆内出现深紫蓝色杂交阳性颗粒(图3B)。
MIE及LA探针检测不同感染时间的鼠脑神经元培养物,结果发现,MIE探针可在HCMV感染物培养的第1周(约5~7d)检出HCMVDNA;而LA探针则可稳定检出HCMV感染后第2~4周的HCMVDNA。因此,同时使用两种探针检测,可避免假阴性,提高准确性(图3C)。

, http://www.100md.com
图3A原位杂交检测正常对照胎鼠大脑皮质压印片中HCMVDNA,无杂交信号(400X)

图3BHCMV试验组胎鼠大脑皮质神经元HCMVDNA阳性信号(400X)

图3CHCMV感染胎鼠大脑皮质神经元原代培养物HCMVDNA杂交性信号(400X)
3 讨论
一般认为,HCMV感染的宿主范围和细胞范围均较狭窄,种属特异较高,即HCMV只能感染人及HCMV体外培养仅在人成纤维细胞中增殖。但HCMVAD169株作为HCMV标准毒株已在体外广泛传代并冷藏多年,已有实验证实,在实验动物体内HCMV可致家兔[9]全身感染和小白鼠[10]脑内感染;在体外,HCMVAD169株尚可在培养的人MΦ[11]、外周血单核细胞[12]、脑毛细血管内皮细胞[13]和神经细胞[14]中增殖复制。此表明,经过长期体外传代的AD169株宿主范围已变得相当广泛。
, http://www.100md.com
本文首次将HCMVAD169株接种至生育龄雌雄Balb/c小鼠腹腔内,虽导致了小鼠全身病毒血症(资料未示),但因此年龄段小鼠对HCMV有一定程度抵抗力而无发病、死亡情况发生。此种情形很类似于人类大多数孕妇原发感染(或激活)HCMV时,常无任何临床症状;但此时病毒可经胎盘传给胎儿,导致流产、死产、先天性畸形[15]本研究在整个实验过程中,亦发现试验组雌鼠在妊娠16~18d以后,常有流产、死产的情况,但由于雌鼠有产下病或死胎很快自己吃掉的习性,此给试验监测带来极大不便。抢下幸存的死胎鼠脑组织在剖检时均发现了波及范围广泛的严重侵袭性脑膜脑炎性病理改变;剖腹胎鼠脑组织经压印固定后,利用地高辛标记的HCMV MIE和LA寡核苷酸探针进行的原位杂交检测到了存在于神经元核内及胞浆内的病毒特异性核酸;同时进行的病毒分离亦从感染胎鼠脑组织悬液上清中分离出HCMV。结果证实,HCMV可经感染小鼠胎盘,垂直传播至胎鼠脑组织中,引起病毒特征性炎性病理改变;且感染组雌鼠所产子鼠的死胎率及出生后1周内死亡率均明显高于对照组(P<0.01);幸存者亦有出生体重较轻,睁眼期推迟,皮毛稀疏等异常表现(详细结果见另文)。
, http://www.100md.com
实验研究过程中还发现,感染组雌鼠接种病毒后一周内不易受孕;此可能与大剂量病毒作为感染源进入机体,干扰了体内正常生理功能有关。在进行正式实验之前,我们已进行了多次多方案的预实验,经历多次失败后,发现病毒毒力的强弱是确定实验成功与否的关键要素之一。当我们选用近期反复传代且病毒的CPE在24~48h内达+++~++++的病毒悬液以较大剂量给小鼠接种时,才出现明显宫内感染,产生了垂直传播的效果。
HCMV体外感染人脑神经元原代培养物的研究已有报道[14],但实验所需的人胚脑组织来源受限。本组在临产剖腹胎鼠大脑皮质制备的原代神经元培养物上试用HCMV感染,根据观察鉴定结果证明,HCMV确能感染临产剖腹胎鼠大脑皮质神经元,并能在胞内复制,有明显致细胞病变作用(CPE),且CPE主要特征与在人细胞来源的培养物上一致。由于胎鼠价廉,易得,取材方便,且其脑神经元可被HCMV感染,这将促进对HCMV致先天性CNS感染发生机制的更深入的基础研究;促进抗HCMV感染药物和疫苗研制的基础研究。
, http://www.100md.com
基金项目:安徽省科学技术委员会自然科学基金资助项目(95-医-018)和安徽省教育委员会自然科学基金资助项目。
作者简介:王明丽(1956-),女,副教授,医学硕士学位。研究方向:病毒与中枢神经系统感染。
参考文献
[1] Plotkin SA,Starr.SE,Friedman HM.Vaccines for the preven tion of human cytomegalovirus infection[J].Rev Infect Dis 1990, 12:827~ 838
[2] 刘佩莉.新生儿巨细胞病毒感染的流行病学〔J〕.实用内科杂志,1992,7(2):65~67
[3] 宋海静,谷志远,卢彦平,等.原位PCR技术检测石蜡包埋脑组织中人巨细胞病毒DNA.中华微生物学和免疫学杂志,1997, 17(6): 475~ 477
, http://www.100md.com
[4] Mocarski,Jr ES.Cytomegalovirus Biology and Replication[M].In:B Roizman RJ whitley,and C. Lopez ed.The Human Her pesvirues.New York:Raven press.~ Ltd~ ,1993,173~ 226
[5] Gibson W.Structural and nonstructural proteins of strain col burn cytomegalovirus[J]. Virology,1981,111:516~ 537
[6] Smith KL,Kulski JK,Cobain T. et al.Detection of cy tomegalovirus in blood donous by the polymerase chain reac tion[J].Transfusion,1993;33, 497~ 503
, http://www.100md.com
[7] 吴希如,张一,马守兴,等.胚鼠大脑皮层神经细胞的体外原代分离单层培养方法〔J〕.北京医学院学报,1983,15: 169~ 172
[8] 王明丽,曹惠,史百芬,等.特发性血小板减少性癜与HCMV活动感染〔J〕.安徽医科大学学报,1996,31(1): 16~18
[9] 高又新,杨占秋,文莉,等.巨细胞病毒AD169株家兔感染机制的动物模型研究〔J〕.中华微生物学和免疫学杂志,1992,12:324
[10] 李天宪,赵林,冯锋,等.人巨细胞病毒小鼠模型的建立[J].微生物学报,1996,36: 292~ 294
[11] Ibanez CE,Schrier R,Ghazal P. et al .Human cytomegalovir us productively infects primary differentiated macrophages[J]. J Virol,1991, 65:6 581~ 6 588
, 百拇医药
[12] SOderberg C, Larsson S,Bergstedt Lindqvist S.et al. Defi-nition of a subset of Human peripheral blood mononulcear cells that are permissive to human cytomegalovius infection.J Virol,1993, 67: 3166~ 3175
[13] Lathey JL. Wiley CA,Verity MA. et al.Cultured human brain capillary endothelial cells are permissive for by Human Cytomegalovirus.Virology,1990, 176:266~ 273
[14] McCarthy M,Resnick L,Taub F.et al.Infection of human neural cell aggregate cultures with a clinical isolate of cytom-egalovirus[J].J Neuropathol Experimental Neurol,1991, 50:441~ 450
[15] Alford CA.Britt WJ.Cytomegalovirus [M].In:B Roizman. R J.whitley,and C.lopez ed.The Human Herpesviruses. NewYork: Raven Press,Ltd,1993, 227~ 255
收稿日期:1999-04-30, 百拇医药