胶束电动毛细管色谱法测定兔血浆中氟比洛芬的浓度
作者:张国庆 柴逸峰 纪松岗 钟延强 殷学平 李捷玮 吴玉田
单位:第二军医大学东方肝胆外科医院药剂科,上海,200433;柴逸峰 吴玉田:第二军医大学药学院药物分析教研室;纪松岗:海军第401医院药剂科;钟延强:第二军医大学药学院药剂学教研室;殷学平:第二军医大学科研部
关键词:色谱法;胶束电动毛细管;氟比洛芬
第二军医大学学报991019 摘要 目的:建立胶束电动毛细管色谱法测定兔血浆中氟比洛芬的浓度。方法:兔血浆经甲醇除蛋白质后,加入0.1 ml分离用缓冲液溶解后进样测定。电泳条件为:75 μm×100 cm空心石英毛细管柱,缓冲液为20 mmol/L 硼砂(含25 mmol/L 十二烷基硫酸钠)。结果:本法以酮基布洛芬为内标,在1~24 μg/ml内呈良好的线性关系和重现性,2.4,7.2和12.0 μg的加样回收率分别为95.36%,93.55%和95.22%,最低检测浓度为0.2 μg/ml。结论:本法准确、简便,可用于药代动力学研究。
, http://www.100md.com
中图分类号 R 971.1 文献标识码:A
Determination of flurbiprofen in rabbit plasma by micellar electrokinetic capillary chromatography
Zhang Guoqing, Chai Yifeng, Ji Songgang, Zhong Yanqiang, Ying Xueping, Li Jiewei, Wu Yutian
(Department of Pharmacy, Eastern Hospital of Hepatobiliary Surgery, Second Military Medical University, Shanghai, 200438)
ABSTRACT Objective: To set up micellar electrokinetic capillary chromatography for the determination of flurbiprofen in rabbit plasma. Methods: 0.2 ml of rabbit plasma was deproteined by methanol which was then evaporated under N2 flow. The residue was resolved by methanol for injection. The electrophoretic conditions were as follows: 75 μm×100 cm capillary tube; buffer: 20 mmol/L of borate solution containing 25 mmol/L of sodium dodecyl sulphate. Results: The established method using ketoprofen as internal standard was linear in the range of 1~24 μg/ml of flurbiprofen with good precision. The added recovery of 2.4, 7.2 and 12.0 μg was 95.36%,93.55% and 95.22% respectively and the detection limit was 0.2 μg/ml. Conclusion: The method is accurate and simple, which could be used for the pharmacokinetic study of flurbiprofen.
, 百拇医药
KEY WORDS chromatography,micellar electrokinetic capillary; flurbiprofen
氟比洛芬(flurbiprofen)是一种口服有效的非甾体类抗炎药,用于治疗风湿性关节炎[1]。目前已报道GC[2,3]和HPLC法[4~7]测定其体液中的浓度。GC法操作繁琐。采用荧光[4,5]和紫外[6,7]检测的HPLC法可简化操作,但是有机溶剂的消耗量大,高成本的色谱柱易被体液中的内源性物质污染且难以再生。
胶束电动毛细管色谱法是一种具有高效、简便、低耗等特点的新型的液相分离技术[8,9],其空心毛细管柱成本低,抗污染能力强且容易再生,为此,本研究采用胶束电动毛细管色谱法测定兔血浆中氟比洛芬的浓度,结果令人满意。
, http://www.100md.com
1 材料和方法
1.1 仪器和试剂 Waters Capillary Ion Analyzer, 75 μm×100 cm空心熔融石英毛细管柱,柱上紫外检测。氟比洛芬和酮基布洛芬(内标)的标准对照品分别由德国Knoll制药公司和重庆合成制药厂提供,批号分别为96041102和97060815,并用甲醇配制成溶液备用。甲醇、硼砂、十二烷基硫酸钠(SDS)均为分析纯。
1.2 电泳条件 分离电压 30 kV;温度 30℃;虹吸进样,时间30 s;紫外检测波长254 nm;分离用缓冲液为20 mmol/L 硼砂含25 mmol/L SDS, pH 9.02。
1.3 样品制备 取0.2 ml兔血浆,加入内标2 μg,甲醇1 ml,混匀后离心,取出上清液,于70℃水浴中氮气吹干,加入0.1 ml分离用缓冲液溶解后进样测定。
, 百拇医药 1.4 家兔药代动力学实验 采用所建立的方法测定了兔血浆中氟比洛芬的浓度及其药代动力学参数。家兔3只,体质量 (2.0±0.2) kg,雌2只,雄1只,由第二军医大学实验动物中心提供。家兔空腹灌服氟比洛芬12.5 mg/kg后,分别于0.5, 1, 1.5, 2, 3, 4, 6, 8和12 h从耳缘静脉取血,置于内有肝素的试管中,离心后取血浆进行测定。所得药-时数据经3P87药代动力学程序处理。
2 结果和讨论
2.1 分离条件的选择 使用75 μm×60 cm的毛细管柱时,有干扰,难以满足测定要求。将柱长增加至100 cm时,可消除血浆中内源性物质的干扰,改善分离状况。硼砂缓冲液中加入SDS可包裹血浆中的蛋白质,减少蛋白质对分离测定的干扰及对毛细管柱的污染。进样时间延长,方法灵敏度提高,但柱效降低。根据实验,进样时间为30 s时,可满足方法灵敏度和分离测定的要求。另外,还对紫外检测波长进行了选择,结果在254 nm处比214 nm处灵敏度高,故选择254 nm为测定波长。其分离色谱图见图1。
, 百拇医药
图1 样品的色谱图
Fig 1 Electropherograms of sample
a: Control plasma; b: Sample plasma; 1: Endogenous
substances; 2:Internal standard; 3:Flurbiprofen
2.2 方法评价 取0.2 ml空白兔血浆,分别加入氟比洛芬使其浓度分别为1.0,2.0,6.0,12.0,18.0和24.0 μg/ ml,均加入内标2 μg,按“样品制备”项下操作。以氟比洛芬与内标峰面积之比Y和浓度X进行回归,线性回归方程为:Y= 0.677 X-0.019 1(r=0.999 7),表明线性关系良好。对浓度分别为2,12,24 μg/ml的样品进行日内(n=3)和日间(n=3)精密度实验,结果日内RSD(%)分别为3.39,2.57,2.33;日间RSD(%)分别为4.76,3.20,4.15。表明其RSD%均小于5%,符合体内药物分析的要求。取已知浓度的血浆样品0.2 ml,分别加入氟比洛芬对照品2.4,7.2和12.0 μg,按“样品制备”项下操作,进行加样回收率实验,结果加样回收率分别为95.36%,RSD=3.44% (n=3);93.55%,RSD=4.65%(n=3)和95.22%,RSD=4.18%(n=3)。取0.2 ml血浆,以信噪比等于3为标准,其最小检测浓度为0.2 μg/ml。
, 百拇医药
2.3 家兔药代动力学研究结果 家兔口服氟比咯芬后的药代动力学符合开放一室模型,所得血药浓度-时间曲线见图2,所得主要药代动力学参数为:t1/2α为(0.078±0.046)h;t1/2β为(5.56±1.00)h;tmax为(0.49±0.25)h;cmax(9.85±0.89) μg/ml;AUC为(82.93±9.03) μg.h/ml。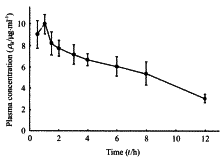
图2 家兔灌服25 mg氟比洛芬
后的药-时曲线(n=3)
Fig 2 The drug-time curve of 25 mg flurbiprofen in rabbit
, 百拇医药
本研究建立准确、简便的胶束电动毛细管色谱法测定兔血浆中氟比洛芬的浓度,方法具有良好的线性关系和重现性,样品仅需简单处理即可进样测定,体现了胶束电动毛细管色谱法抗污染、抗干扰能力强的特点,为氟比洛芬血药浓度的测定提供了新的方法学手段。
文章编号:0258-879X(1999)10-0767-03
参考文献
1 Chalmers IM, Cathcart BJ, Kumar EB, et al. Clinic-pharmacokinetic studies and clinical evaluations of flurbiprofen[J]. Ann Rheum Dis, 1972, 31(4):319
2 Kawahara K, Matsumura M, Kimura K. Determination of flurbiprofen in human plasma using gas chromatrophy-mass spectrometry with selected ion monitoring[J]. J Chromatogr, 1981, 223:202
, 百拇医药
3 Kaiser DG, Shaw SR, Vangiessen GJ. GLC determination of dl-2(2-fluoro-4-biphenylyl) propionic acid(flurbiprofen) in plasma[J]. J Pharm Sci, 1974, 63(4):567
4 Albert KS, Gillespie WR, Raabe A, et al. Determination of flurbiprofen in human serum by reverse-phase high-performance liquid chromatography with fluorescence detection[J]. J Pharm Sci, 1984, 73(12):1823
5 Adams WJ, Bothwell BE, Bothwell WM, et al. Simultaneous determination of flurbiprofen and its major metabolite in physiological fluids using liquid chromatography with fluorescence detection[J]. Anal Chem, 1987, 59(11):1504
, 百拇医药
6 Kumbhat S, Mathur NK. Determination of flurbiprofen in aqueous humor of human by high performance liquid chromatography[J]. Anal Lett, 1990, 23(4):627
7 Chi SC, Kim H, Lee SC. High performance liquid chromatographic analysis of flurbiprofen in rat plasma[J]. Anal Lett, 1994, 27(2):377
8 Terabe S, Otsuka K, Ichikawa K, et al. Electrokinetic separations with micellar solutions and open-tubular capillaries[J]. Anal Chem, 1984, 56(1):111
9 Qing Y, Kus H, Sam FYL. Trends in capillary electrophoresis: 1997[J]. J Chromatogr Sci, 1997, 35 (8) :358
(1999-06-17 收稿,1999-08-31修回), 百拇医药
单位:第二军医大学东方肝胆外科医院药剂科,上海,200433;柴逸峰 吴玉田:第二军医大学药学院药物分析教研室;纪松岗:海军第401医院药剂科;钟延强:第二军医大学药学院药剂学教研室;殷学平:第二军医大学科研部
关键词:色谱法;胶束电动毛细管;氟比洛芬
第二军医大学学报991019 摘要 目的:建立胶束电动毛细管色谱法测定兔血浆中氟比洛芬的浓度。方法:兔血浆经甲醇除蛋白质后,加入0.1 ml分离用缓冲液溶解后进样测定。电泳条件为:75 μm×100 cm空心石英毛细管柱,缓冲液为20 mmol/L 硼砂(含25 mmol/L 十二烷基硫酸钠)。结果:本法以酮基布洛芬为内标,在1~24 μg/ml内呈良好的线性关系和重现性,2.4,7.2和12.0 μg的加样回收率分别为95.36%,93.55%和95.22%,最低检测浓度为0.2 μg/ml。结论:本法准确、简便,可用于药代动力学研究。
, http://www.100md.com
中图分类号 R 971.1 文献标识码:A
Determination of flurbiprofen in rabbit plasma by micellar electrokinetic capillary chromatography
Zhang Guoqing, Chai Yifeng, Ji Songgang, Zhong Yanqiang, Ying Xueping, Li Jiewei, Wu Yutian
(Department of Pharmacy, Eastern Hospital of Hepatobiliary Surgery, Second Military Medical University, Shanghai, 200438)
ABSTRACT Objective: To set up micellar electrokinetic capillary chromatography for the determination of flurbiprofen in rabbit plasma. Methods: 0.2 ml of rabbit plasma was deproteined by methanol which was then evaporated under N2 flow. The residue was resolved by methanol for injection. The electrophoretic conditions were as follows: 75 μm×100 cm capillary tube; buffer: 20 mmol/L of borate solution containing 25 mmol/L of sodium dodecyl sulphate. Results: The established method using ketoprofen as internal standard was linear in the range of 1~24 μg/ml of flurbiprofen with good precision. The added recovery of 2.4, 7.2 and 12.0 μg was 95.36%,93.55% and 95.22% respectively and the detection limit was 0.2 μg/ml. Conclusion: The method is accurate and simple, which could be used for the pharmacokinetic study of flurbiprofen.
, 百拇医药
KEY WORDS chromatography,micellar electrokinetic capillary; flurbiprofen
氟比洛芬(flurbiprofen)是一种口服有效的非甾体类抗炎药,用于治疗风湿性关节炎[1]。目前已报道GC[2,3]和HPLC法[4~7]测定其体液中的浓度。GC法操作繁琐。采用荧光[4,5]和紫外[6,7]检测的HPLC法可简化操作,但是有机溶剂的消耗量大,高成本的色谱柱易被体液中的内源性物质污染且难以再生。
胶束电动毛细管色谱法是一种具有高效、简便、低耗等特点的新型的液相分离技术[8,9],其空心毛细管柱成本低,抗污染能力强且容易再生,为此,本研究采用胶束电动毛细管色谱法测定兔血浆中氟比洛芬的浓度,结果令人满意。
, http://www.100md.com
1 材料和方法
1.1 仪器和试剂 Waters Capillary Ion Analyzer, 75 μm×100 cm空心熔融石英毛细管柱,柱上紫外检测。氟比洛芬和酮基布洛芬(内标)的标准对照品分别由德国Knoll制药公司和重庆合成制药厂提供,批号分别为96041102和97060815,并用甲醇配制成溶液备用。甲醇、硼砂、十二烷基硫酸钠(SDS)均为分析纯。
1.2 电泳条件 分离电压 30 kV;温度 30℃;虹吸进样,时间30 s;紫外检测波长254 nm;分离用缓冲液为20 mmol/L 硼砂含25 mmol/L SDS, pH 9.02。
1.3 样品制备 取0.2 ml兔血浆,加入内标2 μg,甲醇1 ml,混匀后离心,取出上清液,于70℃水浴中氮气吹干,加入0.1 ml分离用缓冲液溶解后进样测定。
, 百拇医药 1.4 家兔药代动力学实验 采用所建立的方法测定了兔血浆中氟比洛芬的浓度及其药代动力学参数。家兔3只,体质量 (2.0±0.2) kg,雌2只,雄1只,由第二军医大学实验动物中心提供。家兔空腹灌服氟比洛芬12.5 mg/kg后,分别于0.5, 1, 1.5, 2, 3, 4, 6, 8和12 h从耳缘静脉取血,置于内有肝素的试管中,离心后取血浆进行测定。所得药-时数据经3P87药代动力学程序处理。
2 结果和讨论
2.1 分离条件的选择 使用75 μm×60 cm的毛细管柱时,有干扰,难以满足测定要求。将柱长增加至100 cm时,可消除血浆中内源性物质的干扰,改善分离状况。硼砂缓冲液中加入SDS可包裹血浆中的蛋白质,减少蛋白质对分离测定的干扰及对毛细管柱的污染。进样时间延长,方法灵敏度提高,但柱效降低。根据实验,进样时间为30 s时,可满足方法灵敏度和分离测定的要求。另外,还对紫外检测波长进行了选择,结果在254 nm处比214 nm处灵敏度高,故选择254 nm为测定波长。其分离色谱图见图1。

, 百拇医药
图1 样品的色谱图
Fig 1 Electropherograms of sample
a: Control plasma; b: Sample plasma; 1: Endogenous
substances; 2:Internal standard; 3:Flurbiprofen
2.2 方法评价 取0.2 ml空白兔血浆,分别加入氟比洛芬使其浓度分别为1.0,2.0,6.0,12.0,18.0和24.0 μg/ ml,均加入内标2 μg,按“样品制备”项下操作。以氟比洛芬与内标峰面积之比Y和浓度X进行回归,线性回归方程为:Y= 0.677 X-0.019 1(r=0.999 7),表明线性关系良好。对浓度分别为2,12,24 μg/ml的样品进行日内(n=3)和日间(n=3)精密度实验,结果日内RSD(%)分别为3.39,2.57,2.33;日间RSD(%)分别为4.76,3.20,4.15。表明其RSD%均小于5%,符合体内药物分析的要求。取已知浓度的血浆样品0.2 ml,分别加入氟比洛芬对照品2.4,7.2和12.0 μg,按“样品制备”项下操作,进行加样回收率实验,结果加样回收率分别为95.36%,RSD=3.44% (n=3);93.55%,RSD=4.65%(n=3)和95.22%,RSD=4.18%(n=3)。取0.2 ml血浆,以信噪比等于3为标准,其最小检测浓度为0.2 μg/ml。
, 百拇医药
2.3 家兔药代动力学研究结果 家兔口服氟比咯芬后的药代动力学符合开放一室模型,所得血药浓度-时间曲线见图2,所得主要药代动力学参数为:t1/2α为(0.078±0.046)h;t1/2β为(5.56±1.00)h;tmax为(0.49±0.25)h;cmax(9.85±0.89) μg/ml;AUC为(82.93±9.03) μg.h/ml。

图2 家兔灌服25 mg氟比洛芬
后的药-时曲线(n=3)
Fig 2 The drug-time curve of 25 mg flurbiprofen in rabbit
, 百拇医药
本研究建立准确、简便的胶束电动毛细管色谱法测定兔血浆中氟比洛芬的浓度,方法具有良好的线性关系和重现性,样品仅需简单处理即可进样测定,体现了胶束电动毛细管色谱法抗污染、抗干扰能力强的特点,为氟比洛芬血药浓度的测定提供了新的方法学手段。
文章编号:0258-879X(1999)10-0767-03
参考文献
1 Chalmers IM, Cathcart BJ, Kumar EB, et al. Clinic-pharmacokinetic studies and clinical evaluations of flurbiprofen[J]. Ann Rheum Dis, 1972, 31(4):319
2 Kawahara K, Matsumura M, Kimura K. Determination of flurbiprofen in human plasma using gas chromatrophy-mass spectrometry with selected ion monitoring[J]. J Chromatogr, 1981, 223:202
, 百拇医药
3 Kaiser DG, Shaw SR, Vangiessen GJ. GLC determination of dl-2(2-fluoro-4-biphenylyl) propionic acid(flurbiprofen) in plasma[J]. J Pharm Sci, 1974, 63(4):567
4 Albert KS, Gillespie WR, Raabe A, et al. Determination of flurbiprofen in human serum by reverse-phase high-performance liquid chromatography with fluorescence detection[J]. J Pharm Sci, 1984, 73(12):1823
5 Adams WJ, Bothwell BE, Bothwell WM, et al. Simultaneous determination of flurbiprofen and its major metabolite in physiological fluids using liquid chromatography with fluorescence detection[J]. Anal Chem, 1987, 59(11):1504
, 百拇医药
6 Kumbhat S, Mathur NK. Determination of flurbiprofen in aqueous humor of human by high performance liquid chromatography[J]. Anal Lett, 1990, 23(4):627
7 Chi SC, Kim H, Lee SC. High performance liquid chromatographic analysis of flurbiprofen in rat plasma[J]. Anal Lett, 1994, 27(2):377
8 Terabe S, Otsuka K, Ichikawa K, et al. Electrokinetic separations with micellar solutions and open-tubular capillaries[J]. Anal Chem, 1984, 56(1):111
9 Qing Y, Kus H, Sam FYL. Trends in capillary electrophoresis: 1997[J]. J Chromatogr Sci, 1997, 35 (8) :358
(1999-06-17 收稿,1999-08-31修回), 百拇医药