金属蛋白酶及其抑制剂在大鼠正常及纤维化肝脏中的表达
作者:曾仲 马宏敏
单位:曾仲(第三军医大学附属西南医院肝胆外科中心) 重庆,400038;马宏敏(第三军医大学附属西南医院肝胆外科中心 普通外科) 重庆,400038
关键词:肝纤维化;膜型基质金属蛋白酶1;基质金属蛋白酶2;基质金属蛋白酶组织抑制剂1;成纤维细胞
第三军医大学学报991011 提 要 目的:了解膜型基质金属蛋白酶1(MT1-MMP)、基质金属蛋白酶2(MMP2)、基质金属蛋白酶组织抑制剂1(TIMP1)在大鼠正常及纤维化肝脏中的表达。方法:用60%CCl4加5%乙醇制作大鼠肝纤维化模型,利用原位杂交及免疫组化的方法检测MT1-MMP, MMP2,TIMP1的表达并与正常对照组比较。结果:在纤维化肝脏中,MT1-MMP, MMP2,TIMP1主要表达在成纤维细胞、肌成纤维细胞中,以纤维间隔及汇管区最明显,血管内皮细胞有低水平表达。而正常组中仅有内皮细胞有低表达,明显弱于肝纤维化组。结论:在肝纤维化中,成纤维细胞及肌成纤维细胞是MT1-MMP、 MMP2、TIMP1表达的主要细胞。
, 百拇医药
中图法分类号 R575.5 文献标识码:A
Expression of MT1-MMP,MMP2 and TIMP1 in normal and fibrotic liver in rats
Zheng Zhong, Ma Hongming (Department of Hepatobiliary Surgery, Southwest Hospital, Third Military Medical University, Chongqing,400038)
Abstract Objective: To observe the pattern of expression of MT1-MMP, MMP2 and TIMP1 in normal and fibrotic liver in rats. Methods: Fibrosis was induced in the liver of rats with the injection of 60% CCl4 and 5% alcohol. The expression of MT1-MMP, MMP2 and TIMP1 in the liver was observed with in situ hybridization and immunohistochemistry. Results: In the fibrotis liver, the expressions occurred predominantly in the myofibroblasts and fibroblasts of the areas of portal tracts and fibrotic septa and in low degrees in the vascular endothelium. Nevertheless, in the normal liver, the expression took place mainly in the vascular endothelium in low degrees. Conclusion: In liver fibrosis, fibroblasts and myofibroblasts are the main sites for the expression of MT1-MMP, MMP2 and TIMP1 to occur.
, 百拇医药
Key words liver fibrosis; fibroblast; MT1-MMP; TIMP1
肝纤维化的主要病理变化就是肝细胞外基质(Extracellular matrix,ECM)在肝脏中过多沉积。目前的研究表明,肝ECM的代谢主要由基质金属蛋白酶(Matrix metalloproteinase,MMP)及其抑制剂(Tissue inhibitor of metalloproteinase,TIMP)所调节,MMP促进ECM的降解,而TIMP通过抑制MMP阻止ECM的降解,从而形成和促进纤维化[1,2]。但在正常和纤维化肝脏中由哪些细胞表达和合成MMP和TIMP目前的认识还不尽一致,为此,本研究用原位杂交和免疫组化检测了大鼠正常肝脏和实验性肝纤维化中基质金属蛋白酶2(MMP2),膜型基质金属蛋白酶1(Membrane type1-MMP, MT1-MMP)和基质金属蛋白酶抑制剂1(TIMP1)的基因表达。
, 百拇医药
1 材料和方法
1.1 实验动物及分组
30只Wistar大鼠分为制作肝纤维化组(LF)20只,正常组(NC)10只;前者利用注射CCl4加饮用5%乙醇的方法,60 d后制成肝纤维化模型,存活10只,正常组常规喂养60 d,所有动物活杀取肝脏标本,一部份置于液氧中备检,一部份置10%福尔马林中固定备检。
1.2 原位杂交
将质粒MMP2、TIMP1(本院宋波教授馈赠),MT1-MMP(日本Sato教授馈赠)转入JM109大肠杆菌后大量扩增、提取、纯化、酶切、回收cDNA片段,按宝灵曼公司试剂盒说明操作,用地高辛随机引物法标记制备cDNA探针,按文献[3]方法进行原位杂交。阴性对照不加探针或经RNase处理后再进行原位杂交。
, http://www.100md.com
1.3 免疫组化
按北京中山公司SPTM试剂盒说明书操作。 MT1-MMP单抗(日本Sato教授馈赠)浓度为1∶100,TIMP1多抗(美国癌症研究所William G. Stetler-Stevenson教授馈赠)浓度为1∶50。
1.4 图像分折
每一玻片任选5个视野,自动检测阳性细胞面密度,取其平均值,进行统计分析。
1.5 统计学处理
数据用 ±s表示。利用本校统计学教研室的统计程序包行方差分析。
±s表示。利用本校统计学教研室的统计程序包行方差分析。
, 百拇医药
2 结果
2.1 MT1-MMP的表达
纤维化肝脏中MT1-MMP mRNA的表达主要在纤维间隔和汇管区成纤维细胞、梭形的肌成纤维细胞及血管、胆管的内皮细胞中表达,见图1,免疫组化也显示了相同的分布,且在肝窦边缘及纤维间隔中的细胞外也有MT1-MMP的存在,见图2,正常肝脏中仅在内皮有弱阳性表达。图像分析显示LF组显著高于NC组(P<0.0001),见表1、2。
图1 纤维化肝脏中MT1-MMP mRNA表达 (ISH×400)
Fig 1 Expression of MT1-MMP mRNA in fibrotic liver (ISH×400)
, http://www.100md.com
图2 纤维化肝脏MT1-MMP免疫组化染色 (SPTM×400)
Fig 2 Immunohistochemical staining for MT1-MMP in fibrotic liver (SPTM×400)
表1 大鼠肝脏中MT1-MMP、 MMP2、TIMP1 mRNA
的表达(×10-4,x±s,n=10)
Tab 1 Expression of MT1-MMP, MMP2, TIMP1 mRNA
in rat liver (×10-4,x±s,n=10) Groups
, http://www.100md.com
NC
LF
MT1-MMP
47.63 ± 6.23
336.50 ± 12.99*
TIMP1
288.25 ± 7.85
646.50 ± 16.42*
MMP2
209.38 ± 15.45
, http://www.100md.com 781.50 ± 13.36*
*:P<0.0001 vs NC
表2 大鼠肝脏中MT1-MMP,TIMP1 蛋白质的
表达(×10-4,x±s,n=10)
Tab 2 Expression of MT1-MMP, TIMP1 protein
in rat liver (×10-4,x±s,n=10) Groups
NC
LF
, 百拇医药
MT1-MMP
15.88 ± 4.36
131.25 ± 9.65*
TIMP1
59.80 ± 20.31
482.50 ± 65.00*
*:P<0.0001 vs NC
2.2 TIMP1的表达
大鼠纤维化肝中TIMP1 mRNA主要表达在肌成纤维细胞、成纤维细胞、血管内皮细胞中,阳性颗粒集中在细胞浆中,见图3,免疫组化也展示了相同的分布,见图4,正常肝脏中仅在血管内皮细胞及汇管区的成纤维细胞中发现有弱阳性表达。图像分析显示LF组显著高于NC组(P<0.0001),见表1、2。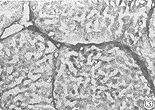
, http://www.100md.com
图3 纤维化肝脏中TIMP1 mRNA 表达 (ISH×200)
Fig 3 Expression of TIMP1 mRNA in fibrotic liver (ISH×200)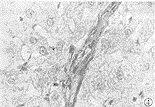
图4 纤维化肝脏中TIMP1 免疫组化染色 (SPTM×400)
Fig 4 Immunohistochemical staining for TIMP1 in fibrotic liver (SPTM×400)
2.3 MMP2的表达
MMP2 mRNA表达在纤维化肝脏中的间质细胞主要有成纤维细胞和肌成纤维细胞、血管内皮细胞,见图5,正常肝脏中仅见血管内皮细胞有少许表达。
, http://www.100md.com
图5 纤维化肝脏中MMP2 mRNA 表达 (ISH×400)
Fig 5 Expression of MMP2 mRNA in fibrotic
liver (ISH×400)
3 讨论
肝纤维化是各种慢性肝病向肝硬变发展的病理过程,是肝内细胞之间及其与细胞外基质(ECM)相互作用的结果,最终导致ECM在肝内的过度沉积。这种过度沉积不仅是由于ECM合成增多,更大程度上特别是后期,是由于降解减少引起的[1]。在ECM降解过程中起主要作用的MMP是一组锌离子依赖酶,TIMP是一组具有抑制MMP功能的活性多肽,它们在ECM代谢的调节作用中起着非常重要的作用[3]。但正常和病理情况下肝脏中哪些细胞合成和分泌MMP、TIMP,目前的结果仍不一致,而这对了解肝纤维化中ECM的代谢过程、肝纤维化的发生发展机制及对肝纤维化的防治都有十分重要的意义。
, http://www.100md.com
本研究发现MMP2 mRNA主要表达在成纤维细胞和梭形的肌成纤维细胞(可能是激活的贮脂细胞,因为分离培养的贮脂细胞激活后变成成纤维样细胞而分泌ECM),以纤维间隔中最明显,血管内皮细胞也有少许表达,总体表达水平比正常肝脏明显增多。MMP2主要降解基底膜成份,启动和加重肝纤维化,并在肝纤维化过程中持续升高,它与MMP1不同,MMP1主要降解间质胶原即纤维化性胶原,在肝纤维化过程中明显减少,而使间质胶原在肝中过度沉积[3,4]。Milani等[4]的研究发现,人纤维化肝中几乎所有的间质细胞都高表达MMP2 ,尤以纤维间隔和汇管区最明显,窦内皮细胞也有表达。但大多数学者对肝贮脂细胞分离培养的研究表明肝贮脂细胞,特别是激活的贮脂细胞是肝内MMP2的主要来源[5~7],这与我们的发现不一致,可能是因为研究方法不同所致。因为贮脂细胞在光镜下不易鉴别。
, 百拇医药
MMP2 以潜活形式的酶原(pro-MMP2 )从细胞(肝贮脂细胞)中分泌到细胞外,必须经过激活后方可发挥其生物学作用,最近的证据表明,MT1 -MMP主要作用就是激活pro-MMP2,从而在肝纤维化中发挥作用[6,7]。我们发现汇管区及纤维间隔中的成纤维细胞、肌成纤维细胞均高表达MT1 -MMP mRNA,胆管、血管内皮细胞也有表达,免疫组化显示上述细胞浆、细胞膜及细胞外均有强染色,这与Theret等[6,7]报道的结果一致。表明表达 MMP2 的细胞同时也表达和合成MT1 -MMP,且MT1 -MMP被分泌到细胞外,通过其膜结合区域与肝细胞、贮脂细胞膜结合,从而激活MMP2,发挥其降解基底膜的作用,启动和促进肝纤维化。
MMP的活性受TIMP的严密调控,在肝纤维化过程中TIMP抑制MMP从而使ECM降解减少,形成和加重肝纤维化。特别是TIMP1 的作用已日益为人们所重视。在肝纤维化过程中,目前发现的4种TIMP中仅TIMP1、TIMP2在肝中有表达,其中TIMP1 升高最明显,它主要抑制MMP1的活性,而对MMP2 的抑制作用较弱。而MMP1又称间质胶原酶,主要降解纤维化性胶原。TIMP1 的高表达严重抑制了MMP1 而反映了肝纤维化的严重程度[3,8]。以往的研究表明,分离培养的贮脂细胞低水平的表达TIMP1 mRNA,当其激活成肌成纤维细胞后,TIMP1 表达明显增加[9]。而Roeb[10]通过原位杂交显示在CCl4和胆管结扎大鼠肝损伤模型中,肝细胞及几乎所有间质细胞中均有TIMP1 mRNA的表达,尤以炎症区域中的脂肪样细胞中表达最明显。而我们观察发现仅肌成纤维细胞、成纤维细胞有TIMP1 mRNA的高表达,以汇管区及纤维间隔中最明显,免疫组化也展示了相同的结果。同样,Iredale等[11]从实验性纤维化肝中分离出肝细胞、贮脂细胞、Kupffer细胞,并行细胞总RNA的Northern杂交发现肝细胞并不表达TIMP1 mRNA。
, http://www.100md.com
可见,纤维化过程中MT1-MMP、MMP2、TIMP1的表达均明显增加,且主要为成纤维细胞、肌成纤维细胞(可能是激活的肝贮脂细胞)产生,因此,贮脂细胞的激活是肝纤维化过程中的主要病理事件。进一步加强对MMP和TIMP及贮脂细胞的研究将有助于了解肝纤维的发生发展过程,并对肝纤维化的防治起到积极的作用。
作者简介:曾仲,男,31岁,住院医师,博士研究生
参考文献
1 Olaso E, Friedman S L. Molecular regulation of hepatic fibrogenesis. J Hepatol,1998,29(5):836
2 Arthur M G. Collagenases and liver fibrosis. J Hepatol, 1995,22(Suppl 2):43
, http://www.100md.com
3 蔡文琴,王伯 主编.实用免疫细胞化学与核酸分子杂交技术.成都:四川省科学技术出版社,1994.406~434
4 Milani S, Herbst H, Schuppan D, et al. Differential expression of matrix-metalloproteinase-1 and-2 genes in normal and fibrotic human liver. Am J Pathol, 1994,144(3):528
5 Takahara T, Furui K, Yata Y, et al. Dual expression of matrix metalloproteinase-2 and membrance-type1-matrix metalloproteinase in fibrotic human liver Hepatology,1993,26(6):1521
, 百拇医药
6 Theret N, Musso O, L’Helgoualc’h A, et al. Activation of matrix metalloproteinase-2 from hepatic stellate cells requires interactions with hepatocytes. Am J Pathol, 1997,150(1):551
7 Theret N, Musso O, L’Helgouale’h A, et al. Differential expression and origin of membrane-type 1 and 2 matrix metalloproteinases (MT-MMPs) in association with MMP2 activation in injured human liver. Am J Pathol, 1998,153(3):945
8 Ueno T, Tamaki S, Sugawara H, et al. Significance of serum tissue inhibitor of metalloproteinases-1 in various liver diseases. J Hepatology,1996,24(1):177
, http://www.100md.com
9 Irdale J P, Murphy G, Hembry R M, et al. Human hepatic lipocytes synthesize tissue inhibitor of metalloproteinases 1 (TIMP-1): Implication for regulation of matrix degradation in liver. J Clin Invest, 1992,90(1):282
10 Roeb E, Purucker E, Breuer B, et al. TIMP expression in toxic and cholestatic liver injury in rat. J Hepatol, 1997,27(2):535
11 Iredale J P, Benyon R C, Arthur M J P, et al. Tissue in-hibiter of metalloproteinase-1 mRNA expression is enhanced relative to interstitial collagenase mRNA in experimental liver injury and fibrosis. Hepatology,1996,24(1):176
(收稿:1999-04-20;修回:1999-07-22), 百拇医药
单位:曾仲(第三军医大学附属西南医院肝胆外科中心) 重庆,400038;马宏敏(第三军医大学附属西南医院肝胆外科中心 普通外科) 重庆,400038
关键词:肝纤维化;膜型基质金属蛋白酶1;基质金属蛋白酶2;基质金属蛋白酶组织抑制剂1;成纤维细胞
第三军医大学学报991011 提 要 目的:了解膜型基质金属蛋白酶1(MT1-MMP)、基质金属蛋白酶2(MMP2)、基质金属蛋白酶组织抑制剂1(TIMP1)在大鼠正常及纤维化肝脏中的表达。方法:用60%CCl4加5%乙醇制作大鼠肝纤维化模型,利用原位杂交及免疫组化的方法检测MT1-MMP, MMP2,TIMP1的表达并与正常对照组比较。结果:在纤维化肝脏中,MT1-MMP, MMP2,TIMP1主要表达在成纤维细胞、肌成纤维细胞中,以纤维间隔及汇管区最明显,血管内皮细胞有低水平表达。而正常组中仅有内皮细胞有低表达,明显弱于肝纤维化组。结论:在肝纤维化中,成纤维细胞及肌成纤维细胞是MT1-MMP、 MMP2、TIMP1表达的主要细胞。
, 百拇医药
中图法分类号 R575.5 文献标识码:A
Expression of MT1-MMP,MMP2 and TIMP1 in normal and fibrotic liver in rats
Zheng Zhong, Ma Hongming (Department of Hepatobiliary Surgery, Southwest Hospital, Third Military Medical University, Chongqing,400038)
Abstract Objective: To observe the pattern of expression of MT1-MMP, MMP2 and TIMP1 in normal and fibrotic liver in rats. Methods: Fibrosis was induced in the liver of rats with the injection of 60% CCl4 and 5% alcohol. The expression of MT1-MMP, MMP2 and TIMP1 in the liver was observed with in situ hybridization and immunohistochemistry. Results: In the fibrotis liver, the expressions occurred predominantly in the myofibroblasts and fibroblasts of the areas of portal tracts and fibrotic septa and in low degrees in the vascular endothelium. Nevertheless, in the normal liver, the expression took place mainly in the vascular endothelium in low degrees. Conclusion: In liver fibrosis, fibroblasts and myofibroblasts are the main sites for the expression of MT1-MMP, MMP2 and TIMP1 to occur.
, 百拇医药
Key words liver fibrosis; fibroblast; MT1-MMP; TIMP1
肝纤维化的主要病理变化就是肝细胞外基质(Extracellular matrix,ECM)在肝脏中过多沉积。目前的研究表明,肝ECM的代谢主要由基质金属蛋白酶(Matrix metalloproteinase,MMP)及其抑制剂(Tissue inhibitor of metalloproteinase,TIMP)所调节,MMP促进ECM的降解,而TIMP通过抑制MMP阻止ECM的降解,从而形成和促进纤维化[1,2]。但在正常和纤维化肝脏中由哪些细胞表达和合成MMP和TIMP目前的认识还不尽一致,为此,本研究用原位杂交和免疫组化检测了大鼠正常肝脏和实验性肝纤维化中基质金属蛋白酶2(MMP2),膜型基质金属蛋白酶1(Membrane type1-MMP, MT1-MMP)和基质金属蛋白酶抑制剂1(TIMP1)的基因表达。
, 百拇医药
1 材料和方法
1.1 实验动物及分组
30只Wistar大鼠分为制作肝纤维化组(LF)20只,正常组(NC)10只;前者利用注射CCl4加饮用5%乙醇的方法,60 d后制成肝纤维化模型,存活10只,正常组常规喂养60 d,所有动物活杀取肝脏标本,一部份置于液氧中备检,一部份置10%福尔马林中固定备检。
1.2 原位杂交
将质粒MMP2、TIMP1(本院宋波教授馈赠),MT1-MMP(日本Sato教授馈赠)转入JM109大肠杆菌后大量扩增、提取、纯化、酶切、回收cDNA片段,按宝灵曼公司试剂盒说明操作,用地高辛随机引物法标记制备cDNA探针,按文献[3]方法进行原位杂交。阴性对照不加探针或经RNase处理后再进行原位杂交。
, http://www.100md.com
1.3 免疫组化
按北京中山公司SPTM试剂盒说明书操作。 MT1-MMP单抗(日本Sato教授馈赠)浓度为1∶100,TIMP1多抗(美国癌症研究所William G. Stetler-Stevenson教授馈赠)浓度为1∶50。
1.4 图像分折
每一玻片任选5个视野,自动检测阳性细胞面密度,取其平均值,进行统计分析。
1.5 统计学处理
数据用
 ±s表示。利用本校统计学教研室的统计程序包行方差分析。
±s表示。利用本校统计学教研室的统计程序包行方差分析。, 百拇医药
2 结果
2.1 MT1-MMP的表达
纤维化肝脏中MT1-MMP mRNA的表达主要在纤维间隔和汇管区成纤维细胞、梭形的肌成纤维细胞及血管、胆管的内皮细胞中表达,见图1,免疫组化也显示了相同的分布,且在肝窦边缘及纤维间隔中的细胞外也有MT1-MMP的存在,见图2,正常肝脏中仅在内皮有弱阳性表达。图像分析显示LF组显著高于NC组(P<0.0001),见表1、2。

图1 纤维化肝脏中MT1-MMP mRNA表达 (ISH×400)
Fig 1 Expression of MT1-MMP mRNA in fibrotic liver (ISH×400)

, http://www.100md.com
图2 纤维化肝脏MT1-MMP免疫组化染色 (SPTM×400)
Fig 2 Immunohistochemical staining for MT1-MMP in fibrotic liver (SPTM×400)
表1 大鼠肝脏中MT1-MMP、 MMP2、TIMP1 mRNA
的表达(×10-4,x±s,n=10)
Tab 1 Expression of MT1-MMP, MMP2, TIMP1 mRNA
in rat liver (×10-4,x±s,n=10) Groups
, http://www.100md.com
NC
LF
MT1-MMP
47.63 ± 6.23
336.50 ± 12.99*
TIMP1
288.25 ± 7.85
646.50 ± 16.42*
MMP2
209.38 ± 15.45
, http://www.100md.com 781.50 ± 13.36*
*:P<0.0001 vs NC
表2 大鼠肝脏中MT1-MMP,TIMP1 蛋白质的
表达(×10-4,x±s,n=10)
Tab 2 Expression of MT1-MMP, TIMP1 protein
in rat liver (×10-4,x±s,n=10) Groups
NC
LF
, 百拇医药
MT1-MMP
15.88 ± 4.36
131.25 ± 9.65*
TIMP1
59.80 ± 20.31
482.50 ± 65.00*
*:P<0.0001 vs NC
2.2 TIMP1的表达
大鼠纤维化肝中TIMP1 mRNA主要表达在肌成纤维细胞、成纤维细胞、血管内皮细胞中,阳性颗粒集中在细胞浆中,见图3,免疫组化也展示了相同的分布,见图4,正常肝脏中仅在血管内皮细胞及汇管区的成纤维细胞中发现有弱阳性表达。图像分析显示LF组显著高于NC组(P<0.0001),见表1、2。

, http://www.100md.com
图3 纤维化肝脏中TIMP1 mRNA 表达 (ISH×200)
Fig 3 Expression of TIMP1 mRNA in fibrotic liver (ISH×200)

图4 纤维化肝脏中TIMP1 免疫组化染色 (SPTM×400)
Fig 4 Immunohistochemical staining for TIMP1 in fibrotic liver (SPTM×400)
2.3 MMP2的表达
MMP2 mRNA表达在纤维化肝脏中的间质细胞主要有成纤维细胞和肌成纤维细胞、血管内皮细胞,见图5,正常肝脏中仅见血管内皮细胞有少许表达。

, http://www.100md.com
图5 纤维化肝脏中MMP2 mRNA 表达 (ISH×400)
Fig 5 Expression of MMP2 mRNA in fibrotic
liver (ISH×400)
3 讨论
肝纤维化是各种慢性肝病向肝硬变发展的病理过程,是肝内细胞之间及其与细胞外基质(ECM)相互作用的结果,最终导致ECM在肝内的过度沉积。这种过度沉积不仅是由于ECM合成增多,更大程度上特别是后期,是由于降解减少引起的[1]。在ECM降解过程中起主要作用的MMP是一组锌离子依赖酶,TIMP是一组具有抑制MMP功能的活性多肽,它们在ECM代谢的调节作用中起着非常重要的作用[3]。但正常和病理情况下肝脏中哪些细胞合成和分泌MMP、TIMP,目前的结果仍不一致,而这对了解肝纤维化中ECM的代谢过程、肝纤维化的发生发展机制及对肝纤维化的防治都有十分重要的意义。
, http://www.100md.com
本研究发现MMP2 mRNA主要表达在成纤维细胞和梭形的肌成纤维细胞(可能是激活的贮脂细胞,因为分离培养的贮脂细胞激活后变成成纤维样细胞而分泌ECM),以纤维间隔中最明显,血管内皮细胞也有少许表达,总体表达水平比正常肝脏明显增多。MMP2主要降解基底膜成份,启动和加重肝纤维化,并在肝纤维化过程中持续升高,它与MMP1不同,MMP1主要降解间质胶原即纤维化性胶原,在肝纤维化过程中明显减少,而使间质胶原在肝中过度沉积[3,4]。Milani等[4]的研究发现,人纤维化肝中几乎所有的间质细胞都高表达MMP2 ,尤以纤维间隔和汇管区最明显,窦内皮细胞也有表达。但大多数学者对肝贮脂细胞分离培养的研究表明肝贮脂细胞,特别是激活的贮脂细胞是肝内MMP2的主要来源[5~7],这与我们的发现不一致,可能是因为研究方法不同所致。因为贮脂细胞在光镜下不易鉴别。
, 百拇医药
MMP2 以潜活形式的酶原(pro-MMP2 )从细胞(肝贮脂细胞)中分泌到细胞外,必须经过激活后方可发挥其生物学作用,最近的证据表明,MT1 -MMP主要作用就是激活pro-MMP2,从而在肝纤维化中发挥作用[6,7]。我们发现汇管区及纤维间隔中的成纤维细胞、肌成纤维细胞均高表达MT1 -MMP mRNA,胆管、血管内皮细胞也有表达,免疫组化显示上述细胞浆、细胞膜及细胞外均有强染色,这与Theret等[6,7]报道的结果一致。表明表达 MMP2 的细胞同时也表达和合成MT1 -MMP,且MT1 -MMP被分泌到细胞外,通过其膜结合区域与肝细胞、贮脂细胞膜结合,从而激活MMP2,发挥其降解基底膜的作用,启动和促进肝纤维化。
MMP的活性受TIMP的严密调控,在肝纤维化过程中TIMP抑制MMP从而使ECM降解减少,形成和加重肝纤维化。特别是TIMP1 的作用已日益为人们所重视。在肝纤维化过程中,目前发现的4种TIMP中仅TIMP1、TIMP2在肝中有表达,其中TIMP1 升高最明显,它主要抑制MMP1的活性,而对MMP2 的抑制作用较弱。而MMP1又称间质胶原酶,主要降解纤维化性胶原。TIMP1 的高表达严重抑制了MMP1 而反映了肝纤维化的严重程度[3,8]。以往的研究表明,分离培养的贮脂细胞低水平的表达TIMP1 mRNA,当其激活成肌成纤维细胞后,TIMP1 表达明显增加[9]。而Roeb[10]通过原位杂交显示在CCl4和胆管结扎大鼠肝损伤模型中,肝细胞及几乎所有间质细胞中均有TIMP1 mRNA的表达,尤以炎症区域中的脂肪样细胞中表达最明显。而我们观察发现仅肌成纤维细胞、成纤维细胞有TIMP1 mRNA的高表达,以汇管区及纤维间隔中最明显,免疫组化也展示了相同的结果。同样,Iredale等[11]从实验性纤维化肝中分离出肝细胞、贮脂细胞、Kupffer细胞,并行细胞总RNA的Northern杂交发现肝细胞并不表达TIMP1 mRNA。
, http://www.100md.com
可见,纤维化过程中MT1-MMP、MMP2、TIMP1的表达均明显增加,且主要为成纤维细胞、肌成纤维细胞(可能是激活的肝贮脂细胞)产生,因此,贮脂细胞的激活是肝纤维化过程中的主要病理事件。进一步加强对MMP和TIMP及贮脂细胞的研究将有助于了解肝纤维的发生发展过程,并对肝纤维化的防治起到积极的作用。
作者简介:曾仲,男,31岁,住院医师,博士研究生
参考文献
1 Olaso E, Friedman S L. Molecular regulation of hepatic fibrogenesis. J Hepatol,1998,29(5):836
2 Arthur M G. Collagenases and liver fibrosis. J Hepatol, 1995,22(Suppl 2):43
, http://www.100md.com
3 蔡文琴,王伯 主编.实用免疫细胞化学与核酸分子杂交技术.成都:四川省科学技术出版社,1994.406~434
4 Milani S, Herbst H, Schuppan D, et al. Differential expression of matrix-metalloproteinase-1 and-2 genes in normal and fibrotic human liver. Am J Pathol, 1994,144(3):528
5 Takahara T, Furui K, Yata Y, et al. Dual expression of matrix metalloproteinase-2 and membrance-type1-matrix metalloproteinase in fibrotic human liver Hepatology,1993,26(6):1521
, 百拇医药
6 Theret N, Musso O, L’Helgoualc’h A, et al. Activation of matrix metalloproteinase-2 from hepatic stellate cells requires interactions with hepatocytes. Am J Pathol, 1997,150(1):551
7 Theret N, Musso O, L’Helgouale’h A, et al. Differential expression and origin of membrane-type 1 and 2 matrix metalloproteinases (MT-MMPs) in association with MMP2 activation in injured human liver. Am J Pathol, 1998,153(3):945
8 Ueno T, Tamaki S, Sugawara H, et al. Significance of serum tissue inhibitor of metalloproteinases-1 in various liver diseases. J Hepatology,1996,24(1):177
, http://www.100md.com
9 Irdale J P, Murphy G, Hembry R M, et al. Human hepatic lipocytes synthesize tissue inhibitor of metalloproteinases 1 (TIMP-1): Implication for regulation of matrix degradation in liver. J Clin Invest, 1992,90(1):282
10 Roeb E, Purucker E, Breuer B, et al. TIMP expression in toxic and cholestatic liver injury in rat. J Hepatol, 1997,27(2):535
11 Iredale J P, Benyon R C, Arthur M J P, et al. Tissue in-hibiter of metalloproteinase-1 mRNA expression is enhanced relative to interstitial collagenase mRNA in experimental liver injury and fibrosis. Hepatology,1996,24(1):176
(收稿:1999-04-20;修回:1999-07-22), 百拇医药