梗阻性黄疸大鼠血及肝组织内皮素水平
作者:李端阳 吴金生 马庆久 高德明 褚延魁
单位:李端阳 武警江苏总队南京医院普外科 江苏省南京市 210024; 吴金生 马庆久 高德明 褚延魁 中国人民解放军第四军医大学唐都医院普外科
关键词:内皮素/血液;肝/化学;黄疸;胆汁郁积/病理学;谷丙氨酸转氨酶/血液
中国图书馆分类号 R575中国图书馆分类号 R575.6
Subject headings endothelin/blood; liver/chemistry; jaundice; cholestasis/pathology; alanin trans minase/blood
内皮素(endothelin, ET)是1988年发现的一种缩血管活性肽,具有强大而持久的收缩血管作用. 近年研究表明,ET能使肝脏血流量下降,造成组织缺血、缺氧,导致肝细胞损伤,能使门静脉压力持续升高造成门静脉高压. 目前已被认为是一种内源性的致伤因素. 但是,有关ET与梗阻性黄疸(obstructive jaundice, OJ)关系的研究较少,ET在OJ形成中的水平变化及与OJ时肝损伤的关系尚不十分清楚. 我们采用大鼠胆总管结扎(bile duct ligation, BDL)模拟OJ的模型,用放射免疫方法(RIA)测定血浆及肝组织中ET含量,以探讨ET在OJ形成中的水平及与OJ肝损伤的关系.
, http://www.100md.com
1 材料和方法
1.1 材料 ♂ SD大鼠70只,体重220g±20g,鼠龄:4个月龄,由第四军医大学实验动物中心提供. 随机分为:正常对照组(normal control, NC)5只、假手术对照组(sham operation, SO)25只和胆总管结扎组(bile duct ligation, BDL)40只,SO和BDL再按术后3,6,9,12,15d分为5个时相组,每组分别为5只和8只.
1.2 方法
1.2.1 模型制作 BDL组:术前禁食12h,自由饮水,采用10g/L戊巴比妥钠25mg/kg ip麻醉,上腹正中切口,沿肝十二指肠韧带找到并游离胆总管,距进肝门部0.5cm处,双重结扎并离断胆总管后关腹,保暖至清醒,继续饲养. SO组:仅游离胆总管后关腹. NC组:不做任何处理.
1.2.2 标本制备 ①血浆标本制备:同前法麻醉,开腹后取下腔静脉血5mL,其中2mL注入含100g/L EDTA二钠30μL和抑肽酶40μL的试管中,混匀,4℃,3000r/min,离心10min,分离血浆,置-75℃低温保存,待测ET值. ②血清标本制备:取另3mL下腔静脉血,肝素抗凝后,4℃,4000r/min,离心15min,取上清,置-75℃低温保存,待测TBi和ALT值. ③肝组织标本制备:开腹后剪取肝组织一块,吸去血污,用分析天平称存100mg,尽快放入含1mol/L HAC 1mL的玻璃匀浆器中研磨,然后在100℃水浴中煮沸10min,匀浆,4℃,3000r/min,离心15min,取上清,-75℃低温保存,待测ET值. ④病理标本制备:开腹后取大鼠肝组织一块,100mL/L福尔马林固定. 1wk后经过脱水、透明、浸蜡、包埋、切片、HE染色后光镜观察.
, http://www.100md.com
1.2.3 指标测定 ①采用ET放免药盒测定血浆及肝组织ET含量,药盒由北京东亚免疫技术研究室提供,严格按照说明书操作. ②由日本产CL-8000临床自动生化分析仪测定血清TBi和ALT. ③病理标本行HE染色后光镜下观察.
统计学处理 所有数据以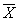 ±s表示,方差分析及直线相关分析与回归.
±s表示,方差分析及直线相关分析与回归.
2 结果
实验过程中由于麻醉和手术出血,先后有4只大鼠死亡,它们分别分布在SO 3d,BDL 3d,12d,15d组中. BDL术后大鼠皮肤粘膜渐黄染,食欲减退,体重下降,精神差,嗜睡,反应迟缓,活动减少,大便呈灰白色;SO组大鼠无变化. TBi:NC组(7.2μmol/L±1.1μmol/L)与SO各时相组无差异(P>0.05). BDL组明显高于SO组(P<0.01),q检验显示BDL各时相之间在9d后无差异(P>0.05,表1). ALT:NC (56U/L±9U/L)与SO各时相组均无差异(P>0.05),BDL和SO有显著差异(P<0.01). BDL各时相组间除14d,15d P>0.05外,余BDL组间均有显著差异(P<0.01),总的变化趋势类同于肝组织ET含量变化.
, http://www.100md.com
表1 血浆ET、肝组织ET含量和血清ALT,TBi水平变化
3d
6d
9d
12d
15d
F
P
血浆ET
SO
129.17±19.46
110.26±22.47
, http://www.100md.com
127.92±20.51
119.68±17.37
126.17±21.66
0.71
>0.05
(pg/mL)
BDL
172.29±19.18
198.92±25.80
204.45±29.91
238.94±33.17
294.98±35.95
, 百拇医药
18.41
<0.01
肝脏ET
SO
33.74±6.93
30.83±9.17
28.52±7.74
31.78±8.01
35.21±10.11
0.45
>0.05
(pg/100mg)
, http://www.100md.com
BDL
72.34±12.69
115.25±23.23
147.75±20.18
187.57±27.25
201.86±24.45
40.61
<0.01
血清ALT
SO
52.16±10.61
47.79±11.63
, http://www.100md.com
56.14±9.28
45.28±12.39
53.91±13.49
0.73
>0.05
(IU/L)
BDL
214.75±30.50
392.63±28.10
432.13±45.58
464.43±55.78
499.14±32.07
, 百拇医药
54.94
<0.01
血清TBi
SO
7.25±1.01
6.92±1.20
6.26±0.98
7.09±0.91
7.20±1.16
2.79
>0.05
(μmol/L)
, 百拇医药
BDL
44.91±8.03
106.47±11.12
119.16±15.67
118.24±13.18
123.77±10.63
13.32
<0.01
2.1 血浆ET水平 SO各时相组与NC组(122ng/L±19ng/L)无差别(P>0.05),BDL组呈逐渐升高趋势,各时相组均明显高于SO各组(P<0.01). BDL各组随梗阻时间延长相差逐渐加大,(3d,6d,P>0.05;6d,9d,P>0.05,9d,12d,P<0.05,12d,15d,P<0.01);见表1.
, 百拇医药
2.2 组织ET水平 SO各时相组与NC组(316pg/g±73pg/g)无差异(P>0.05),BDL各时相组间有显著差异(F=40.61,P<0.01),呈逐渐升高,且均明显高于SO组(P<0.01,表1). BDL组血浆ET与ALT、肝组织ET与ALT,均呈显著正相关(图1,2).
图1 血浆ET与血清ALT的关系.
y=0.3923x+63.515,r=0.8441, (P<0.01).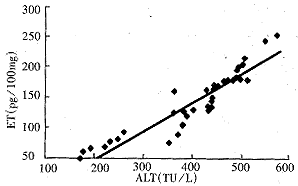
, http://www.100md.com
图2 肝组织ET与血清ALT的关系.
y=0.4749x-46.968,r=0.9303, (P<0.01).
2.3 病理结果 NC,SO两组肝色质正常,无腹水,BDL组肝脏呈墨绿色,弥漫性肿大,肝门部近侧胆管扩大呈囊状,约1.3cm×1.1cm×1.1cm大,充满胆汁,12d组有2只,15d组有3只大鼠腹腔出现大量淡黄色腹水. 光镜下见NC和SO组肝组织结构正常,BDL组3d即有小胆管、毛细血管及结缔组织增生,汇管区尤为明显,随BDL时间延长增生渐加重;肝细胞也出现肿胀、空泡变性,12d后出现灶状、片状坏死及大量炎性细胞浸润.
3 讨论
3.1 血清ALT在肝损伤中的意义 整个肝脏内转氨酶活性约为血中含量的1000倍,肝细胞内转氨酶活性比血清高1000~1500倍,在肝细胞膜损伤通透性增加时,即是无坏死,细胞内转氨酶也可由于此种浓度差而泄漏入血中. 另外肝内ALT的活性超过体内其他任何脏器内该酶的活性,故测定ALT对反映肝损伤具有特异性[1]. 实验结果也证实,血清ALT水平高低与肝组织病理损伤程度一致. 说明ALT能够准确地反映肝细胞的损伤程度.
, http://www.100md.com
3.2 ET在OJ形成中的水平及对肝损伤的作用 我们采用放射免疫(RIA)的方法,观察测定了大鼠OJ形成过程中血浆及肝组织中ET的水平变化,结果表明:OJ形成中不同时期内血浆及肝组织中的ET含量明显升高,且随梗阻时间延长而加重,与肝脏损伤程度(ALT)呈显著正相关(r=0.8441,P<0.01和r=0.9301,P<0.01),与病理改变也一致. 这与刘苗生et al[2]的发现ET与血清ALT呈正相关的结果一致. ET的作用方式有自分泌和旁分泌两种. 作者认为,胆管梗阻后使胆管内压逐渐升高,肝内胆管扩张,压迫肝小动脉及门静脉血管,使肝组织缺血、缺氧,造成肝细胞损伤;ET在肝脏组织生成迅速增多. 作为一种局部激素,其局部作用不仅强烈且持久,作用于中小动脉及肝血窦周围的贮脂细胞,使其强烈收缩,这样,进一步加重了肝微循环缺血、缺氧及肝组织损伤,使肝组织ET释放更多,形成了局部的恶性循环. 就象本实验结果一样,随梗阻时间延长ET含量增加,肝细胞损伤也加重. ET在OJ肝损伤的病理过程中起着重要作用,推测内皮素可能是OJ时产生的一种内源性损伤因子,首先可能是肝损伤的结果,尔后又成为致肝细胞损伤的一个重要因素. 同时肝脏组织产生的大量ET,除局部作用外,可进入体循环,使血液中ET含量升高,反过来,血中升高的ET作为一种循环激素,又作用于肝脏. 实验发现,肝组织ET含量增加的幅度和速度均较血浆ET明显,也说明了这一作用机制. ET随血流至其他脏器. 造成其他远处组织器官的继发性病损,这也许是梗阻性黄疸并发症较多的一个原因. 另外ET收缩门静脉,使门静脉压升高,这样更加重了肝细胞缺氧. Okumura et al[3]发现大鼠原位肝灌注的模型上,内皮素明显加重肝脏组织的损伤,肝脏水肿、细胞脂质过氧化物形成、肝细胞肿胀、空泡形成、溶酶体漏出. Zhang et al[4]的研究也证实了ET-1作为体内最强的缩血管因子,能使肝血流下降,导致肝细胞浊肿变性和酶漏出. ET还可使组织氧自由基增加,损伤组织细胞[5]. 实验中BDL大鼠有5只腹腔出现大量腹水,这除与肝功能受损、门静脉压升高、ET能使血浆蛋白从血管内漏出[6]等因素外,作者认为OJ时的腹水还与以下因素有关:ET直接收缩肝淋巴管,增加其静脉压和通透性,促进淋巴液外漏,肝内小胆管扩张,肝细胞变性肿大,压迫淋巴管,影响肝淋巴液的回流. 临床研究表明,伴腹水的肝硬变患者血中ET也明显升高[7,8]. 因此ET可能还有促进腹水形成的作用.
, 百拇医药
3.3 OJ形成中ET升高的原因 OJ形成中血浆及肝脏组织中ET升高可能有以下原因:①胆道梗阻后,近端胆管高度扩张,挤压Glisson鞘内肝小动脉和门静脉分支,特别是肝小叶内微动脉受压,使肝组织缺血、缺氧,而缺血、缺氧可以明显促进ET的释放,使肝血窦内皮细胞产生和释放ET增加. ②胆道梗阻,胆管内压升高,胆汁逆流刺激肝血窦内皮细胞,使其释放ET;③胆管压力升高刺激肝脏的枯否细胞、细小的胆管上皮细胞产生ET增加;④肝脏是ET的清除器官之一,肝功能的减退,肝清除ET能力下降,也是ET升高的原因之一;⑤梗阻性黄疸时,由于单核巨噬细胞系统尤其是肝脏枯否细胞功能受抑,肠道中胆盐缺乏,内毒素分泌增加,使内毒素血症发生率增高,而内毒素能明显促进ET的合成和释放[9];⑥梗阻性黄疸时机体内的血管加压素、肿瘤坏死因子(TNF-α),IL-1,IL-6等均增加,这些均能刺激ET的合成和释放[10,11]. ⑦ET可经过多种途径增加细胞内Ca2+离子的浓度,Ca2+离子能激活蛋白激酶C(PKC),活化的PKC促进ET mRNA产生增多,形成恶性循环. ⑧另外,病理结果显示BDL后肝小胆管增生明显,且其变化规律与ET水平一致,推测大量增生的小胆管可能与ET的产生也有关.
, 百拇医药
本实验结果表明:ET在OJ的发生、发展中的作用是不容忽视的,尤其在OJ的肝功能损伤方面可能起着重要作用. 这对丰富OJ时的病理生理变化及临床治疗有一定的参考价值. 随着ET和ET拮抗剂的更进一步研究,可能为减轻OJ的肝功能损伤开辟一个有效的治疗前景.
通讯作者:李端阳
参考文献
1 梁扩寰. 肝脏病学. 北京:人民卫生出版社,1995:208-210
2 刘苗生,卢榜裕,卢全书,沈康年,肖开银. 内皮素在梗阻性黄疸并发肝功能失常中的应用. 广西医学,1997;19:940-943
3 Okumura S, Takei Y, Kawano S, Nagano K, Masuda E, Goto M, Tsuji S, Michida T, Chen SS, Kashiwagi T, Fusamoto H, Kamada T, Sato N. Vasoactive effect of endothelin_1 on rat liver in vivo. Hepatology, 1994;19:155-161
, http://www.100md.com
4 Zhang JX, Pegol W, Chemens MG. Endothelin-1 induces direct constriction of hepatic sinusoids. Am J Physiol, 1994;266:624-625
5 王兴鹏,袁耀宗,徐家裕,许叔祥. 急性胰腺炎大鼠血浆内皮素的变化及意义. 上海第二医科大学学报,1995;15:97-99
6 Zimmerman RS, Martinez AJ, Maymind M, Barbee RW. Effect of endothelin on plasma volume and albumin escape. Circ Res, 1992;70:1027-1034
7 Uchihara M, Izumi N, Sato C, Shimokawa W. Clinical significance of elevated plasma endothelin concentration in patients with cirrhosis. J Clin Gastroenterol, 1993;17:227-231
, 百拇医药
8 Asbert M, Gines A, Gines P, Jimenez W, Claria J, Salo J, Arroyo V, Rivera F, Rodes J. Circulation levels of endothelin in cirrhosis. Gastroenterology, 1993;104:1485-1491
9 Hemsen A, Modin A, Weitzberg E. Increased concentration of endothelin-1 messenger RNA in tissues and endothelin-1 peptide in plasma in septic pigs: modulation by etamethasone. Crit Care Med, 1996;24:1530-1536
10 Kanse SM, Takanaihi K, Lam HC, Mari F. Cytokin stimulated endothelin release from endothelial cells. Life Sci, 1991;487:1379-1382
11 Emoti T. Cellular mechanism of endothelin-1 release by agiotention and vasopressin. Hepertention, 1991;18:165-170
收稿日期 1999-05-23 修回日期 1999-08-14, 百拇医药
单位:李端阳 武警江苏总队南京医院普外科 江苏省南京市 210024; 吴金生 马庆久 高德明 褚延魁 中国人民解放军第四军医大学唐都医院普外科
关键词:内皮素/血液;肝/化学;黄疸;胆汁郁积/病理学;谷丙氨酸转氨酶/血液
中国图书馆分类号 R575中国图书馆分类号 R575.6
Subject headings endothelin/blood; liver/chemistry; jaundice; cholestasis/pathology; alanin trans minase/blood
内皮素(endothelin, ET)是1988年发现的一种缩血管活性肽,具有强大而持久的收缩血管作用. 近年研究表明,ET能使肝脏血流量下降,造成组织缺血、缺氧,导致肝细胞损伤,能使门静脉压力持续升高造成门静脉高压. 目前已被认为是一种内源性的致伤因素. 但是,有关ET与梗阻性黄疸(obstructive jaundice, OJ)关系的研究较少,ET在OJ形成中的水平变化及与OJ时肝损伤的关系尚不十分清楚. 我们采用大鼠胆总管结扎(bile duct ligation, BDL)模拟OJ的模型,用放射免疫方法(RIA)测定血浆及肝组织中ET含量,以探讨ET在OJ形成中的水平及与OJ肝损伤的关系.
, http://www.100md.com
1 材料和方法
1.1 材料 ♂ SD大鼠70只,体重220g±20g,鼠龄:4个月龄,由第四军医大学实验动物中心提供. 随机分为:正常对照组(normal control, NC)5只、假手术对照组(sham operation, SO)25只和胆总管结扎组(bile duct ligation, BDL)40只,SO和BDL再按术后3,6,9,12,15d分为5个时相组,每组分别为5只和8只.
1.2 方法
1.2.1 模型制作 BDL组:术前禁食12h,自由饮水,采用10g/L戊巴比妥钠25mg/kg ip麻醉,上腹正中切口,沿肝十二指肠韧带找到并游离胆总管,距进肝门部0.5cm处,双重结扎并离断胆总管后关腹,保暖至清醒,继续饲养. SO组:仅游离胆总管后关腹. NC组:不做任何处理.
1.2.2 标本制备 ①血浆标本制备:同前法麻醉,开腹后取下腔静脉血5mL,其中2mL注入含100g/L EDTA二钠30μL和抑肽酶40μL的试管中,混匀,4℃,3000r/min,离心10min,分离血浆,置-75℃低温保存,待测ET值. ②血清标本制备:取另3mL下腔静脉血,肝素抗凝后,4℃,4000r/min,离心15min,取上清,置-75℃低温保存,待测TBi和ALT值. ③肝组织标本制备:开腹后剪取肝组织一块,吸去血污,用分析天平称存100mg,尽快放入含1mol/L HAC 1mL的玻璃匀浆器中研磨,然后在100℃水浴中煮沸10min,匀浆,4℃,3000r/min,离心15min,取上清,-75℃低温保存,待测ET值. ④病理标本制备:开腹后取大鼠肝组织一块,100mL/L福尔马林固定. 1wk后经过脱水、透明、浸蜡、包埋、切片、HE染色后光镜观察.
, http://www.100md.com
1.2.3 指标测定 ①采用ET放免药盒测定血浆及肝组织ET含量,药盒由北京东亚免疫技术研究室提供,严格按照说明书操作. ②由日本产CL-8000临床自动生化分析仪测定血清TBi和ALT. ③病理标本行HE染色后光镜下观察.
统计学处理 所有数据以
2 结果
实验过程中由于麻醉和手术出血,先后有4只大鼠死亡,它们分别分布在SO 3d,BDL 3d,12d,15d组中. BDL术后大鼠皮肤粘膜渐黄染,食欲减退,体重下降,精神差,嗜睡,反应迟缓,活动减少,大便呈灰白色;SO组大鼠无变化. TBi:NC组(7.2μmol/L±1.1μmol/L)与SO各时相组无差异(P>0.05). BDL组明显高于SO组(P<0.01),q检验显示BDL各时相之间在9d后无差异(P>0.05,表1). ALT:NC (56U/L±9U/L)与SO各时相组均无差异(P>0.05),BDL和SO有显著差异(P<0.01). BDL各时相组间除14d,15d P>0.05外,余BDL组间均有显著差异(P<0.01),总的变化趋势类同于肝组织ET含量变化.
, http://www.100md.com
表1 血浆ET、肝组织ET含量和血清ALT,TBi水平变化
3d
6d
9d
12d
15d
F
P
血浆ET
SO
129.17±19.46
110.26±22.47
, http://www.100md.com
127.92±20.51
119.68±17.37
126.17±21.66
0.71
>0.05
(pg/mL)
BDL
172.29±19.18
198.92±25.80
204.45±29.91
238.94±33.17
294.98±35.95
, 百拇医药
18.41
<0.01
肝脏ET
SO
33.74±6.93
30.83±9.17
28.52±7.74
31.78±8.01
35.21±10.11
0.45
>0.05
(pg/100mg)
, http://www.100md.com
BDL
72.34±12.69
115.25±23.23
147.75±20.18
187.57±27.25
201.86±24.45
40.61
<0.01
血清ALT
SO
52.16±10.61
47.79±11.63
, http://www.100md.com
56.14±9.28
45.28±12.39
53.91±13.49
0.73
>0.05
(IU/L)
BDL
214.75±30.50
392.63±28.10
432.13±45.58
464.43±55.78
499.14±32.07
, 百拇医药
54.94
<0.01
血清TBi
SO
7.25±1.01
6.92±1.20
6.26±0.98
7.09±0.91
7.20±1.16
2.79
>0.05
(μmol/L)
, 百拇医药
BDL
44.91±8.03
106.47±11.12
119.16±15.67
118.24±13.18
123.77±10.63
13.32
<0.01
2.1 血浆ET水平 SO各时相组与NC组(122ng/L±19ng/L)无差别(P>0.05),BDL组呈逐渐升高趋势,各时相组均明显高于SO各组(P<0.01). BDL各组随梗阻时间延长相差逐渐加大,(3d,6d,P>0.05;6d,9d,P>0.05,9d,12d,P<0.05,12d,15d,P<0.01);见表1.
, 百拇医药
2.2 组织ET水平 SO各时相组与NC组(316pg/g±73pg/g)无差异(P>0.05),BDL各时相组间有显著差异(F=40.61,P<0.01),呈逐渐升高,且均明显高于SO组(P<0.01,表1). BDL组血浆ET与ALT、肝组织ET与ALT,均呈显著正相关(图1,2).

图1 血浆ET与血清ALT的关系.
y=0.3923x+63.515,r=0.8441, (P<0.01).

, http://www.100md.com
图2 肝组织ET与血清ALT的关系.
y=0.4749x-46.968,r=0.9303, (P<0.01).
2.3 病理结果 NC,SO两组肝色质正常,无腹水,BDL组肝脏呈墨绿色,弥漫性肿大,肝门部近侧胆管扩大呈囊状,约1.3cm×1.1cm×1.1cm大,充满胆汁,12d组有2只,15d组有3只大鼠腹腔出现大量淡黄色腹水. 光镜下见NC和SO组肝组织结构正常,BDL组3d即有小胆管、毛细血管及结缔组织增生,汇管区尤为明显,随BDL时间延长增生渐加重;肝细胞也出现肿胀、空泡变性,12d后出现灶状、片状坏死及大量炎性细胞浸润.
3 讨论
3.1 血清ALT在肝损伤中的意义 整个肝脏内转氨酶活性约为血中含量的1000倍,肝细胞内转氨酶活性比血清高1000~1500倍,在肝细胞膜损伤通透性增加时,即是无坏死,细胞内转氨酶也可由于此种浓度差而泄漏入血中. 另外肝内ALT的活性超过体内其他任何脏器内该酶的活性,故测定ALT对反映肝损伤具有特异性[1]. 实验结果也证实,血清ALT水平高低与肝组织病理损伤程度一致. 说明ALT能够准确地反映肝细胞的损伤程度.
, http://www.100md.com
3.2 ET在OJ形成中的水平及对肝损伤的作用 我们采用放射免疫(RIA)的方法,观察测定了大鼠OJ形成过程中血浆及肝组织中ET的水平变化,结果表明:OJ形成中不同时期内血浆及肝组织中的ET含量明显升高,且随梗阻时间延长而加重,与肝脏损伤程度(ALT)呈显著正相关(r=0.8441,P<0.01和r=0.9301,P<0.01),与病理改变也一致. 这与刘苗生et al[2]的发现ET与血清ALT呈正相关的结果一致. ET的作用方式有自分泌和旁分泌两种. 作者认为,胆管梗阻后使胆管内压逐渐升高,肝内胆管扩张,压迫肝小动脉及门静脉血管,使肝组织缺血、缺氧,造成肝细胞损伤;ET在肝脏组织生成迅速增多. 作为一种局部激素,其局部作用不仅强烈且持久,作用于中小动脉及肝血窦周围的贮脂细胞,使其强烈收缩,这样,进一步加重了肝微循环缺血、缺氧及肝组织损伤,使肝组织ET释放更多,形成了局部的恶性循环. 就象本实验结果一样,随梗阻时间延长ET含量增加,肝细胞损伤也加重. ET在OJ肝损伤的病理过程中起着重要作用,推测内皮素可能是OJ时产生的一种内源性损伤因子,首先可能是肝损伤的结果,尔后又成为致肝细胞损伤的一个重要因素. 同时肝脏组织产生的大量ET,除局部作用外,可进入体循环,使血液中ET含量升高,反过来,血中升高的ET作为一种循环激素,又作用于肝脏. 实验发现,肝组织ET含量增加的幅度和速度均较血浆ET明显,也说明了这一作用机制. ET随血流至其他脏器. 造成其他远处组织器官的继发性病损,这也许是梗阻性黄疸并发症较多的一个原因. 另外ET收缩门静脉,使门静脉压升高,这样更加重了肝细胞缺氧. Okumura et al[3]发现大鼠原位肝灌注的模型上,内皮素明显加重肝脏组织的损伤,肝脏水肿、细胞脂质过氧化物形成、肝细胞肿胀、空泡形成、溶酶体漏出. Zhang et al[4]的研究也证实了ET-1作为体内最强的缩血管因子,能使肝血流下降,导致肝细胞浊肿变性和酶漏出. ET还可使组织氧自由基增加,损伤组织细胞[5]. 实验中BDL大鼠有5只腹腔出现大量腹水,这除与肝功能受损、门静脉压升高、ET能使血浆蛋白从血管内漏出[6]等因素外,作者认为OJ时的腹水还与以下因素有关:ET直接收缩肝淋巴管,增加其静脉压和通透性,促进淋巴液外漏,肝内小胆管扩张,肝细胞变性肿大,压迫淋巴管,影响肝淋巴液的回流. 临床研究表明,伴腹水的肝硬变患者血中ET也明显升高[7,8]. 因此ET可能还有促进腹水形成的作用.
, 百拇医药
3.3 OJ形成中ET升高的原因 OJ形成中血浆及肝脏组织中ET升高可能有以下原因:①胆道梗阻后,近端胆管高度扩张,挤压Glisson鞘内肝小动脉和门静脉分支,特别是肝小叶内微动脉受压,使肝组织缺血、缺氧,而缺血、缺氧可以明显促进ET的释放,使肝血窦内皮细胞产生和释放ET增加. ②胆道梗阻,胆管内压升高,胆汁逆流刺激肝血窦内皮细胞,使其释放ET;③胆管压力升高刺激肝脏的枯否细胞、细小的胆管上皮细胞产生ET增加;④肝脏是ET的清除器官之一,肝功能的减退,肝清除ET能力下降,也是ET升高的原因之一;⑤梗阻性黄疸时,由于单核巨噬细胞系统尤其是肝脏枯否细胞功能受抑,肠道中胆盐缺乏,内毒素分泌增加,使内毒素血症发生率增高,而内毒素能明显促进ET的合成和释放[9];⑥梗阻性黄疸时机体内的血管加压素、肿瘤坏死因子(TNF-α),IL-1,IL-6等均增加,这些均能刺激ET的合成和释放[10,11]. ⑦ET可经过多种途径增加细胞内Ca2+离子的浓度,Ca2+离子能激活蛋白激酶C(PKC),活化的PKC促进ET mRNA产生增多,形成恶性循环. ⑧另外,病理结果显示BDL后肝小胆管增生明显,且其变化规律与ET水平一致,推测大量增生的小胆管可能与ET的产生也有关.
, 百拇医药
本实验结果表明:ET在OJ的发生、发展中的作用是不容忽视的,尤其在OJ的肝功能损伤方面可能起着重要作用. 这对丰富OJ时的病理生理变化及临床治疗有一定的参考价值. 随着ET和ET拮抗剂的更进一步研究,可能为减轻OJ的肝功能损伤开辟一个有效的治疗前景.
通讯作者:李端阳
参考文献
1 梁扩寰. 肝脏病学. 北京:人民卫生出版社,1995:208-210
2 刘苗生,卢榜裕,卢全书,沈康年,肖开银. 内皮素在梗阻性黄疸并发肝功能失常中的应用. 广西医学,1997;19:940-943
3 Okumura S, Takei Y, Kawano S, Nagano K, Masuda E, Goto M, Tsuji S, Michida T, Chen SS, Kashiwagi T, Fusamoto H, Kamada T, Sato N. Vasoactive effect of endothelin_1 on rat liver in vivo. Hepatology, 1994;19:155-161
, http://www.100md.com
4 Zhang JX, Pegol W, Chemens MG. Endothelin-1 induces direct constriction of hepatic sinusoids. Am J Physiol, 1994;266:624-625
5 王兴鹏,袁耀宗,徐家裕,许叔祥. 急性胰腺炎大鼠血浆内皮素的变化及意义. 上海第二医科大学学报,1995;15:97-99
6 Zimmerman RS, Martinez AJ, Maymind M, Barbee RW. Effect of endothelin on plasma volume and albumin escape. Circ Res, 1992;70:1027-1034
7 Uchihara M, Izumi N, Sato C, Shimokawa W. Clinical significance of elevated plasma endothelin concentration in patients with cirrhosis. J Clin Gastroenterol, 1993;17:227-231
, 百拇医药
8 Asbert M, Gines A, Gines P, Jimenez W, Claria J, Salo J, Arroyo V, Rivera F, Rodes J. Circulation levels of endothelin in cirrhosis. Gastroenterology, 1993;104:1485-1491
9 Hemsen A, Modin A, Weitzberg E. Increased concentration of endothelin-1 messenger RNA in tissues and endothelin-1 peptide in plasma in septic pigs: modulation by etamethasone. Crit Care Med, 1996;24:1530-1536
10 Kanse SM, Takanaihi K, Lam HC, Mari F. Cytokin stimulated endothelin release from endothelial cells. Life Sci, 1991;487:1379-1382
11 Emoti T. Cellular mechanism of endothelin-1 release by agiotention and vasopressin. Hepertention, 1991;18:165-170
收稿日期 1999-05-23 修回日期 1999-08-14, 百拇医药