根除Hp对增殖细胞核抗原P53蛋白表达的影响
作者:高华 袁媛 吴烨秋 王兰 董明 张忠
单位:中国医科大学肿瘤研究所 辽宁省沈阳市 110001
关键词:胃肿瘤;螺杆菌感染;增殖细胞核抗原;P53蛋白
中国图书馆分类号 R 735中国图书馆分类号 R 735.2
Subject headings stomach neoplasms; Helicobacter infections; proliferating cell nuclear antigen; P53 protein
目前认为,幽门螺杆菌(Hp)并非胃癌直接致癌物,而是通过对胃粘膜的损伤,促进病变发展的条件因素使胃癌危险性增高[1]. 我们通过对Hp感染的胃疾病进行根除治疗,采用PCR技术及免疫组化技术观测治疗前后对胃粘膜上皮增殖细胞核抗原(PCNA)及P53蛋白表达的影响. 探讨Hp可能的致癌机制.
, http://www.100md.com
1 材料和方法
1.1 材料 胃粘膜活检标本207例,取自辽宁省庄河市胃癌高发现场,每例取新鲜胃粘膜4块(胃窦及病灶部),其中1块行Hp-PCR检测,另外3块胃粘膜用中性福尔马林固定,石蜡包埋,制成5 μm切片,行HE及免疫组织化学染色. 经Hp染色正常胃粘膜24例;浅表性胃炎58例;萎缩性胃炎Hp阳性18例;Hp阴性34例,不典型增生Hp阳性12例,Hp阴性29例;胃癌Hp阳性4例,Hp阴性28例.
1.2 方法 Hp基因PCR检测采用上海复华公司生产的Hp基因检测试剂盒,按照说明常规操作. Hp组织化学检测用HE染色及亚甲蓝(MB)染色,上述两种方法为阳性者视为Hp阳性,否则为阴性. Hp阳性胃疾病患者按三联疗法常规治疗(铋制剂+氨苄青霉素+甲硝唑)治疗3 mo后在原部位取材复查. 治疗前后标本均进行PCNA,P53蛋白免疫组化染色,全部采用SP法,染色步骤按说明书进行,PBS代替一抗作阴性对照. 光镜下观察PCNA免疫组化染色切片的显色反映,数5个以上高倍视野不少于1000个细胞,计算阳性细胞数(细胞核呈清晰棕黄色)计算PCNA指数(增殖细胞指数). 光镜下P53蛋白阳性细胞胞核染色为棕色颗粒.
, 百拇医药
统计学处理 PCNA指数两样本均数的比较采用t检验. P53蛋白免疫组化检测结果采用χ2检验.
2 结果
本研究检测207例Hp相关性胃疾病不同胃粘膜PCNA指数及P53蛋白的表达情况结果见表1,2.
表1 Hp阳性胃粘膜PCNA指数及P53蛋白的表达
组别
n
Hp
n
PCNA指数(%,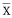 ±s)
±s)
, 百拇医药
P53蛋白阳性
n
%
正常胃粘膜
24
-
24
9.8±3.7
0
0.0
浅表性胃炎
58
+
, 百拇医药
25
14.9±5.3
0
0.0
-
33
10.6±4.8
0
0.0
萎缩性胃炎
52
+
18
, http://www.100md.com
20.1±8.4b
8
44.4b
-
34
11.1±7.6
3
8.9
不典型增生
41
+
12
29.1±5.2b
, http://www.100md.com
6
50.0b
-
29
15.4±8.2
9
31.0
胃癌
32
+
4
46.4±11.7b
3
, 百拇医药
75.0
-
28
35.7±9.3
18
64.3
bP<0.01,vs Hp-组.表2 Hp根除后PCNA指数及P53蛋白的表达
治疗
Hp
n
PCNA指数(%,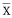 ±s)
±s)
, http://www.100md.com
P53蛋白阳性
n
%
前
+
55
23.5±3.7
14
25.4
-
后
13
19.3±6.6a
, http://www.100md.com
3
23.1a
-
42
11.5±5.2b
5
11.9b
aP<0.05,vs 治疗前;bP<0.01,vs Hp阳性组.
3 讨论
大量研究表明,Hp是胃癌的危险因素[2],与胃癌前病变及胃癌有密切关系[3]. 但Hp的致癌机制至今尚未阐明. PCNA是近年来公认的反映细胞增殖特征的良好指标. 是DNA合成时聚合酶δ的辅酶,是细胞增殖周期中DNA合成的必要蛋白,在细胞进入增殖时期出现[4]. 有资料表明,Hp可以加速胃粘膜细胞的复制,引起胃粘膜细胞增殖的可能机制是:Hp尿素酶分解尿素产生氨,氨可加速有丝分裂[5]. 本研究显示,PCNA指数在Hp阳性组较阴性组明显增加(P<0.01),经除菌治疗后,Hp转阴者PCNA指数同Hp仍为阳性者比较,两者之间的差异有非常显著的意义(P<0.01).
, 百拇医药
p53是一个抑癌基因,在几乎所有种类的恶性肿瘤中皆有高水平的表达[6]. 因为野生型P53蛋白质的T1/ 2仅30min左右,所以免疫组化方法一般难以检测到. 而突变型P53蛋白质的T1/ 2可延长达数小时,因此可用免疫组化方法测出. 野生型p53基因是细胞周期中G1期的监控基因,阻止DNA有突变的细胞克隆进入G1期,以使其有更多时间进行DNA修复. p53基因突变或缺失与恶性肿瘤的发生密切相关[7]. 本研究显示,Hp阳性胃良性病变与Hp阴性胃良性病变相比有非常显著差异(P<0.01). 除菌后Hp阴性组与除菌前及除菌后Hp仍阳性组相比,差异非常显著(P<0.01). 研究表明,Hp感染可促进突变型p53基因表达增强,Hp根除治疗后,其表达降低. Hp感染促进p53基因突变和表达增强的机制可能是,Hp感染后可导致胃粘膜一氧化氮合成酶增多,氧自由基释放[8],进而引起DNA损伤,导致p53基因突变[9]. 正常情况下野生型p53起转录因子作用,能启动WAF/ cipⅠ基因的表达[10],WAF/ cipⅠ基因编码P21蛋白能抑制PCNA,激活DNA聚合酶,从而抑制细胞增殖[11],突变型p53则失去这一功能,细胞增殖活性增加. 我们还发现,P53蛋白染色阳性组PCNA显著高于染色阴性组,提示P53蛋白的表达与细胞增殖密切相关,表明Hp感染可促进胃粘膜上皮细胞增殖,使突变型p53基因不断增强,可能是胃癌发生的一个重要原因. 因此,预防Hp感染及根除Hp治疗,是防止发生胃癌的一个重要措施.
, 百拇医药
通讯作者 高华
4 参考文献
1 张天泽,徐光炜. 肿瘤学. 天津:天津科学技术出版社,1996:1428-1429
2 Parsonnet J, Friedman GD, Vandersteen DP, Chang Y, Vogelman JH, Orentreich N, Sibley RK. Helicobacter pylori infection and the risk of gastric carcinoma. N Engl J Med, 1991;325:1127-1131
3 Correa P. Human gastric carcinogenesis: a multistep and multifactorial Process-first American cancer society award lecture on cancer epidmiology and prevention. Cancer Res, 1992;52:6735-6740
, 百拇医药
4 Fairman NP. DNA polymerase d/ PCNA actions and interactions. J Pathol, 1990;137:313-330
5 Brenes F, Ruiz B, Correa P, Hunter F, Rhamakrishnan T, Fontham E, Shi TY. Helicobacter pylori causes hyper-proliferating of the gastric epithelium; pre and post eradication indices of proliferating cell nuclear antigen. Am J Gastroenterol,1993;88:1870-1872
6 Hoston M. p53 mutation in human cancer. Science, 1991;253:49-53
, http://www.100md.com
7 Lane L. p53 guardian of the genome. Nature, 1992;358:15-21
8 Moss SF, Calam J, Agarwal B, Wang S, Rholt P. Induction of gastric epithelial apoptosis by Helicobacter pylori. Gut, 1996;38:498-501
9 Nguyen T, Brunson D, Crespi CL, Penman BW, Wishnok JS, Tannenbaum SR. DNA damage and mutation in human calls exposed to nitric in vitro. Proc Natl Acad Sci USA, 1992;89:3030-3034
10 Culotta E, Jr DK. p53 sweeps through cancer research. Science, 1993;262:1958-1962
11 Wage S, Hannon GJ, Beach D. The p21 inhibitor of cyclin-dependent kinases controls DNA replication by interaction with PCNA. Nature, 1994;369:574-579
收稿日期 1999-07-01, 百拇医药
单位:中国医科大学肿瘤研究所 辽宁省沈阳市 110001
关键词:胃肿瘤;螺杆菌感染;增殖细胞核抗原;P53蛋白
中国图书馆分类号 R 735中国图书馆分类号 R 735.2
Subject headings stomach neoplasms; Helicobacter infections; proliferating cell nuclear antigen; P53 protein
目前认为,幽门螺杆菌(Hp)并非胃癌直接致癌物,而是通过对胃粘膜的损伤,促进病变发展的条件因素使胃癌危险性增高[1]. 我们通过对Hp感染的胃疾病进行根除治疗,采用PCR技术及免疫组化技术观测治疗前后对胃粘膜上皮增殖细胞核抗原(PCNA)及P53蛋白表达的影响. 探讨Hp可能的致癌机制.
, http://www.100md.com
1 材料和方法
1.1 材料 胃粘膜活检标本207例,取自辽宁省庄河市胃癌高发现场,每例取新鲜胃粘膜4块(胃窦及病灶部),其中1块行Hp-PCR检测,另外3块胃粘膜用中性福尔马林固定,石蜡包埋,制成5 μm切片,行HE及免疫组织化学染色. 经Hp染色正常胃粘膜24例;浅表性胃炎58例;萎缩性胃炎Hp阳性18例;Hp阴性34例,不典型增生Hp阳性12例,Hp阴性29例;胃癌Hp阳性4例,Hp阴性28例.
1.2 方法 Hp基因PCR检测采用上海复华公司生产的Hp基因检测试剂盒,按照说明常规操作. Hp组织化学检测用HE染色及亚甲蓝(MB)染色,上述两种方法为阳性者视为Hp阳性,否则为阴性. Hp阳性胃疾病患者按三联疗法常规治疗(铋制剂+氨苄青霉素+甲硝唑)治疗3 mo后在原部位取材复查. 治疗前后标本均进行PCNA,P53蛋白免疫组化染色,全部采用SP法,染色步骤按说明书进行,PBS代替一抗作阴性对照. 光镜下观察PCNA免疫组化染色切片的显色反映,数5个以上高倍视野不少于1000个细胞,计算阳性细胞数(细胞核呈清晰棕黄色)计算PCNA指数(增殖细胞指数). 光镜下P53蛋白阳性细胞胞核染色为棕色颗粒.
, 百拇医药
统计学处理 PCNA指数两样本均数的比较采用t检验. P53蛋白免疫组化检测结果采用χ2检验.
2 结果
本研究检测207例Hp相关性胃疾病不同胃粘膜PCNA指数及P53蛋白的表达情况结果见表1,2.
表1 Hp阳性胃粘膜PCNA指数及P53蛋白的表达
组别
n
Hp
n
PCNA指数(%,
, 百拇医药
P53蛋白阳性
n
%
正常胃粘膜
24
-
24
9.8±3.7
0
0.0
浅表性胃炎
58
+
, 百拇医药
25
14.9±5.3
0
0.0
-
33
10.6±4.8
0
0.0
萎缩性胃炎
52
+
18
, http://www.100md.com
20.1±8.4b
8
44.4b
-
34
11.1±7.6
3
8.9
不典型增生
41
+
12
29.1±5.2b
, http://www.100md.com
6
50.0b
-
29
15.4±8.2
9
31.0
胃癌
32
+
4
46.4±11.7b
3
, 百拇医药
75.0
-
28
35.7±9.3
18
64.3
bP<0.01,vs Hp-组.表2 Hp根除后PCNA指数及P53蛋白的表达
治疗
Hp
n
PCNA指数(%,
, http://www.100md.com
P53蛋白阳性
n
%
前
+
55
23.5±3.7
14
25.4
-
后
13
19.3±6.6a
, http://www.100md.com
3
23.1a
-
42
11.5±5.2b
5
11.9b
aP<0.05,vs 治疗前;bP<0.01,vs Hp阳性组.
3 讨论
大量研究表明,Hp是胃癌的危险因素[2],与胃癌前病变及胃癌有密切关系[3]. 但Hp的致癌机制至今尚未阐明. PCNA是近年来公认的反映细胞增殖特征的良好指标. 是DNA合成时聚合酶δ的辅酶,是细胞增殖周期中DNA合成的必要蛋白,在细胞进入增殖时期出现[4]. 有资料表明,Hp可以加速胃粘膜细胞的复制,引起胃粘膜细胞增殖的可能机制是:Hp尿素酶分解尿素产生氨,氨可加速有丝分裂[5]. 本研究显示,PCNA指数在Hp阳性组较阴性组明显增加(P<0.01),经除菌治疗后,Hp转阴者PCNA指数同Hp仍为阳性者比较,两者之间的差异有非常显著的意义(P<0.01).
, 百拇医药
p53是一个抑癌基因,在几乎所有种类的恶性肿瘤中皆有高水平的表达[6]. 因为野生型P53蛋白质的T1/ 2仅30min左右,所以免疫组化方法一般难以检测到. 而突变型P53蛋白质的T1/ 2可延长达数小时,因此可用免疫组化方法测出. 野生型p53基因是细胞周期中G1期的监控基因,阻止DNA有突变的细胞克隆进入G1期,以使其有更多时间进行DNA修复. p53基因突变或缺失与恶性肿瘤的发生密切相关[7]. 本研究显示,Hp阳性胃良性病变与Hp阴性胃良性病变相比有非常显著差异(P<0.01). 除菌后Hp阴性组与除菌前及除菌后Hp仍阳性组相比,差异非常显著(P<0.01). 研究表明,Hp感染可促进突变型p53基因表达增强,Hp根除治疗后,其表达降低. Hp感染促进p53基因突变和表达增强的机制可能是,Hp感染后可导致胃粘膜一氧化氮合成酶增多,氧自由基释放[8],进而引起DNA损伤,导致p53基因突变[9]. 正常情况下野生型p53起转录因子作用,能启动WAF/ cipⅠ基因的表达[10],WAF/ cipⅠ基因编码P21蛋白能抑制PCNA,激活DNA聚合酶,从而抑制细胞增殖[11],突变型p53则失去这一功能,细胞增殖活性增加. 我们还发现,P53蛋白染色阳性组PCNA显著高于染色阴性组,提示P53蛋白的表达与细胞增殖密切相关,表明Hp感染可促进胃粘膜上皮细胞增殖,使突变型p53基因不断增强,可能是胃癌发生的一个重要原因. 因此,预防Hp感染及根除Hp治疗,是防止发生胃癌的一个重要措施.
, 百拇医药
通讯作者 高华
4 参考文献
1 张天泽,徐光炜. 肿瘤学. 天津:天津科学技术出版社,1996:1428-1429
2 Parsonnet J, Friedman GD, Vandersteen DP, Chang Y, Vogelman JH, Orentreich N, Sibley RK. Helicobacter pylori infection and the risk of gastric carcinoma. N Engl J Med, 1991;325:1127-1131
3 Correa P. Human gastric carcinogenesis: a multistep and multifactorial Process-first American cancer society award lecture on cancer epidmiology and prevention. Cancer Res, 1992;52:6735-6740
, 百拇医药
4 Fairman NP. DNA polymerase d/ PCNA actions and interactions. J Pathol, 1990;137:313-330
5 Brenes F, Ruiz B, Correa P, Hunter F, Rhamakrishnan T, Fontham E, Shi TY. Helicobacter pylori causes hyper-proliferating of the gastric epithelium; pre and post eradication indices of proliferating cell nuclear antigen. Am J Gastroenterol,1993;88:1870-1872
6 Hoston M. p53 mutation in human cancer. Science, 1991;253:49-53
, http://www.100md.com
7 Lane L. p53 guardian of the genome. Nature, 1992;358:15-21
8 Moss SF, Calam J, Agarwal B, Wang S, Rholt P. Induction of gastric epithelial apoptosis by Helicobacter pylori. Gut, 1996;38:498-501
9 Nguyen T, Brunson D, Crespi CL, Penman BW, Wishnok JS, Tannenbaum SR. DNA damage and mutation in human calls exposed to nitric in vitro. Proc Natl Acad Sci USA, 1992;89:3030-3034
10 Culotta E, Jr DK. p53 sweeps through cancer research. Science, 1993;262:1958-1962
11 Wage S, Hannon GJ, Beach D. The p21 inhibitor of cyclin-dependent kinases controls DNA replication by interaction with PCNA. Nature, 1994;369:574-579
收稿日期 1999-07-01, 百拇医药