窒息死亡尸体心脏移植复苏的实验研究
作者:龚 斌 朱家麟 张宝仁 郝家骅 徐志云
单位:第二军医大学长海医院胸心外科,上海,200433
关键词:心脏移植;复苏术
第二军医大学学报991242 目前,供心来源贫乏已成为限制大量终末期心脏病患者接受心脏移植的障碍[1]。另外,尚有较多国家仍未建立脑死亡的法律。因此,专业人员另辟途径尝试开发临床死亡后尸体的停搏心脏(CNBH)作为供心进行移植复苏[2,3]。临床有望开发利用的CNBH,其主要死因为ICU内长期依赖呼吸机支持的患者,一旦终止治疗,撤停呼吸机引发窒息而死亡。这类CNBH的特点是死前允许预处理及开展与心脏移植有关的准备工作,待一切就绪后停止人工呼吸,取心移植。迄今,有关大鼠窒息死亡的CNBH移植复苏研究鲜有报道。我们采用大鼠为实验动物,通过颈部异位移植评价围死期多因素干预对窒息死亡CNBH移植复苏的促进作用。
, http://www.100md.com
1 材料和方法
1.1 材料 采用SD雄性大鼠,体质量280~320 g。双人双目手术显微镜、显微外科器械、Cuff管、血管阻断管、多道生物信息分析系统。
1.2 方法
1.2.1 动物分组 72只大鼠按取心时间分成6组,每组6对(供受体)。Ⅰ:正常对照组;Ⅱ:窒息死亡10 min组;Ⅲ:窒息死亡15 min组;Ⅳ:围死期多因素干预的窒息死亡后10 min组;Ⅴ:围死期多因素干预的窒息死亡后15 min组;Ⅵ:围死期多因素干预的窒息死亡后30 min组。
1.2.2 灌注液制备 采用改良Kreb-Henseleit碳酸氢盐缓冲液作为灌注液(KHB),其中添加前列腺素E1、链激酶、盐酸维拉帕米及50%葡萄糖构成含药物干预成分灌注液(mKHB)。停跳液以St. ThamasⅡ号方(ST)为基本配方,其中添加与mKHB相同的药物干预成分的停跳液(mST)。
, 百拇医药
1.2.3 大鼠同种异位心脏移植模型 供、受体质量比为0.8~1∶1。手术方法:在本科大鼠异位心脏移植法基础上改用Cuff管行血管对接[4,5]。
1.2.4 窒息死亡模型 供体尾静脉穿刺,建立静脉通道。将多道生物信息分析系统的心电图监测导线的针形电极分别固定在左、右前胸及右下肢皮下,在电脑屏幕上显示出正常的心电图。在供体颈部右侧作纵切口,分离出右颈外静脉及右颈总动脉,于尾静脉注射肝素钠3 mg/kg后,行颈总动脉插管,通过三通接头与多道生物信息系统监测血压。平稳5 min后于尾静脉注射肌松药泮库溴铵(巴活朗)0.2 mg/kg。记录血压、心率,以心电图自动心律消失为死亡起点。沿双侧腋前线自肋缘至锁骨剪开胸腔及剪开心包,显露心脏及各主要血管。于死亡后10,15,30 min,分别经右颈总动脉插管注入4℃ ST液5~6 ml,将两侧肺与心脏一并取出置于冷ST液中,用4-0丝线靠右心房结扎下腔静脉,分离出升主动脉、肺动脉干,经心包横窦紧靠头臂干和肺动脉干分叉处剪断升主动脉和肺动脉干,用1-0丝线一次性集束结扎左、右肺动脉和上腔静脉,剪去两侧肺组织。供心在受体颈部移植。
, 百拇医药
1.2.5 围死期的多因素干预措施 (1)供体先经尾静脉注入 50%葡萄糖0.4 ml、前列腺素E1 2 μg/kg、盐酸维拉帕米0.1 mg/kg、甲泼尼龙10 mg/kg、普萘洛尔0.1 mg/kg、链激酶2.5 万U/L,再给肝素3 mg/kg,使全身肝素化。死后10,15或30 min,经右颈总动脉插管注入4℃ mST液5~6 ml,然后将两侧肺与心脏一并取出置冷mST中修剪、准备。(2)供心准备的同时,受体大鼠经尾静脉注射前列腺素E1 2 μg/kg、盐酸维拉帕米0.1 mg/kg、链激酶2.5 万U/kg。
1.2.6 统计学处理 数据以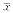 ±s表示,采用t检验。
±s表示,采用t检验。
2 结果
2.1 窒息死亡模型濒死期的心率、血压变化 尾静脉注射肌松药后约30 s动物出现抽搐,心律出现短暂室速后,心率逐渐减慢,3 min后心电图示自主心律消失,死前多因素干预者则约于5 min后自主心律消失,同时血压为零。
, 百拇医药
2.2 CNBH异位移植存活时间 Ⅰ~Ⅳ组大鼠心脏颈部异位移植后存活时间分别为(58.17±4.49) d, (2.83±0.41) h, 0 h, (58.33±4.08) d, 60 d, (2.33±0.52) h。大鼠CNBH异位移植手术成功的标准是术后受体存活和CNBH移植复跳后搏动良好(移植CNBH存活)。移植CNBH完全排斥后,受体仍可存活良好。本研究经过20次预实验,待手术技术稳定、步骤规范后正式实验。手术成功率为92%。整个手术时间为60 min,对照组供心缺血时间20 min,供心准备时间5~10 min。Ⅰ组术后5例饲养60 d后受体存活良好,颈部仍可触及搏动,1例术后第49天发生排斥。Ⅱ组在(2.83±0.41) h后即出现移植CNBH搏动无力、水肿、变硬等因缺血和再灌注损伤而停搏死亡。Ⅳ、Ⅴ组与Ⅰ组(对照组)间无差异(P>0.05),两者之间也无差异(P>0.05)。Ⅳ组有1例于术后第50天发生排斥。Ⅵ组存活时间为(2.33±0.5) h,均因缺血和再灌注损伤而停搏死亡。Ⅱ、Ⅵ组与Ⅰ(对照)组相比较差异非常显著(P<0.01)。
, http://www.100md.com
2.3 病理学检查 (1)Ⅰ组采用ST供心保护方法,供心缺血达1 h后,心脏显微、超微结构均无损害表现。(2)完全排斥的移植心组织学检查,表现为大量淋巴细胞浸润、粒细胞增多,心肌结构消失、心肌细胞坏死。(3)窒息死亡10 min后(Ⅱ组),见心肌细胞出现急性凝固性坏死,线粒体嵴发生断裂、分离,肌丝断裂; 15 min后(Ⅲ组),心肌细胞出现急性凝固性坏死,线粒体嵴断裂,核染色质着边。(4)围死期多因素干预的窒息死亡后10 min(Ⅳ)组,心肌细胞出现颗粒样变性,肌浆呈嗜伊红染色,线粒体肿大、增生,嵴之间出现小空泡,糖原颗粒减少; 15 min(Ⅴ)组,心肌细胞亦呈颗粒样变性,少数细胞变性坏死;而30 min(Ⅵ)组的CNBH,则出现不可逆的凝固性坏死,线粒体嵴断裂,核染色质着边。
3 讨论
3.1 窒息死亡CNBH移植复苏的评价 CNBH移植复苏首先遇到的是低血、低氧对心肌细胞的损害作用,通常认为脑细胞缺血、低氧4~6 min即出现不可逆的致死性病理改变[6,7]。而心肌细胞从缺血性损伤到心肌细胞死亡有一段时间,称为可恢复阶段[8]。心肌缺血最早(快)发生的变化是代谢变化,由代谢变化继发功能的变化,足够严重时最终出现形态的变化。本研究显示:窒息死亡10 min后CNBH颈部异位移植仅存活2.5~3.5 h,而15 min组颈部异位移植复跳失败;病理研究显示心肌细胞出现急性凝固性坏死,线粒体嵴断裂甚至融合,肌丝结构彻底破坏。证实,窒息死亡≥10 min的CNBH,已进入不可逆转阶段,难以进行移植复苏。
, http://www.100md.com
3.2 围死期多因素干预对窒息死亡CNBH移植复苏的促进作用 濒死期停搏心脏遭受了死前休克低压灌注、窒息时低氧及常温下缺血性损害,而且在原位遭受儿茶酚胺类、内皮素样物质等内源性缩血管物质急剧的冲击,故在原位难以被复苏。一旦CNBH被取离尸体,脱离毒害因素,并对其濒死期的不良因素进行干预中和,可促进复苏成功[9]。
本研究针对窒息死亡10~15 min后的损害特点,在致死前给予普萘洛尔、盐酸维拉帕米、前列腺素E1、链激酶及甲泼尼龙,死亡后对CNBH追踪施加盐酸维拉帕米、前列腺素E1、链激酶等干预措施直至移植复苏,结果表明是有效的。Ⅳ组和Ⅴ组颈部异位移植后存活时间与对照组无差异,光镜显示仅有轻度的心肌水肿、变性,无明显的坏死、溶解灶,胞核完好,电镜示线粒体除有轻度肿胀,数目增多外,无严重的改变。但Ⅵ组异位移植复跳失败,病理学检查显示发生不可逆的病变。作者认为,围死期多因素干预保护措施虽然能抵御窒息、低氧对CNBH的毒害作用,但这种保护效应是脆弱的,覆盖的时间范围约是窒息死亡后15 min内。若欲利用窒息死亡30 min的大鼠CNBH,本研究的围死期保护措施显得软弱,尚需进一步改进。
, 百拇医药
中图分类号 R 654.2 文章编号:0258-879X(1999)12-1043-03 文献标识码:B
作者简介:龚斌,男,1966年9月生,博士,讲师
参考文献
1 Kriett JM, Kay MP. The registry of the international society for heart transplantation: seventh official report-1990[J]. J Heart Transplant, 1990,9(4):323
2 Meguro AQ. Experimental study of cadaver heart preservation-examination of the preservation soulution and the time timit from death to cardioectomy[J]. Nippon Kyubu Gekkai Zasshi, 1994, 42(6):906
, http://www.100md.com
3 Gundry SR, Kawauchi M, Liu H, et al. Successful transplantation in tambs using asystolic pulseless, dead donors[J]. J Am Coll Cardiol, 1990,15 (SupplⅡ):224A
4 徐志云,张宝仁,朱家麟,等.改进的大鼠异位心脏移植[J]. 第二军医大学学报,1992,13(2):16
5 邹良建,张宝仁,朱家麟,等.改良豚鼠至大鼠异种移植模型[J]. 第二军医大学学报,1994,15(6):329
6 Silver MD. Cardiovascular pathology[M]. 2nd. Boston: Churchill Livingstone Inc, 1991. 621~641
, http://www.100md.com
7 Sink JD, Pellpm GL, Currie WD, et al. Response of hypertrophied myocardium to ischemia: correlation with biochemical and physiological parameters[J]. J Thorac Cardiovasc Surg,1981,81(5):865
8 Lichtensten SV, Ashe KA, El Dalati II, et al. Warm heart surg[J]. J Thorac Cardiovasc Surg,1991,101(2):269
9 Shirakura R, Matsuda H, Nakano S, et al. 24-hour storage for asphyxiated canine hearts with use of Belzer university of Wisconsin solution[J]. Transplant Proc, 1991,23(1):662
(1999-05-18收稿,1999-10-27修回), 百拇医药
单位:第二军医大学长海医院胸心外科,上海,200433
关键词:心脏移植;复苏术
第二军医大学学报991242 目前,供心来源贫乏已成为限制大量终末期心脏病患者接受心脏移植的障碍[1]。另外,尚有较多国家仍未建立脑死亡的法律。因此,专业人员另辟途径尝试开发临床死亡后尸体的停搏心脏(CNBH)作为供心进行移植复苏[2,3]。临床有望开发利用的CNBH,其主要死因为ICU内长期依赖呼吸机支持的患者,一旦终止治疗,撤停呼吸机引发窒息而死亡。这类CNBH的特点是死前允许预处理及开展与心脏移植有关的准备工作,待一切就绪后停止人工呼吸,取心移植。迄今,有关大鼠窒息死亡的CNBH移植复苏研究鲜有报道。我们采用大鼠为实验动物,通过颈部异位移植评价围死期多因素干预对窒息死亡CNBH移植复苏的促进作用。
, http://www.100md.com
1 材料和方法
1.1 材料 采用SD雄性大鼠,体质量280~320 g。双人双目手术显微镜、显微外科器械、Cuff管、血管阻断管、多道生物信息分析系统。
1.2 方法
1.2.1 动物分组 72只大鼠按取心时间分成6组,每组6对(供受体)。Ⅰ:正常对照组;Ⅱ:窒息死亡10 min组;Ⅲ:窒息死亡15 min组;Ⅳ:围死期多因素干预的窒息死亡后10 min组;Ⅴ:围死期多因素干预的窒息死亡后15 min组;Ⅵ:围死期多因素干预的窒息死亡后30 min组。
1.2.2 灌注液制备 采用改良Kreb-Henseleit碳酸氢盐缓冲液作为灌注液(KHB),其中添加前列腺素E1、链激酶、盐酸维拉帕米及50%葡萄糖构成含药物干预成分灌注液(mKHB)。停跳液以St. ThamasⅡ号方(ST)为基本配方,其中添加与mKHB相同的药物干预成分的停跳液(mST)。
, 百拇医药
1.2.3 大鼠同种异位心脏移植模型 供、受体质量比为0.8~1∶1。手术方法:在本科大鼠异位心脏移植法基础上改用Cuff管行血管对接[4,5]。
1.2.4 窒息死亡模型 供体尾静脉穿刺,建立静脉通道。将多道生物信息分析系统的心电图监测导线的针形电极分别固定在左、右前胸及右下肢皮下,在电脑屏幕上显示出正常的心电图。在供体颈部右侧作纵切口,分离出右颈外静脉及右颈总动脉,于尾静脉注射肝素钠3 mg/kg后,行颈总动脉插管,通过三通接头与多道生物信息系统监测血压。平稳5 min后于尾静脉注射肌松药泮库溴铵(巴活朗)0.2 mg/kg。记录血压、心率,以心电图自动心律消失为死亡起点。沿双侧腋前线自肋缘至锁骨剪开胸腔及剪开心包,显露心脏及各主要血管。于死亡后10,15,30 min,分别经右颈总动脉插管注入4℃ ST液5~6 ml,将两侧肺与心脏一并取出置于冷ST液中,用4-0丝线靠右心房结扎下腔静脉,分离出升主动脉、肺动脉干,经心包横窦紧靠头臂干和肺动脉干分叉处剪断升主动脉和肺动脉干,用1-0丝线一次性集束结扎左、右肺动脉和上腔静脉,剪去两侧肺组织。供心在受体颈部移植。
, 百拇医药
1.2.5 围死期的多因素干预措施 (1)供体先经尾静脉注入 50%葡萄糖0.4 ml、前列腺素E1 2 μg/kg、盐酸维拉帕米0.1 mg/kg、甲泼尼龙10 mg/kg、普萘洛尔0.1 mg/kg、链激酶2.5 万U/L,再给肝素3 mg/kg,使全身肝素化。死后10,15或30 min,经右颈总动脉插管注入4℃ mST液5~6 ml,然后将两侧肺与心脏一并取出置冷mST中修剪、准备。(2)供心准备的同时,受体大鼠经尾静脉注射前列腺素E1 2 μg/kg、盐酸维拉帕米0.1 mg/kg、链激酶2.5 万U/kg。
1.2.6 统计学处理 数据以
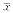 ±s表示,采用t检验。
±s表示,采用t检验。2 结果
2.1 窒息死亡模型濒死期的心率、血压变化 尾静脉注射肌松药后约30 s动物出现抽搐,心律出现短暂室速后,心率逐渐减慢,3 min后心电图示自主心律消失,死前多因素干预者则约于5 min后自主心律消失,同时血压为零。
, 百拇医药
2.2 CNBH异位移植存活时间 Ⅰ~Ⅳ组大鼠心脏颈部异位移植后存活时间分别为(58.17±4.49) d, (2.83±0.41) h, 0 h, (58.33±4.08) d, 60 d, (2.33±0.52) h。大鼠CNBH异位移植手术成功的标准是术后受体存活和CNBH移植复跳后搏动良好(移植CNBH存活)。移植CNBH完全排斥后,受体仍可存活良好。本研究经过20次预实验,待手术技术稳定、步骤规范后正式实验。手术成功率为92%。整个手术时间为60 min,对照组供心缺血时间20 min,供心准备时间5~10 min。Ⅰ组术后5例饲养60 d后受体存活良好,颈部仍可触及搏动,1例术后第49天发生排斥。Ⅱ组在(2.83±0.41) h后即出现移植CNBH搏动无力、水肿、变硬等因缺血和再灌注损伤而停搏死亡。Ⅳ、Ⅴ组与Ⅰ组(对照组)间无差异(P>0.05),两者之间也无差异(P>0.05)。Ⅳ组有1例于术后第50天发生排斥。Ⅵ组存活时间为(2.33±0.5) h,均因缺血和再灌注损伤而停搏死亡。Ⅱ、Ⅵ组与Ⅰ(对照)组相比较差异非常显著(P<0.01)。
, http://www.100md.com
2.3 病理学检查 (1)Ⅰ组采用ST供心保护方法,供心缺血达1 h后,心脏显微、超微结构均无损害表现。(2)完全排斥的移植心组织学检查,表现为大量淋巴细胞浸润、粒细胞增多,心肌结构消失、心肌细胞坏死。(3)窒息死亡10 min后(Ⅱ组),见心肌细胞出现急性凝固性坏死,线粒体嵴发生断裂、分离,肌丝断裂; 15 min后(Ⅲ组),心肌细胞出现急性凝固性坏死,线粒体嵴断裂,核染色质着边。(4)围死期多因素干预的窒息死亡后10 min(Ⅳ)组,心肌细胞出现颗粒样变性,肌浆呈嗜伊红染色,线粒体肿大、增生,嵴之间出现小空泡,糖原颗粒减少; 15 min(Ⅴ)组,心肌细胞亦呈颗粒样变性,少数细胞变性坏死;而30 min(Ⅵ)组的CNBH,则出现不可逆的凝固性坏死,线粒体嵴断裂,核染色质着边。
3 讨论
3.1 窒息死亡CNBH移植复苏的评价 CNBH移植复苏首先遇到的是低血、低氧对心肌细胞的损害作用,通常认为脑细胞缺血、低氧4~6 min即出现不可逆的致死性病理改变[6,7]。而心肌细胞从缺血性损伤到心肌细胞死亡有一段时间,称为可恢复阶段[8]。心肌缺血最早(快)发生的变化是代谢变化,由代谢变化继发功能的变化,足够严重时最终出现形态的变化。本研究显示:窒息死亡10 min后CNBH颈部异位移植仅存活2.5~3.5 h,而15 min组颈部异位移植复跳失败;病理研究显示心肌细胞出现急性凝固性坏死,线粒体嵴断裂甚至融合,肌丝结构彻底破坏。证实,窒息死亡≥10 min的CNBH,已进入不可逆转阶段,难以进行移植复苏。
, http://www.100md.com
3.2 围死期多因素干预对窒息死亡CNBH移植复苏的促进作用 濒死期停搏心脏遭受了死前休克低压灌注、窒息时低氧及常温下缺血性损害,而且在原位遭受儿茶酚胺类、内皮素样物质等内源性缩血管物质急剧的冲击,故在原位难以被复苏。一旦CNBH被取离尸体,脱离毒害因素,并对其濒死期的不良因素进行干预中和,可促进复苏成功[9]。
本研究针对窒息死亡10~15 min后的损害特点,在致死前给予普萘洛尔、盐酸维拉帕米、前列腺素E1、链激酶及甲泼尼龙,死亡后对CNBH追踪施加盐酸维拉帕米、前列腺素E1、链激酶等干预措施直至移植复苏,结果表明是有效的。Ⅳ组和Ⅴ组颈部异位移植后存活时间与对照组无差异,光镜显示仅有轻度的心肌水肿、变性,无明显的坏死、溶解灶,胞核完好,电镜示线粒体除有轻度肿胀,数目增多外,无严重的改变。但Ⅵ组异位移植复跳失败,病理学检查显示发生不可逆的病变。作者认为,围死期多因素干预保护措施虽然能抵御窒息、低氧对CNBH的毒害作用,但这种保护效应是脆弱的,覆盖的时间范围约是窒息死亡后15 min内。若欲利用窒息死亡30 min的大鼠CNBH,本研究的围死期保护措施显得软弱,尚需进一步改进。
, 百拇医药
中图分类号 R 654.2 文章编号:0258-879X(1999)12-1043-03 文献标识码:B
作者简介:龚斌,男,1966年9月生,博士,讲师
参考文献
1 Kriett JM, Kay MP. The registry of the international society for heart transplantation: seventh official report-1990[J]. J Heart Transplant, 1990,9(4):323
2 Meguro AQ. Experimental study of cadaver heart preservation-examination of the preservation soulution and the time timit from death to cardioectomy[J]. Nippon Kyubu Gekkai Zasshi, 1994, 42(6):906
, http://www.100md.com
3 Gundry SR, Kawauchi M, Liu H, et al. Successful transplantation in tambs using asystolic pulseless, dead donors[J]. J Am Coll Cardiol, 1990,15 (SupplⅡ):224A
4 徐志云,张宝仁,朱家麟,等.改进的大鼠异位心脏移植[J]. 第二军医大学学报,1992,13(2):16
5 邹良建,张宝仁,朱家麟,等.改良豚鼠至大鼠异种移植模型[J]. 第二军医大学学报,1994,15(6):329
6 Silver MD. Cardiovascular pathology[M]. 2nd. Boston: Churchill Livingstone Inc, 1991. 621~641
, http://www.100md.com
7 Sink JD, Pellpm GL, Currie WD, et al. Response of hypertrophied myocardium to ischemia: correlation with biochemical and physiological parameters[J]. J Thorac Cardiovasc Surg,1981,81(5):865
8 Lichtensten SV, Ashe KA, El Dalati II, et al. Warm heart surg[J]. J Thorac Cardiovasc Surg,1991,101(2):269
9 Shirakura R, Matsuda H, Nakano S, et al. 24-hour storage for asphyxiated canine hearts with use of Belzer university of Wisconsin solution[J]. Transplant Proc, 1991,23(1):662
(1999-05-18收稿,1999-10-27修回), 百拇医药