组胺H2受体激动剂4-甲基组胺对阿糖胞苷抑制HL-60细胞增殖的负性影响
作者:何群 徐有恒
单位:何群(血液生理研究室 长沙 410078);徐有恒(血液生理研究室 长沙 410078)
关键词:4-甲基组胺;阿糖胞苷;HL-60白血病细胞;细胞;培养的;细胞增殖;药物作用
湖南医科大学学报000101 摘 要:在用4-甲基组胺(4-MH)激动HL-60细胞上的组胺 H2受体后,观察抗白血病药物阿糖胞苷(Ara-C)对HL-60白血病细胞增殖抑制作用的影响 。以3H-TdR掺入和集落培养为增殖指标,用NBT还原试验检测细胞的分化,用HP LC和荧光分光光度法分别检测细胞内cAMP和Ca2+离子的变化。结果显示,HL-60细胞 上的组胺H2受体经4-MH激动后,Ara-C对其增殖的抑制作用明显减弱(P<0.01)。4- MH升高HL-60细胞内cAMP和Ca2+水平,启动HL-60细胞分化机制,抑制HL-60细胞的 增殖等动因与癌细胞对Ara-C不敏感可能有关。
, 百拇医药
分类号:R329.28 文献标识码:A
文章编号:1000-5625(2000)01-0001-05
The negative effect of 4-methylhistamine, an H2 recep tor agonist,on cytotoxicity of Ara-C for HL-60 leukemia cells
HE Qun, XU You-heng
(Research Laboratory of Blood Physiology, Hunan Medical University Chang sha 410078)
Abstract:Objective: To study the effect of 4-methylhistamine on cytotoxicity of Ara-C for HL-60 leukemia cells in vitro. Methods: Prolife ration of HL-60 cells was determined by semi-solid colony culture and 3H-TdR incorporation. The typical NBT reduction was used to check cell diffe rentiation. Intracellular cAMP and calcium concentration were determined by high pressure liquid chromatography(HPLC) and fluorescence method, respectively. Res ults: When HL-60 cells were pretreated with 10-8 mol.L-1 4-MH fo r 24 hrs, the cytotoxicity of Ara-C[10-8~10-4mol.L-1] fo r HL-60 leukemia cells was significantly decreased both in liquid and semisolid culture. The result of colony counting indicated that the IC50 for HL-60 cells were 1.68×10-6mol.L-1 with 4-MH pretreatment nad 2.14×10 -8mol.L-1 without 4-MH pretreatment, respectively. Therefore, the potency of Ara-C was reduced nearly 80 times according to IC50 doses. It is interesting that 10-6mol.L-1 ranitidine, an antagonist of H2 r eceptor, can elaborate the negative effect of 4-MH on cytotoxicity of Ara-C fo r HL-60 cells. Conclusion: The dose of Ara-C should be adequately increased, o r Ara-C should be used with H2 receptor antagonist such as ranitidine when tr eating myeloid leukemia patients.
, http://www.100md.com
Key words:4-methylhistamine;Ara-C;HL-60 leukemia cell;cell proliferation;drug effects▲
人们早已观察到,患髓系白血病病人的血液中组胺 含量大量增加[1],而患淋巴系白血病病人血液中未见组胺含量的增加[2] 。这表明组胺与髓系白血病有某种联系。1982年,法国学者Gespach C等人首次证实了在 人的早幼粒白血病细胞系HL-60上存在组胺H2受体[3]。然而,当HL-60白血病 细胞上的组胺H2受体被其激动剂4-甲基组胺(4-MH)激动后,对S周期特异性的细胞毒剂 阿糖胞苷(Ara-C)的反应将发生何种变化,以及在髓系白血病患者血液中组胺含量大大增加 的情况下使用抗白血病药物阿糖胞苷,对其细胞毒作用将产生什么影响 此等问题尚待解决 ,迄今未见文献报道。笔者研究了4-MH对Ara-C细胞毒作用的体外影响,旨在为临床用药 提供实验依据。
, http://www.100md.com
1 材料与方法
1.1 药品与试剂 4-甲基组胺盐酸盐(4-MH,化学名1H-imidazole-4- ethanamine-5-methyl dihydrochloride)系英国Smith Kline and French Research公司 产品。用双蒸水将其配成10-1mol.L-1浓度的备用液置-20℃冰 箱中,实验时 作系列稀释。阿糖胞苷盐酸盐[Ara-C,化学名2(1H)-pyrimidinone, 4-amino-1-β- D-arabinofuranosyl-,hydrochloride]系美国Sigma公司产品。用双蒸水配成1 mol.L -1浓度的备用液置-20℃冰箱中,实验时作系列稀释。硝基蓝四氮唑(NBT), 系美国Sigma公司产品。在电子天平上精称NB T固体100 mg加入50 ml双蒸水中溶解,配成0.2%的水溶液。用0.45 μm孔径的纤维系 膜过滤除去杂质后置4℃冰箱贮存备用。佛波醇脂(TPA)系美国Sigma公司产品。在1.0 mg TPA的安瓶内加入生理盐水溶解后 ,吸至小瓶中稀释成1 mg.ml-1浓度的贮存液置-20℃冰箱中备用。cAMP(化学名ade nosine-3′,5′-cyclic monophosphate)系美国Sigma公司产品。将含有320 pmol.L -1 cAMP的安瓶内容物溶于800 μl的PBS溶液中,用PBS系列稀释成每40 μl含cAMP 0 .25,0.5,1.0,2.0,4.0,8.0,16.0 pmol.L-1的标准溶液,置-20℃冰箱备用。Triton -X100(化学名polyoxyethylene ethers)系德国Union Carbide Chemicals and Plastics公 司产品,用双蒸水配成0.2%的浓度备用。EGTA[化学名Ethylene glycol-bis(β-aminoe thyl ether)N,N,N′,N′-tetraacetic acid]系美国Sigma公司产品。用缓冲液配成0. 2 mol.L-1的贮存液备用。Quin 2/AM,系美国Sigma公司产品,用DMSO配成10 mmol.L-1浓度的贮存液置-20℃冰箱备用。
, 百拇医药
1.2 白血病细胞的培养 HL-60白血病细胞系由北京军事医学科学院提供 。细胞采用RMPI-1640(Sigma)培养液培养,其中含10% FCS,100 U.ml-1的青霉素 钠盐,100μg.ml-1硫酸链霉素,每3~4 d全量换新鲜培养液一次。经药物处理 后置含5% CO2,37℃湿热空气培养箱中培养1~6 d,每天用Trypan蓝计数HL-60细胞的 活细胞数。
1.3 HL-60白血病细胞3H-TdR的掺入 离心收集4-MH预处理2 4 h后的HL-60细胞,PBS洗涤一次,将细胞悬浮于RMPI-1640培养液中。体系中含HL-60 1×105.ml-1,10% FCS和不同浓度的Ara-C,并接种于96孔板中。每组设3个平 行孔,对照组加等体积的培养液。置CO2培养箱中培养3 d,提前5 h加入3H-TdR (1 μCi)溶液,1N HCl终止反应后吸至玻璃纤维滤膜上抽滤收集细胞,洗涤后置液闪瓶中 即刻测定cpm值。每次实验设空瓶测定基线cpm值。
, http://www.100md.com
1.4 HL-60细胞的集落培养 将4-MH预处理后的HL-60细胞离心洗涤后再 悬浮于RMPI-1640培养液中,调整细胞浓度,HL-60细胞集落培养体系中含HL-60细胞1×1 03个.ml-1,10% FCS, 0.85% MC以及不同浓度的Ara-C。对照组加等体积的培 养液,置含5% CO2饱和湿度空气的CO2培养箱中培养7 d,置倒置显微镜下计数大于50 个细胞组成的集落。
1.5 NBT还原试验 将(10-8~10-4)mol.L-1浓度的4 -MH处理HL-60细胞6 d。离心收集HL-60细胞,用PBS洗一次,然后以106.ml-1 的细胞浓度悬浮于500 μl RMPI-1640培养液中,其中含FCS 20%, TPA 100 ng.ml -1,置37℃培育15 min,加入等体积的0.2% NBT溶液,继续培育30 min。将细胞离心 ,用PBS洗2次,涂片后用Wright-Giesma染色,计数100~200细胞,计算NBT还原阳性细胞 百分率。
, 百拇医药
1.6 HL-60细胞内cAMP浓度的检测 将(10-8~10-4)mol.10 -1浓度的4-MH处理HL-60白血病细胞30 min,离心收集细胞,洗涤后破碎细胞,高 速离心后吸上清100 μl注入HPLC仪中待测(日本Shimadzu SCL-6A型)。色谱柱购自美国Wa ters,Bondapak C18,30 cm×3.9 mm。数据处理器Shimadzu C-R3A Chromatopac。检测器 UV-VIS Spectrophotometric detector SPD-6AV)。标准品cAMP浓度分别为每升含1.0,2 .5,5.0,20,30 pmol。流动相组成:2.5%甲醇,20 mmol.L-1 KH2PO4, 流速0.9 ml.min-1,柱温25℃。cAMP的tR为3.8 min。样品浓度按以下公式计 算:样品含量/样品峰面积=标准品含量/标准品峰面积
, 百拇医药
1.7 HL-60细胞内[Ca2+]i的测定 离心收集指数增殖期的HL-60 细胞,洗涤2次后悬浮于新鲜RMPI-1640培养液中,调整细胞浓度为5×107个.ml-1 。培养液中含Quin2/AM 10 μmol.L-1,置37℃培育20 min;然后离心细胞,洗 涤2次,悬浮于4 ml荧光测定液中,立刻置荧光光谱仪(日本产HITACHI 850型,配有自动时 间扫描装置和恒温水浴样品检测池)上测定[Ca2+]i。测定前加入(10-8~10 -4)mol.L-1浓度的4-MH,测定EX为339 nm,EM为492 nm。[Ca2+] i浓度依以下公式计算:[Ca2+]i=Kd(F-Fmin)/(Fmax-F)。Kd=115 nm,F-测定的荧 光值,Fmin-测定的最小荧光值,Fmax-测定的最大荧光值。Fmin和Fmax分别由加入EGTA和Tr iton X-100测得。
, 百拇医药
1.8 药物处理 将一定浓度的4-MH加入HL-60白血病细胞培养体系中预处 理24 h,离心洗涤细胞后再作液体培养或集落培养。抗白血病药物Ara-C直接加入培养体 系。各种药物均采用培养液新鲜配制,系列稀释后加入培养体系。
1.9 统计处理 样本均数以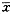 ±s表示;组间差别采用Studnet t检验。IC50的计算采用概率单位法;IC50间的比较采用U检验。
±s表示;组间差别采用Studnet t检验。IC50的计算采用概率单位法;IC50间的比较采用U检验。
2 结 果
2.1 4-MH和Ara-C对HL-60白血病细胞增殖的影响 在HL-60白血病细胞 的液体悬浮培养中,当4-MH的浓度自10-8mol.L-1增加至10-4mol.L -1时,对培养3 d的HL-60白血病细胞呈现轻微的抑制作用(表1)。
, http://www.100md.com
表1 4-MH和Ara-C对HL-60细胞增殖的作 用 药物浓度
(mol.L-1)
3H-TdR掺入值①
4-MH
Ara-C
0
6 200±743
6 200±743
10-8
5 350±524②
, http://www.100md.com
2 264±251③
10-7
4 860±318③
1 262±207
10-6
4 717±291
1 059±187
10-5
4 019±286
607±87
10-4
, 百拇医药
3 874±273
434±46
①药物处理3 d后的3H-TdR数据为3次实验的结果;②P<0.05,③ P<0.01(与对照组比)
当加入10-8mol.L-1浓度的4-MH,其3H-TdR掺入值为对照组( 不加4-甲基组胺)的86.92%;加入10-4mol.L-1浓度的4-MH后,其3H -TdR掺入值为对照组的62.48%。表明4-MH对粒白血病细胞系HL-60的增殖具有轻微的抑 制作用。在HL-60细胞的液体悬浮培养中,当加入的Ara-C剂量为(10-8~10-4 )mol.L-1时,对3 d生长的HL-60细胞呈剂量依赖性抑制。第3 d 10-8mo l.L-1剂量的Ara-C对HL-60的3H-TdR掺入值为对照组的36.52%,而10 -4mol.L-1 Ara-C的3H-TdR掺入值为对照组的7%。表明大部分HL-60细胞 已被抑制(表1)。
, 百拇医药
2.2 4-MH对Ara-C细胞毒作用的影响 在HL-60白血病细胞的液体悬浮培 养中,用10-8mol.L-1小剂量的4-MH预培养处理HL-60细胞24 h,洗涤细胞 后再加入(10-8~10-4)mol.L-1浓度的Ara-C,发现4-MH对Ara-C 的细胞毒作用具有明显的减弱作用。3H-TdR掺入数据显示,用10-8mol.L -1剂量的4-MH预处理24 h后,10-8mol.L-1剂量的Ara-C对HL-60细胞 的抑制率较不用4-MH预处理的对照组降低15%,而10-4mol.L-1剂量的Ara-C 对HL-60细胞的抑制率比对照组降低7%(表2)。
, 百拇医药
表2 4-MH对Ara-C抑制HL-60细胞增殖的 影响① Ara-C
(mol.L-1)
4-MH预处理
(10-8mol.L-1)②
未经4-MH预处理
3H-TdR
集落数
3H-TdR
, http://www.100md.com
集落数
0
6 200±743
38.17±3.06
6 200±743
38.17±3.06
10-8
3 158±203④
33.67±2.16③
2 264±251
28.33±5.05
, http://www.100md.com
10-7
1 939±224④
23.50±4.23③
1 262±207
17.33±2.58
10-6
1 703±196④
21.83±4.17④
1 059±187
1.17±1.17
, 百拇医药
10-5
1 454±208④
19.67±3.33④
607±87
0.33±0.52
10-4
886±97④
8.33±1.63④
434±46
0
①Ara-C处理HL-60细胞3 d(3H-TdR)或7 d(集落数)的数据,为3次实验 结果;②加入Ara-C之前用4-MH预处理24 h;③P<0.05,④P<0.01(与未经4-MH 预处理数据比较)
, 百拇医药
当用10-8mol.L-1剂量的4-MH预处理HL-60细胞24 h后,再作集落培 养,发现(10-9~10-3)mol.L-1剂量范围的Ara-C对HL-60细胞抑制的 IC50为(1.68×10-6)mol.L-1;而未经4-MH预处理的对照组的IC 50为(2.14×10-8)mol.L-1(P<0.01)。表明经4-MH预处理后,Ara-C 对HL-60白血病细胞的抑制强化比未经4-MH预处理的对照组降低了近80倍。若先用10- 6mol.L-1剂量的Ranit拮抗4-MH的作用,即能消除4-MH对Ara-C细胞毒作用的负 性影响(图1)。
, http://www.100md.com
图1 雷尼替丁对4-MH影响Ara- C细胞毒性的拮抗作用
Fig. 1 The antagonism of ranitidine to the effect of 4-MH on the cytoxicity of Ara-C The points represent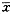 ±s of the triplicate wells of each of the cultures in 2~3 experiments(n =6~9). The HL-60 leukemia cells were sequentially pretreated with 10-6 mol.L-1 ranitidine and 10-8mol.L-1 4-MH before the colony c ulture in which (10-9~10-3)mol.L-1 of Ara-C were added ① P<0.05,②P<0.01
±s of the triplicate wells of each of the cultures in 2~3 experiments(n =6~9). The HL-60 leukemia cells were sequentially pretreated with 10-6 mol.L-1 ranitidine and 10-8mol.L-1 4-MH before the colony c ulture in which (10-9~10-3)mol.L-1 of Ara-C were added ① P<0.05,②P<0.01
, 百拇医药
2.3 4-MH对HL-60白血病细胞预处理的作用机制 实验证实,(10-8 ~10-4)mol.L-1剂量的4-MH预处理HL-60白血病细胞0.5 h,可使HL-6 0细胞内的cAMP浓度明显升高,且具有剂量依赖性。当4-MH剂量为10-4mol.L-1 时,最大升高的cAMP浓度为对照组的16倍(表3)。
表3 4-MH预处理HL-60的细胞机制① 4-MH
(mol.L-1)
cAMP
, http://www.100md.com (pmol.L-1)
[Ca2+]i
(nmol.L-1)
NBT
(%)
0
6.66±0.31
48.10±14.06
7±1
10-8
, 百拇医药
9.56±0.24②
110.08±10.03②
18±2.65②
10-7
15.58±0.37
110.94±8.78
24.67±4.73
10-6
18.28±0.76
121.94±9.73
, 百拇医药
28.33±1.16
10-5
34.86±0.85
164.05±12.88
29.33±0.58
10-4
102.10±1.23
240.70±16.29
37±2
①数值为2次的实验结果;②与对照组比P<0.01
(10-8~10-4)mol.L-1剂量的4-MH亦可使HL-60细胞内的[Ca 2+]i一过性升高,且呈剂量依赖性;当4-MH为10-8mol.L-1时,[Ca 2+]i升高为对照组的2倍(表3)。在用(10-8~10-4)mol.L-1剂 量的4-MH处理HL-60白血病细胞6 d后,形态学和NBT还原率均表明4-MH能促使HL-60细 胞向成熟的髓系细胞分化。说明4-MH对HL-60白血病细胞具有诱导分化的作用(表3,图2) 。


, 百拇医药
图2 4-MH诱导HL-60白血病细胞分化的形态学
Fig. 2 The morphology of HL-60 leukemia cells induced by 4-MH HL-60 cells were treated with 10-6mol.L-1 of 4-MH for 6 d in liquid culture and stained by Wright's method
3 讨 论
阿糖胞苷是一种核苷类似物,最早提取自一种海绵体。经研究发现该物质对治疗人的白血病 非常有效。在急性粒细胞白血病的治疗中,Ara-C一直作为诱导缓解的首选药之一沿用至今 。Ara-C对白血病细胞的抑制作用很强,但对正常骨髓也有一定的抑制作用,故临床所见毒 副作用较大。为了加强Ara-C的抗白血病作用而减低其毒性,人们进行了大量研究工作。这 其中包括增强Ara-C的生物活性,阻断Ara-C的降解途径,阻止Ara-C从白血病细胞中排出 ,保护正常骨髓细胞免受Ara-C的毒性,以及促使白血病细胞进入DNA合成期而对Ara-C的 毒性更加敏感。研究工作也发现,抗癌药能促使肥大细胞释放组胺[4,5],说明 抗癌药与组胺之间存在某种联系。本文结果显示,4-MH和Ara-C对HL-60白血病细胞均具 有不同程度的抑制作用,但Ara-C的抑制作用大于4-MH。当用4-MH预处理HL-60白血病细 胞一段时间后,却能减低Ara-C对HL-60白血病细胞的细胞毒作用。组胺H2受体拮抗剂雷 尼替丁(ranitidine)能阻断4-MH对Ara-C的这种负性影响。这说明4-MH对Ara-C细胞毒作 用的影响乃通过组胺H2受体所介导。组胺具有H1和H2受体激动活性,正常人体内血浆 组胺水平约为10-8mol.L-1或更低[6]。有文献报道髓系白血病患者 血浆组胺浓度还要大大增加[1],这对于临床应用Ara-C治疗白血病将会产生什么 影响值得思考。实验结果表明,当4-MH的浓度为10-8mol.L-1时即能减低Ara -C的细胞毒性。这是否意味着治疗粒细胞白血病可考虑加入Ara-C剂量,或伍用组胺H2 受体拮抗剂以阻断组胺对Ara-C细胞毒作用的负性影响。
, 百拇医药
据文献报道[7~9],胃壁细胞上的组胺H2受体在介导胃酸分泌的过程中,其机 制是由于组胺H2受体激动剂可刺激胃壁细胞的腺苷酸环化酶,从而使腺苷-3′,5′-环 单磷酸(cAMP)的生成增加。HL-60白血病细胞存在组胺H2受体,当此H2受体被激动,也 能使HL-60白血病细胞内的cAMP含量增加[3]。近年来,有关细胞内的钙离子作为 第二信使调节细胞的生理机能的作用越来越引起人们的广泛重视。笔者测定组胺H2受体激 动剂4-MH对HL-60细胞内cAMP和[Ca2+]i的浓度变化以及对HL-60白血病细胞分化 的影响,以阐明组胺H2受体激动剂4-MH对Ara-C细胞毒作用负性影响的可能机制。
1985年Klainyak KA等人发现组胺H2受体激动剂Dimaprit具有诱导HL-60白血病细胞向成 熟粒细胞分化的作用[10]。1990年Tasaka K等人发现组胺也具有诱导HL-60白血 病细胞向成熟粒细胞分化的作用[11]。但有关4-MH诱导HL-60白血病细胞分化 的文献尚未见报道。本文实验证实,当(10-8~10-4)mol.L-1浓度的4 -MH处理HL-60白血病细胞6 d,即见明显的诱导HL-60细胞向成熟髓性细胞分化的作用。 这提示4-MH对HL-60白血病细胞增殖的抑制作用是由于诱导分化的结果。当诱导分化的信 号传入HL-60细胞,该白血病细胞的增殖速度下降,而随着培养时间的延长出现NBT阳性细 胞。
, 百拇医药
笔者还观察到,4-MH能使HL-60白血病细胞内的cAMP和[Ca2+]i浓度升高,并呈剂 量依赖关系。这与Gespach C等人报道的结果一致[30]。一般来说,细胞内cAMP 浓度的增加所导致的生物学效应在大多数正常的和癌变的细胞上表现为细胞增殖的抑制和细 胞形态的分化[12]。这提示,用4-MH预处理HL-60白血病细胞,引起其上的组 胺H2受体与其配基4-MH结合而被激动,信号传达到细胞膜上的腺苷酸环化酶。在此酶的 作用下,HL-60细胞内的ATP分解为cAMP。同时,引起HL-60白血病细胞内胞浆游离[Ca 2+]i水平升高,从而启动了HL-60细胞的分化机制。这一传递过程一旦起始,HL-60 白血病细胞的增殖速度减慢,亦即进入DNA合成期的HL-60细胞数目减少,最终导致对DNA合 成期特异性的抗代谢剂Ara-C的不敏感,表现为对Ara-C细胞毒作用的负性影响。另外,小 剂量Ara-C对HL-60细胞的作用是诱导该细胞向单核巨噬细胞分化,从而抑制HL-60细胞的 增殖。可见,一旦4-MH诱导HL-60向粒细胞分化的机制被启动,即能对抗Ara-C诱导HL-6 0向单核巨噬系分化而引起细胞增殖的抑制效应。这也可能是4-MH对Ara-C细胞毒作用负性 影响的机制之一。
, 百拇医药
基金项目:国家自然科学基金资助项目(39170323)
作者简介:何群(1957-),男副教授,博士
参考文献:
[1]Shimkin MB, Bierman HR, Low-Beer BVA, et al. Histam ine and myelogenous leukemia[J]. Cancer, 1951,4:570-578.
[2]Thiersch JB. Lymphocytic leukemia and blood histamine[J]. Aust J Exp Biol Med Sci, 1947,25:79-82.
[3]Gespach C, Saal F, Cost H, et al. Identification and characterization of surface receptors for histamine in the human promyelocytic leukemia line HL-60[J]. Mol Pharmacol, 1982,22:547-553.
, http://www.100md.com
[4]Arnaez E. Effect of purification, theophylline and sodium fluoride on his tamine release produced by antineoplastic drugs on rat mast cells[J]. Biochem Pharmacol, 1992,44(3):533-538.
[5]Botara LM. Non-immunological release of histamine from rat mast cells el icited by antineoplastic agents[J]. Cancer Chemother Pharmacol, 1992,29(6):495 -498.
[6]Beaven MA. Factors regulating availability of histamine at tissue recepto rs. In: Genellin CR, Parsons ME (ed). Pharmacology of Histamine Receptors[M]. Bristol Wright, 1982:1-32.
, 百拇医药
[7]Chew CS, Hersey SJ, Sachs G, et al. Histamine responsiveness of isola ted gastric glands[J]. Am J Physiol, 1980,238:G312-G320.
[8]Soll AH, Wollin A. Histamine and cyclic AMP in isolated canine parietal c ells[J]. Am J Physiol, 1979,237:E444-E450.
[9]Wollin A, Soll AH, Samloff IM. Actions of histamine, secretin, and PGE2 on cyclinc AMP production by isolated canine fundic mucosal cells[J]. Am J Ph ysiol, 1979,237:E437-E443.
, 百拇医药
[10]Kalinyak KA, Sawutz DG, Lampkin BC, et al. Effect of dimapri t on growth and differentiation of human promelocytic cell line HL-60[J]. Lif e Science, 1985,36:1909-1916.
[11]Tasaka K, Nakaya N, Nonaka T. Effect of histamine, granulocyte colony-s timulating factor and db-cAMP on the diferentiation of HL-60 cells[J]. Agents Actions, 1990,30(1/2):240-242.
[12]Ryan WL, and Heidrick ML. Cellular cAMP and cell proliferation and differentiation[J]. Adv Cyclic Nucleotide Res, 1974,4:80-116.
收稿日期:1999-10-15, 百拇医药
单位:何群(血液生理研究室 长沙 410078);徐有恒(血液生理研究室 长沙 410078)
关键词:4-甲基组胺;阿糖胞苷;HL-60白血病细胞;细胞;培养的;细胞增殖;药物作用
湖南医科大学学报000101 摘 要:在用4-甲基组胺(4-MH)激动HL-60细胞上的组胺 H2受体后,观察抗白血病药物阿糖胞苷(Ara-C)对HL-60白血病细胞增殖抑制作用的影响 。以3H-TdR掺入和集落培养为增殖指标,用NBT还原试验检测细胞的分化,用HP LC和荧光分光光度法分别检测细胞内cAMP和Ca2+离子的变化。结果显示,HL-60细胞 上的组胺H2受体经4-MH激动后,Ara-C对其增殖的抑制作用明显减弱(P<0.01)。4- MH升高HL-60细胞内cAMP和Ca2+水平,启动HL-60细胞分化机制,抑制HL-60细胞的 增殖等动因与癌细胞对Ara-C不敏感可能有关。
, 百拇医药
分类号:R329.28 文献标识码:A
文章编号:1000-5625(2000)01-0001-05
The negative effect of 4-methylhistamine, an H2 recep tor agonist,on cytotoxicity of Ara-C for HL-60 leukemia cells
HE Qun, XU You-heng
(Research Laboratory of Blood Physiology, Hunan Medical University Chang sha 410078)
Abstract:Objective: To study the effect of 4-methylhistamine on cytotoxicity of Ara-C for HL-60 leukemia cells in vitro. Methods: Prolife ration of HL-60 cells was determined by semi-solid colony culture and 3H-TdR incorporation. The typical NBT reduction was used to check cell diffe rentiation. Intracellular cAMP and calcium concentration were determined by high pressure liquid chromatography(HPLC) and fluorescence method, respectively. Res ults: When HL-60 cells were pretreated with 10-8 mol.L-1 4-MH fo r 24 hrs, the cytotoxicity of Ara-C[10-8~10-4mol.L-1] fo r HL-60 leukemia cells was significantly decreased both in liquid and semisolid culture. The result of colony counting indicated that the IC50 for HL-60 cells were 1.68×10-6mol.L-1 with 4-MH pretreatment nad 2.14×10 -8mol.L-1 without 4-MH pretreatment, respectively. Therefore, the potency of Ara-C was reduced nearly 80 times according to IC50 doses. It is interesting that 10-6mol.L-1 ranitidine, an antagonist of H2 r eceptor, can elaborate the negative effect of 4-MH on cytotoxicity of Ara-C fo r HL-60 cells. Conclusion: The dose of Ara-C should be adequately increased, o r Ara-C should be used with H2 receptor antagonist such as ranitidine when tr eating myeloid leukemia patients.
, http://www.100md.com
Key words:4-methylhistamine;Ara-C;HL-60 leukemia cell;cell proliferation;drug effects▲
人们早已观察到,患髓系白血病病人的血液中组胺 含量大量增加[1],而患淋巴系白血病病人血液中未见组胺含量的增加[2] 。这表明组胺与髓系白血病有某种联系。1982年,法国学者Gespach C等人首次证实了在 人的早幼粒白血病细胞系HL-60上存在组胺H2受体[3]。然而,当HL-60白血病 细胞上的组胺H2受体被其激动剂4-甲基组胺(4-MH)激动后,对S周期特异性的细胞毒剂 阿糖胞苷(Ara-C)的反应将发生何种变化,以及在髓系白血病患者血液中组胺含量大大增加 的情况下使用抗白血病药物阿糖胞苷,对其细胞毒作用将产生什么影响 此等问题尚待解决 ,迄今未见文献报道。笔者研究了4-MH对Ara-C细胞毒作用的体外影响,旨在为临床用药 提供实验依据。
, http://www.100md.com
1 材料与方法
1.1 药品与试剂 4-甲基组胺盐酸盐(4-MH,化学名1H-imidazole-4- ethanamine-5-methyl dihydrochloride)系英国Smith Kline and French Research公司 产品。用双蒸水将其配成10-1mol.L-1浓度的备用液置-20℃冰 箱中,实验时 作系列稀释。阿糖胞苷盐酸盐[Ara-C,化学名2(1H)-pyrimidinone, 4-amino-1-β- D-arabinofuranosyl-,hydrochloride]系美国Sigma公司产品。用双蒸水配成1 mol.L -1浓度的备用液置-20℃冰箱中,实验时作系列稀释。硝基蓝四氮唑(NBT), 系美国Sigma公司产品。在电子天平上精称NB T固体100 mg加入50 ml双蒸水中溶解,配成0.2%的水溶液。用0.45 μm孔径的纤维系 膜过滤除去杂质后置4℃冰箱贮存备用。佛波醇脂(TPA)系美国Sigma公司产品。在1.0 mg TPA的安瓶内加入生理盐水溶解后 ,吸至小瓶中稀释成1 mg.ml-1浓度的贮存液置-20℃冰箱中备用。cAMP(化学名ade nosine-3′,5′-cyclic monophosphate)系美国Sigma公司产品。将含有320 pmol.L -1 cAMP的安瓶内容物溶于800 μl的PBS溶液中,用PBS系列稀释成每40 μl含cAMP 0 .25,0.5,1.0,2.0,4.0,8.0,16.0 pmol.L-1的标准溶液,置-20℃冰箱备用。Triton -X100(化学名polyoxyethylene ethers)系德国Union Carbide Chemicals and Plastics公 司产品,用双蒸水配成0.2%的浓度备用。EGTA[化学名Ethylene glycol-bis(β-aminoe thyl ether)N,N,N′,N′-tetraacetic acid]系美国Sigma公司产品。用缓冲液配成0. 2 mol.L-1的贮存液备用。Quin 2/AM,系美国Sigma公司产品,用DMSO配成10 mmol.L-1浓度的贮存液置-20℃冰箱备用。
, 百拇医药
1.2 白血病细胞的培养 HL-60白血病细胞系由北京军事医学科学院提供 。细胞采用RMPI-1640(Sigma)培养液培养,其中含10% FCS,100 U.ml-1的青霉素 钠盐,100μg.ml-1硫酸链霉素,每3~4 d全量换新鲜培养液一次。经药物处理 后置含5% CO2,37℃湿热空气培养箱中培养1~6 d,每天用Trypan蓝计数HL-60细胞的 活细胞数。
1.3 HL-60白血病细胞3H-TdR的掺入 离心收集4-MH预处理2 4 h后的HL-60细胞,PBS洗涤一次,将细胞悬浮于RMPI-1640培养液中。体系中含HL-60 1×105.ml-1,10% FCS和不同浓度的Ara-C,并接种于96孔板中。每组设3个平 行孔,对照组加等体积的培养液。置CO2培养箱中培养3 d,提前5 h加入3H-TdR (1 μCi)溶液,1N HCl终止反应后吸至玻璃纤维滤膜上抽滤收集细胞,洗涤后置液闪瓶中 即刻测定cpm值。每次实验设空瓶测定基线cpm值。
, http://www.100md.com
1.4 HL-60细胞的集落培养 将4-MH预处理后的HL-60细胞离心洗涤后再 悬浮于RMPI-1640培养液中,调整细胞浓度,HL-60细胞集落培养体系中含HL-60细胞1×1 03个.ml-1,10% FCS, 0.85% MC以及不同浓度的Ara-C。对照组加等体积的培 养液,置含5% CO2饱和湿度空气的CO2培养箱中培养7 d,置倒置显微镜下计数大于50 个细胞组成的集落。
1.5 NBT还原试验 将(10-8~10-4)mol.L-1浓度的4 -MH处理HL-60细胞6 d。离心收集HL-60细胞,用PBS洗一次,然后以106.ml-1 的细胞浓度悬浮于500 μl RMPI-1640培养液中,其中含FCS 20%, TPA 100 ng.ml -1,置37℃培育15 min,加入等体积的0.2% NBT溶液,继续培育30 min。将细胞离心 ,用PBS洗2次,涂片后用Wright-Giesma染色,计数100~200细胞,计算NBT还原阳性细胞 百分率。
, 百拇医药
1.6 HL-60细胞内cAMP浓度的检测 将(10-8~10-4)mol.10 -1浓度的4-MH处理HL-60白血病细胞30 min,离心收集细胞,洗涤后破碎细胞,高 速离心后吸上清100 μl注入HPLC仪中待测(日本Shimadzu SCL-6A型)。色谱柱购自美国Wa ters,Bondapak C18,30 cm×3.9 mm。数据处理器Shimadzu C-R3A Chromatopac。检测器 UV-VIS Spectrophotometric detector SPD-6AV)。标准品cAMP浓度分别为每升含1.0,2 .5,5.0,20,30 pmol。流动相组成:2.5%甲醇,20 mmol.L-1 KH2PO4, 流速0.9 ml.min-1,柱温25℃。cAMP的tR为3.8 min。样品浓度按以下公式计 算:样品含量/样品峰面积=标准品含量/标准品峰面积
, 百拇医药
1.7 HL-60细胞内[Ca2+]i的测定 离心收集指数增殖期的HL-60 细胞,洗涤2次后悬浮于新鲜RMPI-1640培养液中,调整细胞浓度为5×107个.ml-1 。培养液中含Quin2/AM 10 μmol.L-1,置37℃培育20 min;然后离心细胞,洗 涤2次,悬浮于4 ml荧光测定液中,立刻置荧光光谱仪(日本产HITACHI 850型,配有自动时 间扫描装置和恒温水浴样品检测池)上测定[Ca2+]i。测定前加入(10-8~10 -4)mol.L-1浓度的4-MH,测定EX为339 nm,EM为492 nm。[Ca2+] i浓度依以下公式计算:[Ca2+]i=Kd(F-Fmin)/(Fmax-F)。Kd=115 nm,F-测定的荧 光值,Fmin-测定的最小荧光值,Fmax-测定的最大荧光值。Fmin和Fmax分别由加入EGTA和Tr iton X-100测得。
, 百拇医药
1.8 药物处理 将一定浓度的4-MH加入HL-60白血病细胞培养体系中预处 理24 h,离心洗涤细胞后再作液体培养或集落培养。抗白血病药物Ara-C直接加入培养体 系。各种药物均采用培养液新鲜配制,系列稀释后加入培养体系。
1.9 统计处理 样本均数以
 ±s表示;组间差别采用Studnet t检验。IC50的计算采用概率单位法;IC50间的比较采用U检验。
±s表示;组间差别采用Studnet t检验。IC50的计算采用概率单位法;IC50间的比较采用U检验。2 结 果
2.1 4-MH和Ara-C对HL-60白血病细胞增殖的影响 在HL-60白血病细胞 的液体悬浮培养中,当4-MH的浓度自10-8mol.L-1增加至10-4mol.L -1时,对培养3 d的HL-60白血病细胞呈现轻微的抑制作用(表1)。
, http://www.100md.com
表1 4-MH和Ara-C对HL-60细胞增殖的作 用 药物浓度
(mol.L-1)
3H-TdR掺入值①
4-MH
Ara-C
0
6 200±743
6 200±743
10-8
5 350±524②
, http://www.100md.com
2 264±251③
10-7
4 860±318③
1 262±207
10-6
4 717±291
1 059±187
10-5
4 019±286
607±87
10-4
, 百拇医药
3 874±273
434±46
①药物处理3 d后的3H-TdR数据为3次实验的结果;②P<0.05,③ P<0.01(与对照组比)
当加入10-8mol.L-1浓度的4-MH,其3H-TdR掺入值为对照组( 不加4-甲基组胺)的86.92%;加入10-4mol.L-1浓度的4-MH后,其3H -TdR掺入值为对照组的62.48%。表明4-MH对粒白血病细胞系HL-60的增殖具有轻微的抑 制作用。在HL-60细胞的液体悬浮培养中,当加入的Ara-C剂量为(10-8~10-4 )mol.L-1时,对3 d生长的HL-60细胞呈剂量依赖性抑制。第3 d 10-8mo l.L-1剂量的Ara-C对HL-60的3H-TdR掺入值为对照组的36.52%,而10 -4mol.L-1 Ara-C的3H-TdR掺入值为对照组的7%。表明大部分HL-60细胞 已被抑制(表1)。
, 百拇医药
2.2 4-MH对Ara-C细胞毒作用的影响 在HL-60白血病细胞的液体悬浮培 养中,用10-8mol.L-1小剂量的4-MH预培养处理HL-60细胞24 h,洗涤细胞 后再加入(10-8~10-4)mol.L-1浓度的Ara-C,发现4-MH对Ara-C 的细胞毒作用具有明显的减弱作用。3H-TdR掺入数据显示,用10-8mol.L -1剂量的4-MH预处理24 h后,10-8mol.L-1剂量的Ara-C对HL-60细胞 的抑制率较不用4-MH预处理的对照组降低15%,而10-4mol.L-1剂量的Ara-C 对HL-60细胞的抑制率比对照组降低7%(表2)。
, 百拇医药
表2 4-MH对Ara-C抑制HL-60细胞增殖的 影响① Ara-C
(mol.L-1)
4-MH预处理
(10-8mol.L-1)②
未经4-MH预处理
3H-TdR
集落数
3H-TdR
, http://www.100md.com
集落数
0
6 200±743
38.17±3.06
6 200±743
38.17±3.06
10-8
3 158±203④
33.67±2.16③
2 264±251
28.33±5.05
, http://www.100md.com
10-7
1 939±224④
23.50±4.23③
1 262±207
17.33±2.58
10-6
1 703±196④
21.83±4.17④
1 059±187
1.17±1.17
, 百拇医药
10-5
1 454±208④
19.67±3.33④
607±87
0.33±0.52
10-4
886±97④
8.33±1.63④
434±46
0
①Ara-C处理HL-60细胞3 d(3H-TdR)或7 d(集落数)的数据,为3次实验 结果;②加入Ara-C之前用4-MH预处理24 h;③P<0.05,④P<0.01(与未经4-MH 预处理数据比较)
, 百拇医药
当用10-8mol.L-1剂量的4-MH预处理HL-60细胞24 h后,再作集落培 养,发现(10-9~10-3)mol.L-1剂量范围的Ara-C对HL-60细胞抑制的 IC50为(1.68×10-6)mol.L-1;而未经4-MH预处理的对照组的IC 50为(2.14×10-8)mol.L-1(P<0.01)。表明经4-MH预处理后,Ara-C 对HL-60白血病细胞的抑制强化比未经4-MH预处理的对照组降低了近80倍。若先用10- 6mol.L-1剂量的Ranit拮抗4-MH的作用,即能消除4-MH对Ara-C细胞毒作用的负 性影响(图1)。

, http://www.100md.com
图1 雷尼替丁对4-MH影响Ara- C细胞毒性的拮抗作用
Fig. 1 The antagonism of ranitidine to the effect of 4-MH on the cytoxicity of Ara-C The points represent
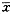 ±s of the triplicate wells of each of the cultures in 2~3 experiments(n =6~9). The HL-60 leukemia cells were sequentially pretreated with 10-6 mol.L-1 ranitidine and 10-8mol.L-1 4-MH before the colony c ulture in which (10-9~10-3)mol.L-1 of Ara-C were added ① P<0.05,②P<0.01
±s of the triplicate wells of each of the cultures in 2~3 experiments(n =6~9). The HL-60 leukemia cells were sequentially pretreated with 10-6 mol.L-1 ranitidine and 10-8mol.L-1 4-MH before the colony c ulture in which (10-9~10-3)mol.L-1 of Ara-C were added ① P<0.05,②P<0.01, 百拇医药
2.3 4-MH对HL-60白血病细胞预处理的作用机制 实验证实,(10-8 ~10-4)mol.L-1剂量的4-MH预处理HL-60白血病细胞0.5 h,可使HL-6 0细胞内的cAMP浓度明显升高,且具有剂量依赖性。当4-MH剂量为10-4mol.L-1 时,最大升高的cAMP浓度为对照组的16倍(表3)。
表3 4-MH预处理HL-60的细胞机制① 4-MH
(mol.L-1)
cAMP
, http://www.100md.com (pmol.L-1)
[Ca2+]i
(nmol.L-1)
NBT
(%)
0
6.66±0.31
48.10±14.06
7±1
10-8
, 百拇医药
9.56±0.24②
110.08±10.03②
18±2.65②
10-7
15.58±0.37
110.94±8.78
24.67±4.73
10-6
18.28±0.76
121.94±9.73
, 百拇医药
28.33±1.16
10-5
34.86±0.85
164.05±12.88
29.33±0.58
10-4
102.10±1.23
240.70±16.29
37±2
①数值为2次的实验结果;②与对照组比P<0.01
(10-8~10-4)mol.L-1剂量的4-MH亦可使HL-60细胞内的[Ca 2+]i一过性升高,且呈剂量依赖性;当4-MH为10-8mol.L-1时,[Ca 2+]i升高为对照组的2倍(表3)。在用(10-8~10-4)mol.L-1剂 量的4-MH处理HL-60白血病细胞6 d后,形态学和NBT还原率均表明4-MH能促使HL-60细 胞向成熟的髓系细胞分化。说明4-MH对HL-60白血病细胞具有诱导分化的作用(表3,图2) 。



, 百拇医药
图2 4-MH诱导HL-60白血病细胞分化的形态学
Fig. 2 The morphology of HL-60 leukemia cells induced by 4-MH HL-60 cells were treated with 10-6mol.L-1 of 4-MH for 6 d in liquid culture and stained by Wright's method
3 讨 论
阿糖胞苷是一种核苷类似物,最早提取自一种海绵体。经研究发现该物质对治疗人的白血病 非常有效。在急性粒细胞白血病的治疗中,Ara-C一直作为诱导缓解的首选药之一沿用至今 。Ara-C对白血病细胞的抑制作用很强,但对正常骨髓也有一定的抑制作用,故临床所见毒 副作用较大。为了加强Ara-C的抗白血病作用而减低其毒性,人们进行了大量研究工作。这 其中包括增强Ara-C的生物活性,阻断Ara-C的降解途径,阻止Ara-C从白血病细胞中排出 ,保护正常骨髓细胞免受Ara-C的毒性,以及促使白血病细胞进入DNA合成期而对Ara-C的 毒性更加敏感。研究工作也发现,抗癌药能促使肥大细胞释放组胺[4,5],说明 抗癌药与组胺之间存在某种联系。本文结果显示,4-MH和Ara-C对HL-60白血病细胞均具 有不同程度的抑制作用,但Ara-C的抑制作用大于4-MH。当用4-MH预处理HL-60白血病细 胞一段时间后,却能减低Ara-C对HL-60白血病细胞的细胞毒作用。组胺H2受体拮抗剂雷 尼替丁(ranitidine)能阻断4-MH对Ara-C的这种负性影响。这说明4-MH对Ara-C细胞毒作 用的影响乃通过组胺H2受体所介导。组胺具有H1和H2受体激动活性,正常人体内血浆 组胺水平约为10-8mol.L-1或更低[6]。有文献报道髓系白血病患者 血浆组胺浓度还要大大增加[1],这对于临床应用Ara-C治疗白血病将会产生什么 影响值得思考。实验结果表明,当4-MH的浓度为10-8mol.L-1时即能减低Ara -C的细胞毒性。这是否意味着治疗粒细胞白血病可考虑加入Ara-C剂量,或伍用组胺H2 受体拮抗剂以阻断组胺对Ara-C细胞毒作用的负性影响。
, 百拇医药
据文献报道[7~9],胃壁细胞上的组胺H2受体在介导胃酸分泌的过程中,其机 制是由于组胺H2受体激动剂可刺激胃壁细胞的腺苷酸环化酶,从而使腺苷-3′,5′-环 单磷酸(cAMP)的生成增加。HL-60白血病细胞存在组胺H2受体,当此H2受体被激动,也 能使HL-60白血病细胞内的cAMP含量增加[3]。近年来,有关细胞内的钙离子作为 第二信使调节细胞的生理机能的作用越来越引起人们的广泛重视。笔者测定组胺H2受体激 动剂4-MH对HL-60细胞内cAMP和[Ca2+]i的浓度变化以及对HL-60白血病细胞分化 的影响,以阐明组胺H2受体激动剂4-MH对Ara-C细胞毒作用负性影响的可能机制。
1985年Klainyak KA等人发现组胺H2受体激动剂Dimaprit具有诱导HL-60白血病细胞向成 熟粒细胞分化的作用[10]。1990年Tasaka K等人发现组胺也具有诱导HL-60白血 病细胞向成熟粒细胞分化的作用[11]。但有关4-MH诱导HL-60白血病细胞分化 的文献尚未见报道。本文实验证实,当(10-8~10-4)mol.L-1浓度的4 -MH处理HL-60白血病细胞6 d,即见明显的诱导HL-60细胞向成熟髓性细胞分化的作用。 这提示4-MH对HL-60白血病细胞增殖的抑制作用是由于诱导分化的结果。当诱导分化的信 号传入HL-60细胞,该白血病细胞的增殖速度下降,而随着培养时间的延长出现NBT阳性细 胞。
, 百拇医药
笔者还观察到,4-MH能使HL-60白血病细胞内的cAMP和[Ca2+]i浓度升高,并呈剂 量依赖关系。这与Gespach C等人报道的结果一致[30]。一般来说,细胞内cAMP 浓度的增加所导致的生物学效应在大多数正常的和癌变的细胞上表现为细胞增殖的抑制和细 胞形态的分化[12]。这提示,用4-MH预处理HL-60白血病细胞,引起其上的组 胺H2受体与其配基4-MH结合而被激动,信号传达到细胞膜上的腺苷酸环化酶。在此酶的 作用下,HL-60细胞内的ATP分解为cAMP。同时,引起HL-60白血病细胞内胞浆游离[Ca 2+]i水平升高,从而启动了HL-60细胞的分化机制。这一传递过程一旦起始,HL-60 白血病细胞的增殖速度减慢,亦即进入DNA合成期的HL-60细胞数目减少,最终导致对DNA合 成期特异性的抗代谢剂Ara-C的不敏感,表现为对Ara-C细胞毒作用的负性影响。另外,小 剂量Ara-C对HL-60细胞的作用是诱导该细胞向单核巨噬细胞分化,从而抑制HL-60细胞的 增殖。可见,一旦4-MH诱导HL-60向粒细胞分化的机制被启动,即能对抗Ara-C诱导HL-6 0向单核巨噬系分化而引起细胞增殖的抑制效应。这也可能是4-MH对Ara-C细胞毒作用负性 影响的机制之一。
, 百拇医药
基金项目:国家自然科学基金资助项目(39170323)
作者简介:何群(1957-),男副教授,博士
参考文献:
[1]Shimkin MB, Bierman HR, Low-Beer BVA, et al. Histam ine and myelogenous leukemia[J]. Cancer, 1951,4:570-578.
[2]Thiersch JB. Lymphocytic leukemia and blood histamine[J]. Aust J Exp Biol Med Sci, 1947,25:79-82.
[3]Gespach C, Saal F, Cost H, et al. Identification and characterization of surface receptors for histamine in the human promyelocytic leukemia line HL-60[J]. Mol Pharmacol, 1982,22:547-553.
, http://www.100md.com
[4]Arnaez E. Effect of purification, theophylline and sodium fluoride on his tamine release produced by antineoplastic drugs on rat mast cells[J]. Biochem Pharmacol, 1992,44(3):533-538.
[5]Botara LM. Non-immunological release of histamine from rat mast cells el icited by antineoplastic agents[J]. Cancer Chemother Pharmacol, 1992,29(6):495 -498.
[6]Beaven MA. Factors regulating availability of histamine at tissue recepto rs. In: Genellin CR, Parsons ME (ed). Pharmacology of Histamine Receptors[M]. Bristol Wright, 1982:1-32.
, 百拇医药
[7]Chew CS, Hersey SJ, Sachs G, et al. Histamine responsiveness of isola ted gastric glands[J]. Am J Physiol, 1980,238:G312-G320.
[8]Soll AH, Wollin A. Histamine and cyclic AMP in isolated canine parietal c ells[J]. Am J Physiol, 1979,237:E444-E450.
[9]Wollin A, Soll AH, Samloff IM. Actions of histamine, secretin, and PGE2 on cyclinc AMP production by isolated canine fundic mucosal cells[J]. Am J Ph ysiol, 1979,237:E437-E443.
, 百拇医药
[10]Kalinyak KA, Sawutz DG, Lampkin BC, et al. Effect of dimapri t on growth and differentiation of human promelocytic cell line HL-60[J]. Lif e Science, 1985,36:1909-1916.
[11]Tasaka K, Nakaya N, Nonaka T. Effect of histamine, granulocyte colony-s timulating factor and db-cAMP on the diferentiation of HL-60 cells[J]. Agents Actions, 1990,30(1/2):240-242.
[12]Ryan WL, and Heidrick ML. Cellular cAMP and cell proliferation and differentiation[J]. Adv Cyclic Nucleotide Res, 1974,4:80-116.
收稿日期:1999-10-15, 百拇医药