核酶对膀胱癌细胞系多药耐药性的逆转研究
作者:何斌 金锡御 杨唐俊 金欢胜 王祥卫 刘素英 曾毅
单位:何斌(第三军医大学:附属新桥医院泌尿外科,重庆 400037);金锡御(附属西南医院泌尿外科,重庆 400038);杨唐俊(第三军医大学:附属新桥医院泌尿外科,重庆 400037);金欢胜(第三军医大学:附属新桥医院泌尿外科,重庆 400037);王祥卫(第三军医大学:附属新桥医院泌尿外科,重庆 400037)
关键词:核酶;多药耐药;肿瘤
第三军医大学学报000116
提要 目的:探讨核酶对膀胱癌多药耐药性的逆转效应。方法:设计针对mdr1mRNA1959位GUC的“锤头状”(Hammerhead)核酶(Ribozyme1,RZ1)基因,定点克隆于逆转录病毒载体pLXSN的BamHI和EcoRI位点上,重组出带有核酶基因的逆转录病毒质粒pLXSN-RZ1。应用脂质体DoTap将pLXSN-RZ1导入到耐药的人膀胱癌细胞系BHA-60细胞中。结果:导入pLXSN-RZ1的细胞系耐药性显著降低,RT-PCR结果显示,细胞内mdr1mRNA显著减少。结论:本研究中设计的核酶能明显逆转膀胱癌细胞系多药耐药性。
, 百拇医药
中图法分类号 R73-361;R737.14 文献标识码 A
文章编号:1000-5404(2000)01-0053-04
Reversal of multi-drug resistance of bladder cancer cell line with hammerhead ribozyme
HE Bin,JIN Xi-yu,YANG Tang-jun,JIN Huan-sheng,WANG Xiang-wei,LIU Su-ying,ZEN Yi
(Department of Urology,Xinqiao Hospital,Third Military Medical University,Chongqing 400037)
Abstract Objective:To explore the effects of ribozyme on the reversal of multi-drug resistance of bladder cancer.Methods:A hammerhead ribozyme designed to cleave the GUC sequence at codon 1959 of mdr1 mRNA was recombined to retroviral vector pLXSN named as pLXSN-RZ1.The recombinant retroviral vector pLXSN-RZ1 was transfected into the multi-drug resistant bladder cancer cell line BHA-60 with liposome DoTap.Results:The transfected cell line showed significant decline of mdr1 mRNA level as revealed by RT-PCR and decrease of multi-drug resistance.Conclusion:The designed ribozyme is an effective tool for multi-drug resistance reversal of bladder cancer.
, 百拇医药
Key words ribozyme; multi-drug resistance; tumor
肿瘤细胞的多药耐药性(Multidrug resistance,MDR)是影响肿瘤化疗效果的重要因素,我们曾应用体外转录mdr1 mRNA的方法证明核酶能切割mdr1 mRNA[1],但是,由于细胞内mdr1 mRNA较体外转录的mdr1 mRNA长,结构也复杂得多,尚不能肯定所设计的核酶也能在细胞内切割mdr1 mRNA,所以,我们将带有核酶(RZ1)基因的重组逆转录病毒质粒导入到耐药的人膀胱癌细胞系BHA-60细胞中,检测所设计的核酶能否在细胞内切割mdr1 mRNA,观察它们对MDR的逆转效应。
1 材料和方法
1.1 细胞模型的建立
1.1.1 BIU-87 人膀胱癌移行上皮细胞系,引自北京医科大学泌尿外科研究所[2]。该细胞取材前及建株过程未接触任何抗癌药物。
, http://www.100md.com
1.1.2 BHA-60细胞 为本实验室应用转基因方法建立的多药耐药细胞系[3]。
1.2 主要试剂
质粒pLXSN:美国Miller教授惠赠,为逆转录病毒载体,在其多克隆位点上游含5’-LTR,在其多克隆位点下游含SV-40启动子和Neo基因。脂质体(DoTap)、TriPuretmRNA提取试剂盒购自德国Boehringer Mannheim公司。G418:美国Gibercol BRL公司产品,用20mmol/L的HEPES稀释成100μg/ml,0.2μm过滤器过滤除菌,分装后保存于-20℃备用。
1.3 方法
1.3.1 细胞培养 细胞置于37℃,饱和湿度,含5%CO2的孵箱中培养,培养液为含有10%新生小牛血清的RPMI1640。
, 百拇医药
1.3.2 核酶逆转录病毒载体的构建 根据计算机模拟mdr1mRNA二级结构,设计并合成核酶基因。质粒pLXSN经BamHI和EcoRI双酶切,在T4DNA连接酶作用下完成连接反应,导入JM109大肠杆菌,筛选出重组克隆。
1.3.3 重组逆转录病毒质粒pLXSN-RZ1对耐药细胞BHA-60的转染 按DoTap说明书操作。加入G418(终浓度为800μg/ml)选择培养,定期更换新鲜培养液,共选择培养14~16d,长出肉眼可见克隆。该细胞系命名为BHA-RZ1。
1.3.4 细胞对药物(阿霉素ADM、秋水仙素COL)半数抑制量(IC50)的测定 按文献[4]报道用MTT法测定。
LgIC50=∑(Xi+Xi+1)(Pi+1-Pi)/2
, 百拇医药
i为组号,Xi+Xi+1为相邻两组对数剂量之和,Pi+1-Pi为相邻两组抑制率之差。
1.3.5 RT-PCR检测细胞内mdr1 mRNA的表达量 按文献[5]进行。
1.4 统计学处理
取5次试验的平均值,所有数据以 表示,两个样本比较用t检验。
表示,两个样本比较用t检验。
2 结果
2.1 重组逆转录病毒载体pLXSN-RZ1的酶切鉴定
RZ1基因与pLXSN载体连接混合物,常规CaCl2方法导入大肠杆菌JM109,得到2个转化子,提取质粒。经BamHI和EcoRI各酶切6h,然后加入等体积的甲酰胺,55℃×5min,8%PAGE-8M尿素,电泳结果见图1。双酶切后的片段长度为48bp。该逆转录病毒载体命名为pLXSN-RZ1。
, http://www.100md.com
图1 重组逆转录质粒pLXSN-RZ1的酶切分析(8%-PAGE)
Fig1 Restrictive digestion analysis of pLXSN-RZ1
1:pLXSN-RZ1+BamH I+EcoR I
2:pGEM-7Zf(+)/Hae Ⅲ marker
2.2 重组逆转录病毒质粒pLXSN-RZ1对BHA-60细胞的转染
加入DoTap及DNA混合液孵育后,未见细胞内出现异常颗粒或空泡化。加入G418后第2天即出现大量细胞死亡,第7天可见个别区域细胞呈岛状生长,细胞岛处细胞呈增生象,第11天散在的细胞几乎全部死亡(对照组细胞也全部死亡),细胞岛处细胞密度进一步增高。第14天时G418减少为600μg/ml,继续维持2d,然后G418减少为400μg/ml,维持1d后停用,说明pLXSN-RZ1已转染到BHA-60细胞内,该细胞命名为BHA-RZ1。
, http://www.100md.com
2.3 细胞系多药耐药性的测定
2.3.1 细胞对ADM的半数抑制量(IC50) 图2显示各细胞对ADM的IC50值。BHA-RZ1与BHA-60细胞比较显著下降(P<0.05),但高于BIU-87细胞的IC50值。
图2 细胞对ADM的IC50值
Fig2 Value of cell IC50 to ADM
2.3.2 细胞对COL的半数抑制量(IC50) 图3显示各细胞对COL的IC50值,BHA-60是BIU-87细胞的5.3倍(P<0.01),BHA-RZ1较BHA-60细胞显著下降(P<0.01)。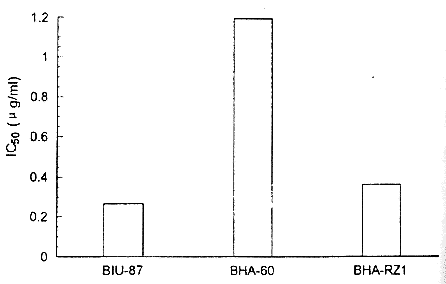
, http://www.100md.com
图3 细胞对COL的IC50值
Fig3 Value of cell IC50 to COL
2.4 RT-PCR检测细胞内mdr1mRNA表达
图4显示不同细胞在相同条件下RT-PCR的结果,β-actin作为内对照,在总RNA相同量的条件下β-actin的扩增条带基本相同(长度为587bp),mdr1157bp条带出现明显差异,以BHA-60细胞扩增条带最为明显,BHA-RZ1的扩增条带较BHA-60细胞弱。
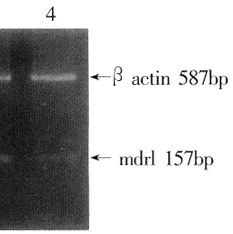
图4 不同细胞RT-PCR结果(2%琼脂糖凝胶)
, 百拇医药
Fig4 Agarose gel analysis of RT-PCR products for mdrl mRNA
1:pGEM-7zf(+)/Hae Ⅱ marker
2:BIU-87 cells
3:BHA-60 cells
4:BHA-RZ1 cells
3 讨论
MDR的发生机制较多,目前认为P-GP是形成MDR的最主要机制。因此,有关MDR的逆转研究也主要集中于对这一机制上。最早人们试图用药物来逆转MDR,Tsuruo[6]用非细胞抑制剂量的异博定(Verapemil,VPL)能明显降低肿瘤细胞对长春新碱(Vincristine,VCR)的耐药性。尽管很多药物都有不同程度的逆转MDR作用,但是这些药物均只是在较高浓度条件下才能发挥作用,由于毒副作用,临床上不可能达到如此高的血药浓度,使应用药物逆转MDR受到限制。随着P-GP机制的进一步明确以及mdr1基因的成功克隆,使得用转基因方法逆转MDR成为可能。Elsa等[7]报道,化疗药物Rhadamine123(R-123)在正常人肾系膜细胞(Human mersangial cell,HMC)中的半衰期为(25±3)s,将人工合成的mdr1mRNA反义寡核苷酸(aODN)20μg/ml与HMC共同孵育3d,R-123在HMC中的半衰期延长达(304±53)s,aODN显著地减少了P-GP在细胞膜上的表达量。
, 百拇医药
近年来,核酶用于基因治疗已取得很大进展,特别是在AIDS研究中的成果更是让人们对基因治疗的前景充满信心。核酶用于MDR的逆转研究近年来才有报道。Kobayashi[8]合成两个核酶基因,分别切割mdr1 mRNA 196位和179位密码子,将切割mdr1 mRNA 196位密码子的核酶构建于pHβAPr-1 neo载体上,电穿孔法导入到耐药的人急性淋巴母细胞白血病细胞系(Human acute lymphoblastic leukemia cell line)MOLT-3/TMQ800中,转染核酶后MOLT-3/TMQ800对VCR的耐药性由原来的700倍(与其母细胞MOLT-3比较)下降至20~30倍。我们应用体外转录mdr1 mRNA等方法也证明,在无细胞环境下,本实验室设计的针对mdr1 mRNA1959位GUC的RZ1对mdr1 mRNA的切割达90%[1]。本研究进一步将RZ1基因构建于逆转逆转录病毒载体上,然后再导入到MDR细胞系BHA-60中,多药耐药性测定结果表明RZ1能显著逆转BHA-60细胞的耐药性。RT-PCR结果也显示,导入RZ1基因的细胞mdr1 mRNA水平较母细胞BHA-60细胞低,说明本研究中所构建的核酶基因能明显逆转膀胱癌细胞系的MDR。
, 百拇医药
但是,本研究所构建的核酶的逆转作用并不完全,我们认为可能与下列因素有关:①核酶与mdr1 mRNA比例不平衡。体外切割实验表明核酶与靶RNA比例是影响核酶切割活性的因素之一[9],mdr1 mRNA在BHA-60细胞中处于高表达状态,而直接用脂质体导入的核酶基因受限制,细胞内表达的核酶不足以完全切割mdr1 mRNA,因而转染核酶基因后的细胞仍具有一定的耐药性[10]。②细胞内mdr1mRNA二、三级结构的变化影响核酶与靶RNA的结合,导致核酶活性下降。因此,如何更有效地应用核酶达到完全逆转MDR的作用,尚有待于进一步探讨。
基金项目:国家自然科学基金资助项目(39670824)
作者简介:何斌(1964.3),男,安徽省贵池市人,博士,副主任医师,副教授,主要从事膀胱癌的基因治疗方面的研究,发表论文17篇。电话:(023)68755624
, 百拇医药 作者单位:刘素英(第三军医大学:附属新桥医院泌尿外科,重庆 400037)
曾毅(第三军医大学:附属新桥医院泌尿外科,重庆 400037)
参考文献
[1]何斌,金锡御,杨唐俊,等.核酶对mdr1mRNA的体外切割[J].中华泌尿外科杂志,1998,19(4):195-198.
[2]俞莉章,黄雅丽,顾方六,等.人膀胱癌细胞系BIU87的建立及其生物学特征[J].中华泌尿外科杂志,1989,10(3):131-133.
[3]何斌,金锡御,杨唐俊,等.转基因方法建立一种新的多药耐药细胞系[J].中华泌尿外科杂志,1999,20(7):403-405.
[4]陈鹏,刘叙仪,赫复生.耐顺铂人肺腺癌细胞系A549/cDDP的建立及耐药机制[J].中国肿瘤临床,1995,22(8):582-587.
, 百拇医药
[5]Noonan K E,Beck D,Holzmayer T A.Quantitative analysis of MDR1(multidrug resistance) gene expression in human tumors by polymerase chain reaction[J].Proc Natl Acad Sci USA,1990,87(18):7160-7164.
[6]Tsuruo T,Lida H,Tsukagoshi S,et al.Overcoming of VCR resistance in P338 leukemia in vivo and in vitro through enhanced cytotoxicity of VCR and VDS by VPL[J].Cancer Res,1981,41(5):1967-1972.
[7]Elsa B R,Ernest S.Expression and function of P-glycoprotein in human mesangial cells[J].Am J Physiol,1994,267(5):C1351-1358.
, http://www.100md.com
[8]Kobayashi H,Dorai T,Holland J F,et al.Reversals of drug sensitivity in multidrug-resistant tumor cells by an MDR1(PGY1) ribozyme[J].Cancer Res,1994,54(5):1271-1275.
[9]Bertrand E,Pictet R,Grange T,et al.Can hammerhead ribozymes be efficient tools to inactivate gene function[J]? Nucleic Acids Res,1994,22(3):293-300.
[10]Scanlon K J,Ishida H,Kashani-Sabet M.Ribozyme-mediated reversal of the multidrug-resistant phenotype(drug resistance/ovarian carcinoma)[J].Proc Natl Acad Sci USA,1994,91(23):11123-11127.
收稿日期:1999-03-15
修回日期:1999-09-07, 百拇医药
单位:何斌(第三军医大学:附属新桥医院泌尿外科,重庆 400037);金锡御(附属西南医院泌尿外科,重庆 400038);杨唐俊(第三军医大学:附属新桥医院泌尿外科,重庆 400037);金欢胜(第三军医大学:附属新桥医院泌尿外科,重庆 400037);王祥卫(第三军医大学:附属新桥医院泌尿外科,重庆 400037)
关键词:核酶;多药耐药;肿瘤
第三军医大学学报000116
提要 目的:探讨核酶对膀胱癌多药耐药性的逆转效应。方法:设计针对mdr1mRNA1959位GUC的“锤头状”(Hammerhead)核酶(Ribozyme1,RZ1)基因,定点克隆于逆转录病毒载体pLXSN的BamHI和EcoRI位点上,重组出带有核酶基因的逆转录病毒质粒pLXSN-RZ1。应用脂质体DoTap将pLXSN-RZ1导入到耐药的人膀胱癌细胞系BHA-60细胞中。结果:导入pLXSN-RZ1的细胞系耐药性显著降低,RT-PCR结果显示,细胞内mdr1mRNA显著减少。结论:本研究中设计的核酶能明显逆转膀胱癌细胞系多药耐药性。
, 百拇医药
中图法分类号 R73-361;R737.14 文献标识码 A
文章编号:1000-5404(2000)01-0053-04
Reversal of multi-drug resistance of bladder cancer cell line with hammerhead ribozyme
HE Bin,JIN Xi-yu,YANG Tang-jun,JIN Huan-sheng,WANG Xiang-wei,LIU Su-ying,ZEN Yi
(Department of Urology,Xinqiao Hospital,Third Military Medical University,Chongqing 400037)
Abstract Objective:To explore the effects of ribozyme on the reversal of multi-drug resistance of bladder cancer.Methods:A hammerhead ribozyme designed to cleave the GUC sequence at codon 1959 of mdr1 mRNA was recombined to retroviral vector pLXSN named as pLXSN-RZ1.The recombinant retroviral vector pLXSN-RZ1 was transfected into the multi-drug resistant bladder cancer cell line BHA-60 with liposome DoTap.Results:The transfected cell line showed significant decline of mdr1 mRNA level as revealed by RT-PCR and decrease of multi-drug resistance.Conclusion:The designed ribozyme is an effective tool for multi-drug resistance reversal of bladder cancer.
, 百拇医药
Key words ribozyme; multi-drug resistance; tumor
肿瘤细胞的多药耐药性(Multidrug resistance,MDR)是影响肿瘤化疗效果的重要因素,我们曾应用体外转录mdr1 mRNA的方法证明核酶能切割mdr1 mRNA[1],但是,由于细胞内mdr1 mRNA较体外转录的mdr1 mRNA长,结构也复杂得多,尚不能肯定所设计的核酶也能在细胞内切割mdr1 mRNA,所以,我们将带有核酶(RZ1)基因的重组逆转录病毒质粒导入到耐药的人膀胱癌细胞系BHA-60细胞中,检测所设计的核酶能否在细胞内切割mdr1 mRNA,观察它们对MDR的逆转效应。
1 材料和方法
1.1 细胞模型的建立
1.1.1 BIU-87 人膀胱癌移行上皮细胞系,引自北京医科大学泌尿外科研究所[2]。该细胞取材前及建株过程未接触任何抗癌药物。
, http://www.100md.com
1.1.2 BHA-60细胞 为本实验室应用转基因方法建立的多药耐药细胞系[3]。
1.2 主要试剂
质粒pLXSN:美国Miller教授惠赠,为逆转录病毒载体,在其多克隆位点上游含5’-LTR,在其多克隆位点下游含SV-40启动子和Neo基因。脂质体(DoTap)、TriPuretmRNA提取试剂盒购自德国Boehringer Mannheim公司。G418:美国Gibercol BRL公司产品,用20mmol/L的HEPES稀释成100μg/ml,0.2μm过滤器过滤除菌,分装后保存于-20℃备用。
1.3 方法
1.3.1 细胞培养 细胞置于37℃,饱和湿度,含5%CO2的孵箱中培养,培养液为含有10%新生小牛血清的RPMI1640。
, 百拇医药
1.3.2 核酶逆转录病毒载体的构建 根据计算机模拟mdr1mRNA二级结构,设计并合成核酶基因。质粒pLXSN经BamHI和EcoRI双酶切,在T4DNA连接酶作用下完成连接反应,导入JM109大肠杆菌,筛选出重组克隆。
1.3.3 重组逆转录病毒质粒pLXSN-RZ1对耐药细胞BHA-60的转染 按DoTap说明书操作。加入G418(终浓度为800μg/ml)选择培养,定期更换新鲜培养液,共选择培养14~16d,长出肉眼可见克隆。该细胞系命名为BHA-RZ1。
1.3.4 细胞对药物(阿霉素ADM、秋水仙素COL)半数抑制量(IC50)的测定 按文献[4]报道用MTT法测定。

LgIC50=∑(Xi+Xi+1)(Pi+1-Pi)/2
, 百拇医药
i为组号,Xi+Xi+1为相邻两组对数剂量之和,Pi+1-Pi为相邻两组抑制率之差。
1.3.5 RT-PCR检测细胞内mdr1 mRNA的表达量 按文献[5]进行。
1.4 统计学处理
取5次试验的平均值,所有数据以
 表示,两个样本比较用t检验。
表示,两个样本比较用t检验。2 结果
2.1 重组逆转录病毒载体pLXSN-RZ1的酶切鉴定
RZ1基因与pLXSN载体连接混合物,常规CaCl2方法导入大肠杆菌JM109,得到2个转化子,提取质粒。经BamHI和EcoRI各酶切6h,然后加入等体积的甲酰胺,55℃×5min,8%PAGE-8M尿素,电泳结果见图1。双酶切后的片段长度为48bp。该逆转录病毒载体命名为pLXSN-RZ1。

, http://www.100md.com
图1 重组逆转录质粒pLXSN-RZ1的酶切分析(8%-PAGE)
Fig1 Restrictive digestion analysis of pLXSN-RZ1
1:pLXSN-RZ1+BamH I+EcoR I
2:pGEM-7Zf(+)/Hae Ⅲ marker
2.2 重组逆转录病毒质粒pLXSN-RZ1对BHA-60细胞的转染
加入DoTap及DNA混合液孵育后,未见细胞内出现异常颗粒或空泡化。加入G418后第2天即出现大量细胞死亡,第7天可见个别区域细胞呈岛状生长,细胞岛处细胞呈增生象,第11天散在的细胞几乎全部死亡(对照组细胞也全部死亡),细胞岛处细胞密度进一步增高。第14天时G418减少为600μg/ml,继续维持2d,然后G418减少为400μg/ml,维持1d后停用,说明pLXSN-RZ1已转染到BHA-60细胞内,该细胞命名为BHA-RZ1。
, http://www.100md.com
2.3 细胞系多药耐药性的测定
2.3.1 细胞对ADM的半数抑制量(IC50) 图2显示各细胞对ADM的IC50值。BHA-RZ1与BHA-60细胞比较显著下降(P<0.05),但高于BIU-87细胞的IC50值。

图2 细胞对ADM的IC50值
Fig2 Value of cell IC50 to ADM
2.3.2 细胞对COL的半数抑制量(IC50) 图3显示各细胞对COL的IC50值,BHA-60是BIU-87细胞的5.3倍(P<0.01),BHA-RZ1较BHA-60细胞显著下降(P<0.01)。

, http://www.100md.com
图3 细胞对COL的IC50值
Fig3 Value of cell IC50 to COL
2.4 RT-PCR检测细胞内mdr1mRNA表达
图4显示不同细胞在相同条件下RT-PCR的结果,β-actin作为内对照,在总RNA相同量的条件下β-actin的扩增条带基本相同(长度为587bp),mdr1157bp条带出现明显差异,以BHA-60细胞扩增条带最为明显,BHA-RZ1的扩增条带较BHA-60细胞弱。


图4 不同细胞RT-PCR结果(2%琼脂糖凝胶)
, 百拇医药
Fig4 Agarose gel analysis of RT-PCR products for mdrl mRNA
1:pGEM-7zf(+)/Hae Ⅱ marker
2:BIU-87 cells
3:BHA-60 cells
4:BHA-RZ1 cells
3 讨论
MDR的发生机制较多,目前认为P-GP是形成MDR的最主要机制。因此,有关MDR的逆转研究也主要集中于对这一机制上。最早人们试图用药物来逆转MDR,Tsuruo[6]用非细胞抑制剂量的异博定(Verapemil,VPL)能明显降低肿瘤细胞对长春新碱(Vincristine,VCR)的耐药性。尽管很多药物都有不同程度的逆转MDR作用,但是这些药物均只是在较高浓度条件下才能发挥作用,由于毒副作用,临床上不可能达到如此高的血药浓度,使应用药物逆转MDR受到限制。随着P-GP机制的进一步明确以及mdr1基因的成功克隆,使得用转基因方法逆转MDR成为可能。Elsa等[7]报道,化疗药物Rhadamine123(R-123)在正常人肾系膜细胞(Human mersangial cell,HMC)中的半衰期为(25±3)s,将人工合成的mdr1mRNA反义寡核苷酸(aODN)20μg/ml与HMC共同孵育3d,R-123在HMC中的半衰期延长达(304±53)s,aODN显著地减少了P-GP在细胞膜上的表达量。
, 百拇医药
近年来,核酶用于基因治疗已取得很大进展,特别是在AIDS研究中的成果更是让人们对基因治疗的前景充满信心。核酶用于MDR的逆转研究近年来才有报道。Kobayashi[8]合成两个核酶基因,分别切割mdr1 mRNA 196位和179位密码子,将切割mdr1 mRNA 196位密码子的核酶构建于pHβAPr-1 neo载体上,电穿孔法导入到耐药的人急性淋巴母细胞白血病细胞系(Human acute lymphoblastic leukemia cell line)MOLT-3/TMQ800中,转染核酶后MOLT-3/TMQ800对VCR的耐药性由原来的700倍(与其母细胞MOLT-3比较)下降至20~30倍。我们应用体外转录mdr1 mRNA等方法也证明,在无细胞环境下,本实验室设计的针对mdr1 mRNA1959位GUC的RZ1对mdr1 mRNA的切割达90%[1]。本研究进一步将RZ1基因构建于逆转逆转录病毒载体上,然后再导入到MDR细胞系BHA-60中,多药耐药性测定结果表明RZ1能显著逆转BHA-60细胞的耐药性。RT-PCR结果也显示,导入RZ1基因的细胞mdr1 mRNA水平较母细胞BHA-60细胞低,说明本研究中所构建的核酶基因能明显逆转膀胱癌细胞系的MDR。
, 百拇医药
但是,本研究所构建的核酶的逆转作用并不完全,我们认为可能与下列因素有关:①核酶与mdr1 mRNA比例不平衡。体外切割实验表明核酶与靶RNA比例是影响核酶切割活性的因素之一[9],mdr1 mRNA在BHA-60细胞中处于高表达状态,而直接用脂质体导入的核酶基因受限制,细胞内表达的核酶不足以完全切割mdr1 mRNA,因而转染核酶基因后的细胞仍具有一定的耐药性[10]。②细胞内mdr1mRNA二、三级结构的变化影响核酶与靶RNA的结合,导致核酶活性下降。因此,如何更有效地应用核酶达到完全逆转MDR的作用,尚有待于进一步探讨。
基金项目:国家自然科学基金资助项目(39670824)
作者简介:何斌(1964.3),男,安徽省贵池市人,博士,副主任医师,副教授,主要从事膀胱癌的基因治疗方面的研究,发表论文17篇。电话:(023)68755624
, 百拇医药 作者单位:刘素英(第三军医大学:附属新桥医院泌尿外科,重庆 400037)
曾毅(第三军医大学:附属新桥医院泌尿外科,重庆 400037)
参考文献
[1]何斌,金锡御,杨唐俊,等.核酶对mdr1mRNA的体外切割[J].中华泌尿外科杂志,1998,19(4):195-198.
[2]俞莉章,黄雅丽,顾方六,等.人膀胱癌细胞系BIU87的建立及其生物学特征[J].中华泌尿外科杂志,1989,10(3):131-133.
[3]何斌,金锡御,杨唐俊,等.转基因方法建立一种新的多药耐药细胞系[J].中华泌尿外科杂志,1999,20(7):403-405.
[4]陈鹏,刘叙仪,赫复生.耐顺铂人肺腺癌细胞系A549/cDDP的建立及耐药机制[J].中国肿瘤临床,1995,22(8):582-587.
, 百拇医药
[5]Noonan K E,Beck D,Holzmayer T A.Quantitative analysis of MDR1(multidrug resistance) gene expression in human tumors by polymerase chain reaction[J].Proc Natl Acad Sci USA,1990,87(18):7160-7164.
[6]Tsuruo T,Lida H,Tsukagoshi S,et al.Overcoming of VCR resistance in P338 leukemia in vivo and in vitro through enhanced cytotoxicity of VCR and VDS by VPL[J].Cancer Res,1981,41(5):1967-1972.
[7]Elsa B R,Ernest S.Expression and function of P-glycoprotein in human mesangial cells[J].Am J Physiol,1994,267(5):C1351-1358.
, http://www.100md.com
[8]Kobayashi H,Dorai T,Holland J F,et al.Reversals of drug sensitivity in multidrug-resistant tumor cells by an MDR1(PGY1) ribozyme[J].Cancer Res,1994,54(5):1271-1275.
[9]Bertrand E,Pictet R,Grange T,et al.Can hammerhead ribozymes be efficient tools to inactivate gene function[J]? Nucleic Acids Res,1994,22(3):293-300.
[10]Scanlon K J,Ishida H,Kashani-Sabet M.Ribozyme-mediated reversal of the multidrug-resistant phenotype(drug resistance/ovarian carcinoma)[J].Proc Natl Acad Sci USA,1994,91(23):11123-11127.
收稿日期:1999-03-15
修回日期:1999-09-07, 百拇医药