血管平滑肌细胞对血啉甲醚吸收特性的研究
作者:顾瑛 刘凡光 富秋涛 潘玉明
单位:解放军总医院激光医学科 北京市,100853
关键词:血管平滑肌细胞;血啉甲醚;血卟啉衍生物
中国激光医学杂志000101摘 要:目的:探讨血管平滑肌细胞(SMC)对光敏剂血啉甲醚(HMME)的吸收特点及影响因素,为进一步建立动脉粥样硬化和血管成形术后再狭窄的光动力治疗方法提供实验依据。方法:培养兔主动脉SMC并接种至96孔培养板。首先,培养液中分别加入HMME和血卟啉衍生物(HpD),浓度分别为20、40、60、80、100 μg/ml,孵育时间分别为0、15、30、60、120、180、240 min,采用荧光分析法测定细胞内光敏剂含量,绘制SMC吸收光敏剂的浓度-含量和时间-含量关系曲线。其次,将SMC分成血小板生长因子组、胎牛血清组和对照组,前两组培养液中分别加入10 ng/ml血小板生长因子或10%胎牛血清,12 h后进行光敏剂含量测定、细胞计数,并用MTT比色法测定琥珀酸脱氢酶活性。结果:SMC对HMME和HpD的吸收量随孵育浓度的增高和孵育时间的延长而增加,但HMME的曲线上升斜率明显大于HpD。SMC对HMME的吸收量可较HpD高130%~170%(P<0.05)。血小板生长因子或胎牛血清作用12 h后,两组SMC数量与对照组比较差异均无显著性(P>0.05),但SMC琥珀酸脱氢酶活性血小板生长因子组较对照组增加62.1%(P<0.05),胎牛血清组较对照组增加119.4%(P<0.05);同时,SMC吸收HMME的浓度-含量和时间-含量关系曲线均明显上移,其关系为胎牛血清组>血小板生长因子组>对照组(P<0.05)。结论:SMC对HMME的摄取量呈孵育浓度和孵育时间依赖性,并显著高于HpD;SMC代谢状态影响其对IMME的吸收。
, 百拇医药
分类号:R544.4;Q445 文献标识码:A
文章编号:1003-9430(2000)02-0001-04
Absorption Characteristics of HMME by Vascular Smooth
Muscle Cells
GU Ying, LIU Fanguang, FU Qiutao, PAN Yuming
(Department of Laser Medicine, Chinese PLA General Hospital, Beijing 100853, China)
ABSTRACT:Objective To investigate the absorption characteristics of hematoporphyrin monomethyl ether (HMME) by vascular smooth muscle cells (SMC) and to provide a basis for suitable photodynamic therapy (PDT) for atherosclerosis and restenosis.Methods:The SMC from rabbit normal abdominal aorta were cultured and divided into three groups. First, the absorption characteristics of HMME and hematoporphyrin derivative(HpD) in several concentrations and for different incubation time in SMC were investigated by using fluorospectrophotometer. Secondly, SMC were incubated in serum-free medium, 10 ng/ml PDGF-BB or 10% fetal bovine serum (FBS) respectively for 12 hours, and the activity status of SMC, cell number and content of HMME in SMC were investigated.Results:The absorption curves of HMME and HpD by SMC were similar, but the content of HMME in SMC was significantly higher than that of HpD (P<0.05). The SMC number did not increase obviously after incubation with growth factors (P>0.05), but the activity status of SMC was 62.1% higher in PDGF group and 119.4% higher in FBS group than that in control group(P<0.05). The curves of HMME uptake in PDGF group and in FBS group ascended significantly (P<0.05).Conclusions:The content of HMME in SMC is dose-dependent and time-dependent, and is significantly higher than that of HpD. The HMME uptake is significantly affected by the metabolic status of SMC.
, 百拇医药
Key words:Vascular smooth muscle cells; Hematoporphyrin monomethyl ether; Hematoporphyrin derivative▲
血啉甲醚(hematoporphyrin monomethyl ether, HMME)是国内研制开发的新型光敏剂,其临床光动力疗效显著高于血卟啉衍生物(hematoporphyrin derivative, HpD),且毒副作用低,具有良好的临床应用前景[1]。本研究中我们观察体外培养的兔血管平滑肌细胞(SMC)对HMME的吸收特点,了解HMME孵育浓度、孵育时间以及SMC代谢状态等因素的影响作用,并与HpD进行比较,旨在为建立用于动脉粥样硬化和血管成形术后再狭窄的光动力疗法(photodynamic therapy, PDT)提供实验依据。
材料与方法
, 百拇医药 一、材料和仪器
雄性新西兰兔,8~12周龄,解放军总医院医学动物实验中心提供;HMME,第二军医大学五二三药物研究室研制,规格10 mg/ml,批号980225;HpD,北京制药工业研究所生产,规格5 mg/ml,批号970423;血小板生长因子BB链(PDGF-BB),英国Peprotechec公司产品;胎牛血清(FBS),美国Sigma公司产品;日本岛津RF-540型荧光分光光度计;318MC型酶标仪,上海第三仪器有限公司生产。
二、细胞培养
兔经静脉注射空气处死,开胸取胸至腹段主动脉约12 cm,沿血管纵轴剪开,刮除内膜,取动脉中层剪成碎块后贴于细胞培养瓶底,加入含20%FBS的DMEM培养液,置于37℃、5% CO2孵箱内孵育,5天后换液,待10~12天后组织块周围形成“细胞晕”时传代,传代后用10%小牛血清培养。实验采用第4代细胞,接种于96孔细胞培养板中,种植密度为
, 百拇医药
5×103个/孔。
三、检测方法
1.SMC内光敏剂含量 采用荧光分析法测定细胞内光敏剂含量。PBS冲洗细胞3次,酶溶加低渗法裂解细胞。测定条件:激发波长395 nm,发射波长613 nm,由显示器直接读出最大荧光强度值。
2.SMC数量 采用细胞计数法确定SMC数量。倒置相差显微镜低倍镜下每孔随机取4个视野,计数全部细胞,结果取6孔平均值。
3.SMC代谢状态 采用MTT比色法测定SMC琥珀酸脱氢酶活性以反映其代谢状态。吸弃培养液,每孔加入MTT溶液(四唑盐5 mg/ml)20 μl,37℃继续培养4 h,吸弃上清液,每孔加入二甲基亚砜100 μl,振荡5 min,置酶标仪在吸收波长570 nm条件下测定各孔吸光度(A)值,取9孔平均值。
, http://www.100md.com
四、标准曲线的制备
用蒸馏水稀释HMME和HpD,终浓度分别为100、200、300、400、500、600、700、800、900 ng/ml,加入0.25%胰酶1 ml,使其液体成分与SMC的消化液相同。荧光分光光度计测定荧光强度,每个浓度点取双孔平均值,重复3次。以光敏剂浓度对平均荧光强度值进行线性回归。
五、HMME、HpD的浓度-含量关系曲线和时间-含量关系曲线的制备
SMC接种于培养板后继续孵育24 h,PBS冲洗,更换不含血清的DMEM液,暗室中加入HMME或HpD。制备浓度-含量关系曲线时,光敏剂的孵育浓度分别为20、40、60、80、100 μg/ml,孵育时间为60 min;制备时间-含量关系曲线时,光敏剂的浓度分别为60 μg/ml,孵育时间分别为0、15、30、60、120、180、240 min。荧光分光光度计测定荧光强度,每浓度点或时间点测定9孔,重复3次,取平均值。以HMME和HpD 的孵育浓度或孵育时间对SMC内光敏剂含量绘制曲线。
, http://www.100md.com
六、PDGF对SMC的处理
SMC接种于培养板后继续孵育8 h,待细胞贴壁后,换含2%小牛血清的DMEM液,培养48 h,使细胞进入G0期。将细胞分成PDGF组、FBS组和对照组3组。PDGF组的DMEM培养液中含2%小牛血清、10 ng/ml PDGF-BB;FBS组的培养液中含2%小牛血清、10%FBS;对照组的培养液中含2%小牛血清。继续培养12 h后进行细胞计数、SMC内琥珀酸脱氢酶活性和HMME含量测定(检测方法及HMME的孵育浓度、孵育时间同前)。 实验重复3次。
七、数据处理
数据以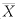 ±s表示。统计学处理采用SAS软件,作组间方差分析,P<0.05为差异有显著意义。
±s表示。统计学处理采用SAS软件,作组间方差分析,P<0.05为差异有显著意义。
, 百拇医药
结 果
一、HMME和HpD的标准曲线
HMME和HpD标准曲线见图1。HMME的回归方程:Y=9.1753X+1.6486,r=0.999;HpD的回归方程:Y=7.5623X-40.3443,r=0.999。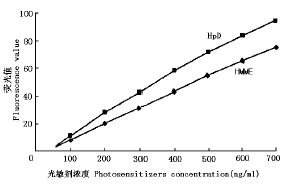
图1 HMME、HpD标准浓度曲线
Fig.1 Standard concentration curve of HMME and HpD
二、SMC吸收HMME和HpD的浓度-含量关系曲线和时间-含量关系曲线
, 百拇医药
曲线特点见图2和图3。SMC对HMME的吸收量显著高于HpD,在浓度-含量关系曲线的各浓度点上较HpD高136%~172%(P<0.05),在时间-含量关系曲线的各时间点上较HpD高133%~173%(P<0.05)。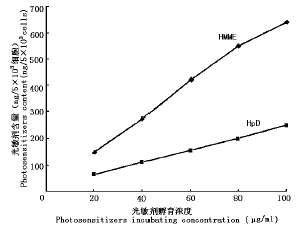
图2 SMC吸收HMME和HpD的浓度-含量关系曲线
Fig.2 Curves of relationship between content of photosensitizers in SMC and incubating concentration of photosensitizers
, http://www.100md.com
图3 SMC吸收HMME和HpD的时间-含量关系曲线
Fig.3 Curves of relationship between content of photosensitizers in SMC and incubating time of photosensitizers
三、PDGF对SMC数量和琥珀酸脱氢酶活性的影响
PDGF组、FBS组和对照组G0期SMC经12 h孵育,每孔细胞数量分别为1 466±80、1 469±92和1 463±83,组间差异无显著意义(P>0.05)。对照组琥珀酸脱氢酶活性为0.201±0.053(A值);PDGF组为0.326±0.053,较对照组高62.1%(P<0.05);FBS组为0.441±0.059,较对照组高119.4%(P<0.05)。
, http://www.100md.com 四、PDGF对SMC光敏剂吸收量的影响
PDGF作用后,SMC吸收HMME的浓度-含量关系曲线(图4)和时间-含量关系曲线(图5)均上移。
在浓度-含量关系曲线上,PDGF组和FBS组的细胞HMME含量在各浓度点上均显著高于对照组(P<0.05);在时间-含量关系曲线上,PDGF组和FBS组的细胞HMME含量在15 min以上各点时间均显著高于对照组(P<0.05);如果以HMME 60 μg/ml孵育60 min为例,PDGF组细胞HMME含量较对照组高36%,FBS组较对照组高57%。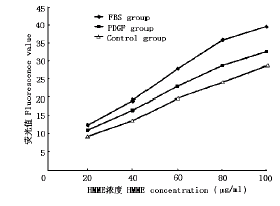
图4 PDGF对SMC吸收HMME的浓度-含量关系曲线的影响
, http://www.100md.com
Fig.4 Effect of growth factor on the relationship between content of HMME in SMC and incubating concentration of HMME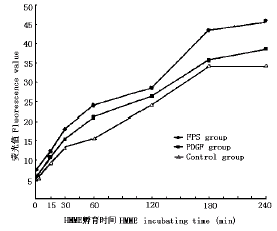
图5 PDGF对SMC吸收HMME的孵育时间-含量关系曲线的影响
Fig.5 Effect of growth factor on the relationship between content of HMME in SMC and incubating time of HMME
讨 论
, 百拇医药 一、SMC对HMME的吸收特点
HMME是一种单体卟啉,化学纯度达98%;HpD则是多种卟啉的混合物,含有血卟啉、原卟啉和二血卟啉醚等十多种化学成分[1]。在本研究中,HMME标准液的荧光生成量低于相同浓度的HpD,但HMME在SMC内含量却较HpD高出130%~170%。这表明HpD含有某些能发出较强荧光但不易被细胞摄取的成分,而作为单体卟啉的HMME更易被SMC吸收。
光敏剂孵育浓度和孵育时间直接决定着SMC对HMME和HpD的吸收量,对HMME的影响更为显著。以往的研究表明,HMME的血浆清除速率显著大于HpD,例如,静脉注射20 mg/kg HMME或HpD后0.5、1和3 h,血浆HMME与HpD浓度分别为4.23与27.44 μg/ml、1.87与13.12 μg/ml、0.66与3.03 μg/ml[2]。由于HMME血药浓度下降快及其细胞吸收量对孵育浓度、时间依赖程度高,给药剂量和静脉注射速度方面的细小差异就可能对在体SMC吸收HMME产生较大影响,有必要对此进行研究。
, 百拇医药
二、SMC代谢状态对吸收HMME的影响
本实验结果显示,SMC经PDGF或FBS等生长因子刺激后,在线粒体琥珀酸脱氢酶活性增强的同时,对HMME的吸收显著增加。这表明,SMC代谢状态影响其对HMME的吸收。Dartsch等[3]曾报道,体外培养的取自动脉粥样硬化斑块的SMC,对光敏剂的吸收量明显高于正常SMC,状态不同的SMC,对光敏剂的吸收能力有较大的差别。正常动脉壁的SMC为收缩表型,其功能是维持血管壁的张力;而动脉粥样硬化斑块和球囊损伤处的SMC为合成表型,功能发生很大的变化,除具有增殖和合成细胞外基质的能力外,还能通过自分泌和旁分泌产生多种生长因子[4]。由于合成表型SMC的代谢活性明显增高,细胞膜对外界物质的运输能力也相应增强。
血卟啉类光敏剂在血液中是与血浆膜脂蛋白结合而运输的,因此一般认为合成表型SMC吸收光敏剂能力的增强,主要与细胞膜的脂蛋白受体上调有关[5]。但在本实验中,HMME为游离状态,其跨膜运输显然与脂蛋白受体介导的内吞作用无关。说明可能存在多种机制,参与并影响合成表型SMC对光敏剂的吸收。
, 百拇医药
三、PDT与动脉粥样硬化和血管成形术后再狭窄
Spears等[6]在1983年首次报道,兔动脉粥样硬化斑块组织中HpD的含量明显高于正常动脉组织,提示PDT能用于治疗动脉粥样硬化和血管成形术后再狭窄。随后,有关研究报道日渐增多。现已发现,动脉粥样硬化斑块和球囊损伤处的SMC对苯并卟啉衍生物(BPD-MA)[7]、二血卟啉醚(DHE)[8]、5-氨基酮戊酸(ALA)[9]和酞青(PC)[10]等国外开发的新型光敏剂的摄取能力明显增强。光敏物质含量较正常动脉高2~5倍,并滞留较长时间,这就使得PDT能对病变SMC产生较好的选择性杀伤作用。研究显示,PDT能显著抑制损伤性血管内膜增殖,并能促进实验性动脉粥样斑块的消退。有关国产HMME与SMC的研究报道迄今还未见到。本研究结果提示,建立应用HMME为光敏剂的PDT方法,也能对增殖代谢状态异常的SMC产生理想的选择性杀伤作用。但由于本研究为体外实验,能否反映在体情况,有待进一步研究。■
, 百拇医药
基金项目:军队“九五”杰出人才基金资助项目(98J012)
作者简介:顾瑛(1959-),女,上海人,解放军总医院激光医学科主任、教授、主任医师、博士生导师,主要从事激光医学临床应用和应用基础研究。
参考文献:
[1] 许德余,陈文辉,张浩,等. 光动力治癌新药血卟啉单甲醚的研究[J]. 中国激光医学杂志,1993,2:3-7.
[2] 陈文辉,许德余. 血卟啉单甲醚在荷瘤小鼠体内的分布[M]. 第二军医大学学报,1990,11:118-122.
[3] Dartsch PC, Ischinger T, Betz E. Responses of cultured smooth muscle cells from human nonatherosclerotic arteries and primary stenosing lesions after photoradiation: implications for photodynamic therapy of vascular stenoses[J]. J Am Coll Cardiol, 1990, 15:1545-1550.
, http://www.100md.com
[4] 刘凡光,祝善俊,李天德. 血管成形术后平滑肌细胞增殖的机制[J]. 国外医学心血管疾病分册, 1997, 24:10-12.
[5] Tsuneyuki N, Louie AY, Aizawa k, et al. Selective targeting and photodynamic destruction of intimal hyperplasia by scavenger-receptor mediated protein-chlorite conjugstes[J]. J Cardiovas Surg, 1998, 39:709-715.
[6] Spears JR, Serur J, Shropshire D, et al. Fluorescence of experimental atheromatous plaques with hematoporphyrin derivative[J]. J Clin
, http://www.100md.com
Invest, 1983,71:395-399.
[7] Allison BA, Crespo MT, Jain AK, et al. Delivery of Benzoporphyrin deriative, a photosensitize, into atherosclerotic plaque of Watanable heritable hyperlipidemic rabbits and balloon-injured New Zealand rabbits[J]. Photochem Photobiol, 1997, 65:877-883.
[8] Johson MD, Fox JV, Hammond EM, et al. In vitro removal of photosensitized rabbit atherosclerotic plaque by dye laser irradiation[J]. ICALEO, 1987, 60:13-17.
, 百拇医药
[9] Nyamekye I, Anglin S, McEwan J, et al. Photodynamic therapy of normal and balloon-injured rat carotid arteries using 5-amino-levulinic acid[J]. Circulation, 1995, 91:417-425.
[10] LaMuraglia GM, Ortu P, Flotte TJ, et al. Chloroaluminum sulfonated phthalocyanine partitioning in normal and intimal hyperplastic artery in the rat[J]. Implications for photodynamic therapy. Am J Pathol, 1993, 142:1898-1905.
收稿日期:1999-09-06, 百拇医药
单位:解放军总医院激光医学科 北京市,100853
关键词:血管平滑肌细胞;血啉甲醚;血卟啉衍生物
中国激光医学杂志000101摘 要:目的:探讨血管平滑肌细胞(SMC)对光敏剂血啉甲醚(HMME)的吸收特点及影响因素,为进一步建立动脉粥样硬化和血管成形术后再狭窄的光动力治疗方法提供实验依据。方法:培养兔主动脉SMC并接种至96孔培养板。首先,培养液中分别加入HMME和血卟啉衍生物(HpD),浓度分别为20、40、60、80、100 μg/ml,孵育时间分别为0、15、30、60、120、180、240 min,采用荧光分析法测定细胞内光敏剂含量,绘制SMC吸收光敏剂的浓度-含量和时间-含量关系曲线。其次,将SMC分成血小板生长因子组、胎牛血清组和对照组,前两组培养液中分别加入10 ng/ml血小板生长因子或10%胎牛血清,12 h后进行光敏剂含量测定、细胞计数,并用MTT比色法测定琥珀酸脱氢酶活性。结果:SMC对HMME和HpD的吸收量随孵育浓度的增高和孵育时间的延长而增加,但HMME的曲线上升斜率明显大于HpD。SMC对HMME的吸收量可较HpD高130%~170%(P<0.05)。血小板生长因子或胎牛血清作用12 h后,两组SMC数量与对照组比较差异均无显著性(P>0.05),但SMC琥珀酸脱氢酶活性血小板生长因子组较对照组增加62.1%(P<0.05),胎牛血清组较对照组增加119.4%(P<0.05);同时,SMC吸收HMME的浓度-含量和时间-含量关系曲线均明显上移,其关系为胎牛血清组>血小板生长因子组>对照组(P<0.05)。结论:SMC对HMME的摄取量呈孵育浓度和孵育时间依赖性,并显著高于HpD;SMC代谢状态影响其对IMME的吸收。
, 百拇医药
分类号:R544.4;Q445 文献标识码:A
文章编号:1003-9430(2000)02-0001-04
Absorption Characteristics of HMME by Vascular Smooth
Muscle Cells
GU Ying, LIU Fanguang, FU Qiutao, PAN Yuming
(Department of Laser Medicine, Chinese PLA General Hospital, Beijing 100853, China)
ABSTRACT:Objective To investigate the absorption characteristics of hematoporphyrin monomethyl ether (HMME) by vascular smooth muscle cells (SMC) and to provide a basis for suitable photodynamic therapy (PDT) for atherosclerosis and restenosis.Methods:The SMC from rabbit normal abdominal aorta were cultured and divided into three groups. First, the absorption characteristics of HMME and hematoporphyrin derivative(HpD) in several concentrations and for different incubation time in SMC were investigated by using fluorospectrophotometer. Secondly, SMC were incubated in serum-free medium, 10 ng/ml PDGF-BB or 10% fetal bovine serum (FBS) respectively for 12 hours, and the activity status of SMC, cell number and content of HMME in SMC were investigated.Results:The absorption curves of HMME and HpD by SMC were similar, but the content of HMME in SMC was significantly higher than that of HpD (P<0.05). The SMC number did not increase obviously after incubation with growth factors (P>0.05), but the activity status of SMC was 62.1% higher in PDGF group and 119.4% higher in FBS group than that in control group(P<0.05). The curves of HMME uptake in PDGF group and in FBS group ascended significantly (P<0.05).Conclusions:The content of HMME in SMC is dose-dependent and time-dependent, and is significantly higher than that of HpD. The HMME uptake is significantly affected by the metabolic status of SMC.
, 百拇医药
Key words:Vascular smooth muscle cells; Hematoporphyrin monomethyl ether; Hematoporphyrin derivative▲
血啉甲醚(hematoporphyrin monomethyl ether, HMME)是国内研制开发的新型光敏剂,其临床光动力疗效显著高于血卟啉衍生物(hematoporphyrin derivative, HpD),且毒副作用低,具有良好的临床应用前景[1]。本研究中我们观察体外培养的兔血管平滑肌细胞(SMC)对HMME的吸收特点,了解HMME孵育浓度、孵育时间以及SMC代谢状态等因素的影响作用,并与HpD进行比较,旨在为建立用于动脉粥样硬化和血管成形术后再狭窄的光动力疗法(photodynamic therapy, PDT)提供实验依据。
材料与方法
, 百拇医药 一、材料和仪器
雄性新西兰兔,8~12周龄,解放军总医院医学动物实验中心提供;HMME,第二军医大学五二三药物研究室研制,规格10 mg/ml,批号980225;HpD,北京制药工业研究所生产,规格5 mg/ml,批号970423;血小板生长因子BB链(PDGF-BB),英国Peprotechec公司产品;胎牛血清(FBS),美国Sigma公司产品;日本岛津RF-540型荧光分光光度计;318MC型酶标仪,上海第三仪器有限公司生产。
二、细胞培养
兔经静脉注射空气处死,开胸取胸至腹段主动脉约12 cm,沿血管纵轴剪开,刮除内膜,取动脉中层剪成碎块后贴于细胞培养瓶底,加入含20%FBS的DMEM培养液,置于37℃、5% CO2孵箱内孵育,5天后换液,待10~12天后组织块周围形成“细胞晕”时传代,传代后用10%小牛血清培养。实验采用第4代细胞,接种于96孔细胞培养板中,种植密度为
, 百拇医药
5×103个/孔。
三、检测方法
1.SMC内光敏剂含量 采用荧光分析法测定细胞内光敏剂含量。PBS冲洗细胞3次,酶溶加低渗法裂解细胞。测定条件:激发波长395 nm,发射波长613 nm,由显示器直接读出最大荧光强度值。
2.SMC数量 采用细胞计数法确定SMC数量。倒置相差显微镜低倍镜下每孔随机取4个视野,计数全部细胞,结果取6孔平均值。
3.SMC代谢状态 采用MTT比色法测定SMC琥珀酸脱氢酶活性以反映其代谢状态。吸弃培养液,每孔加入MTT溶液(四唑盐5 mg/ml)20 μl,37℃继续培养4 h,吸弃上清液,每孔加入二甲基亚砜100 μl,振荡5 min,置酶标仪在吸收波长570 nm条件下测定各孔吸光度(A)值,取9孔平均值。
, http://www.100md.com
四、标准曲线的制备
用蒸馏水稀释HMME和HpD,终浓度分别为100、200、300、400、500、600、700、800、900 ng/ml,加入0.25%胰酶1 ml,使其液体成分与SMC的消化液相同。荧光分光光度计测定荧光强度,每个浓度点取双孔平均值,重复3次。以光敏剂浓度对平均荧光强度值进行线性回归。
五、HMME、HpD的浓度-含量关系曲线和时间-含量关系曲线的制备
SMC接种于培养板后继续孵育24 h,PBS冲洗,更换不含血清的DMEM液,暗室中加入HMME或HpD。制备浓度-含量关系曲线时,光敏剂的孵育浓度分别为20、40、60、80、100 μg/ml,孵育时间为60 min;制备时间-含量关系曲线时,光敏剂的浓度分别为60 μg/ml,孵育时间分别为0、15、30、60、120、180、240 min。荧光分光光度计测定荧光强度,每浓度点或时间点测定9孔,重复3次,取平均值。以HMME和HpD 的孵育浓度或孵育时间对SMC内光敏剂含量绘制曲线。
, http://www.100md.com
六、PDGF对SMC的处理
SMC接种于培养板后继续孵育8 h,待细胞贴壁后,换含2%小牛血清的DMEM液,培养48 h,使细胞进入G0期。将细胞分成PDGF组、FBS组和对照组3组。PDGF组的DMEM培养液中含2%小牛血清、10 ng/ml PDGF-BB;FBS组的培养液中含2%小牛血清、10%FBS;对照组的培养液中含2%小牛血清。继续培养12 h后进行细胞计数、SMC内琥珀酸脱氢酶活性和HMME含量测定(检测方法及HMME的孵育浓度、孵育时间同前)。 实验重复3次。
七、数据处理
数据以
, 百拇医药
结 果
一、HMME和HpD的标准曲线
HMME和HpD标准曲线见图1。HMME的回归方程:Y=9.1753X+1.6486,r=0.999;HpD的回归方程:Y=7.5623X-40.3443,r=0.999。

图1 HMME、HpD标准浓度曲线
Fig.1 Standard concentration curve of HMME and HpD
二、SMC吸收HMME和HpD的浓度-含量关系曲线和时间-含量关系曲线
, 百拇医药
曲线特点见图2和图3。SMC对HMME的吸收量显著高于HpD,在浓度-含量关系曲线的各浓度点上较HpD高136%~172%(P<0.05),在时间-含量关系曲线的各时间点上较HpD高133%~173%(P<0.05)。

图2 SMC吸收HMME和HpD的浓度-含量关系曲线
Fig.2 Curves of relationship between content of photosensitizers in SMC and incubating concentration of photosensitizers

, http://www.100md.com
图3 SMC吸收HMME和HpD的时间-含量关系曲线
Fig.3 Curves of relationship between content of photosensitizers in SMC and incubating time of photosensitizers
三、PDGF对SMC数量和琥珀酸脱氢酶活性的影响
PDGF组、FBS组和对照组G0期SMC经12 h孵育,每孔细胞数量分别为1 466±80、1 469±92和1 463±83,组间差异无显著意义(P>0.05)。对照组琥珀酸脱氢酶活性为0.201±0.053(A值);PDGF组为0.326±0.053,较对照组高62.1%(P<0.05);FBS组为0.441±0.059,较对照组高119.4%(P<0.05)。
, http://www.100md.com 四、PDGF对SMC光敏剂吸收量的影响
PDGF作用后,SMC吸收HMME的浓度-含量关系曲线(图4)和时间-含量关系曲线(图5)均上移。
在浓度-含量关系曲线上,PDGF组和FBS组的细胞HMME含量在各浓度点上均显著高于对照组(P<0.05);在时间-含量关系曲线上,PDGF组和FBS组的细胞HMME含量在15 min以上各点时间均显著高于对照组(P<0.05);如果以HMME 60 μg/ml孵育60 min为例,PDGF组细胞HMME含量较对照组高36%,FBS组较对照组高57%。

图4 PDGF对SMC吸收HMME的浓度-含量关系曲线的影响
, http://www.100md.com
Fig.4 Effect of growth factor on the relationship between content of HMME in SMC and incubating concentration of HMME

图5 PDGF对SMC吸收HMME的孵育时间-含量关系曲线的影响
Fig.5 Effect of growth factor on the relationship between content of HMME in SMC and incubating time of HMME
讨 论
, 百拇医药 一、SMC对HMME的吸收特点
HMME是一种单体卟啉,化学纯度达98%;HpD则是多种卟啉的混合物,含有血卟啉、原卟啉和二血卟啉醚等十多种化学成分[1]。在本研究中,HMME标准液的荧光生成量低于相同浓度的HpD,但HMME在SMC内含量却较HpD高出130%~170%。这表明HpD含有某些能发出较强荧光但不易被细胞摄取的成分,而作为单体卟啉的HMME更易被SMC吸收。
光敏剂孵育浓度和孵育时间直接决定着SMC对HMME和HpD的吸收量,对HMME的影响更为显著。以往的研究表明,HMME的血浆清除速率显著大于HpD,例如,静脉注射20 mg/kg HMME或HpD后0.5、1和3 h,血浆HMME与HpD浓度分别为4.23与27.44 μg/ml、1.87与13.12 μg/ml、0.66与3.03 μg/ml[2]。由于HMME血药浓度下降快及其细胞吸收量对孵育浓度、时间依赖程度高,给药剂量和静脉注射速度方面的细小差异就可能对在体SMC吸收HMME产生较大影响,有必要对此进行研究。
, 百拇医药
二、SMC代谢状态对吸收HMME的影响
本实验结果显示,SMC经PDGF或FBS等生长因子刺激后,在线粒体琥珀酸脱氢酶活性增强的同时,对HMME的吸收显著增加。这表明,SMC代谢状态影响其对HMME的吸收。Dartsch等[3]曾报道,体外培养的取自动脉粥样硬化斑块的SMC,对光敏剂的吸收量明显高于正常SMC,状态不同的SMC,对光敏剂的吸收能力有较大的差别。正常动脉壁的SMC为收缩表型,其功能是维持血管壁的张力;而动脉粥样硬化斑块和球囊损伤处的SMC为合成表型,功能发生很大的变化,除具有增殖和合成细胞外基质的能力外,还能通过自分泌和旁分泌产生多种生长因子[4]。由于合成表型SMC的代谢活性明显增高,细胞膜对外界物质的运输能力也相应增强。
血卟啉类光敏剂在血液中是与血浆膜脂蛋白结合而运输的,因此一般认为合成表型SMC吸收光敏剂能力的增强,主要与细胞膜的脂蛋白受体上调有关[5]。但在本实验中,HMME为游离状态,其跨膜运输显然与脂蛋白受体介导的内吞作用无关。说明可能存在多种机制,参与并影响合成表型SMC对光敏剂的吸收。
, 百拇医药
三、PDT与动脉粥样硬化和血管成形术后再狭窄
Spears等[6]在1983年首次报道,兔动脉粥样硬化斑块组织中HpD的含量明显高于正常动脉组织,提示PDT能用于治疗动脉粥样硬化和血管成形术后再狭窄。随后,有关研究报道日渐增多。现已发现,动脉粥样硬化斑块和球囊损伤处的SMC对苯并卟啉衍生物(BPD-MA)[7]、二血卟啉醚(DHE)[8]、5-氨基酮戊酸(ALA)[9]和酞青(PC)[10]等国外开发的新型光敏剂的摄取能力明显增强。光敏物质含量较正常动脉高2~5倍,并滞留较长时间,这就使得PDT能对病变SMC产生较好的选择性杀伤作用。研究显示,PDT能显著抑制损伤性血管内膜增殖,并能促进实验性动脉粥样斑块的消退。有关国产HMME与SMC的研究报道迄今还未见到。本研究结果提示,建立应用HMME为光敏剂的PDT方法,也能对增殖代谢状态异常的SMC产生理想的选择性杀伤作用。但由于本研究为体外实验,能否反映在体情况,有待进一步研究。■
, 百拇医药
基金项目:军队“九五”杰出人才基金资助项目(98J012)
作者简介:顾瑛(1959-),女,上海人,解放军总医院激光医学科主任、教授、主任医师、博士生导师,主要从事激光医学临床应用和应用基础研究。
参考文献:
[1] 许德余,陈文辉,张浩,等. 光动力治癌新药血卟啉单甲醚的研究[J]. 中国激光医学杂志,1993,2:3-7.
[2] 陈文辉,许德余. 血卟啉单甲醚在荷瘤小鼠体内的分布[M]. 第二军医大学学报,1990,11:118-122.
[3] Dartsch PC, Ischinger T, Betz E. Responses of cultured smooth muscle cells from human nonatherosclerotic arteries and primary stenosing lesions after photoradiation: implications for photodynamic therapy of vascular stenoses[J]. J Am Coll Cardiol, 1990, 15:1545-1550.
, http://www.100md.com
[4] 刘凡光,祝善俊,李天德. 血管成形术后平滑肌细胞增殖的机制[J]. 国外医学心血管疾病分册, 1997, 24:10-12.
[5] Tsuneyuki N, Louie AY, Aizawa k, et al. Selective targeting and photodynamic destruction of intimal hyperplasia by scavenger-receptor mediated protein-chlorite conjugstes[J]. J Cardiovas Surg, 1998, 39:709-715.
[6] Spears JR, Serur J, Shropshire D, et al. Fluorescence of experimental atheromatous plaques with hematoporphyrin derivative[J]. J Clin
, http://www.100md.com
Invest, 1983,71:395-399.
[7] Allison BA, Crespo MT, Jain AK, et al. Delivery of Benzoporphyrin deriative, a photosensitize, into atherosclerotic plaque of Watanable heritable hyperlipidemic rabbits and balloon-injured New Zealand rabbits[J]. Photochem Photobiol, 1997, 65:877-883.
[8] Johson MD, Fox JV, Hammond EM, et al. In vitro removal of photosensitized rabbit atherosclerotic plaque by dye laser irradiation[J]. ICALEO, 1987, 60:13-17.
, 百拇医药
[9] Nyamekye I, Anglin S, McEwan J, et al. Photodynamic therapy of normal and balloon-injured rat carotid arteries using 5-amino-levulinic acid[J]. Circulation, 1995, 91:417-425.
[10] LaMuraglia GM, Ortu P, Flotte TJ, et al. Chloroaluminum sulfonated phthalocyanine partitioning in normal and intimal hyperplastic artery in the rat[J]. Implications for photodynamic therapy. Am J Pathol, 1993, 142:1898-1905.
收稿日期:1999-09-06, 百拇医药