反基因及反义寡核苷酸抑制乙型肝炎病毒复制与表达的研究
作者:杨林 姚集鲁 邓练贤 刘淑芳
单位:510630 广州,中山医科大学附属第三医院病毒性肝炎研究室
关键词:肝炎病毒,乙型;抗病毒治疗;反基因寡脱氧核苷酸;反;义寡脱氧核苷酸
中华传染病杂志000104【摘要】目的 探讨反基因及反义寡核苷酸抗乙型肝炎病毒(HBV )作用。方法 设计合成针对HBV核心启动子Sp1位点(1734 nt~1754 nt)及前C RNA 、前基因组RNA 5′端起始区(1814 nt~1834 nt)的21聚硫代修饰反基因寡核苷酸(ODNan21) 及反义寡核苷酸(ODNas21)。将各寡核苷酸与22.1.5细胞温育。采用酶联免疫吸附法(ELISA) 及斑点杂交法分别检测经处理的22.1.5细胞培养上清HBsAg、HBeAg及HBV DNA水平。结果 ODNan21、ODNas21处理的22.1.5细胞HBsAg、HBeAg水平明显低于对 照 组(P<0.001)。浓度为10 μmol/L时,ODNan21,ODNas21对HBsAg、HBeAg的抑制分别 达57.%、77%;61%、79.6%;两者联合给药的抑制达71.5%、85%。该抑制呈剂量依赖性 并于给药 后4 8小时达高峰。ODNan21、ODNas21处理的22.1.5细胞HBV DNA水平低于对照组。无关序列对照 寡核苷酸对HBV DNA及抗原合成无明显影响。在实验范围内,寡核苷酸对22.1.5细胞无毒性 作用。结论 ODNan21、ODNas21在体外能有效抑制HBV复制及抗原合成,具有 较大应用潜力。
, 百拇医药
Inhibition of hepatitis B virus replication and synthesis of antigen by antigene and antisense oligodeoxynucleotides in vitro
YANG Lin YAO Jilu DENG Lianxian et al.
(Viral Hepatitis Research Unit, The Third Affiliated Hospital,SUN Yatsen Unive rsity of Medical Sciences, Guangzhou 510630,China)
【Abstract】Objective To study the antiviral effect of antigene oligodeoxynucleotides (ODNan) and antisense oligodeoxynucleotides (ODN as) on replication of hepatitis B virus(HBV). Methods A 21mer phosphorothioate ODNan (ODNan21) directed at Sp 1 sites in hepatitis B virus(HBV) core promoter (1734 nt~1754 nt) and a 21mer p hosphorothioate ODNa s (ODNas21) complementary to the initiation site of pre C mRNA and pregenomic RN A (1813 nt~1833 nt) were synthesized. 22.1.5 cells were treated with these olig odeoxynucleotides. HBsAg, HBeAg, and HBV DNA were determined by enzyme-linked i mmunosorbent assay(ELISA) and dot hybridizat ion methods, respectively, in the treated 22.1.5 cells. Results The levels of HBsAg and HBeAg in ODNan21 group and O DNas 21 group were lower than that in blank control group (P<0.001). ODNan21 and ODNas21 of 10 μmol/L reduced synthesis of HBsAg, HBeAg by 57.5% and 61%, 77% an d 79.6%, respectively, while the combination of ODNan21 and ODNas21 showed str onger inhibition to HBsAg and HBeAg (71.5% and 85%). The inhibitory effects were d ose-dependent, and reached to the highest point after 48 hours of administratio n. The HBV DNA was significantly decreased in the ODNan21 group as well as ODNas 21 group. No inhibitory effects on the levels of HBsAg, HBeAg and HBV DNA were o bserved in the oligodeoxynucleotide control group. In virus-inhibitory concentr ations the oligodeoxynucleotides were harmless to 22.1.5 cells. Conclusion The results indicated that both antigene oligodeoxynucle otides and antisense oligodeoxynucleotides could partly inhibit the replication of HBV and synthesis of antigen.
, 百拇医药
【Key words】Hepatitis B virus; Antiviral therap y; Antigene oligodeoxynucleotides; Antisense oligodeoxynucleotides
反基因寡脱氧核苷酸(ODNan)技术是近年认识的在作用方式上不同于反义寡脱氧核苷酸( ODNas)的一种基因表达的调控手段,能与双链DNA分子特异性结合形成局部三螺旋结构,从 而在转录水平抑制基因表达[1,2]。通过三螺旋形成,ODNan充当了切割DNA的“分 子剪刀”,提供了基因治疗的新策略。文献报道ODNan及ODNas在体外能抑制癌基因表达及猿 病毒40复制[1~5],但作者尚未见将ODNan应用于抑制乙型肝炎病毒(HBV)的研究报 道。因此,我们在22.1.5细胞观察了针对HBV核心启动子(HBV Cp)Sp1位点的ODNan及针对HBV 前C、前基因组RNA 5′端起始区的ODNas的抗HBV作用。
, http://www.100md.com
材料与方法
一、22.1.5细胞培养
22.1.5细胞为转染了HBV(ayw亚型)全基因组,能分泌HBsAg、HBeAg、HBV DNA及HBV颗粒的人 肝母瘤细胞系[6],由第一军医大学骆抗先教授惠赠。用含10%胎牛血清及G418(400 μg/ml)的DMEM(Sigma公司产品)培养基按常规方法培养。
二、硫代磷酸反基因及反义寡核苷酸合成
选择HBV(ayw)Cp Sp1位点(1734 nt~1754 nt)设计21聚反基因寡核苷酸(ODNan21),序列为T GTGGTGGGGAAGTGGTGGG;以HBV前C、前基因组RNA 5′端起始区(1813 nt~1833 nt)设计21聚 反 义寡核苷酸(ODNas21),序列为CAGAGGTGAAAAAGTTGCATGGT;无关序列对照寡核苷酸(ODNcon) ,序列为GGGTGGTGAAGGG-GTGGTGT。采用固相亚磷酰胺三酯合成法在DNA合成仪(美国AB I公司)上由中国科学院上海细胞生物学研究所协助合成。
, 百拇医药
三、抗病毒作用检测
将22.1.5细胞以2×105 个/孔接种于24孔培养板,同时加入不同剂量ODNan21、ODNas21及 ODNcon,12 h再给药1次继续培养,每个浓度做3个复孔。空白对照细胞仅加培养基。每12 h 收集50 μl培养上清液,采用酶联免疫吸附试验(ELISA)(中山生物公司试剂盒)一次性检 测HBsAg、HBeAg含量,结果以P/N值表示,按下式计算抑制率:
抑制率=(对照孔P/N-实验孔P/N)÷(对照孔P/N-2.1)×100%
按常规方法抽提各组细胞培养上清液中HBV DNA,以地高辛标记的HBV DNA探针采用斑点杂交 法探针检测其HBV DNA水平。
四、细胞毒性试验
22.1.5细胞传代培养24 h后,换含不同浓度ODNan21的培养液,每个浓度接种3孔。设不加OD Nan21的22.1.5细胞作对照。继续培养72 h,采用放射免疫法检测培养上清中甲胎蛋白水平 ,并观察细胞生长情况、细胞形态、细胞破坏程度。
, 百拇医药
结果
一、ODNan21、ODNas21对病毒抗原分泌的抑制
22.1.5细胞传代的同时分别加入浓度为10 μmol/L的ODNan21、ODNas21 及ODNcon,12 h再 给药1次,继续培养48 h后,检测培养上清液中HBsAg、HBeAg,结果见表1。ODNan21、ODNa s21组HBsAg、HBeAg分泌明显降低,而ODNcon对HBsAg、HBeAg无明显影响。
表1 ODNan21、ODNas21对22.1.5细胞
合成HBsAg、HBeAg的抑制 组别
HBsAg
HBeAg
P/N值( ±s)
±s)
, http://www.100md.com
抑 制率(%)
P/N值( ±s)
±s)
抑制 率(%)
空白组
3.82±0.26
4.95±0.22
ODNan21
2.83±0.23
57.5%
2.75±0.21*
, http://www.100md.com
77%
ODNas21
2.77±0.18* *
61%
2.68±0.16**
79.6%
ODNan21+
ODNas21
2.59±0.21△
71.5%
2.52±0.1△
, http://www.100md.com
85%
ODNcon
3.66±0.21△△
9%
4.72±0.17△△
8%
t检验,各处理组与空白对照组比较HBsAg:*P<0.005;**P<0.002,△P<0.002,△△P>0.5;HBeAg:*P<0.001,**P<0.001,△P<0. 001,△△P>0.5
, http://www.100md.com
图1 ODNan21及ODNas21对22.1.5细胞HBeAg合成的抑制动态曲线
二、ODNan21、ODNas21抑制的时效关系
1次给予10 μmol/L的ODNan21、ODNas21,在第12、24、36、48、60、72、84、96 h检测HBsAg、HBeAg。结果ODNan21、ODNas21对HBsAg、HBeAg的抑制在给药后第12 h即可检出,48 h达高峰,以后逐渐降低,给药后96 h仍有一定作用(见图1、2)。
图2 ODNan21及ODNas21对22.1.5细胞HBsAg合成的抑制动态曲线
三、ODNan21的剂量依赖性抑制
, 百拇医药 不同浓度ODNan21(4~30 μoml/L)分别与22.1.5细胞温育48 h后,对HBeAg、HBsAg的抑制作 用如图3。在(1~20 μmol/L)浓度范围内,ODNan21对HBeAg和HBsAg的抑制呈剂量相关性,O DNan21浓度超过20 μmol/L后,增加药物剂量,抑制作用无明显增强,呈平台效应。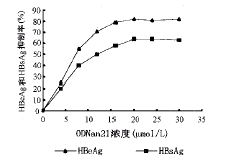
图3 ODNan21对HBeAg、HBsAg合成的剂量依赖性抑制
四、ODNan21、ODNas21联合用药的抑制
浓度为10 μmol/L的ODNan21、ODNas21单独及联合给药2次后48 h,对HBsAg,HBeAg的抑制 分别为57.5%、77%;61%、79.6%;71.5%、85%。联合给药的作用较单独应用强,但差异无显 著性(P>0.5)。ODNas21的作用也略强于ODNan21,但差异也无显著性。
, http://www.100md.com
五、ODNan21、ODNas21对HBV DNA的影响
采用斑点杂交法,用地高辛标记的HBV DNA探针检测22.1.5细胞培养上清中HBV DNA,结果OD Nan21、ODNas21处理的细胞HBV DNA量明显降低,表现为硝酸纤维膜上斑点显色减弱,而ODN con组22.1.5细胞HBV DNA与对照组无明显差别。
六、寡核苷酸对22.1.5细胞的毒性观察
放射免疫法检测ODNan21处理的22.1.5细胞与空白对照组细胞培养上清中甲胎蛋白水平(分别 为640±30.40及658±31.25),结果两组间无明显差别,说明ODNan21对细胞蛋白合成无影响 。ODNan21处理的22.1.5细胞与空白对照组细胞在形态、生长速度方面也无明显差别。
讨论
, 百拇医药
近来,有不少文献报道ODNas在体外能抑制HBV复制。ODNas的靶点为RNA,在翻译水平发挥作 用,有一定局限性,若能直接抑制HBV基因转录,则抗HBV效果可能更强。ODNan即不同于ODN as,能与含同聚嘌呤嘧啶序列的双螺旋DNA形成三螺旋结构而直接在转录水平发挥抑制作用 [2]。
HBV Cp 1734 nt~1754 nt存在两个转录因子Sp1位点[7,8],是决定HBV Cp活性的 重要部位;该区域为同聚嘌呤嘧啶序列[7],又具有形成三螺旋的结构特点;此外 ,HBV基因功能,复制特点决定了HBV前基因组RNA 5′端起始区可能是HBV反义治疗的最佳靶 点。因此,本文选择这两区域为ODNan、ODNas作用靶点,进行抗HBV研究,尚未见类似的研 究报道。
本研究表明ODNan21、ODNas21能明显抑制HBV复制及抗原合成,并对细胞无毒副作用。其抑 制呈剂量依赖性。两者联合应用时抑制作用增强。由于ODNan21作用于转录水平,ODNas21作 用于翻译水平,因此,两者联合应用时HBV前C、C基因的转录、翻译及HBV复制三个环节均可 能被抑制故作用增强。该结果提示,作用于HBV生活周期不同环节的药物联合应用可能提高 抗HBV效果。
, 百拇医药
我们设计的ODNan21针对HBV Cp Sp1,作用于转录水平;ODNas21作用于翻译水平。从理论上 看,ODNan21应显示更强的抑制作用。但本实验发现,ODNan21对HBeAg、HBsAg的抑制反略低 于ODNas21。其原因不太清楚,可能与所用实验细胞有关。因为转录因子Sp1对HBV Cp活性的 调控呈细胞特异性。在去分化细胞,如Hep G2.1细胞系,Sp1的调控作用较强;而在分化细 胞 ,如Hep G2细胞系(包括22.1.5细胞),Sp1对HBV Cp的调控作用较弱[9],因此,在 2 2.1.5细胞,即使应用ODNan21封闭了Sp1,对HBV基因表达及复制的抑制也可能不很强。可以 推测,在正常分化的肝细胞中,ODNan21可能显示出更强的抗HBV作用。
本研究显示,ODNan及ODNas能有效抑制HBV复制,这无疑为乙型肝炎的治疗提供了新思路。 但这仅是体外的初步研究结果,如何降低合成寡核苷酸的成本;如何将ODNan、ODNas定向导 入肝细胞及明确其在动物体内的药效、药代动力学等将是今后急需研究的课题。
, 百拇医药
本课题受广东省科委重点科技攻关项目及中山医科大学“211”工程项目基金资助(97002)
参考文献
1,Moffat AS. Triplex DNA finally Comes of age. Science, 1991,252:1374- 1375.
2,Postel EH, Flint SJ, Kessler DJ, et al. Evidence that a triplex-forming olig odeoxyribonucleotide binds to the c-myc promoter in Hela cells, thereby reducin g c-myc mRNA levels. Proc Natl Acad Sci USA, 1991,88:8227-8231.
3,Birg F, Praseuth D, Zerial A, et al. Inhibition of simian virus 40 DNA replic a tion in CV-1 cells by an oligodeoxynucleotide covalently linked to an intercala ting agent. Nucleic Acids Res, 1990,18:2901-2908.
, http://www.100md.com
4,杨林,张定凤,王玉芝,等.抗基因及反义寡脱氧核苷酸抑制N-ras表达及对肝癌细胞增 殖的影响.中华肝脏病杂志,1996,4:203-206.
5,Goodarzi G, Gross SC, Tewari A, et al. Antisense oligodeoxyribonucleotides in hibit the expression of the gene for hepatitis B virus surface antigen. J Gen V iro, 1990,71:3021-3025.
6,Sells MA, Chen ML, Acs G. Production of hepatitis B virus particles in H ep G2 cells transfected with cloned hepatitis B virus DNA. Proc Natl Acad Sci US A, 1987,84:1005-1009.
, 百拇医药
7,Mclachlan A. Molecular biology of the hepatitis B virus. London: CRC press In c, 1991.5-13.
8,Zhang P, Raney AK, Mclachlan A. Characterization of functional Sp1 transcript ion factor binding sites in the hepatitis B virus nucleocapsid promoter. J Virol , 1993,67:1472-1481.
9,Zhang P, Mclachlan A. Differentiation-specific transcriptional regulation of the hepatitis B virus nucleocapsid gene in human hepatoma cell lines. Virology, 1994,202:430-440.
收稿日期:1999-04-26, 百拇医药
单位:510630 广州,中山医科大学附属第三医院病毒性肝炎研究室
关键词:肝炎病毒,乙型;抗病毒治疗;反基因寡脱氧核苷酸;反;义寡脱氧核苷酸
中华传染病杂志000104【摘要】目的 探讨反基因及反义寡核苷酸抗乙型肝炎病毒(HBV )作用。方法 设计合成针对HBV核心启动子Sp1位点(1734 nt~1754 nt)及前C RNA 、前基因组RNA 5′端起始区(1814 nt~1834 nt)的21聚硫代修饰反基因寡核苷酸(ODNan21) 及反义寡核苷酸(ODNas21)。将各寡核苷酸与22.1.5细胞温育。采用酶联免疫吸附法(ELISA) 及斑点杂交法分别检测经处理的22.1.5细胞培养上清HBsAg、HBeAg及HBV DNA水平。结果 ODNan21、ODNas21处理的22.1.5细胞HBsAg、HBeAg水平明显低于对 照 组(P<0.001)。浓度为10 μmol/L时,ODNan21,ODNas21对HBsAg、HBeAg的抑制分别 达57.%、77%;61%、79.6%;两者联合给药的抑制达71.5%、85%。该抑制呈剂量依赖性 并于给药 后4 8小时达高峰。ODNan21、ODNas21处理的22.1.5细胞HBV DNA水平低于对照组。无关序列对照 寡核苷酸对HBV DNA及抗原合成无明显影响。在实验范围内,寡核苷酸对22.1.5细胞无毒性 作用。结论 ODNan21、ODNas21在体外能有效抑制HBV复制及抗原合成,具有 较大应用潜力。
, 百拇医药
Inhibition of hepatitis B virus replication and synthesis of antigen by antigene and antisense oligodeoxynucleotides in vitro
YANG Lin YAO Jilu DENG Lianxian et al.
(Viral Hepatitis Research Unit, The Third Affiliated Hospital,SUN Yatsen Unive rsity of Medical Sciences, Guangzhou 510630,China)
【Abstract】Objective To study the antiviral effect of antigene oligodeoxynucleotides (ODNan) and antisense oligodeoxynucleotides (ODN as) on replication of hepatitis B virus(HBV). Methods A 21mer phosphorothioate ODNan (ODNan21) directed at Sp 1 sites in hepatitis B virus(HBV) core promoter (1734 nt~1754 nt) and a 21mer p hosphorothioate ODNa s (ODNas21) complementary to the initiation site of pre C mRNA and pregenomic RN A (1813 nt~1833 nt) were synthesized. 22.1.5 cells were treated with these olig odeoxynucleotides. HBsAg, HBeAg, and HBV DNA were determined by enzyme-linked i mmunosorbent assay(ELISA) and dot hybridizat ion methods, respectively, in the treated 22.1.5 cells. Results The levels of HBsAg and HBeAg in ODNan21 group and O DNas 21 group were lower than that in blank control group (P<0.001). ODNan21 and ODNas21 of 10 μmol/L reduced synthesis of HBsAg, HBeAg by 57.5% and 61%, 77% an d 79.6%, respectively, while the combination of ODNan21 and ODNas21 showed str onger inhibition to HBsAg and HBeAg (71.5% and 85%). The inhibitory effects were d ose-dependent, and reached to the highest point after 48 hours of administratio n. The HBV DNA was significantly decreased in the ODNan21 group as well as ODNas 21 group. No inhibitory effects on the levels of HBsAg, HBeAg and HBV DNA were o bserved in the oligodeoxynucleotide control group. In virus-inhibitory concentr ations the oligodeoxynucleotides were harmless to 22.1.5 cells. Conclusion The results indicated that both antigene oligodeoxynucle otides and antisense oligodeoxynucleotides could partly inhibit the replication of HBV and synthesis of antigen.
, 百拇医药
【Key words】Hepatitis B virus; Antiviral therap y; Antigene oligodeoxynucleotides; Antisense oligodeoxynucleotides
反基因寡脱氧核苷酸(ODNan)技术是近年认识的在作用方式上不同于反义寡脱氧核苷酸( ODNas)的一种基因表达的调控手段,能与双链DNA分子特异性结合形成局部三螺旋结构,从 而在转录水平抑制基因表达[1,2]。通过三螺旋形成,ODNan充当了切割DNA的“分 子剪刀”,提供了基因治疗的新策略。文献报道ODNan及ODNas在体外能抑制癌基因表达及猿 病毒40复制[1~5],但作者尚未见将ODNan应用于抑制乙型肝炎病毒(HBV)的研究报 道。因此,我们在22.1.5细胞观察了针对HBV核心启动子(HBV Cp)Sp1位点的ODNan及针对HBV 前C、前基因组RNA 5′端起始区的ODNas的抗HBV作用。
, http://www.100md.com
材料与方法
一、22.1.5细胞培养
22.1.5细胞为转染了HBV(ayw亚型)全基因组,能分泌HBsAg、HBeAg、HBV DNA及HBV颗粒的人 肝母瘤细胞系[6],由第一军医大学骆抗先教授惠赠。用含10%胎牛血清及G418(400 μg/ml)的DMEM(Sigma公司产品)培养基按常规方法培养。
二、硫代磷酸反基因及反义寡核苷酸合成
选择HBV(ayw)Cp Sp1位点(1734 nt~1754 nt)设计21聚反基因寡核苷酸(ODNan21),序列为T GTGGTGGGGAAGTGGTGGG;以HBV前C、前基因组RNA 5′端起始区(1813 nt~1833 nt)设计21聚 反 义寡核苷酸(ODNas21),序列为CAGAGGTGAAAAAGTTGCATGGT;无关序列对照寡核苷酸(ODNcon) ,序列为GGGTGGTGAAGGG-GTGGTGT。采用固相亚磷酰胺三酯合成法在DNA合成仪(美国AB I公司)上由中国科学院上海细胞生物学研究所协助合成。
, 百拇医药
三、抗病毒作用检测
将22.1.5细胞以2×105 个/孔接种于24孔培养板,同时加入不同剂量ODNan21、ODNas21及 ODNcon,12 h再给药1次继续培养,每个浓度做3个复孔。空白对照细胞仅加培养基。每12 h 收集50 μl培养上清液,采用酶联免疫吸附试验(ELISA)(中山生物公司试剂盒)一次性检 测HBsAg、HBeAg含量,结果以P/N值表示,按下式计算抑制率:
抑制率=(对照孔P/N-实验孔P/N)÷(对照孔P/N-2.1)×100%
按常规方法抽提各组细胞培养上清液中HBV DNA,以地高辛标记的HBV DNA探针采用斑点杂交 法探针检测其HBV DNA水平。
四、细胞毒性试验
22.1.5细胞传代培养24 h后,换含不同浓度ODNan21的培养液,每个浓度接种3孔。设不加OD Nan21的22.1.5细胞作对照。继续培养72 h,采用放射免疫法检测培养上清中甲胎蛋白水平 ,并观察细胞生长情况、细胞形态、细胞破坏程度。
, 百拇医药
结果
一、ODNan21、ODNas21对病毒抗原分泌的抑制
22.1.5细胞传代的同时分别加入浓度为10 μmol/L的ODNan21、ODNas21 及ODNcon,12 h再 给药1次,继续培养48 h后,检测培养上清液中HBsAg、HBeAg,结果见表1。ODNan21、ODNa s21组HBsAg、HBeAg分泌明显降低,而ODNcon对HBsAg、HBeAg无明显影响。
表1 ODNan21、ODNas21对22.1.5细胞
合成HBsAg、HBeAg的抑制 组别
HBsAg
HBeAg
P/N值(
 ±s)
±s), http://www.100md.com
抑 制率(%)
P/N值(
 ±s)
±s)抑制 率(%)
空白组
3.82±0.26
4.95±0.22
ODNan21
2.83±0.23
57.5%
2.75±0.21*
, http://www.100md.com
77%
ODNas21
2.77±0.18* *
61%
2.68±0.16**
79.6%
ODNan21+
ODNas21
2.59±0.21△
71.5%
2.52±0.1△
, http://www.100md.com
85%
ODNcon
3.66±0.21△△
9%
4.72±0.17△△
8%
t检验,各处理组与空白对照组比较HBsAg:*P<0.005;**P<0.002,△P<0.002,△△P>0.5;HBeAg:*P<0.001,**P<0.001,△P<0. 001,△△P>0.5

, http://www.100md.com
图1 ODNan21及ODNas21对22.1.5细胞HBeAg合成的抑制动态曲线
二、ODNan21、ODNas21抑制的时效关系
1次给予10 μmol/L的ODNan21、ODNas21,在第12、24、36、48、60、72、84、96 h检测HBsAg、HBeAg。结果ODNan21、ODNas21对HBsAg、HBeAg的抑制在给药后第12 h即可检出,48 h达高峰,以后逐渐降低,给药后96 h仍有一定作用(见图1、2)。

图2 ODNan21及ODNas21对22.1.5细胞HBsAg合成的抑制动态曲线
三、ODNan21的剂量依赖性抑制
, 百拇医药 不同浓度ODNan21(4~30 μoml/L)分别与22.1.5细胞温育48 h后,对HBeAg、HBsAg的抑制作 用如图3。在(1~20 μmol/L)浓度范围内,ODNan21对HBeAg和HBsAg的抑制呈剂量相关性,O DNan21浓度超过20 μmol/L后,增加药物剂量,抑制作用无明显增强,呈平台效应。

图3 ODNan21对HBeAg、HBsAg合成的剂量依赖性抑制
四、ODNan21、ODNas21联合用药的抑制
浓度为10 μmol/L的ODNan21、ODNas21单独及联合给药2次后48 h,对HBsAg,HBeAg的抑制 分别为57.5%、77%;61%、79.6%;71.5%、85%。联合给药的作用较单独应用强,但差异无显 著性(P>0.5)。ODNas21的作用也略强于ODNan21,但差异也无显著性。
, http://www.100md.com
五、ODNan21、ODNas21对HBV DNA的影响
采用斑点杂交法,用地高辛标记的HBV DNA探针检测22.1.5细胞培养上清中HBV DNA,结果OD Nan21、ODNas21处理的细胞HBV DNA量明显降低,表现为硝酸纤维膜上斑点显色减弱,而ODN con组22.1.5细胞HBV DNA与对照组无明显差别。
六、寡核苷酸对22.1.5细胞的毒性观察
放射免疫法检测ODNan21处理的22.1.5细胞与空白对照组细胞培养上清中甲胎蛋白水平(分别 为640±30.40及658±31.25),结果两组间无明显差别,说明ODNan21对细胞蛋白合成无影响 。ODNan21处理的22.1.5细胞与空白对照组细胞在形态、生长速度方面也无明显差别。
讨论
, 百拇医药
近来,有不少文献报道ODNas在体外能抑制HBV复制。ODNas的靶点为RNA,在翻译水平发挥作 用,有一定局限性,若能直接抑制HBV基因转录,则抗HBV效果可能更强。ODNan即不同于ODN as,能与含同聚嘌呤嘧啶序列的双螺旋DNA形成三螺旋结构而直接在转录水平发挥抑制作用 [2]。
HBV Cp 1734 nt~1754 nt存在两个转录因子Sp1位点[7,8],是决定HBV Cp活性的 重要部位;该区域为同聚嘌呤嘧啶序列[7],又具有形成三螺旋的结构特点;此外 ,HBV基因功能,复制特点决定了HBV前基因组RNA 5′端起始区可能是HBV反义治疗的最佳靶 点。因此,本文选择这两区域为ODNan、ODNas作用靶点,进行抗HBV研究,尚未见类似的研 究报道。
本研究表明ODNan21、ODNas21能明显抑制HBV复制及抗原合成,并对细胞无毒副作用。其抑 制呈剂量依赖性。两者联合应用时抑制作用增强。由于ODNan21作用于转录水平,ODNas21作 用于翻译水平,因此,两者联合应用时HBV前C、C基因的转录、翻译及HBV复制三个环节均可 能被抑制故作用增强。该结果提示,作用于HBV生活周期不同环节的药物联合应用可能提高 抗HBV效果。
, 百拇医药
我们设计的ODNan21针对HBV Cp Sp1,作用于转录水平;ODNas21作用于翻译水平。从理论上 看,ODNan21应显示更强的抑制作用。但本实验发现,ODNan21对HBeAg、HBsAg的抑制反略低 于ODNas21。其原因不太清楚,可能与所用实验细胞有关。因为转录因子Sp1对HBV Cp活性的 调控呈细胞特异性。在去分化细胞,如Hep G2.1细胞系,Sp1的调控作用较强;而在分化细 胞 ,如Hep G2细胞系(包括22.1.5细胞),Sp1对HBV Cp的调控作用较弱[9],因此,在 2 2.1.5细胞,即使应用ODNan21封闭了Sp1,对HBV基因表达及复制的抑制也可能不很强。可以 推测,在正常分化的肝细胞中,ODNan21可能显示出更强的抗HBV作用。
本研究显示,ODNan及ODNas能有效抑制HBV复制,这无疑为乙型肝炎的治疗提供了新思路。 但这仅是体外的初步研究结果,如何降低合成寡核苷酸的成本;如何将ODNan、ODNas定向导 入肝细胞及明确其在动物体内的药效、药代动力学等将是今后急需研究的课题。
, 百拇医药
本课题受广东省科委重点科技攻关项目及中山医科大学“211”工程项目基金资助(97002)
参考文献
1,Moffat AS. Triplex DNA finally Comes of age. Science, 1991,252:1374- 1375.
2,Postel EH, Flint SJ, Kessler DJ, et al. Evidence that a triplex-forming olig odeoxyribonucleotide binds to the c-myc promoter in Hela cells, thereby reducin g c-myc mRNA levels. Proc Natl Acad Sci USA, 1991,88:8227-8231.
3,Birg F, Praseuth D, Zerial A, et al. Inhibition of simian virus 40 DNA replic a tion in CV-1 cells by an oligodeoxynucleotide covalently linked to an intercala ting agent. Nucleic Acids Res, 1990,18:2901-2908.
, http://www.100md.com
4,杨林,张定凤,王玉芝,等.抗基因及反义寡脱氧核苷酸抑制N-ras表达及对肝癌细胞增 殖的影响.中华肝脏病杂志,1996,4:203-206.
5,Goodarzi G, Gross SC, Tewari A, et al. Antisense oligodeoxyribonucleotides in hibit the expression of the gene for hepatitis B virus surface antigen. J Gen V iro, 1990,71:3021-3025.
6,Sells MA, Chen ML, Acs G. Production of hepatitis B virus particles in H ep G2 cells transfected with cloned hepatitis B virus DNA. Proc Natl Acad Sci US A, 1987,84:1005-1009.
, 百拇医药
7,Mclachlan A. Molecular biology of the hepatitis B virus. London: CRC press In c, 1991.5-13.
8,Zhang P, Raney AK, Mclachlan A. Characterization of functional Sp1 transcript ion factor binding sites in the hepatitis B virus nucleocapsid promoter. J Virol , 1993,67:1472-1481.
9,Zhang P, Mclachlan A. Differentiation-specific transcriptional regulation of the hepatitis B virus nucleocapsid gene in human hepatoma cell lines. Virology, 1994,202:430-440.
收稿日期:1999-04-26, 百拇医药