核酶细胞内抗丙型肝炎病毒作用的研究
作者:陈智 刘勇 刘克洲 Dennin RH 窦俊 Reinhard U
单位:陈智 刘勇 刘克洲(310003 杭州,浙江大学医学院附属一院传染病研究所,卫生部病毒性传染病重 点实验室);Dennin RH Reinh ard U(德国Luebeck医科大学微生物研究所);窦俊(南京铁道医学院)
关键词:核酶;肝炎病毒,丙型;MT-2细胞
中华传染病杂志000102【摘要】目的 研究核酶抗丙型肝炎病毒(HCV)的有效切割位点并获得高效、特异、无毒、价廉的HCV特异性 反式核酶。方法 根据文献报道的序列设计、合成HCV 5′非结构(NC)区和核心(C)区 的特异性反式核 酶基因并分别克隆进入真核细胞表达载体pSV2-gpt.CD-SRα中,转染HCV感染的MT-2细胞 ,用定量逆转录-聚合酶链反应(RT-PCR)、核酸杂交等方法测定核酶对HCV的抑制作用。结果 所用的HCV 5′NC区核酶和C区核酶对HCV均有显著的抑制作用,抑制 率分别为54.7%和62.1%。两者联合作用时抑制率达78.8%。结论 HCV 5′NC区和C区特异性反式核酶在HCV感染的体外细胞培养模型中 对HCV复制有明显的抑制作用;双靶位核酶联合使用较单靶位核酶效果更好。
, 百拇医药
An in vitro study of ribozyme against hepatitis C virus
CHEN Zhi LIU Yong LIU Kezhou et al.
(The Institute of Infectious Diseases, First Affiliated Hospital, Medic al College, Zhejiang University, Hangzhou 310003, China)
【Abstract】Objective To determine the cleavage sites of ribozymes against hepatitis C virus(HCV), and to obtain a highly effective, nontoxic and inexpensive antisense ribozyme specific for HCV. Methods Two effective ribozymes, targeted to HCV 5′-non-coding region(5′-NCR) and C region, were synthesized. Eukaryotic expression vectors, pSV2-gpt. CD-SRα, containing either HCRZ NC or HCRZC were constructed and transfected into MT-2 cells, which had been in fected by HCV. Quantitative RT-PCR and hybridization methods were used to deter mine the effect of inhibition of HCV by ribozymes. Results HCRZNC and HCRZC suppressed the replication of HCV by 54. 7% and 62.1%, respectively. Furthermore, when the two ribozymes were cotransfect ed into cells, they suppressed replication by 78.8%. Conclusion Two specific antisense ribozymes have strong inhibit ory effects on the replication of HCV in cultured cells, and have better effect when used together.
, 百拇医药
【Key words】Ribozyme; Hepatitis virus, type C; MT-2 cells
核酶(Ribozyme)是一类具有特异性剪切RNA活性的RNA分子。1990年Sarver等[1] 首先报道在体外培养的细胞中用核酶成功抑制了人类免疫缺陷病毒(HIV)的复制,引起越 来越多的医学和生物 工作者的重视。目前核酶已开始应用于人体内治疗[2]。然而,核酶步入临床实践 前,还有许多问题有待于解决。例如:如何选择靶序列中最佳切割位点,如何获得高效、无 毒的特异性反式核酶,如何提高核酶进入靶细胞的效率并稳定发挥作用等。我们在已建立的 丙型肝炎病毒(HCV)感染的细胞模型中进行HCV特异性锤头状核酶抑制HCV复制的研究,探 讨核酶抗HCV的效果 和作用机制。
材料和方法
一、材料
, http://www.100md.com
(一) HCV感染MT-2细胞模型 MT-2细胞为人CD4+T细胞株,按照Kato等[3]报道 的方法制备。
(二) HCV 5′非编码区(NC)及核心区(C)核酶基因及相应的反义引物 根据Sakamoto等 [4]报道的序列,在德国Luebeck医科大学微生物研究所合成。
(三) 其他主要试剂 TA克隆试剂为美国Invitrogen公司产品,以多聚酶链反应产物克隆载 体2.1(PCR 2.1)为载体,在插入片 段两侧各有一个Eco RI位点。真核表达载体pSV2-gpt.CD-SRα由日本九洲大学免疫学研究 所王继扬博士赠送,该质粒带有SV40启动子、信号肽及poly A序列,并带有大肠杆菌的gpt 基 因,该基因编码黄嘌呤-鸟嘌呤磷酸核糖转移酶(XGPRT)可将黄嘌呤转化为鸟苷酸(GMP)的前 体——黄苷酸(XMP),因此可恢复共转染后的受体细胞在XHTA-M选择性培养基(含20%胎 牛血清 、250 μg/ml黄嘌呤、15 μg/ml次黄嘌呤、10 μg/ml胸腺嘧啶、2 μg/ml氨基喋呤和25 μg/ml霉酚酸的1×RPMI 1640培养基,pH 7.4)中被霉酚酸和氨基喋呤阻断的哺乳细胞 的GMP 生物合成途径。外源片段插入该载体的Eco RI位点后转染真核细胞,经gpt筛选可获得稳定 表达的重组体。地高辛(Dig)DNA 3′末端标记试剂盒以及核酸检测试剂盒为德国Boehring M annheim公司产品。
, 百拇医药
二、方法
(一) 抗HCV核酶与pSV2-gpt.CD-SRα的重组 在Taq DNA聚合酶作用下,分别将HCV NC及C 区 核酶基因补成双链,按试剂盒说明书进行TA克隆,转化TOP 10F菌株,经用含有氨苄青霉素 和 X-gel/IPTG的选择性平板作抗性和蓝、白斑筛选,挑出重组克隆后,扩增并纯化重组体, 用内切酶Eco RI进行酶切反应,然后进行琼脂糖电泳,回收和纯化目的片段,按分子克隆常 规插入pSV2-gpt.CD-SRα载体中。为了鉴别抑制HCV复制的作用是来自核酶的切割还是反 义核酸的封闭,以同样的方法构建与HCV C区核酶基因相同但在核酶活性区中有一点突变的 对照重组体,方法与上述相同。上述重组体用相应的探针作斑点杂交后选出阳性克隆,HCV NC区、C区核酶基因及点突变的C区核酶基因分别命名为HCRZNC、HCRZC和HCRZCM。
(二) HCV感染MT-2细胞 用HCV阳性血清感染MT-2细胞后,动态收获部分细胞,用Trizo l试剂提取总RNA,进行逆转录-聚合酶链反应(RT-PCR)检测HCV RNA及其复制中间体,并以 Southern杂交证实,确定HCV感染成功及其感染的时间。
, http://www.100md.com
(三) HCV核酶重组体转染HCV感染的MT-2细胞 HCV感染后的MT-2细胞培养至第5天,用磷 酸钙转染法将上述HCRZNC、HCRZC和HCRZCM重组体转染细胞,操作方法参见文献[5]。转 染细胞培养60 h后收获并洗涤,加XHTA-M选择性培养基重悬细胞,继续培养。
(四) 细胞RNA的提取和检测 于转染后第3、6、9天各收获3×105细胞,用Trizol试剂 抽提总RNA,并以DNase I酶消化后进行如下检测:1.HCV RNA定性检测按先前报道的方法进 行[6]。2.Southern杂交按试剂盒说明书,以HCV NC、C区核酶基因、点突变的C区 核 酶基因寡核苷酸片段及HCV C区寡核苷酸引物分别用Dig进行DNA 3′末端标记。PCR产物电泳 后 ,进行Southern杂交和显色。3.HCV RNA定量RT-PCR检测采用HCV RNA定量检测试剂盒(Ro che Amplicor HCV Monitor TM Test,瑞士Roche公司产品),对第9天收获的细胞进行定量 检测。操作按说明书,并设对照。
, http://www.100md.com
(五) 细胞毒性试验 与未转染核酶基因的细胞对照,动态观察转染核酶基因的各组细胞在 形态和生长方面的情况。
结果
一、HCV感染MT-2细胞
用HCV阳性血清感染的MT-2细胞在培养第7天开始RT-PCR检出HCV RNA,可持续阳性至第28 天 。HCV复制中间体于感染后第10天出现,第18天消失。上述结果经Southern杂交证实其阳性 条带为HCV特异性序列。
二、斑点杂交鉴定核酶
分别用特异性探针作斑点杂交,选出阳性克隆。图1示斑点杂交鉴定核酶与pSV2-gpt.CD-S Rα的重组结果。
, 百拇医药
构建好的HCRZC、HCRZCN和HCRZCM各取10
个克 隆点膜,以含5′NC区和C区基因的HCV cDNA片段为探针杂交,图中A为PCR2.1空载体对照;B 为pSV2-gpt.CD-SRα空载体作阴性对照;C为HCRZC重组体;D为HCRZNC;E为HCRZCM重组体
图1 斑点杂交鉴定核酶重组体结果
三、RT-PCR和Southern杂交
HCRZNC和HCRZC处理的感染细胞中HCV RNA的阳性信号均低于HCRZCM转染的细胞和无核酶基因 插入的空pSV2-gpt.CD-SRα载体转染的细胞。定量PCR结果见图2,经计算,HCR MNC、 HCRMC的抑制作用分别为54.7%和62.1%,两者联合应用时达78.8%。定性PCR结果未 见HCRZCM 对HCV 感染的MT-2细胞中HCV RNA阳性信号有明显影响,定量PCR结果则表明该重组体转染细胞后 ,对HCV复制具有一定的抑制作用,抑制率为28.3%。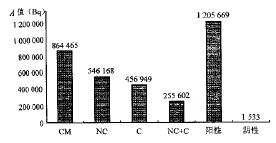
, 百拇医药
CM为点突变的C区核酶(HCRZCM);NC为HCV 5′NC区核酶(HCRZNC);C为HCV C区核酶(HVR ZC); NC+C为此二种核酶联合应用;阳性为无核酶基因插入的载体对照;阴性对照为无HCV感染的M T-2细胞对照
图2 核酶对HCV的抑制率
四、细胞形态学观察
与对照组细胞比较,未发现转染有核酶基因的各组细胞在形态和生长方面出现异常。
讨论
HCV感染易导致慢性化,可发展成为肝硬化甚至肝癌。目前主要用干扰素进行治疗,但疗效 尚不够满意[7,8]。因此,有必要寻找其它抗HCV治疗途径。近年来,应用反义核 酸和核酶进行抗病毒治疗的研究有了较大的进展。由于体外合成RNA价格极为昂贵,且在细 胞内容易被RNA酶降解而失活,故从策略上说,核酶抗病毒治疗以基因表达途径,即将核酶 基因用合适的载体导入细胞内,在细胞内转录产生核酶从而发挥抗病毒作用更为有效。由于 细胞内表达的核酶受到天然的修饰,不易为核酸酶降解,提高了核酶在细胞内的稳定性。我 们 将体外合成的HCV NC区和C区基因的两个反式核酶基因分别克隆入真核细胞表达载体pSV2-g pt.CD-SRα中,转染已证明被HCV感染的MT-2细胞模型,在相对比较接近自然感染的状态下,探讨核酶的抗HCV作用。
, http://www.100md.com
重组HCV 5′NC区及C区核酶基因
(HCRZNC和HCRZC)作用于HCV感染的MT-2细胞后,定量RT-P CR表明单独使用HCRZNC或HCRZC对HCV的抑制率分别为54.7%和62.1%。两者联合作用 时抑制率 达78.8%,提示HCV 5′NC区和C区特异性反式核酶在HCV感染的MT-2细胞模型中对HCV复制均 有明显的抑制作用,两者联合使用较单独使用效果更好,且对细胞无明显的不利影响。核酶 活性区中有一点突变的对照重组体(HCRZCM)对HCV复制具有一定的抑制作用,推测该抑制作 用与核酶两侧的HCV特异性结合部位有关,在以往我们利用特异性反义寡核苷酸体外抑制HCV 的研究中证明了这一点[9]。
参考文献
1,Sarver N, Cantin EM, Chang PS, et al. Ribozymes as potential anti-HI V-1 therapeutic agents. Science, 1990,247:1222-1225.
, 百拇医药
2,Ohkawa J, Koguma T, Kohda T, et al. Ribozymes: from mechanistic studies to ap plications in vivo. J Biochem Tokyo, 1995,118:251-258.
3,Kato N, Nakazawa T, Mizutani T, et al. Susceptibility of human T-lymphotropi c virus type I infected cell line MT-2 to hepatitis C virus infection. Biochem Biophys Res Commun, 1995,206:863-869.
4,Sakamoto N, Wu CH, Wu GY. Intracellular cleavage of hepatitis C virus RNA and inhibition of viral protein translation by hammerhead ribozymes. J Clin Invest 1996,98:2720-2728.
, http://www.100md.com
5,刘勇,陈智,刘克洲,等.重组丙型肝炎病毒基因转染H9细胞模型的建立.中华肝脏病杂 志,1997,5:103-105.
6,陈智,Dennin H,何南祥,等.RT-PCR检测肝炎和肝癌组织中的HCV复制中间体.中华微 生物学和免疫学杂志,1995,15:116-119.
7,Tong MJ, Blatt LM, Tong LT, et al. Long-term retreatment in chronic hepatiti s C patients who were non-responders to an initial course of interferon-alpha 2b. J Viral Hepat 1998,5:323-331.
8,Kasahara A, Hagiwara N, Hayashi N, et al. Ability of prolonged interferon tre atment to suppress ralapse after cessation of therapy in patients with chronic h epatitis C: a multicenter randomized controlled trial. Hepatology, 1995,21:291- 297.
9,刘勇,陈智,何南祥,等.反义寡核苷酸体外抑制丙型肝炎病毒的研究.中华医学杂志,1 997,77:567-570.
收稿日期:1999-02-11, 百拇医药
单位:陈智 刘勇 刘克洲(310003 杭州,浙江大学医学院附属一院传染病研究所,卫生部病毒性传染病重 点实验室);Dennin RH Reinh ard U(德国Luebeck医科大学微生物研究所);窦俊(南京铁道医学院)
关键词:核酶;肝炎病毒,丙型;MT-2细胞
中华传染病杂志000102【摘要】目的 研究核酶抗丙型肝炎病毒(HCV)的有效切割位点并获得高效、特异、无毒、价廉的HCV特异性 反式核酶。方法 根据文献报道的序列设计、合成HCV 5′非结构(NC)区和核心(C)区 的特异性反式核 酶基因并分别克隆进入真核细胞表达载体pSV2-gpt.CD-SRα中,转染HCV感染的MT-2细胞 ,用定量逆转录-聚合酶链反应(RT-PCR)、核酸杂交等方法测定核酶对HCV的抑制作用。结果 所用的HCV 5′NC区核酶和C区核酶对HCV均有显著的抑制作用,抑制 率分别为54.7%和62.1%。两者联合作用时抑制率达78.8%。结论 HCV 5′NC区和C区特异性反式核酶在HCV感染的体外细胞培养模型中 对HCV复制有明显的抑制作用;双靶位核酶联合使用较单靶位核酶效果更好。
, 百拇医药
An in vitro study of ribozyme against hepatitis C virus
CHEN Zhi LIU Yong LIU Kezhou et al.
(The Institute of Infectious Diseases, First Affiliated Hospital, Medic al College, Zhejiang University, Hangzhou 310003, China)
【Abstract】Objective To determine the cleavage sites of ribozymes against hepatitis C virus(HCV), and to obtain a highly effective, nontoxic and inexpensive antisense ribozyme specific for HCV. Methods Two effective ribozymes, targeted to HCV 5′-non-coding region(5′-NCR) and C region, were synthesized. Eukaryotic expression vectors, pSV2-gpt. CD-SRα, containing either HCRZ NC or HCRZC were constructed and transfected into MT-2 cells, which had been in fected by HCV. Quantitative RT-PCR and hybridization methods were used to deter mine the effect of inhibition of HCV by ribozymes. Results HCRZNC and HCRZC suppressed the replication of HCV by 54. 7% and 62.1%, respectively. Furthermore, when the two ribozymes were cotransfect ed into cells, they suppressed replication by 78.8%. Conclusion Two specific antisense ribozymes have strong inhibit ory effects on the replication of HCV in cultured cells, and have better effect when used together.
, 百拇医药
【Key words】Ribozyme; Hepatitis virus, type C; MT-2 cells
核酶(Ribozyme)是一类具有特异性剪切RNA活性的RNA分子。1990年Sarver等[1] 首先报道在体外培养的细胞中用核酶成功抑制了人类免疫缺陷病毒(HIV)的复制,引起越 来越多的医学和生物 工作者的重视。目前核酶已开始应用于人体内治疗[2]。然而,核酶步入临床实践 前,还有许多问题有待于解决。例如:如何选择靶序列中最佳切割位点,如何获得高效、无 毒的特异性反式核酶,如何提高核酶进入靶细胞的效率并稳定发挥作用等。我们在已建立的 丙型肝炎病毒(HCV)感染的细胞模型中进行HCV特异性锤头状核酶抑制HCV复制的研究,探 讨核酶抗HCV的效果 和作用机制。
材料和方法
一、材料
, http://www.100md.com
(一) HCV感染MT-2细胞模型 MT-2细胞为人CD4+T细胞株,按照Kato等[3]报道 的方法制备。
(二) HCV 5′非编码区(NC)及核心区(C)核酶基因及相应的反义引物 根据Sakamoto等 [4]报道的序列,在德国Luebeck医科大学微生物研究所合成。
(三) 其他主要试剂 TA克隆试剂为美国Invitrogen公司产品,以多聚酶链反应产物克隆载 体2.1(PCR 2.1)为载体,在插入片 段两侧各有一个Eco RI位点。真核表达载体pSV2-gpt.CD-SRα由日本九洲大学免疫学研究 所王继扬博士赠送,该质粒带有SV40启动子、信号肽及poly A序列,并带有大肠杆菌的gpt 基 因,该基因编码黄嘌呤-鸟嘌呤磷酸核糖转移酶(XGPRT)可将黄嘌呤转化为鸟苷酸(GMP)的前 体——黄苷酸(XMP),因此可恢复共转染后的受体细胞在XHTA-M选择性培养基(含20%胎 牛血清 、250 μg/ml黄嘌呤、15 μg/ml次黄嘌呤、10 μg/ml胸腺嘧啶、2 μg/ml氨基喋呤和25 μg/ml霉酚酸的1×RPMI 1640培养基,pH 7.4)中被霉酚酸和氨基喋呤阻断的哺乳细胞 的GMP 生物合成途径。外源片段插入该载体的Eco RI位点后转染真核细胞,经gpt筛选可获得稳定 表达的重组体。地高辛(Dig)DNA 3′末端标记试剂盒以及核酸检测试剂盒为德国Boehring M annheim公司产品。
, 百拇医药
二、方法
(一) 抗HCV核酶与pSV2-gpt.CD-SRα的重组 在Taq DNA聚合酶作用下,分别将HCV NC及C 区 核酶基因补成双链,按试剂盒说明书进行TA克隆,转化TOP 10F菌株,经用含有氨苄青霉素 和 X-gel/IPTG的选择性平板作抗性和蓝、白斑筛选,挑出重组克隆后,扩增并纯化重组体, 用内切酶Eco RI进行酶切反应,然后进行琼脂糖电泳,回收和纯化目的片段,按分子克隆常 规插入pSV2-gpt.CD-SRα载体中。为了鉴别抑制HCV复制的作用是来自核酶的切割还是反 义核酸的封闭,以同样的方法构建与HCV C区核酶基因相同但在核酶活性区中有一点突变的 对照重组体,方法与上述相同。上述重组体用相应的探针作斑点杂交后选出阳性克隆,HCV NC区、C区核酶基因及点突变的C区核酶基因分别命名为HCRZNC、HCRZC和HCRZCM。
(二) HCV感染MT-2细胞 用HCV阳性血清感染MT-2细胞后,动态收获部分细胞,用Trizo l试剂提取总RNA,进行逆转录-聚合酶链反应(RT-PCR)检测HCV RNA及其复制中间体,并以 Southern杂交证实,确定HCV感染成功及其感染的时间。
, http://www.100md.com
(三) HCV核酶重组体转染HCV感染的MT-2细胞 HCV感染后的MT-2细胞培养至第5天,用磷 酸钙转染法将上述HCRZNC、HCRZC和HCRZCM重组体转染细胞,操作方法参见文献[5]。转 染细胞培养60 h后收获并洗涤,加XHTA-M选择性培养基重悬细胞,继续培养。
(四) 细胞RNA的提取和检测 于转染后第3、6、9天各收获3×105细胞,用Trizol试剂 抽提总RNA,并以DNase I酶消化后进行如下检测:1.HCV RNA定性检测按先前报道的方法进 行[6]。2.Southern杂交按试剂盒说明书,以HCV NC、C区核酶基因、点突变的C区 核 酶基因寡核苷酸片段及HCV C区寡核苷酸引物分别用Dig进行DNA 3′末端标记。PCR产物电泳 后 ,进行Southern杂交和显色。3.HCV RNA定量RT-PCR检测采用HCV RNA定量检测试剂盒(Ro che Amplicor HCV Monitor TM Test,瑞士Roche公司产品),对第9天收获的细胞进行定量 检测。操作按说明书,并设对照。
, http://www.100md.com
(五) 细胞毒性试验 与未转染核酶基因的细胞对照,动态观察转染核酶基因的各组细胞在 形态和生长方面的情况。
结果
一、HCV感染MT-2细胞
用HCV阳性血清感染的MT-2细胞在培养第7天开始RT-PCR检出HCV RNA,可持续阳性至第28 天 。HCV复制中间体于感染后第10天出现,第18天消失。上述结果经Southern杂交证实其阳性 条带为HCV特异性序列。
二、斑点杂交鉴定核酶
分别用特异性探针作斑点杂交,选出阳性克隆。图1示斑点杂交鉴定核酶与pSV2-gpt.CD-S Rα的重组结果。

, 百拇医药
构建好的HCRZC、HCRZCN和HCRZCM各取10
个克 隆点膜,以含5′NC区和C区基因的HCV cDNA片段为探针杂交,图中A为PCR2.1空载体对照;B 为pSV2-gpt.CD-SRα空载体作阴性对照;C为HCRZC重组体;D为HCRZNC;E为HCRZCM重组体
图1 斑点杂交鉴定核酶重组体结果
三、RT-PCR和Southern杂交
HCRZNC和HCRZC处理的感染细胞中HCV RNA的阳性信号均低于HCRZCM转染的细胞和无核酶基因 插入的空pSV2-gpt.CD-SRα载体转染的细胞。定量PCR结果见图2,经计算,HCR MNC、 HCRMC的抑制作用分别为54.7%和62.1%,两者联合应用时达78.8%。定性PCR结果未 见HCRZCM 对HCV 感染的MT-2细胞中HCV RNA阳性信号有明显影响,定量PCR结果则表明该重组体转染细胞后 ,对HCV复制具有一定的抑制作用,抑制率为28.3%。

, 百拇医药
CM为点突变的C区核酶(HCRZCM);NC为HCV 5′NC区核酶(HCRZNC);C为HCV C区核酶(HVR ZC); NC+C为此二种核酶联合应用;阳性为无核酶基因插入的载体对照;阴性对照为无HCV感染的M T-2细胞对照
图2 核酶对HCV的抑制率
四、细胞形态学观察
与对照组细胞比较,未发现转染有核酶基因的各组细胞在形态和生长方面出现异常。
讨论
HCV感染易导致慢性化,可发展成为肝硬化甚至肝癌。目前主要用干扰素进行治疗,但疗效 尚不够满意[7,8]。因此,有必要寻找其它抗HCV治疗途径。近年来,应用反义核 酸和核酶进行抗病毒治疗的研究有了较大的进展。由于体外合成RNA价格极为昂贵,且在细 胞内容易被RNA酶降解而失活,故从策略上说,核酶抗病毒治疗以基因表达途径,即将核酶 基因用合适的载体导入细胞内,在细胞内转录产生核酶从而发挥抗病毒作用更为有效。由于 细胞内表达的核酶受到天然的修饰,不易为核酸酶降解,提高了核酶在细胞内的稳定性。我 们 将体外合成的HCV NC区和C区基因的两个反式核酶基因分别克隆入真核细胞表达载体pSV2-g pt.CD-SRα中,转染已证明被HCV感染的MT-2细胞模型,在相对比较接近自然感染的状态下,探讨核酶的抗HCV作用。
, http://www.100md.com
重组HCV 5′NC区及C区核酶基因
(HCRZNC和HCRZC)作用于HCV感染的MT-2细胞后,定量RT-P CR表明单独使用HCRZNC或HCRZC对HCV的抑制率分别为54.7%和62.1%。两者联合作用 时抑制率 达78.8%,提示HCV 5′NC区和C区特异性反式核酶在HCV感染的MT-2细胞模型中对HCV复制均 有明显的抑制作用,两者联合使用较单独使用效果更好,且对细胞无明显的不利影响。核酶 活性区中有一点突变的对照重组体(HCRZCM)对HCV复制具有一定的抑制作用,推测该抑制作 用与核酶两侧的HCV特异性结合部位有关,在以往我们利用特异性反义寡核苷酸体外抑制HCV 的研究中证明了这一点[9]。
参考文献
1,Sarver N, Cantin EM, Chang PS, et al. Ribozymes as potential anti-HI V-1 therapeutic agents. Science, 1990,247:1222-1225.
, 百拇医药
2,Ohkawa J, Koguma T, Kohda T, et al. Ribozymes: from mechanistic studies to ap plications in vivo. J Biochem Tokyo, 1995,118:251-258.
3,Kato N, Nakazawa T, Mizutani T, et al. Susceptibility of human T-lymphotropi c virus type I infected cell line MT-2 to hepatitis C virus infection. Biochem Biophys Res Commun, 1995,206:863-869.
4,Sakamoto N, Wu CH, Wu GY. Intracellular cleavage of hepatitis C virus RNA and inhibition of viral protein translation by hammerhead ribozymes. J Clin Invest 1996,98:2720-2728.
, http://www.100md.com
5,刘勇,陈智,刘克洲,等.重组丙型肝炎病毒基因转染H9细胞模型的建立.中华肝脏病杂 志,1997,5:103-105.
6,陈智,Dennin H,何南祥,等.RT-PCR检测肝炎和肝癌组织中的HCV复制中间体.中华微 生物学和免疫学杂志,1995,15:116-119.
7,Tong MJ, Blatt LM, Tong LT, et al. Long-term retreatment in chronic hepatiti s C patients who were non-responders to an initial course of interferon-alpha 2b. J Viral Hepat 1998,5:323-331.
8,Kasahara A, Hagiwara N, Hayashi N, et al. Ability of prolonged interferon tre atment to suppress ralapse after cessation of therapy in patients with chronic h epatitis C: a multicenter randomized controlled trial. Hepatology, 1995,21:291- 297.
9,刘勇,陈智,何南祥,等.反义寡核苷酸体外抑制丙型肝炎病毒的研究.中华医学杂志,1 997,77:567-570.
收稿日期:1999-02-11, 百拇医药