肝细胞癌和癌旁肝组织中血管内皮生长因子表达与微血管密度的关系
作者:冯德云 沈明 郑晖 程瑞雪
单位:冯德云(病理学教研室 长沙 410078);沈明(病理学教研室 长沙 410078);郑晖(病理学教研室 长沙 410078);程瑞雪(病理学教研室 长沙 410078)
关键词:肝肿瘤;癌;血管;内皮生长因子;免疫组织化学
湖南医科大学学报000212 [摘要] 用免疫组织化学法研究肝细胞癌(HCC)及癌旁肝 组织血管内皮生长因子(VEGF)的表达与微血管 (MV)密度的关系。VEGF在癌旁肝组织中 的阳性率较HCC中者为高(85.4% vs. 66.7%;P<0.05);其表达强度在两者中差异 无显 著性(P>0.05);其阳性信号主要位于癌细胞、癌旁肝细胞和血管内皮细胞胞浆。HCC中M V密度明显高于癌旁肝组织(P<0.01),并随癌细胞分化程度的降低而升高。结果提示 ,在HCC发生发展过程中VEGF并非唯一刺激MV生成的因子;MV密度在判断 HCC的预后和生物 学行为方面可能较VEGF蛋白表达更有意义。
, 百拇医药
[中图分类号] R730.22 [文献标识码] A [文章编号] 1000-5625(2000)02-0132-03
Relationship between vascular endothelial growth factor expression and microvessel density in hepatocellular carcinomas and their surrounding liver tissue
FENG De-yun, SHEN Ming, ZHENG Hui, CHENG Rui-xue
Department of Pathology, Hunan Medical University(Changsha 410078)
[Abstract] The relationship between vascular endothelial growth factor (VEGF) expression and microvessel density was studied with immunohistochemical method in hepatocel lular carcinoma (HCC) and pericarcinomatous liver tissue. The positive rate of V EGF in HCCs was significantly lower than in surrounding liver tissues (66.7% v s. 85.4%, P<0.05). There was no significant difference between HCC and pericar cino matous liver tissue on expressive intensity of VEGF. The positive signal of VEGF was mainly localized in cytoplasma of cancer cells, pericarcinomatous hepatocyt es, and vascular endothelial cells. The microvessel density in HCC was higher th an in pericarcinomatous liver tissue and closely correlated to differentiated de gree of cancer cells (rs=0.5870; rs=0.8235). The poorer cancer cell differentiat ion, the higher microvessel density. The results suggest that VEGF may not be th e sole factor that stimulates angiogenesis in HCC genesis and development. To de tect microvessel density in judging prognosis and biological behavior of HCC is more important than that of VEGF.
, http://www.100md.com
[Key words] liver neoplasms; carcinomas; blood vessels; endothelial growth factors; immunohistochemistry
肿瘤血管生成是实体瘤生长和转移的必要条件 [1~4]。微血管(MV)包括细小血管及毛细血管[4],肿瘤中MV可分布于癌细 胞之间和癌巢之间。血管内皮生长因子(VEGF)是与肿瘤血 管生成有关的最重要因子之一[1~5]。关于VEGF表达和MV密度与肝细胞癌(HCC) 的生物学行 为及临床意义的研究仅见个别报道[3]。本文利用免疫组化技术检测HCC和癌旁肝组 织中VEG F的表达、分布,以及分析VEGF表达与MV生成的相关关系,为阐述VEGF在HCC发生发展中的生 物学意义提供一些实验依据。
1 材料与方法
, 百拇医药
1.1 标本 收集1994~1998年我校附属湘雅医院和第二附属医院肝胆外科 手术切除的HCC标 本48例和正常肝组织9例,其中HCC标本均有紧邻癌组织的癌旁肝组织。所有组织经10% Form alin固定,常规石蜡包埋,5 μm连续切片。HCC组织根据Edmondson[6]标准分级, 其中Ⅰ级8 例;Ⅱ级20例;Ⅲ级14例;Ⅳ级6例。癌旁肝组织均有不同程度的肝硬变和肝纤维化,其中3 6例有不典型增生。
1.2 一般资料 HCC患者48例,男42例,女6例,平均年龄52.8 (38~69 )岁。肿瘤直 径≤2 cm者2例;2.1~5 cm者28例;5.1~10 cm者16例;>10 cm者2例。所有患者未发现远 隔转移灶,且术前未做任何放疗和化疗。
1.3 试剂 抗VEGF抗体、抗CD34抗体 (显示血管内皮细胞)和SP试剂盒均 购自武汉博士德公司。
1.4 方法 检测VEGF和CD34采用SP法;用PBS分别代替抗VEGF和抗CD34作阴 性对照。
, 百拇医药
1.4.1 结果评估 VEGF染色结果采用Fromowitz等[7]的综合计分 法;MV计数参照Weidner [8]的方法,随机取5个高倍视野(HP),计数MV,然后取其平均值作为每例样本的 MV密度。
1.4.2 统计学处理 采用t检验、F检验、χ2检 验和相关分析。
2 结 果
2.1 VEGF在HCC及癌旁肝组织中的表达强度及分布 VEGF在HCC和癌旁肝组 织中的阳性率分别为66.7%(32/48)和85.4%(41/48),两者差异显著(P<0.05)。阳性 信号均为全浆型,定位于癌细胞、癌旁肝细胞和血管内皮细胞胞浆;HCC中阳性细胞多呈簇 状分布(图1),癌旁阳性细胞为大片状分布(图2)。癌组织中VEGF信号强度与癌细胞分化 程度无关(P>0.05)(表1)。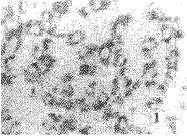
, 百拇医药
图1 Ⅲ级HCC组织中VEGF的表达 SP法,×400
Fig. 1 Expression of VEGF in HCC(Grade Ⅲ) SP ×400
图2 癌旁肝组织中VEGF的表达 SP法,×400
Fig. 1 Expression of VEGF in HCC(Grade Ⅲ) SP ×400
表1 VEGF在HCC及癌旁肝组织中的表达强度 及分布(例) 分组
例数
VEGF表达强度
-
, 百拇医药
+
++
+++
癌旁
48
7
8
13
20
HCC分级
Ⅰ
8
4
2
, http://www.100md.com
1
1
Ⅱ
20
7
2
6
5
Ⅲ
14
4
1
3
6
, 百拇医药
Ⅳ
6
1
0
2
3
2.2 HCC和癌旁肝组织中MV密度 MV在HCC组织中的分布呈异质性,不同区 域计数不同。由 表2可见,MV在Ⅰ~Ⅳ级HCC中的密度随癌细胞分化程度降低而逐渐升高。癌旁肝组织中MV主 要分布近癌区域,尤其是肝硬变假小叶周边 (图3),其平均密度为21±5.4个/HP;正常肝组 织中MV密度为18±5.2个/HP。
图3 癌旁肝组织中MV主要位于肝硬变假小叶周边 SP法 ,×400
, http://www.100md.com
Fig. 3 MV in pericarcinomatous liver tissue mai nly localizing in the peripseudolobular region of cirrhosis SP ×400
表2 HCC和癌旁肝组织中MV密度( ±s) 分 组
±s) 分 组
例数
MV密度(个/HP)
癌 旁
48
21±5.4
HCC分级
, 百拇医药 Ⅰ
8
23±7.2
Ⅱ
20
42±7.4①
Ⅲ
14
63±12.4①
Ⅳ
6
89±10.7①
①与癌旁肝组织比较P<0.01
, http://www.100md.com
2.3 HCC和癌旁肝组织中VEGF的表达强度与MV密度的相关性 表3示,在HC C和癌旁肝组织中MV密度随VEGF表达增强而增高,并呈线性相关(rs=0.58 70;rs=0.8235)。
表3 HCC和癌旁组织中VEGF的表达强度 与MV密度的相关性( ±s) VEGF强度
±s) VEGF强度
HCC组织
癌旁组织
例数
MV密度(个/HP)
例数
MV密度(个/HP)
, http://www.100md.com
-
16
37±15.2
7
15±4.2
+
5
41±18.1
8
17±5.1
++
12
52±16.5①
, 百拇医药
13
22±5.5②④
+++
15
69±23.1②③
20
25±4.8②④
与(-)比较:①P<0.05; ②P<0.01。 与(+)比较: ③P<0. 05; ④P<0.01
3 讨 论
HCC是血管丰富、浸润生长快、转移早的恶性肿瘤[1]。VEGF可特异性地促进血管内皮细胞有丝分裂,与血管生成密切相关,但其与HCC发生发展和生物学行为的关系尚不清楚。Chow等[1]报道VEGF在HCC组织中其阳性反应位于癌细胞胞浆,阳性率36.1% (13/36);非癌组织中阳性信号位于细胞外基质,阳性率100%(36/36),而肝细胞均阴性。本文发现VEGF在HCC和癌旁组织中的阳性率分别为66.7%(32/48)和85.4%(41/48),前者显著低于后者(P<0.05),但表达强度差异不显著(P>0.05);阳性信号主要位于癌细胞、癌旁肝细胞和血管内皮细胞胞浆,细胞外基质中未见阳性反应物。故认为在HCC发生发展中肝癌细胞和肝细胞可能是产生VEGF的主要细胞,而血管内皮细胞可能是VEGF的靶细胞。
, http://www.100md.com
在HCC发生发展过程中伴随有MV的生成,MV主要是血管内皮细胞通过发芽方式生成,VEG F作用的靶细胞可能主要是内皮细胞。有文献谓实体肿瘤MV密度并非每个部位均相同,按其 密度可分为三层,最外MV多,中间层由于缺氧,MV少,而肿瘤的中心MV可缺如[9] 。本文HCC 标本均取自于肿瘤的最外层,且附紧邻的癌旁组织,故各样本的MV密度之间具有可比性。VE GF的表达强度与MV密度的关系已有少数文献报道。E1 Assal等[3]发现HCC中VEGF的 mRNA和蛋 白表达水平与MV密度无关,而肝硬变组织中VEGF表达与MV密度明显相关。笔者发现癌旁肝细 胞VEGF阳性率高于HCC,而表达强度与 HCC差异无显著性(P>0.05),但癌旁组织中MV 密度 却低于肝癌组织(P<0.01),且多位于近癌区域和肝硬变结节的纤维隔附近,与E1 Assa l等[ 3]的结果不一致。笔者认为肝硬变时由于血管重构及纤维组织挤压,使局部缺血缺氧, 刺激 该处 肝细胞表达VEGF增强[10]。但是HCC和癌旁肝组织中VEGF的表达强度 和MV密度均具相 关 性(rs=0.5870;rs=0.8235),提示在HCC中VEGF可能并非促进MV生成的唯一 因子,它 可能与其它生长因子如碱性成纤维细胞生长因子等共同作用促进MV生成。另外,从肝硬变至 HCCⅣ级MV密度逐渐增高。提示MV生成与HCC发生发展和生物学行为密切相关。因此,MV密度 在判断HCC的预后和生物学行为方面可能较VEGF蛋白表达更有意义。
, 百拇医药
参考文献:
[1] Chow NH, Hsu PI, Lin XZ, et al. Expression of vascul ar endothelial growth fact or in normal liver and hepatocelluar carcinoma: An immunohistochemical study[J ]. Hum Pathol, 1997,28(6):698-703.
[2] Mise M, Arii S, Higashituji H, et al. Clinical significance of vascul ar endoth elial growth factor and basic fibroblast growth factor gene expression in liver tumor[J]. Hepatololy, 1996,23(3):455-464.
, 百拇医药
[3] E1 Assal ON, Yamanoi A, Soda Y, et al. Clinical significance of micro vessel de nsity and vascular endothelial growth factor expression in hepatocellular carcin oma and surrounding liver: possible involvement of vascular endothelial growth f actor in the angiogenesis of cirrhotic liver[J]. Hepatology, 1998,27:1554-1562 .
[4] 黄生福,杨竹林,喻梅英,等. 乳腺癌组织中血管定量及其意义[J].湖南医学,1 997,14(5):263-264.
[5] Suzuki K, Hayashi N, Miyamoto Y, et al. Expression of vascular permea bility fa ctor /vascular endothelial growth factor in human hepatocellular carcinoma[J]. Cancer Res, 1996, 56:3004-3009.
, 百拇医药
[6] Edmondson HA, Sterner PE. Primary carcinoma of the liver - A study of 10 0 cases among 48 900 necropsies[J]. Cancer, 1954,462-503.
[7] Fromowitz FB, Viola MV, Chao S, et al. ras p21 expression in the prog ression of breast cancer[J]. Hum Pathol, 1987, 18(12):1268-1275.
[8] Weidner N, Semple JP, Weleh WR, et al. Tumor angiogenesis and metasta sis-correlation in invasive breast carcinoma[J]. N Engl J Med, 1991, 324:1-5.
[9] Rakesh KJ. Physiological barriers to delivery of monoclonal antibodies an d other macromolecules in tumors[J]. Cancer Res, 1990, 55(Suppl): 814s-819s.
[10] Schweiki D, Itin A, Soffer D, et al. Vascular endothelial gro wth fact or induced by hypoxia may mediate hypoxia-initiated angiogenesis[J]. Nature, 1 992,359:843-845., http://www.100md.com
单位:冯德云(病理学教研室 长沙 410078);沈明(病理学教研室 长沙 410078);郑晖(病理学教研室 长沙 410078);程瑞雪(病理学教研室 长沙 410078)
关键词:肝肿瘤;癌;血管;内皮生长因子;免疫组织化学
湖南医科大学学报000212 [摘要] 用免疫组织化学法研究肝细胞癌(HCC)及癌旁肝 组织血管内皮生长因子(VEGF)的表达与微血管 (MV)密度的关系。VEGF在癌旁肝组织中 的阳性率较HCC中者为高(85.4% vs. 66.7%;P<0.05);其表达强度在两者中差异 无显 著性(P>0.05);其阳性信号主要位于癌细胞、癌旁肝细胞和血管内皮细胞胞浆。HCC中M V密度明显高于癌旁肝组织(P<0.01),并随癌细胞分化程度的降低而升高。结果提示 ,在HCC发生发展过程中VEGF并非唯一刺激MV生成的因子;MV密度在判断 HCC的预后和生物 学行为方面可能较VEGF蛋白表达更有意义。
, 百拇医药
[中图分类号] R730.22 [文献标识码] A [文章编号] 1000-5625(2000)02-0132-03
Relationship between vascular endothelial growth factor expression and microvessel density in hepatocellular carcinomas and their surrounding liver tissue
FENG De-yun, SHEN Ming, ZHENG Hui, CHENG Rui-xue
Department of Pathology, Hunan Medical University(Changsha 410078)
[Abstract] The relationship between vascular endothelial growth factor (VEGF) expression and microvessel density was studied with immunohistochemical method in hepatocel lular carcinoma (HCC) and pericarcinomatous liver tissue. The positive rate of V EGF in HCCs was significantly lower than in surrounding liver tissues (66.7% v s. 85.4%, P<0.05). There was no significant difference between HCC and pericar cino matous liver tissue on expressive intensity of VEGF. The positive signal of VEGF was mainly localized in cytoplasma of cancer cells, pericarcinomatous hepatocyt es, and vascular endothelial cells. The microvessel density in HCC was higher th an in pericarcinomatous liver tissue and closely correlated to differentiated de gree of cancer cells (rs=0.5870; rs=0.8235). The poorer cancer cell differentiat ion, the higher microvessel density. The results suggest that VEGF may not be th e sole factor that stimulates angiogenesis in HCC genesis and development. To de tect microvessel density in judging prognosis and biological behavior of HCC is more important than that of VEGF.
, http://www.100md.com
[Key words] liver neoplasms; carcinomas; blood vessels; endothelial growth factors; immunohistochemistry
肿瘤血管生成是实体瘤生长和转移的必要条件 [1~4]。微血管(MV)包括细小血管及毛细血管[4],肿瘤中MV可分布于癌细 胞之间和癌巢之间。血管内皮生长因子(VEGF)是与肿瘤血 管生成有关的最重要因子之一[1~5]。关于VEGF表达和MV密度与肝细胞癌(HCC) 的生物学行 为及临床意义的研究仅见个别报道[3]。本文利用免疫组化技术检测HCC和癌旁肝组 织中VEG F的表达、分布,以及分析VEGF表达与MV生成的相关关系,为阐述VEGF在HCC发生发展中的生 物学意义提供一些实验依据。
1 材料与方法
, 百拇医药
1.1 标本 收集1994~1998年我校附属湘雅医院和第二附属医院肝胆外科 手术切除的HCC标 本48例和正常肝组织9例,其中HCC标本均有紧邻癌组织的癌旁肝组织。所有组织经10% Form alin固定,常规石蜡包埋,5 μm连续切片。HCC组织根据Edmondson[6]标准分级, 其中Ⅰ级8 例;Ⅱ级20例;Ⅲ级14例;Ⅳ级6例。癌旁肝组织均有不同程度的肝硬变和肝纤维化,其中3 6例有不典型增生。
1.2 一般资料 HCC患者48例,男42例,女6例,平均年龄52.8 (38~69 )岁。肿瘤直 径≤2 cm者2例;2.1~5 cm者28例;5.1~10 cm者16例;>10 cm者2例。所有患者未发现远 隔转移灶,且术前未做任何放疗和化疗。
1.3 试剂 抗VEGF抗体、抗CD34抗体 (显示血管内皮细胞)和SP试剂盒均 购自武汉博士德公司。
1.4 方法 检测VEGF和CD34采用SP法;用PBS分别代替抗VEGF和抗CD34作阴 性对照。
, 百拇医药
1.4.1 结果评估 VEGF染色结果采用Fromowitz等[7]的综合计分 法;MV计数参照Weidner [8]的方法,随机取5个高倍视野(HP),计数MV,然后取其平均值作为每例样本的 MV密度。
1.4.2 统计学处理 采用t检验、F检验、χ2检 验和相关分析。
2 结 果
2.1 VEGF在HCC及癌旁肝组织中的表达强度及分布 VEGF在HCC和癌旁肝组 织中的阳性率分别为66.7%(32/48)和85.4%(41/48),两者差异显著(P<0.05)。阳性 信号均为全浆型,定位于癌细胞、癌旁肝细胞和血管内皮细胞胞浆;HCC中阳性细胞多呈簇 状分布(图1),癌旁阳性细胞为大片状分布(图2)。癌组织中VEGF信号强度与癌细胞分化 程度无关(P>0.05)(表1)。

, 百拇医药
图1 Ⅲ级HCC组织中VEGF的表达 SP法,×400

Fig. 1 Expression of VEGF in HCC(Grade Ⅲ) SP ×400
图2 癌旁肝组织中VEGF的表达 SP法,×400
Fig. 1 Expression of VEGF in HCC(Grade Ⅲ) SP ×400
表1 VEGF在HCC及癌旁肝组织中的表达强度 及分布(例) 分组
例数
VEGF表达强度
-
, 百拇医药
+
++
+++
癌旁
48
7
8
13
20
HCC分级
Ⅰ
8
4
2
, http://www.100md.com
1
1
Ⅱ
20
7
2
6
5
Ⅲ
14
4
1
3
6
, 百拇医药
Ⅳ
6
1
0
2
3
2.2 HCC和癌旁肝组织中MV密度 MV在HCC组织中的分布呈异质性,不同区 域计数不同。由 表2可见,MV在Ⅰ~Ⅳ级HCC中的密度随癌细胞分化程度降低而逐渐升高。癌旁肝组织中MV主 要分布近癌区域,尤其是肝硬变假小叶周边 (图3),其平均密度为21±5.4个/HP;正常肝组 织中MV密度为18±5.2个/HP。

图3 癌旁肝组织中MV主要位于肝硬变假小叶周边 SP法 ,×400
, http://www.100md.com
Fig. 3 MV in pericarcinomatous liver tissue mai nly localizing in the peripseudolobular region of cirrhosis SP ×400
表2 HCC和癌旁肝组织中MV密度(
 ±s) 分 组
±s) 分 组例数
MV密度(个/HP)
癌 旁
48
21±5.4
HCC分级
, 百拇医药 Ⅰ
8
23±7.2
Ⅱ
20
42±7.4①
Ⅲ
14
63±12.4①
Ⅳ
6
89±10.7①
①与癌旁肝组织比较P<0.01
, http://www.100md.com
2.3 HCC和癌旁肝组织中VEGF的表达强度与MV密度的相关性 表3示,在HC C和癌旁肝组织中MV密度随VEGF表达增强而增高,并呈线性相关(rs=0.58 70;rs=0.8235)。
表3 HCC和癌旁组织中VEGF的表达强度 与MV密度的相关性(
 ±s) VEGF强度
±s) VEGF强度HCC组织
癌旁组织
例数
MV密度(个/HP)
例数
MV密度(个/HP)
, http://www.100md.com
-
16
37±15.2
7
15±4.2
+
5
41±18.1
8
17±5.1
++
12
52±16.5①
, 百拇医药
13
22±5.5②④
+++
15
69±23.1②③
20
25±4.8②④
与(-)比较:①P<0.05; ②P<0.01。 与(+)比较: ③P<0. 05; ④P<0.01
3 讨 论
HCC是血管丰富、浸润生长快、转移早的恶性肿瘤[1]。VEGF可特异性地促进血管内皮细胞有丝分裂,与血管生成密切相关,但其与HCC发生发展和生物学行为的关系尚不清楚。Chow等[1]报道VEGF在HCC组织中其阳性反应位于癌细胞胞浆,阳性率36.1% (13/36);非癌组织中阳性信号位于细胞外基质,阳性率100%(36/36),而肝细胞均阴性。本文发现VEGF在HCC和癌旁组织中的阳性率分别为66.7%(32/48)和85.4%(41/48),前者显著低于后者(P<0.05),但表达强度差异不显著(P>0.05);阳性信号主要位于癌细胞、癌旁肝细胞和血管内皮细胞胞浆,细胞外基质中未见阳性反应物。故认为在HCC发生发展中肝癌细胞和肝细胞可能是产生VEGF的主要细胞,而血管内皮细胞可能是VEGF的靶细胞。
, http://www.100md.com
在HCC发生发展过程中伴随有MV的生成,MV主要是血管内皮细胞通过发芽方式生成,VEG F作用的靶细胞可能主要是内皮细胞。有文献谓实体肿瘤MV密度并非每个部位均相同,按其 密度可分为三层,最外MV多,中间层由于缺氧,MV少,而肿瘤的中心MV可缺如[9] 。本文HCC 标本均取自于肿瘤的最外层,且附紧邻的癌旁组织,故各样本的MV密度之间具有可比性。VE GF的表达强度与MV密度的关系已有少数文献报道。E1 Assal等[3]发现HCC中VEGF的 mRNA和蛋 白表达水平与MV密度无关,而肝硬变组织中VEGF表达与MV密度明显相关。笔者发现癌旁肝细 胞VEGF阳性率高于HCC,而表达强度与 HCC差异无显著性(P>0.05),但癌旁组织中MV 密度 却低于肝癌组织(P<0.01),且多位于近癌区域和肝硬变结节的纤维隔附近,与E1 Assa l等[ 3]的结果不一致。笔者认为肝硬变时由于血管重构及纤维组织挤压,使局部缺血缺氧, 刺激 该处 肝细胞表达VEGF增强[10]。但是HCC和癌旁肝组织中VEGF的表达强度 和MV密度均具相 关 性(rs=0.5870;rs=0.8235),提示在HCC中VEGF可能并非促进MV生成的唯一 因子,它 可能与其它生长因子如碱性成纤维细胞生长因子等共同作用促进MV生成。另外,从肝硬变至 HCCⅣ级MV密度逐渐增高。提示MV生成与HCC发生发展和生物学行为密切相关。因此,MV密度 在判断HCC的预后和生物学行为方面可能较VEGF蛋白表达更有意义。
, 百拇医药
参考文献:
[1] Chow NH, Hsu PI, Lin XZ, et al. Expression of vascul ar endothelial growth fact or in normal liver and hepatocelluar carcinoma: An immunohistochemical study[J ]. Hum Pathol, 1997,28(6):698-703.
[2] Mise M, Arii S, Higashituji H, et al. Clinical significance of vascul ar endoth elial growth factor and basic fibroblast growth factor gene expression in liver tumor[J]. Hepatololy, 1996,23(3):455-464.
, 百拇医药
[3] E1 Assal ON, Yamanoi A, Soda Y, et al. Clinical significance of micro vessel de nsity and vascular endothelial growth factor expression in hepatocellular carcin oma and surrounding liver: possible involvement of vascular endothelial growth f actor in the angiogenesis of cirrhotic liver[J]. Hepatology, 1998,27:1554-1562 .
[4] 黄生福,杨竹林,喻梅英,等. 乳腺癌组织中血管定量及其意义[J].湖南医学,1 997,14(5):263-264.
[5] Suzuki K, Hayashi N, Miyamoto Y, et al. Expression of vascular permea bility fa ctor /vascular endothelial growth factor in human hepatocellular carcinoma[J]. Cancer Res, 1996, 56:3004-3009.
, 百拇医药
[6] Edmondson HA, Sterner PE. Primary carcinoma of the liver - A study of 10 0 cases among 48 900 necropsies[J]. Cancer, 1954,462-503.
[7] Fromowitz FB, Viola MV, Chao S, et al. ras p21 expression in the prog ression of breast cancer[J]. Hum Pathol, 1987, 18(12):1268-1275.
[8] Weidner N, Semple JP, Weleh WR, et al. Tumor angiogenesis and metasta sis-correlation in invasive breast carcinoma[J]. N Engl J Med, 1991, 324:1-5.
[9] Rakesh KJ. Physiological barriers to delivery of monoclonal antibodies an d other macromolecules in tumors[J]. Cancer Res, 1990, 55(Suppl): 814s-819s.
[10] Schweiki D, Itin A, Soffer D, et al. Vascular endothelial gro wth fact or induced by hypoxia may mediate hypoxia-initiated angiogenesis[J]. Nature, 1 992,359:843-845., http://www.100md.com