p14ARF基因抑制肿瘤细胞增殖的研究范国昌 雷磊 谢建君 吴祖泽
作者:
单位:范国昌(军事医学科学院放射医学研究所,北京 100850);雷磊(解放军总医院耳鼻喉科,北京 100853);谢建君(北京儿童医院血检室,北京 100045);吴祖泽(军事医学科学院放射医学研究所,北京 100850)
关键词:p14ARF;肿瘤抑制;p53;耐药肿瘤细胞
癌症000202
【摘 要】目的:从正常人肝细胞系L02细胞中扩增人的肿瘤抑制基因p14ARF,以研究其对人的多种肿瘤细胞生长的影响。方法:应用RT-PCR技术,从培养的正常人肝细胞系L02细胞中扩增出0.4Kb的p14ARFcDNA片段,测序正确后插入真核表达载体pcDNA3上的BamHI和EcoRI位点,命名为pcDNA3ARF。此质粒由脂质体LipofectamineTM介导转染肿瘤细胞Hep2、KB、KB-v200、HepG2、HLE、Huh7以及MCF7和MCF7/ADR,经G418筛选2周后统计形成的集落数。结果:经抗生素G418筛选2周后,发现p53阳性的肿瘤细胞HepG2、Hep2、MCF7形成的集落数较少,分别为59±2.1,60±2.1和66±7.0,占各自对照组的47%,57%,58%;而p53异常的肿瘤细胞KB,HLE,Huh-7,则形成相对较多的集落,分别为91±2.5,48±2.0,41±2.0,占各自对照组的74%,65%,80%,但是二种p53异常的耐药肿瘤细胞株KB-v200和MCF7/ADR,形成的集落数最少,分别为13±2.0和21±1.5,占各自转染空载体pcDNA3的对照组的15%和17%。结论:p14ARF能明显抑制p53阳性肿瘤细胞的生长,具有p53相关性;然而p14ARF对p53阴性的耐药肿瘤细胞却具有强烈的抑制作用,由此提示:p14ARF抑制耐药肿瘤细胞的生长是p53非依赖性的(至少在这两种耐药肿瘤细胞中)。
, http://www.100md.com
中图分类号:R735.5 文献标识码:A
文章编号:1000-467X(2000)02-0104-04
Transfer of p14ARF gene in human tumor cell lines inhibits cell proliferation
FAN Guo-chang
(Beijing Institute of Radiation Medicine,Beijing 100850, P.R.China)
LEI Lei
(PLA General Hospital,Beijing 100853, P.R.China)
, http://www.100md.com
XIE Jian-jun
(Beijing Children Hospital,Beijing 100045, P.R.China)
【Abstract】 Objective: To clone p14ARF gene from cells of the human normal liver cell line L02 and explore its inhibitory effect on tumor cell proliferation. Methods: p14ARF cDNA was cloned from L02 cells by using RT- PCR method and inserted into the BamHI and EcoRI sites of pcDNA3 (called pcDNA3ARF). Lipofectamine mediated pcDNA3ARF was transferred into tumor cell lines, such as Hep2, KB, KB- v200, HepG2, HLE, Huh7, MCF7 and MCF7/ADR. The number of colonies of these tumor cell lines were calculated after more than two weeks' screening in DMEM medium containing G418. Results:The colony-forming efficiency of the p14ARF -transfected KB-v200 and MCF7/ADR drug-resistant cells was 13± 2.0 and 21± 1.5 , respectively, compared with 86± 3.1(15% )and 126± 7.5(17% )in the cells transfected with empty vector pcDNA3, and in the p53 positive tumor cell lines, such as HepG2(47% ), Hep2(57% ), MCF7(58% ) cells, the inhibition was also found, whereas in the p53 negative tumor cell lines, such as KB(74% ), HLE(65% ), Huh-7(80% ) cells, the inhibitory effect was milder. Conclusions: p14ARF can suppress the growth of the p53 positive tumor cell lines in a p53-relevant manner, while in the p53 negative, drug-resistant tumor cells, p14ARF has strong inhibitory effect, indicating the inhibitory effect of p14ARF on growth of drug-resistant tumor cells is independent on p53, at least in KB-v200 and MCF7/ADR drug-resistant cells.
, http://www.100md.com
Key words:p14ARF; Tumor growth suppress; p53; Drug-resistant tumor cells
细胞周期的调控是由许多不同基因组成的多条通路来完成的。在人类肿瘤细胞中,少数的几种基因经常发生突变,这些基因包括p53,RB,INK4α/ARF等。然而,正是它们构成的两条分子通路:RB通路(p16INK4α-RB)和p53通路(ARF-p53)在调控人类肿瘤发生的过程中起着关键的作用,其中RB通路中的INK4α(p16INK4α)和p53通路中的p53是经常发生改变的两个基因[1,2]。RB通路发挥肿瘤抑制功能,是通过抑制细胞G1-S期必须基因的转录,从而将细胞阻滞于G1期;p53通路则产生两种情况:细胞凋亡和阻滞细胞于G1期,这主要依赖于细胞类型和细胞状态。p53作为顺式作用因子和细胞内其它蛋白相互作用,最终产生肿瘤抑制功能。最近研究表明[3],这两条途径通过INK4α/ARF(9p21)位点而联系起来,该位点通过不同的阅读框架而编码两种不同的肿瘤抑制蛋白:p16和p14ARF(鼠的同源物为p19ARF)。关于p16INK4α抑制肿瘤细胞增殖及其机制的研究,已有很多报道。而目前有关p14ARF的认识大都来源于鼠的p19ARF[4]。因此本文从正常人肝细胞系L02细胞中,RT-PCR扩增出0.4kb长的p14ARF基因,以研究其对人的多种肿瘤细胞生长的影响。
, 百拇医药
1 材料与方法
1.1 细胞系
L02,人正常肝细胞系;Hep2,人喉鳞癌细胞系;KB,人鼻咽癌细胞系;KB-v200,鼻咽癌长春新碱耐药株;HepG2、HLE、Huh-7,人肝癌细胞系;MCF-7,人乳腺癌细胞系;MCF-7/ADR,乳腺癌阿霉素耐药株。上述细胞系除耐药细胞株外皆培养在37℃、5%CO2的条件,含10%胎牛血清的高糖DMEM培养基(Gibco/BRL)中;KB-v200细胞的培养则需要在正常培养液中添加80nmol/ml长春新碱,MCF-7/ADR细胞的培养则需要添加8μg/ml阿霉素,实验前一周撤去药物。
1.2 p14ARF基因的克隆及真核表达载体的构建
1.2.1 一般分子生物学操作方法:按常规方法[5]进行,一些分子生物学工具酶均为Promega公司产品。引物的合成及序列测定由大连宝生物工程公司完成。
, http://www.100md.com
1.2.2 RNA的提取及RT-PCR反应:胰酶消化生长状态良好的L02细胞,离心收集后用冷的PBS洗两次,再按RNA提取试剂盒操作步骤提取细胞总RNA。取总RNA1μg,加入Oligo(dT)引物1μg,在20μl体积、42℃作逆转录反应。取5μl逆转录产物为模板,进行PCR反应扩增。PCR反应条件如下:94℃,1min;50℃,1min;72℃,1.5min;5个循环。94℃,1min;60℃,1min;72℃,1.5min;35个循环。72℃延伸10min。AMV逆转录酶,Taq酶均为Promega公司产品。p14ARF基因的引物如下:
上游引物:5'GGC GGA TCC ATG GTG CGC AGG TTC T-3'
下游引物:5'CCG AAT TCT CAG CCA GGT CCA CG-3'
1.2.3 p14ARFcDNA测序载体及真核表达载体的构建:上述RTPCR产物用Wizard Plus Minipreps DNA Purification System(Promega公司)回收纯化,再用BamHI和EcoRI酶切,1.5%的琼脂糖凝胶电泳回收此酶切的0.4kbp14ARF cDNA,克隆到质粒pSK的BamHI和EcoRI位点,命名为pSKARF。测序正确无误后,再将0.4kbp14ARF cDNA定向插入真核表达载体pcDNA3上的BamHI和EcoRI位点,命名为pcDNA3ARF。
, http://www.100md.com
1.3 pcDNA3ARF转染肿瘤细胞
生长状态良好的肿瘤细胞,胰酶消化后铺于6孔板中,每孔3×105细胞,生长至80%汇合后,按脂质体试剂LipofectamineTM(Gibco/BRL)转染步骤转染pcDNA3ARF和对照质粒pcDNA3。每孔加入1μg质粒和6μl脂质体,转染混合液加入到肿瘤细胞后,37℃,5%CO2培养6h,再加入含20%胎牛血清的DMEM培养液,继续培养72h,胰酶消化,转入25cm2的培养瓶内,每瓶5×105细胞,同时加入相应浓度的抗生素G418(Gibco/BRL)。Hep2、HepG2、MCF7和KB细胞,加入的抗生素浓度为800μg/ml,HLE和Huh7细胞为400μg/ml,KB-v200和MCF7/ADR细胞为300μg/ml。每隔3至4天换一次培养液,G418筛选2周(Huh7细胞生长较慢,需筛选3至4周)后,4%甲醛固定,结晶紫染色,统计形成的集落数。
, http://www.100md.com
2 结果
2.1 p14ARFcDNA的扩增和鉴定
应用RT-PCR技术,从培养的正常人肝细胞系L02细胞中扩增了0.4Kb的cDNA片段(图1)。BamHI和EcoRI酶切回收此片段,克隆到质粒pSK的BamHI和EcoRI位点上,命名为pSKARF,进行核苷酸序列测定分析,结果证实与文献[6,7]报道的序列一致。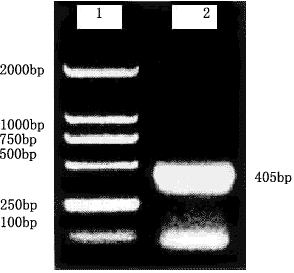
图1 p14ARFcDNA的RT-PCR扩增
1.DL2000 DNA Marker 2.p14ARFcDNA
GGC GGA TCC ATG GTG CGC AGG TTC TTG GTG ACC CTC CGG ATT CGG CGC GCG TGC GGC CCG
, 百拇医药
CCG CGA GTG AGG GTT TTC GTG GTT CAC ATC CCG CGG CTC ACG GGG GAG TGG GCA GCG CCA
GGG GCG CCC GCC GCT GTG GCC CTC GTG CTG ATG CTA CTG AGG AGC CAG CGT CTA GGG CAG
CAG CCG CTT CCT AGA AGA CCA GGT CAT GAT GAT GGG CAG CGC CCG AGT GGC GGA GCT GCT
GCT GCT CCA CGG CGC GGA GCC CAA CTG CGC CGA CCC CGC CAC TCT CAC CCG ACC CGT GCA
CGA CGC TGC CCG GGA GGG CTT CCT GGA CAC GCT GGT GGT GCT GCA CCG GGC CGG GGC GCG
, http://www.100md.com
GCT GGA CGT GCG CGA TGC CTG GGG CCG CCG TCT GCC CGT GGA CCT GGC TGA GAA TTC
2.2 p14ARF真核表达载体的构建
经测序分析正确无误后,再用BamHI和EcoRI酶切质粒pSKARF,得到0.4Kb的ARF基因片段,插入真核表达载体pcDNA3的BamHI和EcoRI位点,命名为pcDNA3ARF,具体构建过程如图2,酶切鉴定证实p14ARF真核表达载体构建正确(图3)。
图2 p14ARF真核表达载体的构建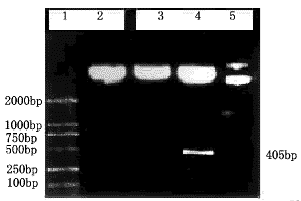
, 百拇医药
图3 pcDNA3ARF的酶切鉴定
1.DL2000DNAMarker;2.pcDNA3ARF/EcoRI;
3.pcDNA3ARF/BamHI;4.pcDNA3ARF/EcoRI+BamHI;
5.pcDNA3ARF
2.3 p14ARF对肿瘤细胞集落生长的影响
pcDNA3ARF由脂质体介导转染肿瘤细胞后,经抗生素G418筛选2周(Huh7细胞生长较慢,需筛选3至4周),再用甲醛固定、结晶紫染色后,计数各种肿瘤细胞的集落(表1)。结果发现二种耐药肿瘤细胞株KB-v200和MCF7/ADR的集落数最少,分别为13±2.0和21±1.5,占各自转染空载体pcDNA3对照组的15%和17%。而p53阳性的肿瘤细胞HepG2、Hep2、MCF7形成的集落数也较少,分别为59±2.1,60±2.1和66±7.0,占各自对照组的47%,57%,58%;p53异常的肿瘤细胞KB,HLE,Huh-7,则形成相对较多的集落,分别为91±2.5,48±2.0,41±2.0,占各自对照组的74%,65%,80%。由此可见,p14ARF能明显抑制p53阳性肿瘤细胞的生长,而对p53阴性的肿瘤细胞生长的影响则相对较少,表明p14ARF抑制人肿瘤细胞的生长具有p53相关性。但是本文实验结果也显示出:p14ARF对耐药肿瘤细胞具有强烈的抑制作用,而这两种耐药细胞株都是p53异常的,这说明p14ARF抑制耐药肿瘤细胞的生长是p53非依赖性的。
, http://www.100md.com
表1 转染p14ARF基因后肿瘤细胞克隆形成率 细胞系
细胞类型
内源性
p53状况
转染pcDNA3ARF
( ±s)
±s)
转染pcDNA3
( ±s)
±s)
相对生长率
, 百拇医药 pcDNA3ARF/pcDNA3)
Hep2
喉鳞癌
+
60±2.1
105±2.0
57%
KB
鼻咽癌
-
91±2.5
123±5.5
74%
, http://www.100md.com
KB-v200
鼻咽癌/VCR
-
13±2.0
86±3.1
15%
耐药株
HepG2
肝癌
+
59±2.1
126±6.2
47%
, 百拇医药
HLE
肝癌
-
48±2.0
74±4.2
65%
Hle
肝癌
-
41±2.0
50±3.1
80%
Huh-7
, 百拇医药
乳腺癌
+
66±7.0
114±6.7
58%
MCF-7
乳腺癌/ADR
-
21±1.5
126±7.5
17%
MCF-7/ADR
耐药株
, 百拇医药
3 讨论
目前对细胞周期调控和细胞凋亡的分子机理的认识逐渐加深,促进了肿瘤基因治疗研究的发展。迄今为止,人们已对p53,p16,RB,Mda-7等抑癌基因,通过各种载体导入多种肿瘤细胞进行体内、外试验,均获得了一定的预期效果[8]。而对于抑癌基因家族的新成员p14ARF则研究较少,对此基因功能的认识基本上都来源于鼠的p19ARF。鉴于此,本文从正常人肝细胞系L02细胞中RT-PCR扩增出0.4Kb基因,并克隆到真核表达载体pcDNA3上,转染多种肿瘤细胞。结果显示:p14ARF能明显抑制p53阳性肿瘤细胞集落的形成。过去已有报道鼠的p19ARF能阻滞细胞于G1期和G2/M期(Quelle等,1995)[9],而Stott[10]等人(1998)的研究结果也说明:p14ARF的表达能阻滞人p53阳性的乳腺癌细胞系MCF7于G1期,但却不能诱导p53阴性的人肺癌细胞系H1299细胞和骨肉瘤SOAS2细胞的生长阻滞,由此提示了:p14ARF抑制人肿瘤细胞生长的p53相关性。我们的研究结果进一步支持了这一观点;但是另一方面,本文从p14ARF转染耐药肿瘤细胞的实验结果中却得出了相反的观点,即尽管KB-V200和MCF7/ADR都有p53异常,但是p14ARF却强烈抑制它们的生长,这提示p14ARF抑制耐药肿瘤细胞的生长是独立于p53途径的。由于大多数肿瘤患者经多次化疗后,都会产生肿瘤细胞对化疗药物的耐药性,因而在肿瘤基因治疗中,p14ARF的应用将是继p53之后的一个重要发展策略,这一发现的分子机理我们正在研究之中。
, http://www.100md.com
[编辑 :钟均行 ;校对 :甘可建 ]
通讯作者:吴祖泽:Tel:86-10-68158311
Fax:86-10-68158311
E-mail:wuct@nic.bmi.ac.cn
[参考文献]
[1] Levine AJ. p53,the cellular gatekeeper for growth and division [J]. Cell, 1997,88(3):323~331.
[2] Sheer CJ. Cancer cell cycle [J]. Science, 1996,274:1672~1677.
, 百拇医药
[3] Chin L, Pomerantz J, DePinho RA. The INK4α/ARF tumor suppressor: one gene-two products-two pathways [J]. Trends Biochem Sci, 1998,23(8):291~296.
[4] Sheer CJ. Tumor surveillance via the ARF- p53 pathway [J]. Genes & Development, 1998,12(19):2984~2991.
[5] 奥斯伯 F ,金斯顿 RE,赛德曼 JG,等,编著. 颜子颍,王海林,译.精编分子生物学实验指南[M].北京:科学出版社,1998:29~108.
[6] Duro D, Bernard O, Della Valle V, et al. A new type of p16INK4/MTS1 gene transcript expressed in B-cell malignancies [J]. Oncogene,1995,11(1):21~29.
, 百拇医药
[7] Mao L, Merlo A, Bedi G, et al. A novel p16INK4A transcript [J]. Cancer Res. 1995,55(14):2995~2997.
[8] Paillard F. Cancer gene therapy annual conference 1997:Trends and News [J]. Human Gene Therapy,1998,9(3):283~286.
[9] Quelle DE, Zindy F, Ashmun RA, et al. Alternative reading frames of the INK4a tumor suppressor gene encode two unrelated proteins capable of inducing cell cycle arrest [J]. Cell, 1995,83(6):993~1000.
[10] Stott FJ, Bates SA, James MC, et al. The alternative product from the human CDKN2A locus, p14ARF, participates in a regulatory feedback loop with p53 and MDM2 [J]. EMBO J, 1998,17(17):5001~5014.
收稿日期:1999-12-02;修回日期:1999-12-24, http://www.100md.com
单位:范国昌(军事医学科学院放射医学研究所,北京 100850);雷磊(解放军总医院耳鼻喉科,北京 100853);谢建君(北京儿童医院血检室,北京 100045);吴祖泽(军事医学科学院放射医学研究所,北京 100850)
关键词:p14ARF;肿瘤抑制;p53;耐药肿瘤细胞
癌症000202
【摘 要】目的:从正常人肝细胞系L02细胞中扩增人的肿瘤抑制基因p14ARF,以研究其对人的多种肿瘤细胞生长的影响。方法:应用RT-PCR技术,从培养的正常人肝细胞系L02细胞中扩增出0.4Kb的p14ARFcDNA片段,测序正确后插入真核表达载体pcDNA3上的BamHI和EcoRI位点,命名为pcDNA3ARF。此质粒由脂质体LipofectamineTM介导转染肿瘤细胞Hep2、KB、KB-v200、HepG2、HLE、Huh7以及MCF7和MCF7/ADR,经G418筛选2周后统计形成的集落数。结果:经抗生素G418筛选2周后,发现p53阳性的肿瘤细胞HepG2、Hep2、MCF7形成的集落数较少,分别为59±2.1,60±2.1和66±7.0,占各自对照组的47%,57%,58%;而p53异常的肿瘤细胞KB,HLE,Huh-7,则形成相对较多的集落,分别为91±2.5,48±2.0,41±2.0,占各自对照组的74%,65%,80%,但是二种p53异常的耐药肿瘤细胞株KB-v200和MCF7/ADR,形成的集落数最少,分别为13±2.0和21±1.5,占各自转染空载体pcDNA3的对照组的15%和17%。结论:p14ARF能明显抑制p53阳性肿瘤细胞的生长,具有p53相关性;然而p14ARF对p53阴性的耐药肿瘤细胞却具有强烈的抑制作用,由此提示:p14ARF抑制耐药肿瘤细胞的生长是p53非依赖性的(至少在这两种耐药肿瘤细胞中)。
, http://www.100md.com
中图分类号:R735.5 文献标识码:A
文章编号:1000-467X(2000)02-0104-04
Transfer of p14ARF gene in human tumor cell lines inhibits cell proliferation
FAN Guo-chang
(Beijing Institute of Radiation Medicine,Beijing 100850, P.R.China)
LEI Lei
(PLA General Hospital,Beijing 100853, P.R.China)
, http://www.100md.com
XIE Jian-jun
(Beijing Children Hospital,Beijing 100045, P.R.China)
【Abstract】 Objective: To clone p14ARF gene from cells of the human normal liver cell line L02 and explore its inhibitory effect on tumor cell proliferation. Methods: p14ARF cDNA was cloned from L02 cells by using RT- PCR method and inserted into the BamHI and EcoRI sites of pcDNA3 (called pcDNA3ARF). Lipofectamine mediated pcDNA3ARF was transferred into tumor cell lines, such as Hep2, KB, KB- v200, HepG2, HLE, Huh7, MCF7 and MCF7/ADR. The number of colonies of these tumor cell lines were calculated after more than two weeks' screening in DMEM medium containing G418. Results:The colony-forming efficiency of the p14ARF -transfected KB-v200 and MCF7/ADR drug-resistant cells was 13± 2.0 and 21± 1.5 , respectively, compared with 86± 3.1(15% )and 126± 7.5(17% )in the cells transfected with empty vector pcDNA3, and in the p53 positive tumor cell lines, such as HepG2(47% ), Hep2(57% ), MCF7(58% ) cells, the inhibition was also found, whereas in the p53 negative tumor cell lines, such as KB(74% ), HLE(65% ), Huh-7(80% ) cells, the inhibitory effect was milder. Conclusions: p14ARF can suppress the growth of the p53 positive tumor cell lines in a p53-relevant manner, while in the p53 negative, drug-resistant tumor cells, p14ARF has strong inhibitory effect, indicating the inhibitory effect of p14ARF on growth of drug-resistant tumor cells is independent on p53, at least in KB-v200 and MCF7/ADR drug-resistant cells.
, http://www.100md.com
Key words:p14ARF; Tumor growth suppress; p53; Drug-resistant tumor cells
细胞周期的调控是由许多不同基因组成的多条通路来完成的。在人类肿瘤细胞中,少数的几种基因经常发生突变,这些基因包括p53,RB,INK4α/ARF等。然而,正是它们构成的两条分子通路:RB通路(p16INK4α-RB)和p53通路(ARF-p53)在调控人类肿瘤发生的过程中起着关键的作用,其中RB通路中的INK4α(p16INK4α)和p53通路中的p53是经常发生改变的两个基因[1,2]。RB通路发挥肿瘤抑制功能,是通过抑制细胞G1-S期必须基因的转录,从而将细胞阻滞于G1期;p53通路则产生两种情况:细胞凋亡和阻滞细胞于G1期,这主要依赖于细胞类型和细胞状态。p53作为顺式作用因子和细胞内其它蛋白相互作用,最终产生肿瘤抑制功能。最近研究表明[3],这两条途径通过INK4α/ARF(9p21)位点而联系起来,该位点通过不同的阅读框架而编码两种不同的肿瘤抑制蛋白:p16和p14ARF(鼠的同源物为p19ARF)。关于p16INK4α抑制肿瘤细胞增殖及其机制的研究,已有很多报道。而目前有关p14ARF的认识大都来源于鼠的p19ARF[4]。因此本文从正常人肝细胞系L02细胞中,RT-PCR扩增出0.4kb长的p14ARF基因,以研究其对人的多种肿瘤细胞生长的影响。
, 百拇医药
1 材料与方法
1.1 细胞系
L02,人正常肝细胞系;Hep2,人喉鳞癌细胞系;KB,人鼻咽癌细胞系;KB-v200,鼻咽癌长春新碱耐药株;HepG2、HLE、Huh-7,人肝癌细胞系;MCF-7,人乳腺癌细胞系;MCF-7/ADR,乳腺癌阿霉素耐药株。上述细胞系除耐药细胞株外皆培养在37℃、5%CO2的条件,含10%胎牛血清的高糖DMEM培养基(Gibco/BRL)中;KB-v200细胞的培养则需要在正常培养液中添加80nmol/ml长春新碱,MCF-7/ADR细胞的培养则需要添加8μg/ml阿霉素,实验前一周撤去药物。
1.2 p14ARF基因的克隆及真核表达载体的构建
1.2.1 一般分子生物学操作方法:按常规方法[5]进行,一些分子生物学工具酶均为Promega公司产品。引物的合成及序列测定由大连宝生物工程公司完成。
, http://www.100md.com
1.2.2 RNA的提取及RT-PCR反应:胰酶消化生长状态良好的L02细胞,离心收集后用冷的PBS洗两次,再按RNA提取试剂盒操作步骤提取细胞总RNA。取总RNA1μg,加入Oligo(dT)引物1μg,在20μl体积、42℃作逆转录反应。取5μl逆转录产物为模板,进行PCR反应扩增。PCR反应条件如下:94℃,1min;50℃,1min;72℃,1.5min;5个循环。94℃,1min;60℃,1min;72℃,1.5min;35个循环。72℃延伸10min。AMV逆转录酶,Taq酶均为Promega公司产品。p14ARF基因的引物如下:
上游引物:5'GGC GGA TCC ATG GTG CGC AGG TTC T-3'
下游引物:5'CCG AAT TCT CAG CCA GGT CCA CG-3'
1.2.3 p14ARFcDNA测序载体及真核表达载体的构建:上述RTPCR产物用Wizard Plus Minipreps DNA Purification System(Promega公司)回收纯化,再用BamHI和EcoRI酶切,1.5%的琼脂糖凝胶电泳回收此酶切的0.4kbp14ARF cDNA,克隆到质粒pSK的BamHI和EcoRI位点,命名为pSKARF。测序正确无误后,再将0.4kbp14ARF cDNA定向插入真核表达载体pcDNA3上的BamHI和EcoRI位点,命名为pcDNA3ARF。
, http://www.100md.com
1.3 pcDNA3ARF转染肿瘤细胞
生长状态良好的肿瘤细胞,胰酶消化后铺于6孔板中,每孔3×105细胞,生长至80%汇合后,按脂质体试剂LipofectamineTM(Gibco/BRL)转染步骤转染pcDNA3ARF和对照质粒pcDNA3。每孔加入1μg质粒和6μl脂质体,转染混合液加入到肿瘤细胞后,37℃,5%CO2培养6h,再加入含20%胎牛血清的DMEM培养液,继续培养72h,胰酶消化,转入25cm2的培养瓶内,每瓶5×105细胞,同时加入相应浓度的抗生素G418(Gibco/BRL)。Hep2、HepG2、MCF7和KB细胞,加入的抗生素浓度为800μg/ml,HLE和Huh7细胞为400μg/ml,KB-v200和MCF7/ADR细胞为300μg/ml。每隔3至4天换一次培养液,G418筛选2周(Huh7细胞生长较慢,需筛选3至4周)后,4%甲醛固定,结晶紫染色,统计形成的集落数。
, http://www.100md.com
2 结果
2.1 p14ARFcDNA的扩增和鉴定
应用RT-PCR技术,从培养的正常人肝细胞系L02细胞中扩增了0.4Kb的cDNA片段(图1)。BamHI和EcoRI酶切回收此片段,克隆到质粒pSK的BamHI和EcoRI位点上,命名为pSKARF,进行核苷酸序列测定分析,结果证实与文献[6,7]报道的序列一致。

图1 p14ARFcDNA的RT-PCR扩增
1.DL2000 DNA Marker 2.p14ARFcDNA
GGC GGA TCC ATG GTG CGC AGG TTC TTG GTG ACC CTC CGG ATT CGG CGC GCG TGC GGC CCG
, 百拇医药
CCG CGA GTG AGG GTT TTC GTG GTT CAC ATC CCG CGG CTC ACG GGG GAG TGG GCA GCG CCA
GGG GCG CCC GCC GCT GTG GCC CTC GTG CTG ATG CTA CTG AGG AGC CAG CGT CTA GGG CAG
CAG CCG CTT CCT AGA AGA CCA GGT CAT GAT GAT GGG CAG CGC CCG AGT GGC GGA GCT GCT
GCT GCT CCA CGG CGC GGA GCC CAA CTG CGC CGA CCC CGC CAC TCT CAC CCG ACC CGT GCA
CGA CGC TGC CCG GGA GGG CTT CCT GGA CAC GCT GGT GGT GCT GCA CCG GGC CGG GGC GCG
, http://www.100md.com
GCT GGA CGT GCG CGA TGC CTG GGG CCG CCG TCT GCC CGT GGA CCT GGC TGA GAA TTC
2.2 p14ARF真核表达载体的构建
经测序分析正确无误后,再用BamHI和EcoRI酶切质粒pSKARF,得到0.4Kb的ARF基因片段,插入真核表达载体pcDNA3的BamHI和EcoRI位点,命名为pcDNA3ARF,具体构建过程如图2,酶切鉴定证实p14ARF真核表达载体构建正确(图3)。

图2 p14ARF真核表达载体的构建

, 百拇医药
图3 pcDNA3ARF的酶切鉴定
1.DL2000DNAMarker;2.pcDNA3ARF/EcoRI;
3.pcDNA3ARF/BamHI;4.pcDNA3ARF/EcoRI+BamHI;
5.pcDNA3ARF
2.3 p14ARF对肿瘤细胞集落生长的影响
pcDNA3ARF由脂质体介导转染肿瘤细胞后,经抗生素G418筛选2周(Huh7细胞生长较慢,需筛选3至4周),再用甲醛固定、结晶紫染色后,计数各种肿瘤细胞的集落(表1)。结果发现二种耐药肿瘤细胞株KB-v200和MCF7/ADR的集落数最少,分别为13±2.0和21±1.5,占各自转染空载体pcDNA3对照组的15%和17%。而p53阳性的肿瘤细胞HepG2、Hep2、MCF7形成的集落数也较少,分别为59±2.1,60±2.1和66±7.0,占各自对照组的47%,57%,58%;p53异常的肿瘤细胞KB,HLE,Huh-7,则形成相对较多的集落,分别为91±2.5,48±2.0,41±2.0,占各自对照组的74%,65%,80%。由此可见,p14ARF能明显抑制p53阳性肿瘤细胞的生长,而对p53阴性的肿瘤细胞生长的影响则相对较少,表明p14ARF抑制人肿瘤细胞的生长具有p53相关性。但是本文实验结果也显示出:p14ARF对耐药肿瘤细胞具有强烈的抑制作用,而这两种耐药细胞株都是p53异常的,这说明p14ARF抑制耐药肿瘤细胞的生长是p53非依赖性的。
, http://www.100md.com
表1 转染p14ARF基因后肿瘤细胞克隆形成率 细胞系
细胞类型
内源性
p53状况
转染pcDNA3ARF
(
 ±s)
±s)转染pcDNA3
(
 ±s)
±s)相对生长率
, 百拇医药 pcDNA3ARF/pcDNA3)
Hep2
喉鳞癌
+
60±2.1
105±2.0
57%
KB
鼻咽癌
-
91±2.5
123±5.5
74%
, http://www.100md.com
KB-v200
鼻咽癌/VCR
-
13±2.0
86±3.1
15%
耐药株
HepG2
肝癌
+
59±2.1
126±6.2
47%
, 百拇医药
HLE
肝癌
-
48±2.0
74±4.2
65%
Hle
肝癌
-
41±2.0
50±3.1
80%
Huh-7
, 百拇医药
乳腺癌
+
66±7.0
114±6.7
58%
MCF-7
乳腺癌/ADR
-
21±1.5
126±7.5
17%
MCF-7/ADR
耐药株
, 百拇医药
3 讨论
目前对细胞周期调控和细胞凋亡的分子机理的认识逐渐加深,促进了肿瘤基因治疗研究的发展。迄今为止,人们已对p53,p16,RB,Mda-7等抑癌基因,通过各种载体导入多种肿瘤细胞进行体内、外试验,均获得了一定的预期效果[8]。而对于抑癌基因家族的新成员p14ARF则研究较少,对此基因功能的认识基本上都来源于鼠的p19ARF。鉴于此,本文从正常人肝细胞系L02细胞中RT-PCR扩增出0.4Kb基因,并克隆到真核表达载体pcDNA3上,转染多种肿瘤细胞。结果显示:p14ARF能明显抑制p53阳性肿瘤细胞集落的形成。过去已有报道鼠的p19ARF能阻滞细胞于G1期和G2/M期(Quelle等,1995)[9],而Stott[10]等人(1998)的研究结果也说明:p14ARF的表达能阻滞人p53阳性的乳腺癌细胞系MCF7于G1期,但却不能诱导p53阴性的人肺癌细胞系H1299细胞和骨肉瘤SOAS2细胞的生长阻滞,由此提示了:p14ARF抑制人肿瘤细胞生长的p53相关性。我们的研究结果进一步支持了这一观点;但是另一方面,本文从p14ARF转染耐药肿瘤细胞的实验结果中却得出了相反的观点,即尽管KB-V200和MCF7/ADR都有p53异常,但是p14ARF却强烈抑制它们的生长,这提示p14ARF抑制耐药肿瘤细胞的生长是独立于p53途径的。由于大多数肿瘤患者经多次化疗后,都会产生肿瘤细胞对化疗药物的耐药性,因而在肿瘤基因治疗中,p14ARF的应用将是继p53之后的一个重要发展策略,这一发现的分子机理我们正在研究之中。
, http://www.100md.com
[编辑 :钟均行 ;校对 :甘可建 ]
通讯作者:吴祖泽:Tel:86-10-68158311
Fax:86-10-68158311
E-mail:wuct@nic.bmi.ac.cn
[参考文献]
[1] Levine AJ. p53,the cellular gatekeeper for growth and division [J]. Cell, 1997,88(3):323~331.
[2] Sheer CJ. Cancer cell cycle [J]. Science, 1996,274:1672~1677.
, 百拇医药
[3] Chin L, Pomerantz J, DePinho RA. The INK4α/ARF tumor suppressor: one gene-two products-two pathways [J]. Trends Biochem Sci, 1998,23(8):291~296.
[4] Sheer CJ. Tumor surveillance via the ARF- p53 pathway [J]. Genes & Development, 1998,12(19):2984~2991.
[5] 奥斯伯 F ,金斯顿 RE,赛德曼 JG,等,编著. 颜子颍,王海林,译.精编分子生物学实验指南[M].北京:科学出版社,1998:29~108.
[6] Duro D, Bernard O, Della Valle V, et al. A new type of p16INK4/MTS1 gene transcript expressed in B-cell malignancies [J]. Oncogene,1995,11(1):21~29.
, 百拇医药
[7] Mao L, Merlo A, Bedi G, et al. A novel p16INK4A transcript [J]. Cancer Res. 1995,55(14):2995~2997.
[8] Paillard F. Cancer gene therapy annual conference 1997:Trends and News [J]. Human Gene Therapy,1998,9(3):283~286.
[9] Quelle DE, Zindy F, Ashmun RA, et al. Alternative reading frames of the INK4a tumor suppressor gene encode two unrelated proteins capable of inducing cell cycle arrest [J]. Cell, 1995,83(6):993~1000.
[10] Stott FJ, Bates SA, James MC, et al. The alternative product from the human CDKN2A locus, p14ARF, participates in a regulatory feedback loop with p53 and MDM2 [J]. EMBO J, 1998,17(17):5001~5014.
收稿日期:1999-12-02;修回日期:1999-12-24, http://www.100md.com