甘氨酸茶碱钠缓释片与普通片药物动力学对比
作者:姚志红 侯景刚 张逸凡 李雪庆 钟大放
单位:姚志红 张逸凡 李雪庆 钟大放(沈阳药科大学药物代谢与药物动力学实验室,沈阳 110015);侯景刚(沈阳药业股份有限公司,沈阳 110043)
关键词:茶碱;甘氨酸茶碱钠;药物动力学;相对生物利用度;缓释片;反相高效液相色谱法
沈阳药科大学学报000206 摘 要:采用一步液液提取反相高效液相色谱法对甘氨酸茶碱钠缓释片(受试制剂)与普通片(参比制剂)在人体内药物动力学行为进行了对比检测,绘制了12名健康男性志愿受试者分别单剂量和多剂量随机交叉口服上述两种制剂后的茶碱血浆浓度-时间曲线并计算主要的药动学参数.经统计检验,两种制剂的AUC无显著性差异.单剂量和多剂量口服甘氨酸茶碱钠缓释片的相对生物利用度分别为(91.7±16.8)%和(107.5±18.6)%.与普通片相比,甘氨酸茶碱钠缓释片的Cmax较低,而Cmin较高,Tmax明显滞后,MRT延长,血药浓度波动幅度显著减小,符合缓释制剂的特点,可较为安全地应用于临床.
, 百拇医药
分类号:R969.1
Comparative Study of the Pharmacokinetics of Theophylline Sodium Glycinate Sustained-Release Tablets and Conventional Tablets
Yao Zhihong Hou Jinggang Zhang Yifan Li Xueqing Zhong Dafang
(Laboratory of Drug Metabolism and Pharmacokinetics, Shenyang Pharmacetical University, Shenyang 110015)
Abstract:The pharmacokinetics of a new sustained-release Tablet,theophylline sodium glycinate sustained-release tablet (Test formulation) was studied in comparison with that of a conventional tablet,Ganfeilin Tablet (Reference formulation).The theophylline concentrations in plasma were determined by the liquid-liquid extraction-RP-HPLC method with UV detector and the plasma concentration-time curves were plotted after a single oral dose as well as multiple oral doses of a 100 mg sustained-release tablet and 165 mg conventional tablet in 12 Chinese healthy male volunteers according to a randomized 2-way crossover design.The main pharmacokinetic parameters of the two formulations and the relative bioavailability of the sustained-release tablet were obtained.The results of the statistical analysis showed no significant difference between the AUC values of the two formulations.The oral relative bioavailabilities of the sustained-release tablet if compared with the conventional tablet were (91.7±16.8)% for a single dose and (107.5±18.6)% for multiple doses respectively. Compared with the conventional tablet, the sustained-release tablet had lower Cmax, higher Cmin and prolonged Tmax and MRT.The peak to trough fluctuation index(FI) of the sustained-release tablet was less than that of the conventional tablet.The above data demonstrated that the theophylline sodium glycinate sustained-release tablet possessed good characteristics of sustained-release formulation and was fitted to be safely used in clinical treatment.
, 百拇医药
Key words:theophylline;theophylline sodium glycinate;pharmacokinetics;relative bioavailability;sustained-release tablet;RP-HPLC ▲
茶碱化学名为1,3-二甲基黄嘌呤,具有较强的舒张气管平滑肌作用,是常用的平喘药.据文献报道,茶碱的治疗窗较窄,有效治疗浓度范围为10~20 μg/mL,当体内血药浓度高于20 μg/mL时易产生毒副作用〔1〕,因此对茶碱进行临床药物监测以控制用药剂量尤其是制备更为安全有效的茶碱缓释制剂一直为人们所关注.关于各种茶碱制剂的药物动力学与人体生物利用度研究国内外虽有许多报道〔2,3〕,但有关甘氨酸茶碱钠缓释片与普通片相对比的药物动力学研究国内未见报道.甘氨酸茶碱钠缓释片为茶碱的甘氨酸钠盐的缓释片剂,作者以甘氨酸茶碱钠普通片为参比,对其进行药物动力学研究,计算其口服相对生物利用度,并考察其在体内的缓释作用,为临床用药提供依据.
, 百拇医药
1 材料与方法
1.1 仪器与试药
高效液相色谱仪:包括LC-10AT泵,SPD-10A紫外检测器和C-R6A积分仪均为日本岛津公司产品.
甘氨酸茶碱钠缓释片(受试制剂)由沈阳华泰药物研究所研制,含茶碱100 mg/片,批号980301;甘非林片(参比制剂,甘氨酸茶碱钠普通片)由丹东制药厂生产,含茶碱165 mg/片,批号960601;茶碱对照品由沈阳药科大学药分研究室提供,含量99.5%;内标多索茶碱由沈阳药科大学药化研究室提供,含量99.0%;甲醇为色谱纯;其它试剂均为分析纯;空白人血浆由沈阳中心血站提供.
茶碱标准系列溶液的配制:精密称取茶碱对照品25.0 mg,用甲醇配成浓度为1 mg/mL的储备液。取该储备液适量,分别用流动相稀释成含茶碱0.4、2.0、5.0、8.0、20.0和40.0 μg/mL的标准系列溶液.
, 百拇医药
1.2 试验对象
选择健康男性志愿受试者12名(年龄20~24岁,体重60~70 kg),签署知情同意书,并于试验前在医院接受包括肝、肾功能和血压及心电图等全面检查,各项指标均正常.试验期间禁忌其它药物、烟酒、茶及任何含咖啡因饮料.
1.3 给药方案与样品采集
试验中将12名受试者随机分为两组,遵从两制剂双周期随机交叉自身对照试验设计方案,两周期间隔时间为7 d.
单剂量试验:受试者于试验当日早晨空腹口服被试制剂(T)1片(100 mg)或参比制剂(R)1片(165 mg),于服药前(0 h)和服药后0.5、1、2、3、4、6、8、10、12、24、36 h分别采取受试者静脉血4 mL,置肝素化试管中,离心(3 500 r/min)15 min,分离血浆,于-20℃保存待测.
, http://www.100md.com
多剂量试验:受试者于单剂量试验末次采血后第2 d早晨开始空腹口服被试制剂(T)1片(100 mg)或参比制剂(R)1片(165 mg),早晚各服1次,间隔12 h(注:服药须于早饭前2 h或晚饭后2 h进行).首次服药后第3~5 d于每晚服药前采取受试者静脉血4 mL以测定其血药谷浓度,第6 d于受试者服药前和服药后0.5、1、2、3、4、6、8、10、12、24、36 h分别采静脉血4 mL,血样处理同上.
1.4 血浆样品的分析方法
作者参考了文献〔4〕中茶碱血药浓度的测定方法并进行了改进.
色谱条件:色谱柱为日本岛津Shim-pack CLC-ODS C18柱,150 mm×4.6 mm I.D.,粒径5 μm;流动相为甲醇-水(体积比为35∶70);流速为1.2 mL/min;检测波长为 UV 275 nm;柱温为室温;记录纸纸速为2 mm/min.
, http://www.100md.com
血浆样品的测定:取0.2 mL血浆样品置10 mL带塞试管中,加入流动相50 μL、内标溶液(多索茶碱40 μg/mL) 50 μL、0.05 mol/L的磷酸二氢铵缓冲溶液200 μL 及二氯甲烷-异丙醇(体积比为95∶5) 2 mL,涡流30 s,往复振荡10 min,离心10 min(3 500 r/min),分离有机相并于50℃下氮气吹干. 残余物加500 μL流动相溶解,进样50 μL,记录色谱图. 样品测定当天随行标准曲线和QC样品.
1.5 药动学参数的计算与统计分析
本试验根据血药浓度-时间曲线进行参数计算.采用梯形法计算AUC值,以半对数作图法由消除相的末4个浓度点计算t1/2和Ke.Cmax、Cmin和Tmax采用实测值,并计算Cav、MRT和FI.首先,对所有与浓度有关的参数进行剂量折算,然后对AUC进行对数转换(ln)后采用方差分析,并进行双单侧t检验和(1-2α)置信区间检验〔6〕,以评价缓释制剂的口服相对生物利用度;对Cmax、Cmin、Cav和FI进行对数转换(ln)后进行方差分析;对Tmax和MRT直接进行方差分析.
, 百拇医药
2 实验结果
2.1 分析方法确证
方法的专属性:分别取6名受试者的空白血浆(不加内标)或一定浓度的茶碱标准溶液加入空白血浆、以及健康受试者服药4 h后收集的血浆样品,按“血浆样品的测定”项下操作,得色谱图如图1所示.结果表明,空白血浆中的内源性物质不干扰茶碱的测定.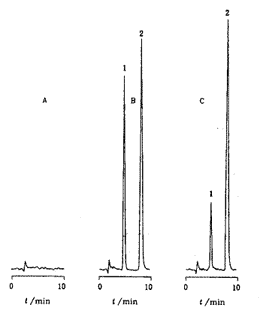
Fig.1 HPLC chromatograms of theophylline
A—Blank plasma sample;B—Plasma sample spiked with theophylline and internal standard;C—Volunteer plasma sample 4 h after a single oral dose of theophylline sodium glycinate sustained-release tablet (100 mg); 1—Theophylline;2—Internal standard
, http://www.100md.com
标准曲线的制备:取空白血浆0.2 mL置于10 mL带塞试管中,分别加入茶碱标准系列溶液,配制成相当于浓度为0.1、0.5、1.0、2.0、5.0和10.0 μg/mL的血浆样品,按“血浆样品的测定”项下操作,进样50 μL,记录色谱图;以待测物浓度为横坐标、待测物与内标物的峰高比值为纵坐标,用加权最小二乘法〔5〕进行回归运算,求得直线回归方程即为标准曲线.本方法的线性范围为0.1~15.0 μg/mL,最低定量限为0.1 μg/mL.
准确度与精密度:连续3 d随行标准曲线同时测定浓度分别为0.1、1.0和5.0 μg/mL的质量控制(QC)样品(6样本),求得本法的准确度与精密度,数据见表1.结果表明,测定血浆中茶碱的分析方法符合规范〔6〕,可用于药物动力学试验.
Tab.1 Precision and recoveries of theophylline in plasma with HPLC assay(n=6) Concentration
, 百拇医药
added/μg。mL-1
Recovery
/%
Within-day
RSD/%
Between-day
RSD/%
0.10
100.0
8.63
4.82
1.00
, http://www.100md.com
101.0
4.98
5.25
5.00
103.0
3.58
4.48
2.2 试验结果
单剂量试验结果:12名健康受试者单剂量口服受试制剂(100 mg)与参比制剂(165 mg)后药动学参数见表2,平均血药浓度-时间曲线见图2.
Tab.2 Pharmacokinetic parameters of theophylline after a single dose of sustained-release and conventional tablets in normal subjects(n=12,mean±s) Parameters
, http://www.100md.com
Sustained-release
tablet (100 mg)
Conventional
tablet(165 mg)
t1/2 /h
12.77
±
3.34
10.41
±
2.37
ke /h-1
, 百拇医药
0.059
±
0.02
0.07
±
0.017
Tmax /h
5.92
±
2.19
1.21
±
0.62
, http://www.100md.com
Cmax /μg。mL-1
1.90
±
0.33
5.82
±
0.76
MRT /h
21.02
±
4.25
15.21
, 百拇医药
±
3.33
AUC0-36 /μg。h。mL-1
38.7
±
5.1
70.7
±
9.8
AUC0-∞ /μg。h。mL-1
, 百拇医药 46.1
±
7.6
78.2
±
13.7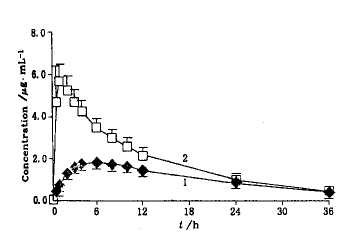
Fig.2 Mean plasma concentration-time curve of theophylline after a single oral dose of two theophylline formulations(n=2,mean±s)
1—Sustained-release tablet;2—Conventional tablet
, 百拇医药
其中AUC0-36分别为(38.7±5.1)和(70.7±9.8) μg。h/mL,对AUC0-36进行剂量折算得到的受试制剂的相对生物利用度为(91.7±16.8)%.
多剂量试验结果:12名健康受试者连续多次给药后第6 d血药浓度已达稳态.多剂量口服受试制剂(100 mg)与参比制剂(165 mg)后药动学参数见表3,平均稳态血药浓度-时间曲线见图3.
Tab.3 Pharmacokinetic parameters of theophylline after a single dose of sustained-release and conventional tablets in normal subjects(n=12,mean±s) Parameters
Sustained release
, http://www.100md.com
tablet (100 mg)
Conventional
tablet(165 mg)
Tmax /h
2.75
±
1.36
0.83
±
0.58
Cmax /μg。mL-1
, 百拇医药
4.52
±
0.61
10.92
±
1.22
Cmin /μg。mL-1
2.95
±
0.62
4.22
±
, 百拇医药
1.13
Cav /μg。mL-1
3.81
±
0.59
6.89
±
1.19
DF
0.42
±
0.11
, http://www.100md.com
1.00
±
0.22
MRT /h
19.44
±
3.9
15.57
±
3.02
AUCss /μg。h。mL-1
88.3
, 百拇医药
±
19.2
137.9
±
33.3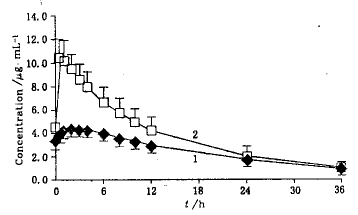
Fig.3 Mean plasma concentration-time curve of theophylline after multiple oral doses of two theophylline formulations(n=12,mean±s)
1—Sustained-release tablet;2—Conventional tablet
其中AUCss分别为(88.3±19.2)和(137.9±33.3) μg。h/mL,对AUCss进行剂量折算得到受试制剂的相对生物利用度为(107.5±18.6)%.
, 百拇医药
2.3 结果评价
AUC0-36和AUCss的方差分析结果显示,两种制剂的AUC0-36和AUCss均无显著性差异(P>0.05),采用双单侧t检验和(1-2α)置信区间法分析,置信区间(90%)分别为82.0%~99.7%和96.2%~115.9%,进一步表明了两种制剂的AUC具有生物等效性;Cmax、Cmin、Cav、FI、Tmax和MRT的方差分析结果显示均有显著性差异(P<0.05).
3 讨论
本实验因受试制剂和参比制剂的茶碱含量不同而使用了不同给药剂量. 根据低剂量茶碱在人体内的吸收与分布符合线性动力学这一特点〔7〕,可对与浓度有关的药动学参数进行剂量折算.
, 百拇医药
甘氨酸茶碱钠缓释片与普通片的AUC值经剂量折算后的统计分析结果无显著性差异,说明两制剂在人体口服吸收程度比较相似,单剂量口服缓释片的相对生物利用度为(91.7±16.8)%,缓释片的吸收程度较普通片稍低,但多剂量口服缓释片的相对生物利用度达到(107.5±18.6)%,有所提高,这表明反复多次给药后缓释片较普通片口服吸收更为完全.其它药动学参数则均有显著性差异,其中缓释片的Cmax值按剂量折算后仅达到普通片的53.9% (单剂量)和68.3%,(多剂量),明显降低;稳态Cmin值按剂量折算后却达普通片的115.3%;缓释片的血药浓度波动幅度则从普通片的1.00±0.22明显降至0.42±0.11;这使药物的毒副作用和不良反应减小,从而保证临床用药的安全性;缓释片平均停留时间明显延长,表明药物在体内作用时间延长;通过采用缓释制剂,减缓了茶碱在体内的吸收,血药浓度-时间曲线形状变得较平缓,表现出缓释制剂无爆发式释放的特点.以上均表明受试制剂—甘氨酸茶碱钠缓释片确具缓释制剂的特点,可以通过多次给药及调整给药剂量使血药浓度始终保持在茶碱有效治疗范围内.另外,多剂量口服与单剂量口服相比,缓释片和普通片的血药浓度达峰时间Tmax均显著减小.
, http://www.100md.com
将甘氨酸茶碱钠缓释片(单剂量服用100 mg)与国外报道〔8〕的3种茶碱缓释制片剂(分别单剂量服用400 mg)的药动学参数相比较,Theobiolongas片、Theopaek片和TheoDur片的Cmax分别为44.0、35.9和34.7 μmol/L,AUC分别为709、680和826 μmol.h/L,t1/2分别为8.4、10.6和12.3 h,而甘氨酸茶碱钠缓释片的Cmax经剂量折算为42.2 μmol/L,处于较高水平,曲线下面积AUC经剂量折算为1 024.4 μmol.h/L, 明显较3种缓释片大,t1/2为12.77 h,较3种缓释片长.根据以上数据推测,与欧洲人相比,中国人单次服用等剂量的茶碱缓释制剂后药物吸收较完全,且消除较缓慢,茶碱的血浆浓度峰值偏高.
参考文献:
[1] The Royal Pharmaceutical Society.Mardindale,the Extra Pharmacopoeia,31.edition.London:The Royal Pharmaceutical Society,1996.1657~1665
, 百拇医药
[2] Torrent J, Izqouierdo I, Barbanouj MJ,et al.Theophy-lline pharmacokinetics following single and repeated administration of slow-release capsules.Eur J Drug Metab Pharmacokinet,1988,13 (4): 225~230
[3] 周芝芳,陈晓平,范剑华,等.长效茶碱片生物利用度研究.医药工业,1986,17(5):205~208
[4] Rasmnssen BB, Brosen K. Determination of theophylline and its metabolites in human urine and plasma by high-performance liquid chromatography.J Chromatogr B,1996,676:169~174
, 百拇医药
[5] 钟大放.以加权最小二乘法建立生物分析标准曲线若干问题.药物分析杂志,1996,16:342~346
[6] 中华人民共和国卫生部药典委员会.中国药典2000年版二部-凡例与 附录(草案).北京:中华人民共和国卫生部药典委员会,1998.71~75
[7] Tröger U, Meyer FP.Influence of endogenous and exogenous effectors on the pharmacokinetics of theophylline.Clin Pharmacokinet,1995, 28(4): 287~314
[8] Kiivet RA, Teder P, Pruunsild T,et al.Bioavailability of two soviet sustained-release theophylline formulations in comparison with TheoDur. Pharmacology & Toxicology,1992,71: 388~390
收稿日期:1999-08-26, 百拇医药
单位:姚志红 张逸凡 李雪庆 钟大放(沈阳药科大学药物代谢与药物动力学实验室,沈阳 110015);侯景刚(沈阳药业股份有限公司,沈阳 110043)
关键词:茶碱;甘氨酸茶碱钠;药物动力学;相对生物利用度;缓释片;反相高效液相色谱法
沈阳药科大学学报000206 摘 要:采用一步液液提取反相高效液相色谱法对甘氨酸茶碱钠缓释片(受试制剂)与普通片(参比制剂)在人体内药物动力学行为进行了对比检测,绘制了12名健康男性志愿受试者分别单剂量和多剂量随机交叉口服上述两种制剂后的茶碱血浆浓度-时间曲线并计算主要的药动学参数.经统计检验,两种制剂的AUC无显著性差异.单剂量和多剂量口服甘氨酸茶碱钠缓释片的相对生物利用度分别为(91.7±16.8)%和(107.5±18.6)%.与普通片相比,甘氨酸茶碱钠缓释片的Cmax较低,而Cmin较高,Tmax明显滞后,MRT延长,血药浓度波动幅度显著减小,符合缓释制剂的特点,可较为安全地应用于临床.
, 百拇医药
分类号:R969.1
Comparative Study of the Pharmacokinetics of Theophylline Sodium Glycinate Sustained-Release Tablets and Conventional Tablets
Yao Zhihong Hou Jinggang Zhang Yifan Li Xueqing Zhong Dafang
(Laboratory of Drug Metabolism and Pharmacokinetics, Shenyang Pharmacetical University, Shenyang 110015)
Abstract:The pharmacokinetics of a new sustained-release Tablet,theophylline sodium glycinate sustained-release tablet (Test formulation) was studied in comparison with that of a conventional tablet,Ganfeilin Tablet (Reference formulation).The theophylline concentrations in plasma were determined by the liquid-liquid extraction-RP-HPLC method with UV detector and the plasma concentration-time curves were plotted after a single oral dose as well as multiple oral doses of a 100 mg sustained-release tablet and 165 mg conventional tablet in 12 Chinese healthy male volunteers according to a randomized 2-way crossover design.The main pharmacokinetic parameters of the two formulations and the relative bioavailability of the sustained-release tablet were obtained.The results of the statistical analysis showed no significant difference between the AUC values of the two formulations.The oral relative bioavailabilities of the sustained-release tablet if compared with the conventional tablet were (91.7±16.8)% for a single dose and (107.5±18.6)% for multiple doses respectively. Compared with the conventional tablet, the sustained-release tablet had lower Cmax, higher Cmin and prolonged Tmax and MRT.The peak to trough fluctuation index(FI) of the sustained-release tablet was less than that of the conventional tablet.The above data demonstrated that the theophylline sodium glycinate sustained-release tablet possessed good characteristics of sustained-release formulation and was fitted to be safely used in clinical treatment.
, 百拇医药
Key words:theophylline;theophylline sodium glycinate;pharmacokinetics;relative bioavailability;sustained-release tablet;RP-HPLC ▲
茶碱化学名为1,3-二甲基黄嘌呤,具有较强的舒张气管平滑肌作用,是常用的平喘药.据文献报道,茶碱的治疗窗较窄,有效治疗浓度范围为10~20 μg/mL,当体内血药浓度高于20 μg/mL时易产生毒副作用〔1〕,因此对茶碱进行临床药物监测以控制用药剂量尤其是制备更为安全有效的茶碱缓释制剂一直为人们所关注.关于各种茶碱制剂的药物动力学与人体生物利用度研究国内外虽有许多报道〔2,3〕,但有关甘氨酸茶碱钠缓释片与普通片相对比的药物动力学研究国内未见报道.甘氨酸茶碱钠缓释片为茶碱的甘氨酸钠盐的缓释片剂,作者以甘氨酸茶碱钠普通片为参比,对其进行药物动力学研究,计算其口服相对生物利用度,并考察其在体内的缓释作用,为临床用药提供依据.
, 百拇医药
1 材料与方法
1.1 仪器与试药
高效液相色谱仪:包括LC-10AT泵,SPD-10A紫外检测器和C-R6A积分仪均为日本岛津公司产品.
甘氨酸茶碱钠缓释片(受试制剂)由沈阳华泰药物研究所研制,含茶碱100 mg/片,批号980301;甘非林片(参比制剂,甘氨酸茶碱钠普通片)由丹东制药厂生产,含茶碱165 mg/片,批号960601;茶碱对照品由沈阳药科大学药分研究室提供,含量99.5%;内标多索茶碱由沈阳药科大学药化研究室提供,含量99.0%;甲醇为色谱纯;其它试剂均为分析纯;空白人血浆由沈阳中心血站提供.
茶碱标准系列溶液的配制:精密称取茶碱对照品25.0 mg,用甲醇配成浓度为1 mg/mL的储备液。取该储备液适量,分别用流动相稀释成含茶碱0.4、2.0、5.0、8.0、20.0和40.0 μg/mL的标准系列溶液.
, 百拇医药
1.2 试验对象
选择健康男性志愿受试者12名(年龄20~24岁,体重60~70 kg),签署知情同意书,并于试验前在医院接受包括肝、肾功能和血压及心电图等全面检查,各项指标均正常.试验期间禁忌其它药物、烟酒、茶及任何含咖啡因饮料.
1.3 给药方案与样品采集
试验中将12名受试者随机分为两组,遵从两制剂双周期随机交叉自身对照试验设计方案,两周期间隔时间为7 d.
单剂量试验:受试者于试验当日早晨空腹口服被试制剂(T)1片(100 mg)或参比制剂(R)1片(165 mg),于服药前(0 h)和服药后0.5、1、2、3、4、6、8、10、12、24、36 h分别采取受试者静脉血4 mL,置肝素化试管中,离心(3 500 r/min)15 min,分离血浆,于-20℃保存待测.
, http://www.100md.com
多剂量试验:受试者于单剂量试验末次采血后第2 d早晨开始空腹口服被试制剂(T)1片(100 mg)或参比制剂(R)1片(165 mg),早晚各服1次,间隔12 h(注:服药须于早饭前2 h或晚饭后2 h进行).首次服药后第3~5 d于每晚服药前采取受试者静脉血4 mL以测定其血药谷浓度,第6 d于受试者服药前和服药后0.5、1、2、3、4、6、8、10、12、24、36 h分别采静脉血4 mL,血样处理同上.
1.4 血浆样品的分析方法
作者参考了文献〔4〕中茶碱血药浓度的测定方法并进行了改进.
色谱条件:色谱柱为日本岛津Shim-pack CLC-ODS C18柱,150 mm×4.6 mm I.D.,粒径5 μm;流动相为甲醇-水(体积比为35∶70);流速为1.2 mL/min;检测波长为 UV 275 nm;柱温为室温;记录纸纸速为2 mm/min.
, http://www.100md.com
血浆样品的测定:取0.2 mL血浆样品置10 mL带塞试管中,加入流动相50 μL、内标溶液(多索茶碱40 μg/mL) 50 μL、0.05 mol/L的磷酸二氢铵缓冲溶液200 μL 及二氯甲烷-异丙醇(体积比为95∶5) 2 mL,涡流30 s,往复振荡10 min,离心10 min(3 500 r/min),分离有机相并于50℃下氮气吹干. 残余物加500 μL流动相溶解,进样50 μL,记录色谱图. 样品测定当天随行标准曲线和QC样品.
1.5 药动学参数的计算与统计分析
本试验根据血药浓度-时间曲线进行参数计算.采用梯形法计算AUC值,以半对数作图法由消除相的末4个浓度点计算t1/2和Ke.Cmax、Cmin和Tmax采用实测值,并计算Cav、MRT和FI.首先,对所有与浓度有关的参数进行剂量折算,然后对AUC进行对数转换(ln)后采用方差分析,并进行双单侧t检验和(1-2α)置信区间检验〔6〕,以评价缓释制剂的口服相对生物利用度;对Cmax、Cmin、Cav和FI进行对数转换(ln)后进行方差分析;对Tmax和MRT直接进行方差分析.
, 百拇医药
2 实验结果
2.1 分析方法确证
方法的专属性:分别取6名受试者的空白血浆(不加内标)或一定浓度的茶碱标准溶液加入空白血浆、以及健康受试者服药4 h后收集的血浆样品,按“血浆样品的测定”项下操作,得色谱图如图1所示.结果表明,空白血浆中的内源性物质不干扰茶碱的测定.

Fig.1 HPLC chromatograms of theophylline
A—Blank plasma sample;B—Plasma sample spiked with theophylline and internal standard;C—Volunteer plasma sample 4 h after a single oral dose of theophylline sodium glycinate sustained-release tablet (100 mg); 1—Theophylline;2—Internal standard
, http://www.100md.com
标准曲线的制备:取空白血浆0.2 mL置于10 mL带塞试管中,分别加入茶碱标准系列溶液,配制成相当于浓度为0.1、0.5、1.0、2.0、5.0和10.0 μg/mL的血浆样品,按“血浆样品的测定”项下操作,进样50 μL,记录色谱图;以待测物浓度为横坐标、待测物与内标物的峰高比值为纵坐标,用加权最小二乘法〔5〕进行回归运算,求得直线回归方程即为标准曲线.本方法的线性范围为0.1~15.0 μg/mL,最低定量限为0.1 μg/mL.
准确度与精密度:连续3 d随行标准曲线同时测定浓度分别为0.1、1.0和5.0 μg/mL的质量控制(QC)样品(6样本),求得本法的准确度与精密度,数据见表1.结果表明,测定血浆中茶碱的分析方法符合规范〔6〕,可用于药物动力学试验.
Tab.1 Precision and recoveries of theophylline in plasma with HPLC assay(n=6) Concentration
, 百拇医药
added/μg。mL-1
Recovery
/%
Within-day
RSD/%
Between-day
RSD/%
0.10
100.0
8.63
4.82
1.00
, http://www.100md.com
101.0
4.98
5.25
5.00
103.0
3.58
4.48
2.2 试验结果
单剂量试验结果:12名健康受试者单剂量口服受试制剂(100 mg)与参比制剂(165 mg)后药动学参数见表2,平均血药浓度-时间曲线见图2.
Tab.2 Pharmacokinetic parameters of theophylline after a single dose of sustained-release and conventional tablets in normal subjects(n=12,mean±s) Parameters
, http://www.100md.com
Sustained-release
tablet (100 mg)
Conventional
tablet(165 mg)
t1/2 /h
12.77
±
3.34
10.41
±
2.37
ke /h-1
, 百拇医药
0.059
±
0.02
0.07
±
0.017
Tmax /h
5.92
±
2.19
1.21
±
0.62
, http://www.100md.com
Cmax /μg。mL-1
1.90
±
0.33
5.82
±
0.76
MRT /h
21.02
±
4.25
15.21
, 百拇医药
±
3.33
AUC0-36 /μg。h。mL-1
38.7
±
5.1
70.7
±
9.8
AUC0-∞ /μg。h。mL-1
, 百拇医药 46.1
±
7.6
78.2
±
13.7

Fig.2 Mean plasma concentration-time curve of theophylline after a single oral dose of two theophylline formulations(n=2,mean±s)
1—Sustained-release tablet;2—Conventional tablet
, 百拇医药
其中AUC0-36分别为(38.7±5.1)和(70.7±9.8) μg。h/mL,对AUC0-36进行剂量折算得到的受试制剂的相对生物利用度为(91.7±16.8)%.
多剂量试验结果:12名健康受试者连续多次给药后第6 d血药浓度已达稳态.多剂量口服受试制剂(100 mg)与参比制剂(165 mg)后药动学参数见表3,平均稳态血药浓度-时间曲线见图3.
Tab.3 Pharmacokinetic parameters of theophylline after a single dose of sustained-release and conventional tablets in normal subjects(n=12,mean±s) Parameters
Sustained release
, http://www.100md.com
tablet (100 mg)
Conventional
tablet(165 mg)
Tmax /h
2.75
±
1.36
0.83
±
0.58
Cmax /μg。mL-1
, 百拇医药
4.52
±
0.61
10.92
±
1.22
Cmin /μg。mL-1
2.95
±
0.62
4.22
±
, 百拇医药
1.13
Cav /μg。mL-1
3.81
±
0.59
6.89
±
1.19
DF
0.42
±
0.11
, http://www.100md.com
1.00
±
0.22
MRT /h
19.44
±
3.9
15.57
±
3.02
AUCss /μg。h。mL-1
88.3
, 百拇医药
±
19.2
137.9
±
33.3

Fig.3 Mean plasma concentration-time curve of theophylline after multiple oral doses of two theophylline formulations(n=12,mean±s)
1—Sustained-release tablet;2—Conventional tablet
其中AUCss分别为(88.3±19.2)和(137.9±33.3) μg。h/mL,对AUCss进行剂量折算得到受试制剂的相对生物利用度为(107.5±18.6)%.
, 百拇医药
2.3 结果评价
AUC0-36和AUCss的方差分析结果显示,两种制剂的AUC0-36和AUCss均无显著性差异(P>0.05),采用双单侧t检验和(1-2α)置信区间法分析,置信区间(90%)分别为82.0%~99.7%和96.2%~115.9%,进一步表明了两种制剂的AUC具有生物等效性;Cmax、Cmin、Cav、FI、Tmax和MRT的方差分析结果显示均有显著性差异(P<0.05).
3 讨论
本实验因受试制剂和参比制剂的茶碱含量不同而使用了不同给药剂量. 根据低剂量茶碱在人体内的吸收与分布符合线性动力学这一特点〔7〕,可对与浓度有关的药动学参数进行剂量折算.
, 百拇医药
甘氨酸茶碱钠缓释片与普通片的AUC值经剂量折算后的统计分析结果无显著性差异,说明两制剂在人体口服吸收程度比较相似,单剂量口服缓释片的相对生物利用度为(91.7±16.8)%,缓释片的吸收程度较普通片稍低,但多剂量口服缓释片的相对生物利用度达到(107.5±18.6)%,有所提高,这表明反复多次给药后缓释片较普通片口服吸收更为完全.其它药动学参数则均有显著性差异,其中缓释片的Cmax值按剂量折算后仅达到普通片的53.9% (单剂量)和68.3%,(多剂量),明显降低;稳态Cmin值按剂量折算后却达普通片的115.3%;缓释片的血药浓度波动幅度则从普通片的1.00±0.22明显降至0.42±0.11;这使药物的毒副作用和不良反应减小,从而保证临床用药的安全性;缓释片平均停留时间明显延长,表明药物在体内作用时间延长;通过采用缓释制剂,减缓了茶碱在体内的吸收,血药浓度-时间曲线形状变得较平缓,表现出缓释制剂无爆发式释放的特点.以上均表明受试制剂—甘氨酸茶碱钠缓释片确具缓释制剂的特点,可以通过多次给药及调整给药剂量使血药浓度始终保持在茶碱有效治疗范围内.另外,多剂量口服与单剂量口服相比,缓释片和普通片的血药浓度达峰时间Tmax均显著减小.
, http://www.100md.com
将甘氨酸茶碱钠缓释片(单剂量服用100 mg)与国外报道〔8〕的3种茶碱缓释制片剂(分别单剂量服用400 mg)的药动学参数相比较,Theobiolongas片、Theopaek片和TheoDur片的Cmax分别为44.0、35.9和34.7 μmol/L,AUC分别为709、680和826 μmol.h/L,t1/2分别为8.4、10.6和12.3 h,而甘氨酸茶碱钠缓释片的Cmax经剂量折算为42.2 μmol/L,处于较高水平,曲线下面积AUC经剂量折算为1 024.4 μmol.h/L, 明显较3种缓释片大,t1/2为12.77 h,较3种缓释片长.根据以上数据推测,与欧洲人相比,中国人单次服用等剂量的茶碱缓释制剂后药物吸收较完全,且消除较缓慢,茶碱的血浆浓度峰值偏高.
参考文献:
[1] The Royal Pharmaceutical Society.Mardindale,the Extra Pharmacopoeia,31.edition.London:The Royal Pharmaceutical Society,1996.1657~1665
, 百拇医药
[2] Torrent J, Izqouierdo I, Barbanouj MJ,et al.Theophy-lline pharmacokinetics following single and repeated administration of slow-release capsules.Eur J Drug Metab Pharmacokinet,1988,13 (4): 225~230
[3] 周芝芳,陈晓平,范剑华,等.长效茶碱片生物利用度研究.医药工业,1986,17(5):205~208
[4] Rasmnssen BB, Brosen K. Determination of theophylline and its metabolites in human urine and plasma by high-performance liquid chromatography.J Chromatogr B,1996,676:169~174
, 百拇医药
[5] 钟大放.以加权最小二乘法建立生物分析标准曲线若干问题.药物分析杂志,1996,16:342~346
[6] 中华人民共和国卫生部药典委员会.中国药典2000年版二部-凡例与 附录(草案).北京:中华人民共和国卫生部药典委员会,1998.71~75
[7] Tröger U, Meyer FP.Influence of endogenous and exogenous effectors on the pharmacokinetics of theophylline.Clin Pharmacokinet,1995, 28(4): 287~314
[8] Kiivet RA, Teder P, Pruunsild T,et al.Bioavailability of two soviet sustained-release theophylline formulations in comparison with TheoDur. Pharmacology & Toxicology,1992,71: 388~390
收稿日期:1999-08-26, 百拇医药