葡甲胺对顺铂所致大鼠肾毒性的预防作用
作者:关英杰仲来福
单位:关英杰(上海医科大学劳动卫生学教研室,博士生 200032);仲来福(大连医科大学毒理研究室,116027)
关键词:葡甲胺;顺铂;肾毒性;脂质过氧化;抗肿瘤作用
卫生毒理学杂志000209 【摘要】 目的 研究葡甲胺(N-MG)对顺铂(CDDP)所致大鼠肾毒性的预防作用及其可能机制。方法 大鼠1次腹腔注射5 mg/kg CDDP动物模型,于CDDP处理前1 h经口给予N-MG预处理。检测指标包括血尿素氮BUN、尿蛋白、尿铂(Pt),肾组织匀浆中NOS、NO、MDA、SOD及肾组织Pt含量,同时观察抗肿瘤活性。结果 给药后第3、5天N-MG预处理组可明显预防CDDP所致大鼠肾功能损害,降低肾组织中NOS、NO、及MDA含量,增加SOD活性(P<0.05或P<0.01)。另外,给药后第3天尿Pt(0.425 μg/mg Cr)排泄量非常显著地高于CDDP组(0.245 μg/mg Cr,P<0.01),肾组织Pt含量于给药后第3、5天显著低于CDDP组(P<0.05)。N-MG预处理对荷瘤小鼠的肿瘤抑制率与CDDP组无显著性差异。结论 N-MG预处理能明显预防CDDP所致大鼠的肾损害,其预防作用机制可能是N-MG促进Pt经尿排出,并减少了肾组织Pt蓄积,从而CDDP产生的自由基减少,脂质过氧化程度减轻。N-MG对CDDP抗肿瘤活性无明显影响。
, 百拇医药
Preventive effect of N-methyl-D-glucamine against cisplatin nephrotoxicity in Rats
Guan Ying-Jie,Zhong Lai-Fu
(Laboratory of Toxicology,Dalian Medical University,Dalian 116027,China.)
【Abstract】 Objective To investigate the protective effect of N-methyl-glucamine(N-MG)on Cisplatin(CDDP)-induced nephrotoxicity in rats and its possible mechanism.Methods Male Sprague-Dauley rats were injected i.p.with 5 mg/kg CDDP combined with 2 g/kg N-MG given i.g 1 hour before the adminstration of CDDP.BUN,Urinary protein and platinum contents were determined.Kidneys were analyzed for NOS,NO,MDA,SOD and platinum on 3,5 and 7 days after treatment.Moreover,the effect of N-MG on the antineoplastic activity of CDDP was measured in mice bearing S180.Results N-MG alleviated nephrotoxicity induced by cisplatin on day 3 and 5 after administration of CDDP.At the same time,NOS,NO and MDA contents decreased and SOD activities restored (P<0.05 or P<0.01).The excretion evels of urinary platinum increased significantly on day 3 after treatment(P<0.01),while renal platinum contents decreased on both day 3 and 5.The combination of CDDP and N-MG didn't influence the inlibition tumor,action of CDDP.Conclusion These results indicated that N-MG was useful for prevention of renal damage induced by CDDP.N-MG mediated protection might be related to a reduced exposure of the renal tissue to platinum during the course of its enhanced excretion.As a result,free radicals induced by CDDP were decreased and the extent of lipid peroxidation was ameliorated in rat kidneys.Moreover,the combination of CDDP and N-MG would not interfere with the antitumor action of CDDP for S180 sarcoma.
, 百拇医药
【Key words】 N-methyl-glucamine; Cisplatin; Nephrotoxicity; Lipid peroxidation; Antitumor action
顺铂(CDDP)是一广谱、有效的抗癌药物,其严重且多发的肾毒性限制了它的临床应用[1]。因此,国内外学者一直重视预防CDDP肾毒性的研究。N-甲基葡萄糖胺,简称葡甲胺(N-MG),是一常用的药用辅料[2]。我们在预试验中发现经口给予N-MG能预防CDDP所致大鼠血尿素氮(BUN)升高。现旨在进一步研究N-MG对CDDP肾毒性的预防作用,并初步探讨其可能机制,同时还观察N-MG对CDDP抗肿瘤效应的影响,以期为N-MG的临床应用提供实验依据。
1 材料与方法
1.1 试剂 CDDP系冶金部云南贵金属研究所提供,其纯度不低于96 %,临用前用生理盐水配制。N-MG、硫代巴比妥酸(TBA)为美国Sigma产品。一氧化氮(NO)及一氧化氮合酶(NOS)试剂盒、超氧化物歧化酶(SOD)试剂盒购于南京建成生物制品研究所。β2-微球蛋白(β2-MG)放免试剂盒购于天津九鼎公司。其余试剂均为分析纯。N-MG临用前用蒸馏水配制,并用1 mol/L HCl调至中性。
, http://www.100md.com
1.2 动物及其处理 成年雄性SD大鼠,体重190~230 g,本校实验动物中心提供,随机分为3组,每组18只。对照组:1次腹腔注射(ip)等容积生理盐水(NS);CDDP组:1次ip5 mg/kg CDDP;CDDP+N-MG组:1次ip5 mg/kg CDDP前1 h灌胃(ig)N-MG(2 g/kg),大鼠给药后第2、4、6 天晚间留取12 h尿液,第3、5、7天采血后断头处死大鼠(每组每一时间点6只),取出肾脏。
1.3 观察指标 BUN、尿蛋白、尿β2-MG及尿肌酐含量测定按常规操作。肾皮质丙二醛(MDA)用TBA反应法测定[3]。肾皮质线粒体SOD活性测定按试剂盒操作。干燥肾皮质经消化溶解及尿1 000×g离心10 min的上清液用石墨炉原子吸收分光光度计测定肾组织及尿中Pt含量[4]。
1.4 体内抗小鼠移植性实体瘤(S180肉瘤)试验 昆明种小鼠50只,雌雄各半,体重18~22 g,由本校实验动物中心提供。接种S180瘤液(细胞数为4×106)。24 h后将小鼠随机分为5组,每组10只。NS组:1次ip等容积的NS;CDDP组:1次ip CDDP 5 mg/kg;低、中、高3个剂量N-MG预处理后给予CDDP组:分别1次ig 1.60、2.80、4.66 g/kg的N-MG后1 h ip CDDP 5 mg/kg。接种瘤液后第8天处死小鼠,摘取瘤组织并称重,计算瘤重抑制率。
, http://www.100md.com
1.5 统计处理 结果以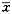 ±s表示,多组间总体均数比较采用ANOVA法,有差异者做Q检验。2组间总体均数比较用t检验。采用POMS统计软件处理。
±s表示,多组间总体均数比较采用ANOVA法,有差异者做Q检验。2组间总体均数比较用t检验。采用POMS统计软件处理。
2 结果
2.1 N-MG对CDDP所致大鼠肾功能的变化 表1显示CDDP处理后第3天和第5天,大鼠血清BUN、尿蛋白及尿β2-MG显著或非常显著地高于对照组(P<0.05或P<0.01);第5天达高峰,第7天BUN恢复至对照组水平(P>0.05),尿蛋白及尿β2-MG仍稍高于对照组,但差异无显著性(P>0.05)。CDDP+N-MG组大鼠于第3、5天BUN、尿蛋白及尿β2-MG含量明显低于CDDP组(P<0.05或P<0.01),与对照组相比,差异无显著性(P>0.05)。
2.2 N-MG对CDDP所致肾组织氧化性损伤的影响
, http://www.100md.com
2.2.1 肾皮质NOS、NO含量变化 由表2可见,CDDP处理后第3、5天大鼠肾皮质NOS、NO含量均明显高于对照组(P<0.01),第7天2组间差异无显著性。CDDP+N-MG组大鼠于第3、5天NOS、NO含量明显低于CDDP组(P<0.05或P<0.01),与对照组相比,差异无显著性(P>0.05)。
2.2.2 对肾皮质SOD活性影响 CDDP处理后第3、5、7天肾皮质SOD活性下降,其中第3、5天 SOD活性显著或非常显著地低于对照组(P<0.05或P<0.01),第7天仍低于对照组,但差异无显著性。N-MG预处理组给药后第3、5天SOD活性均显著高于CDDP组(P<0.05或P<0.01),与对照组相比差异无显著性(P>0.05,表3)。
表1 N-MG对CDDP所致大鼠肾功能各指标的变化(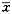 +s) 组 别
+s) 组 别
, 百拇医药
BUN(mg/dL)
尿β2-MG(μg/mg Cr)
尿蛋白(mg/mg Cr)
第3天
第5天
第7天
第3天
第5天
第7天
第3天
第5天
第7天
, 百拇医药
CDDP
61.5±43.1* *
93.8±63.7* *
26.6±3.7
0.264±0.035*
0.337±0.100*
0.220±0.108
0.802±0.162*
0.825±0.193*
0.572±0.073
, http://www.100md.com
CDDP+N-MG
28.9±7.7
29.3±9.3* *
22.3±3.4
0.202±0.052*
0.205±0.152*
0.206±0.112
0.558±0.203*
0.638±0.148*
0.581±0.052
, 百拇医药
对照
21.3±1.3
22.4±2.5
22.5±2.6
0.204±0.053
0.204±0.071
0.194±0.038
0.558±0.163
0.573±0.142
0.556±0.111
CDDP,N-MG分别经ip,ig给予大鼠,n=6,与对照组相比,*P<0.05,* *P<0.01;与CDDP组相比,#P<0.05,# #P<0.01表2 N-MG对CDDP所致大鼠肾皮质NOS、NO含量的变化(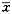 ±s) 组别
±s) 组别
, 百拇医药
NOS(U/μg)
NO(μmol/g)
第3天
第5天
第7天
第3天
第5天
第7天
CDDP
0.318±0.042* *
0.337±0.032* *
0.286±0.022
, 百拇医药
1.782±0.147* *
2.288±0.492* *
1.650±0.220
CDDP+N-MG
0.284±0.021#
0.278±0.011# #
0.277±0.009
1.488±0.082#
1.610±0.214# #
, http://www.100md.com 1.570±0.057
对照
0.246±0.016
0.269±0.021
0.267±0.011
1.426±0.092
1.412±0.103
1.440±0.126
与对照组相比,* *P<0.01;与CDDP组相比,#P<0.05,# #P<0.01 2.2.3 对肾皮质MDA形成的影响 CDDP处理后第3、5天CDDP组大鼠肾皮质MDA水平明显高于对照组(P<0.05或P<0.01),第7天2组相比,差异无显著性。CDDP+N-MG组MDA水平于第3、5天均低于CDDP组,其中第5天与CDDP组间差异非常显著(P<0.01),与相应对照组比,差异无显著性(P>0.05,表3)。
, http://www.100md.com
2.3 N-MG对肾组织Pt含量及尿Pt排出量的影响 CDDP处理后第5天大鼠肾组织Pt含量最高。N-MG预处理组大鼠3个时间点肾组织Pt含量均低于CDDP组,其中第3、5天与CDDP组相比,差异有显著性(P<0.05或P<0.01)。另外,CDDP+N-MG组于第3天尿Pt排出量非常显著地高于CDDP组(P<0.01),而第5天尿Pt排出量明显低于CDDP组(P<0.05),第7天2组间差异无显著性(P>0.05,表4)。
表3 N-MG对CDDP所致大鼠肾脏线粒体SOD活性和肾皮质匀浆MDA含量的变化(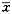 ±s) 组别
±s) 组别
SOD活性(NU/ml)
MDA(nmol/g)
第3天
, http://www.100md.com
第5天
第7天
第3天
第5天
第7天
CDDP
150.6±12.2*
134.7±16.6* *
159.1±14.5
71.6±7.9*
87.1±9.3* *
, http://www.100md.com
60.0±4.4
CDDP+N-MG
176.0±14.1#
178.3±13.7# #
174.7±14.1
64.9±7.5
69.0±6.9# #
62.1±4.2
对照
185.2±13.6
187.1±8.9
, http://www.100md.com
182.0±24.6
60.5±5.5
62.6±3.0
60.1±5.2
与对照组相比,*P<0.05,* *P<0.01;与CDDP组相比,#P<0.05,# #P<0.01表4 N-MG对CDDP处理大鼠肾组织Pt及尿Pt含量的影响(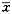 ±s) 组别
±s) 组别
肾组织Pt(μg/g干重)
尿Pt(μg/mg Cr)
第3天
, http://www.100md.com
第5天
第7天
第3天
第5天
第7天
CDDP
29.8±7.1
60.8±9.1
27.1±7.0
0.247±0.064
0.352±0.071
0.165±0.062
, 百拇医药
CDDP+N-MG
21.7±2.9*
45.1±5.4* *
23.4±4.0
0.425±0.104* *
0.250±0.051*
0.132±0.029
与CDDP组相比,*P<0.05,* *P<0.012.4 N-MG对CDDP抗瘤活性的影响 CDDP组及1.60、2.80、4.66 g/kg N-MG预处理组小鼠的瘤重抑制率分别为72.9 %、62.1 %、66.8 %、63.3 %,各N-MG预处理组与单纯CDDP组相比差异无显著性(P>0.05)。
, http://www.100md.com
3 讨论
本研究通过给大鼠1次ip 5 mg/kg CDDP后经时过程的动态观察发现,给药后第3天出现肾损害,第5天最严重。N-MG预处理可明显预防CDDP所致肾损害。CDDP所致肾损害的机制目前尚未完全清楚,大量研究认为脂质过氧化是其中机制之一[5]。体外研究已表明,外源性NO启动脂质过氧化形成[6],关于NO在CDDP肾毒性中的作用尚未肯定。本实验结果表明CDDP诱导NOS活性增强,催化生成NO量增多,推测NO自由基参与了CDDP所致毒性反应。本实验还观察到SOD活性下降,使得机体清除自由基能力受损,加重了脂质过氧化形成及肾损害。
肾组织Pt的蓄积是引起肾损害的决定因素[7,8]。本研究对肾组织Pt及尿Pt的动态观察发现,给药后第5天肾组织Pt含量达高峰,CDDP所致大鼠肾功能损害及氧化性损害亦于第5天最重,提示肾组织Pt蓄积与肾损害关系密切。N-MG预处理组大鼠于给药后第3天尿Pt排泄量非常显著地高于CDDP组,肾组织Pt浓度于给药后第3、5天均明显低于CDDP组。提示N-MG可能促进Pt经尿排出并减少肾组织中Pt的蓄积,从而在体内产生的自由基减少,脂质过氧化损害减轻,以致明显预防CDDP引起的肾毒性。体内抗小鼠S180试验结果表明,采用N-MG预防CDDP引起的肾毒性的同时不降低CDDP的抗瘤效果。
, 百拇医药
参考文献
[1] Heidemann HTH,Muller ST,Mertins L,et al.Effect of aminophylline on cisplatin nephrotoxicity:Antioxidant.System.Drug Chem.Toxicol,1995,18:151-170.
[2] 罗明生,高天惠.药剂辅料大全.成都:四川科学技术出版社,1995.698-699.
[3] 万伯健.卫生毒理学.沈阳:辽宁科学技术出版社,1992.51-52.
[4] Denniston ML,Sterson LA,Repta AJ,et al.Analysis of total platinum derived from cisplatin in tissue.Analyt Lett,1981,14:451-462.
, http://www.100md.com
[5] Zhang JG,Lindup WE.Role of mitochondria in cisplatin induced oxidative damage exhibited by rat renal cortical slices.Biochem Pharmacol,1993,45:2215-2222.
[6] 申兆菊,沈川,肖希龙,等.外源性一氧化氮对大鼠抗氧化酶活性的影响.卫生毒理学杂志,1997,11:148-149.
[7] Rangaprasad S,Cacin W.Effects of route of administration and dose on diabetes-induced protection against cisplatin nephrotoxicity.PSEBM,1996,212:362-368.
[8] Badary OA,Nagi MN,Al-sawaf HA,et al.Effect of L-histidinol on cisplatin nephrotoxicity in the rats.Nephron,1997,77:435-439.
(收稿日期:1999-09-13), http://www.100md.com
单位:关英杰(上海医科大学劳动卫生学教研室,博士生 200032);仲来福(大连医科大学毒理研究室,116027)
关键词:葡甲胺;顺铂;肾毒性;脂质过氧化;抗肿瘤作用
卫生毒理学杂志000209 【摘要】 目的 研究葡甲胺(N-MG)对顺铂(CDDP)所致大鼠肾毒性的预防作用及其可能机制。方法 大鼠1次腹腔注射5 mg/kg CDDP动物模型,于CDDP处理前1 h经口给予N-MG预处理。检测指标包括血尿素氮BUN、尿蛋白、尿铂(Pt),肾组织匀浆中NOS、NO、MDA、SOD及肾组织Pt含量,同时观察抗肿瘤活性。结果 给药后第3、5天N-MG预处理组可明显预防CDDP所致大鼠肾功能损害,降低肾组织中NOS、NO、及MDA含量,增加SOD活性(P<0.05或P<0.01)。另外,给药后第3天尿Pt(0.425 μg/mg Cr)排泄量非常显著地高于CDDP组(0.245 μg/mg Cr,P<0.01),肾组织Pt含量于给药后第3、5天显著低于CDDP组(P<0.05)。N-MG预处理对荷瘤小鼠的肿瘤抑制率与CDDP组无显著性差异。结论 N-MG预处理能明显预防CDDP所致大鼠的肾损害,其预防作用机制可能是N-MG促进Pt经尿排出,并减少了肾组织Pt蓄积,从而CDDP产生的自由基减少,脂质过氧化程度减轻。N-MG对CDDP抗肿瘤活性无明显影响。
, 百拇医药
Preventive effect of N-methyl-D-glucamine against cisplatin nephrotoxicity in Rats
Guan Ying-Jie,Zhong Lai-Fu
(Laboratory of Toxicology,Dalian Medical University,Dalian 116027,China.)
【Abstract】 Objective To investigate the protective effect of N-methyl-glucamine(N-MG)on Cisplatin(CDDP)-induced nephrotoxicity in rats and its possible mechanism.Methods Male Sprague-Dauley rats were injected i.p.with 5 mg/kg CDDP combined with 2 g/kg N-MG given i.g 1 hour before the adminstration of CDDP.BUN,Urinary protein and platinum contents were determined.Kidneys were analyzed for NOS,NO,MDA,SOD and platinum on 3,5 and 7 days after treatment.Moreover,the effect of N-MG on the antineoplastic activity of CDDP was measured in mice bearing S180.Results N-MG alleviated nephrotoxicity induced by cisplatin on day 3 and 5 after administration of CDDP.At the same time,NOS,NO and MDA contents decreased and SOD activities restored (P<0.05 or P<0.01).The excretion evels of urinary platinum increased significantly on day 3 after treatment(P<0.01),while renal platinum contents decreased on both day 3 and 5.The combination of CDDP and N-MG didn't influence the inlibition tumor,action of CDDP.Conclusion These results indicated that N-MG was useful for prevention of renal damage induced by CDDP.N-MG mediated protection might be related to a reduced exposure of the renal tissue to platinum during the course of its enhanced excretion.As a result,free radicals induced by CDDP were decreased and the extent of lipid peroxidation was ameliorated in rat kidneys.Moreover,the combination of CDDP and N-MG would not interfere with the antitumor action of CDDP for S180 sarcoma.
, 百拇医药
【Key words】 N-methyl-glucamine; Cisplatin; Nephrotoxicity; Lipid peroxidation; Antitumor action
顺铂(CDDP)是一广谱、有效的抗癌药物,其严重且多发的肾毒性限制了它的临床应用[1]。因此,国内外学者一直重视预防CDDP肾毒性的研究。N-甲基葡萄糖胺,简称葡甲胺(N-MG),是一常用的药用辅料[2]。我们在预试验中发现经口给予N-MG能预防CDDP所致大鼠血尿素氮(BUN)升高。现旨在进一步研究N-MG对CDDP肾毒性的预防作用,并初步探讨其可能机制,同时还观察N-MG对CDDP抗肿瘤效应的影响,以期为N-MG的临床应用提供实验依据。
1 材料与方法
1.1 试剂 CDDP系冶金部云南贵金属研究所提供,其纯度不低于96 %,临用前用生理盐水配制。N-MG、硫代巴比妥酸(TBA)为美国Sigma产品。一氧化氮(NO)及一氧化氮合酶(NOS)试剂盒、超氧化物歧化酶(SOD)试剂盒购于南京建成生物制品研究所。β2-微球蛋白(β2-MG)放免试剂盒购于天津九鼎公司。其余试剂均为分析纯。N-MG临用前用蒸馏水配制,并用1 mol/L HCl调至中性。
, http://www.100md.com
1.2 动物及其处理 成年雄性SD大鼠,体重190~230 g,本校实验动物中心提供,随机分为3组,每组18只。对照组:1次腹腔注射(ip)等容积生理盐水(NS);CDDP组:1次ip5 mg/kg CDDP;CDDP+N-MG组:1次ip5 mg/kg CDDP前1 h灌胃(ig)N-MG(2 g/kg),大鼠给药后第2、4、6 天晚间留取12 h尿液,第3、5、7天采血后断头处死大鼠(每组每一时间点6只),取出肾脏。
1.3 观察指标 BUN、尿蛋白、尿β2-MG及尿肌酐含量测定按常规操作。肾皮质丙二醛(MDA)用TBA反应法测定[3]。肾皮质线粒体SOD活性测定按试剂盒操作。干燥肾皮质经消化溶解及尿1 000×g离心10 min的上清液用石墨炉原子吸收分光光度计测定肾组织及尿中Pt含量[4]。
1.4 体内抗小鼠移植性实体瘤(S180肉瘤)试验 昆明种小鼠50只,雌雄各半,体重18~22 g,由本校实验动物中心提供。接种S180瘤液(细胞数为4×106)。24 h后将小鼠随机分为5组,每组10只。NS组:1次ip等容积的NS;CDDP组:1次ip CDDP 5 mg/kg;低、中、高3个剂量N-MG预处理后给予CDDP组:分别1次ig 1.60、2.80、4.66 g/kg的N-MG后1 h ip CDDP 5 mg/kg。接种瘤液后第8天处死小鼠,摘取瘤组织并称重,计算瘤重抑制率。
, http://www.100md.com
1.5 统计处理 结果以
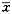 ±s表示,多组间总体均数比较采用ANOVA法,有差异者做Q检验。2组间总体均数比较用t检验。采用POMS统计软件处理。
±s表示,多组间总体均数比较采用ANOVA法,有差异者做Q检验。2组间总体均数比较用t检验。采用POMS统计软件处理。2 结果
2.1 N-MG对CDDP所致大鼠肾功能的变化 表1显示CDDP处理后第3天和第5天,大鼠血清BUN、尿蛋白及尿β2-MG显著或非常显著地高于对照组(P<0.05或P<0.01);第5天达高峰,第7天BUN恢复至对照组水平(P>0.05),尿蛋白及尿β2-MG仍稍高于对照组,但差异无显著性(P>0.05)。CDDP+N-MG组大鼠于第3、5天BUN、尿蛋白及尿β2-MG含量明显低于CDDP组(P<0.05或P<0.01),与对照组相比,差异无显著性(P>0.05)。
2.2 N-MG对CDDP所致肾组织氧化性损伤的影响
, http://www.100md.com
2.2.1 肾皮质NOS、NO含量变化 由表2可见,CDDP处理后第3、5天大鼠肾皮质NOS、NO含量均明显高于对照组(P<0.01),第7天2组间差异无显著性。CDDP+N-MG组大鼠于第3、5天NOS、NO含量明显低于CDDP组(P<0.05或P<0.01),与对照组相比,差异无显著性(P>0.05)。
2.2.2 对肾皮质SOD活性影响 CDDP处理后第3、5、7天肾皮质SOD活性下降,其中第3、5天 SOD活性显著或非常显著地低于对照组(P<0.05或P<0.01),第7天仍低于对照组,但差异无显著性。N-MG预处理组给药后第3、5天SOD活性均显著高于CDDP组(P<0.05或P<0.01),与对照组相比差异无显著性(P>0.05,表3)。
表1 N-MG对CDDP所致大鼠肾功能各指标的变化(
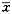 +s) 组 别
+s) 组 别, 百拇医药
BUN(mg/dL)
尿β2-MG(μg/mg Cr)
尿蛋白(mg/mg Cr)
第3天
第5天
第7天
第3天
第5天
第7天
第3天
第5天
第7天
, 百拇医药
CDDP
61.5±43.1* *
93.8±63.7* *
26.6±3.7
0.264±0.035*
0.337±0.100*
0.220±0.108
0.802±0.162*
0.825±0.193*
0.572±0.073
, http://www.100md.com
CDDP+N-MG
28.9±7.7
29.3±9.3* *
22.3±3.4
0.202±0.052*
0.205±0.152*
0.206±0.112
0.558±0.203*
0.638±0.148*
0.581±0.052
, 百拇医药
对照
21.3±1.3
22.4±2.5
22.5±2.6
0.204±0.053
0.204±0.071
0.194±0.038
0.558±0.163
0.573±0.142
0.556±0.111
CDDP,N-MG分别经ip,ig给予大鼠,n=6,与对照组相比,*P<0.05,* *P<0.01;与CDDP组相比,#P<0.05,# #P<0.01表2 N-MG对CDDP所致大鼠肾皮质NOS、NO含量的变化(
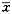 ±s) 组别
±s) 组别, 百拇医药
NOS(U/μg)
NO(μmol/g)
第3天
第5天
第7天
第3天
第5天
第7天
CDDP
0.318±0.042* *
0.337±0.032* *
0.286±0.022
, 百拇医药
1.782±0.147* *
2.288±0.492* *
1.650±0.220
CDDP+N-MG
0.284±0.021#
0.278±0.011# #
0.277±0.009
1.488±0.082#
1.610±0.214# #
, http://www.100md.com 1.570±0.057
对照
0.246±0.016
0.269±0.021
0.267±0.011
1.426±0.092
1.412±0.103
1.440±0.126
与对照组相比,* *P<0.01;与CDDP组相比,#P<0.05,# #P<0.01 2.2.3 对肾皮质MDA形成的影响 CDDP处理后第3、5天CDDP组大鼠肾皮质MDA水平明显高于对照组(P<0.05或P<0.01),第7天2组相比,差异无显著性。CDDP+N-MG组MDA水平于第3、5天均低于CDDP组,其中第5天与CDDP组间差异非常显著(P<0.01),与相应对照组比,差异无显著性(P>0.05,表3)。
, http://www.100md.com
2.3 N-MG对肾组织Pt含量及尿Pt排出量的影响 CDDP处理后第5天大鼠肾组织Pt含量最高。N-MG预处理组大鼠3个时间点肾组织Pt含量均低于CDDP组,其中第3、5天与CDDP组相比,差异有显著性(P<0.05或P<0.01)。另外,CDDP+N-MG组于第3天尿Pt排出量非常显著地高于CDDP组(P<0.01),而第5天尿Pt排出量明显低于CDDP组(P<0.05),第7天2组间差异无显著性(P>0.05,表4)。
表3 N-MG对CDDP所致大鼠肾脏线粒体SOD活性和肾皮质匀浆MDA含量的变化(
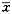 ±s) 组别
±s) 组别SOD活性(NU/ml)
MDA(nmol/g)
第3天
, http://www.100md.com
第5天
第7天
第3天
第5天
第7天
CDDP
150.6±12.2*
134.7±16.6* *
159.1±14.5
71.6±7.9*
87.1±9.3* *
, http://www.100md.com
60.0±4.4
CDDP+N-MG
176.0±14.1#
178.3±13.7# #
174.7±14.1
64.9±7.5
69.0±6.9# #
62.1±4.2
对照
185.2±13.6
187.1±8.9
, http://www.100md.com
182.0±24.6
60.5±5.5
62.6±3.0
60.1±5.2
与对照组相比,*P<0.05,* *P<0.01;与CDDP组相比,#P<0.05,# #P<0.01表4 N-MG对CDDP处理大鼠肾组织Pt及尿Pt含量的影响(
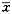 ±s) 组别
±s) 组别肾组织Pt(μg/g干重)
尿Pt(μg/mg Cr)
第3天
, http://www.100md.com
第5天
第7天
第3天
第5天
第7天
CDDP
29.8±7.1
60.8±9.1
27.1±7.0
0.247±0.064
0.352±0.071
0.165±0.062
, 百拇医药
CDDP+N-MG
21.7±2.9*
45.1±5.4* *
23.4±4.0
0.425±0.104* *
0.250±0.051*
0.132±0.029
与CDDP组相比,*P<0.05,* *P<0.012.4 N-MG对CDDP抗瘤活性的影响 CDDP组及1.60、2.80、4.66 g/kg N-MG预处理组小鼠的瘤重抑制率分别为72.9 %、62.1 %、66.8 %、63.3 %,各N-MG预处理组与单纯CDDP组相比差异无显著性(P>0.05)。
, http://www.100md.com
3 讨论
本研究通过给大鼠1次ip 5 mg/kg CDDP后经时过程的动态观察发现,给药后第3天出现肾损害,第5天最严重。N-MG预处理可明显预防CDDP所致肾损害。CDDP所致肾损害的机制目前尚未完全清楚,大量研究认为脂质过氧化是其中机制之一[5]。体外研究已表明,外源性NO启动脂质过氧化形成[6],关于NO在CDDP肾毒性中的作用尚未肯定。本实验结果表明CDDP诱导NOS活性增强,催化生成NO量增多,推测NO自由基参与了CDDP所致毒性反应。本实验还观察到SOD活性下降,使得机体清除自由基能力受损,加重了脂质过氧化形成及肾损害。
肾组织Pt的蓄积是引起肾损害的决定因素[7,8]。本研究对肾组织Pt及尿Pt的动态观察发现,给药后第5天肾组织Pt含量达高峰,CDDP所致大鼠肾功能损害及氧化性损害亦于第5天最重,提示肾组织Pt蓄积与肾损害关系密切。N-MG预处理组大鼠于给药后第3天尿Pt排泄量非常显著地高于CDDP组,肾组织Pt浓度于给药后第3、5天均明显低于CDDP组。提示N-MG可能促进Pt经尿排出并减少肾组织中Pt的蓄积,从而在体内产生的自由基减少,脂质过氧化损害减轻,以致明显预防CDDP引起的肾毒性。体内抗小鼠S180试验结果表明,采用N-MG预防CDDP引起的肾毒性的同时不降低CDDP的抗瘤效果。
, 百拇医药
参考文献
[1] Heidemann HTH,Muller ST,Mertins L,et al.Effect of aminophylline on cisplatin nephrotoxicity:Antioxidant.System.Drug Chem.Toxicol,1995,18:151-170.
[2] 罗明生,高天惠.药剂辅料大全.成都:四川科学技术出版社,1995.698-699.
[3] 万伯健.卫生毒理学.沈阳:辽宁科学技术出版社,1992.51-52.
[4] Denniston ML,Sterson LA,Repta AJ,et al.Analysis of total platinum derived from cisplatin in tissue.Analyt Lett,1981,14:451-462.
, http://www.100md.com
[5] Zhang JG,Lindup WE.Role of mitochondria in cisplatin induced oxidative damage exhibited by rat renal cortical slices.Biochem Pharmacol,1993,45:2215-2222.
[6] 申兆菊,沈川,肖希龙,等.外源性一氧化氮对大鼠抗氧化酶活性的影响.卫生毒理学杂志,1997,11:148-149.
[7] Rangaprasad S,Cacin W.Effects of route of administration and dose on diabetes-induced protection against cisplatin nephrotoxicity.PSEBM,1996,212:362-368.
[8] Badary OA,Nagi MN,Al-sawaf HA,et al.Effect of L-histidinol on cisplatin nephrotoxicity in the rats.Nephron,1997,77:435-439.
(收稿日期:1999-09-13), http://www.100md.com