高密度脂蛋白3介导大鼠腹腔巨噬细胞内胆固醇流出
作者:陈佩芳 李剑军 吴满平 楼滨 杨小琪
单位:上海医科大学药学院生物化学教研室, 上海市 200032
关键词:巨噬细胞,腹腔;胆固醇;脂蛋白,高密度;细胞内吞;异硫氰酸荧光素酯;大鼠
中国动脉硬化杂志000206[摘 要] 为了研究高密度脂蛋白3介导大鼠腹腔巨噬细胞内胆固醇流出的机理,用N-乙酰咪唑修饰高密度脂蛋白3,阻断其与细胞表面受体的结合,观察细胞内胆固醇流出。用异硫氰酸荧光素酯标记高密度脂蛋白3,示踪其在细胞内的代谢。结果发现牛血清白蛋白(对照组)介导2.87%细胞内胆固醇流出,高密度脂蛋白3组和N-乙酰咪唑-高密度脂蛋白3组分别为40.68%和8.69%。异硫氰酸荧光素酯-高密度脂蛋白3与细胞在37℃共育3 h后,细胞内吞荧光强度占结合的65.0%,细胞在37℃继续培养2 h后,细胞释放的荧光强度占内吞的78.4%,并且内吞和释放的荧光强度均主要存在于三氯醋酸沉淀部分。结果提示高密度脂蛋白3通过与细胞表面受体作用进入细胞,在细胞内不经过溶酶体途径降解,而是接受细胞内胆固醇后通过逆胞饮形式释放到细胞外。
, 百拇医药
[中图分类号] Q548.1 [文献标识码] A
[文章编号] 1007-3949(2000)-02-0111-04
Cholesterol Efflux from Macrophages Mediated by High Density Lipoprotein-3
CHEN Pei-Fang, LI Jian-Jun, WU Man-Ping, LOU Bin, and YANG Xiao-Qi
(Department of Biochemistry, School of Pharmacy, Shanghai Medical University, Shanghai 200032, China)
ABSTRACT Aim To study the mechanism of cholesterol efflux from rat peritoneal macrophages mediated by high density lipoprotein-3(HDL3). Methods Modification of HDL3 by N-acetylimidazole blocked interaction between HDL and its cellular receptor. FITC labeled HDL3 were used to observed the cellular metabolic process of HDL3. Results BSA (control group) mediated 2.9% cellular cholesterol efflux from the cells. In HDL3 group and N-acetylimidazole-HDL3 group,they were 40.7% and 8.7% respectively. After incubation of macrophages with FITC-HDL3 at 37℃for 3 h, the cell-endocytic fluorescence strength (FS) was 65.0% of the cell-associated FS. When the cells were further incubated with blank media at 37℃for 2 h, 78.4% of the cell-endocytic FS was released into the media. Both the cell-endocytic FS and the cell-released FS were mainly in trichloroacetic acid precepitable form. Conclusions The cellular cholesterol efflux from macrophages mediated by HDL3 was HDL receptor-dependent. The possible mechanism could be that macrophages internalized HDL3 by HDL receptor. HDL3 picked up cellular cholesterol and was resecreted out of cells by a retroendocytic pathway without taking a celluar lysosomal phathway.
, 百拇医药
MeSH Macrophages,Peritoneal; Cholesterol ; Lipoprotein,HDL; Endocytosis; Fluorescence Isothiocyanate; Rat
高密度脂蛋白3(high density lipoprotein-3, HDL3)具有抗动脉粥样硬化作用,主要是因为其参与了胆固醇(cholesterol)逆转运。胆固醇逆向转运包含三个步骤:①胆固醇从肝外细胞流出,被HDL3接受;②在血浆中卵磷脂:胆固醇酰基转移酶催化下,胆固醇转变成胆固醇酯,使HDL3转化成富含胆固醇酯的HDL2;③肝脏选择性摄取HDL2中胆固醇酯。其中第二步胆固醇酯化反应过程早已阐明,第三步肝脏选择性摄取HDL2中胆固醇酯的机理,我们已作了研讨[1]。但关于第一步HDL3介导细胞内胆固醇流出的机理,至今尚未阐明,有几种代表观点:① 胆固醇通过简单扩散透过细胞膜,进入细胞间液与HDL结合并被运走[2];②细胞上HDL受体介导细胞内胆固醇流出[3];③细胞内胆固醇流出是由HDL中脂质部分介导的[4];④HDL中两种组分,即载脂蛋白与脂质部分均参与了细胞内胆固醇的流出[5]。本研究将以大鼠腹腔巨噬细胞为对象来探讨细胞内胆固醇流出的机理。
, http://www.100md.com
1 材料与方法
1.1 材 料
健康人血由上海市中心血站提供。Wistar大鼠由我校实验动物部提供。RPMI-1640培养基系GIBCO产品。胰蛋白酶系Difco进口分装。异硫氰酸荧光素酯(fluorescence isothiocyanate, FITC)系上海第二军医大学药学系工厂产品。胆固醇酶联试剂盒系上海十八药厂产品。超速离心机系Beckman产品。CO2培养箱系日本Tabaiespec公司产品。荧光分光光度计系日本Hitachi产品。D-Hanks液(pH7.4)含0.8%NaCl、0.04%KCl、0.006%Na2HPO4*H2O、0.006%KH2PO4、0.035%NaHCO3和0.002%酚红。细胞培养基为含10%小牛血清、100 mg/L青霉素和100 mg/L链霉素的RPMI-1640液。
, http://www.100md.com
1.2 无载脂蛋白E-高密度脂蛋白3的制备与纯化
参照我室方法[2]。人新鲜血浆经超速离心后,采用吸流法,取密度在1.125~1.210 kg/L部分,经肝素-Sepharose CL-4B亲和层析制备,经电泳证明不含载脂蛋白E。本实验所用HDL3均为无载脂蛋白E-HDL3。
1.3 大鼠腹腔巨噬细胞制备
以85%普通饲料、2%胆固醇、0.5%胆酸钠和12.5%猪油配成的高脂饲料喂养老鼠,建立高脂模型。实验前4天,大鼠腹腔注射3%无菌硫代乙醇酸钠肉汤,诱导巨噬细胞产生。实验时将大鼠乙醚麻醉处死,用D-Hanks液腹腔灌洗收集腹腔巨噬细胞,1 000 r/min离心10 min,将沉淀用含10%小牛血清的RPMI-1640培养基制成悬液,调节细胞浓度至3×109个/L,接种于直径35 mm培养皿中。置37℃、5%CO2孵箱中培养,3 h后洗去未贴壁的细胞,加入2 mL培养基,预培养24 h后加入各种样品。
, 百拇医药
1.4 N-乙酰咪唑修饰高密度脂蛋白3
参照我室方法[6]。
1.5 高密度脂蛋白3的异硫氰酸荧光素酯标记及异硫氰酸荧光素酯-高密度脂蛋白3的纯化
参照我室方法[7]。
1.6 细胞内胆固醇含量的测定
用1 mL 0.5%胰蛋白酶消化贴壁细胞,洗涤,超声波粉碎,离心后取上清液,按胆固醇-酶联法测定胆固醇含量。
1.7 N-乙酰咪唑修饰对高密度脂蛋白3介导巨噬细胞内胆固醇流出的影响
实验分三组,每组4皿。分别加入100 μg牛血清白蛋白(BSA)、100 μg HDL3和100 μg N-乙酰咪唑-HDL3。37℃培养24 h,测定细胞内胆固醇含量。用q检验方法进行数据显著性差异分析。
, http://www.100md.com
1.8 高密度脂蛋白3和N-乙酰咪唑-高密度脂蛋白3介导细胞内胆固醇外流的时间-效应曲线和剂量-效应曲线
三组各取10皿细胞,分别加入100 μg BSA、100 μg HDL3、100 μg N-乙酰咪唑-HDL3。每组再分别分成三组,37℃分别培养12 h(n=3)、24 h(n=4)和36 h(n=3),测定细胞内胆固醇含量,绘制时间-效应曲线。取10皿细胞,分别加入50 μg(n=3)、100 μg(n=4)和150 μg(n=3)HDL3,相应浓度依次为25、50和75 mg/L。另各取10皿细胞,分别加入相应剂量的BSA和N-乙酰咪唑-HDL3。37℃培养24 h,测定细胞内胆固醇含量,绘制剂量-效应曲线。
1.9 细胞结合、内吞和释放载脂蛋白实验
取6皿细胞,加入100 μg 异硫氰酸荧光素酯-HDL3,总体积定容至2 mL,37℃培养3 h后用无酚红D-Hanks液洗三遍,分成三组(每组2皿)。第一组每皿加入1.5 mL含0.5%胰蛋白酶的无酚红D-Hanks液,室温消化2 min,回收细胞,超声波粉碎,测定细胞结合内吞的荧光强度(激发波长495 nm,发射波长519 nm)。第二组每皿加1 mL含0.5%胰蛋白酶的无酚红D-Hanks液,0℃处理15 min,离心洗涤后加入1.5 mL含0.5%胰蛋白酶的无酚红D-Hanks液,室温消化2 min,回收细胞,超声波粉碎后加三氯醋酸沉淀蛋白质,分离沉淀和上清液,分别测定细胞内吞三氯醋酸沉淀部分和上清液部分的荧光强度。第三组按第二组0℃处理后再加入2 mL培养基,37℃培养2 h,取上清液加入三氯醋酸沉淀蛋白质,分别测定细胞释放的三氯醋酸沉淀部分和上清液部分的荧光强度。
, http://www.100md.com
2 结 果
2.1 N-乙酰咪唑修饰高密度脂蛋白3对其介导巨噬细胞内胆固醇流出的影响
从表1(Table 1)中可见,BSA、HDL3和N-乙酰咪唑-HDL3分别介导2.87%、40.68%和8.69%细胞内胆固醇流出,Q检验结果显示HDL3组与BSA组及N-乙酰咪唑-HDL3组均有显著性差异(P<0.05)。而BSA组与N-乙酰咪唑-HDL3组之间差异不显著(P>0.05)。
2.2 高密度脂蛋白3和N-乙酰咪唑-高密度脂蛋白3介导巨噬细胞内胆固醇流出的时间-效应曲线和剂量-效应曲线
由图1(Figure 1)中可见,随着时间的延长,HDL3介导细胞内胆固醇流出增加,细胞内胆固醇含量逐渐减少,而N-乙酰咪唑-HDL3组变化不明显。
, http://www.100md.com
表1. N-乙酰咪唑修饰对高密度脂蛋白3介导巨噬细胞内胆固醇流出的影响.
Table 1. Cholesterol efflux from macrophages in the presence of HDL3 and N-acetylimidazole-HDL3(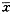 ±s,n=4). Groups
±s,n=4). Groups
TC
(μg/plate)
Cholesterol
efflux
Efflux
, 百拇医药 percentage (%)
Control
80.6±3.3
0
0
BSA
78.3±4.7
2.31
2.87
HDL3
47.8±5.4ab
32.78
, http://www.100md.com
40.68
N-ALD-HDL3
73.6±4.7
7.00
8.69
ALD-HDL3: N-acetylimidazole-HDL3. a: P<0.05, compared with control and BSA group; b: P<0.05, compared with N-ALD-HDL3 group.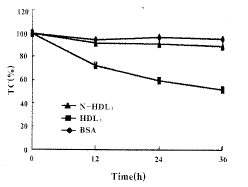
图1. 高密度脂蛋白3和N-乙酰咪唑-高密度脂蛋白3介导巨噬细胞内胆固醇流出的时间-效应曲线(24 h组n=4,其它时间组n=3).
, http://www.100md.com
Figure 1. Time-course of cholesterol efflux from macrophages in the presence of HDL3 and N-acetylimidazole treated HDL3 ( n=4 at 24 h, n=3 at other time).
同样,图2(Figure 2)结果显示,随着剂量的增加,HDL3介导细胞内胆固醇流出量逐渐增加,细胞内胆固醇含量逐渐减少,而N-乙酰咪唑-HDL3组无明显变化。
2.3 细胞结合、内吞和释放载脂蛋白实验
表2(Table 2)结果显示,细胞内吞的荧光强度占结合荧光强度的65.0%,细胞释放的荧光强度占内吞荧光强度的78.4%,且两者的荧光强度分别以94.4%和94.2%的比例存在于三氯醋酸沉淀部分。
, http://www.100md.com
图2. 高密度脂蛋白3和N-乙酰咪唑-高密度脂蛋白3介导巨噬细胞内胆固醇流出的剂量-效应曲线 (100 μg组n=4,其它剂量组n=3).
Figure 2. Cholesterol efflux from macrophages in the presence of HDL3 and N-acetylimidazole-HDL3 (n=4 at 100 μg, n=3 at other dose).
表2. 细胞结合、内吞和释放荧光强度.
Table 2. Cell-associated,cell-endocytic and cell-released fluorescence strength (FS) after incubation of macrophages with FITC-HDL3(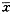 ±s,n=2). Groups
±s,n=2). Groups
, 百拇医药
FS
Precepitable FS
Souluble FS
Associated(Ⅰ)
14.8±0.2
-
-
Endocytic(Ⅱ)
-
9.1±0.8
0.5±0.1
Released(Ⅲ)
, http://www.100md.com
-
7.1±0.3
0.4±0.1
Ⅱ/Ⅰ(%)
65.0
-
-
Ⅲ/Ⅱ(%)
78.4
-
-
3 讨 论
大量研究表明高密度脂蛋白能促进肝外细胞内胆固醇流出,从而具有抗动脉粥样硬化作用。我们的结果有力证明了这一点(表1),高密度脂蛋白3将巨噬细胞内40.68% 胆固醇介导流出,与牛血清白蛋白组(对照组)有显著性差异(P<0.05)。载脂蛋白A-I是高密度脂蛋白的主要载脂蛋白,它的缺失或者减少会引起血浆高密度脂蛋白减少和冠心病发病率的增加。载脂蛋白A-I能识别高密度脂蛋白受体,修饰它使其不能与细胞结合,对研究受体在细胞内胆固醇外流中的功能非常有用。N-乙酰咪唑特异修饰高密度脂蛋白中的酪氨酸,几乎能完全阻断细胞与高密度脂蛋白的结合,细胞内胆固醇的流出率也显著降低(P<0.05),说明高密度脂蛋白3促进细胞内胆固醇的流出是由受体介导的。从时间-效应曲线(图1)和剂量-效应曲线(图2)上可以看出,高密度脂蛋白3介导细胞内胆固醇流出的能力随时间的延长和剂量的增加而增强,而N-乙酰咪唑-高密度脂蛋白3组无明显变化,这更进一步说明了高密度脂蛋白3介导巨噬细胞内胆固醇的流出是由受体介导的。
, 百拇医药
用异硫氰酸荧光素酶标记观察载脂蛋白的摄取和代谢的实验中,细胞内吞的荧光强度占结合量的65.0%,三氯醋酸检测出存在于三氯醋酸沉淀部分的荧光强度占94.4%,即内吞以后异硫氰酸荧光素酶仍与载脂蛋白相结合,说明载脂蛋白在巨噬细胞内未经溶酶体降解。这与我们实验室以前在大鼠肝窦状隙细胞中得到的结果一致[1]。释放到介质中的荧光强度占内吞量的78.4%,并且以94.2%的比例存在于三氯醋酸沉淀部分(表2)。说明巨噬细胞与高密度脂蛋白3作用过程中,细胞摄取了高密度脂蛋白3,并且未被溶酶体降解,而是以逆向胞饮的途径释放出来。
从本实验结果我们可以提出高密度脂蛋白3介导巨噬细胞内胆固醇外流的假说,即高密度脂蛋白3通过载脂蛋白A-I与细胞受体作用被细胞内吞,不经溶酶体途径降解,而是摄取胞浆中胆固醇,以逆向胞饮方式释放到细胞外。
[基金项目] 国家自然科学基金资助课题(项目编号39570158)
, 百拇医药
[作者简介] 陈佩芳,女,46岁,主管技师,参与国家自然科学基金资助课题5次,发表论文20余篇,两次赴香港中文大学生物化学系进修。
参考文献
[1] 魏 强, 吴满平, 陈佩芳, 等. HDL受体和肝性脂酶在肝选择性摄取HDL2-CE中的协同作用 [J]. 生物化学与生物物理学报, 1996, 28: 659-662
[2] Rothblat GH, Mahlberg FH, Johnson WJ, et al. Apolipoproteins, membrane cholesterol domains, and the regulation of cholesterol efflux [J]. J Lipid Res, 1992, 33: 1 091-098
[3] Shotte JF, Oram JF, Bierman EL. Binding of HDL to cell receptors promotes translocation of cholesterol from intercellular membranes to the cell surface [J]. J Bio Chem, 1987, 262: 12 001-012
, http://www.100md.com
[4] Mahlberg FH, Glick JM, Kafz SL, et al. Influence of apolipoprotein A-I, A-II, and Cs on the metabolism of membrane and lyosomal cholesterol in macrophages [J]. J Biol Chem, 1991, 266: 19 931-935
[5] Oram JF, Mendez JA, Slotte JP, et al. HDL apolipoproteins mediated removal of sterol from intracellular pools but not from plasma membranes of cholesterol-loaded fibroblasts [J]. Arterioscler Thromb, 1991, 11: 403-413
[6] 吴满平, 陈佩芳, 卜书红, 等. 乙酰咪唑修饰对高密度脂蛋白结合人肝癌SMMC-7721细胞的影响 [J]. 上海医科大学学报, 1994, 21: 321-323
[7] 吴满平, 陈佩芳, 陈其善, 等. 大鼠肝外非实质细胞的高密度脂蛋白非溶酶体途径内吞 [J]. 生物化学与生物物理学报, 1993, 25: 543-544
1999-12-03 收到
2000-03-15 修回, 百拇医药
单位:上海医科大学药学院生物化学教研室, 上海市 200032
关键词:巨噬细胞,腹腔;胆固醇;脂蛋白,高密度;细胞内吞;异硫氰酸荧光素酯;大鼠
中国动脉硬化杂志000206[摘 要] 为了研究高密度脂蛋白3介导大鼠腹腔巨噬细胞内胆固醇流出的机理,用N-乙酰咪唑修饰高密度脂蛋白3,阻断其与细胞表面受体的结合,观察细胞内胆固醇流出。用异硫氰酸荧光素酯标记高密度脂蛋白3,示踪其在细胞内的代谢。结果发现牛血清白蛋白(对照组)介导2.87%细胞内胆固醇流出,高密度脂蛋白3组和N-乙酰咪唑-高密度脂蛋白3组分别为40.68%和8.69%。异硫氰酸荧光素酯-高密度脂蛋白3与细胞在37℃共育3 h后,细胞内吞荧光强度占结合的65.0%,细胞在37℃继续培养2 h后,细胞释放的荧光强度占内吞的78.4%,并且内吞和释放的荧光强度均主要存在于三氯醋酸沉淀部分。结果提示高密度脂蛋白3通过与细胞表面受体作用进入细胞,在细胞内不经过溶酶体途径降解,而是接受细胞内胆固醇后通过逆胞饮形式释放到细胞外。
, 百拇医药
[中图分类号] Q548.1 [文献标识码] A
[文章编号] 1007-3949(2000)-02-0111-04
Cholesterol Efflux from Macrophages Mediated by High Density Lipoprotein-3
CHEN Pei-Fang, LI Jian-Jun, WU Man-Ping, LOU Bin, and YANG Xiao-Qi
(Department of Biochemistry, School of Pharmacy, Shanghai Medical University, Shanghai 200032, China)
ABSTRACT Aim To study the mechanism of cholesterol efflux from rat peritoneal macrophages mediated by high density lipoprotein-3(HDL3). Methods Modification of HDL3 by N-acetylimidazole blocked interaction between HDL and its cellular receptor. FITC labeled HDL3 were used to observed the cellular metabolic process of HDL3. Results BSA (control group) mediated 2.9% cellular cholesterol efflux from the cells. In HDL3 group and N-acetylimidazole-HDL3 group,they were 40.7% and 8.7% respectively. After incubation of macrophages with FITC-HDL3 at 37℃for 3 h, the cell-endocytic fluorescence strength (FS) was 65.0% of the cell-associated FS. When the cells were further incubated with blank media at 37℃for 2 h, 78.4% of the cell-endocytic FS was released into the media. Both the cell-endocytic FS and the cell-released FS were mainly in trichloroacetic acid precepitable form. Conclusions The cellular cholesterol efflux from macrophages mediated by HDL3 was HDL receptor-dependent. The possible mechanism could be that macrophages internalized HDL3 by HDL receptor. HDL3 picked up cellular cholesterol and was resecreted out of cells by a retroendocytic pathway without taking a celluar lysosomal phathway.
, 百拇医药
MeSH Macrophages,Peritoneal; Cholesterol ; Lipoprotein,HDL; Endocytosis; Fluorescence Isothiocyanate; Rat
高密度脂蛋白3(high density lipoprotein-3, HDL3)具有抗动脉粥样硬化作用,主要是因为其参与了胆固醇(cholesterol)逆转运。胆固醇逆向转运包含三个步骤:①胆固醇从肝外细胞流出,被HDL3接受;②在血浆中卵磷脂:胆固醇酰基转移酶催化下,胆固醇转变成胆固醇酯,使HDL3转化成富含胆固醇酯的HDL2;③肝脏选择性摄取HDL2中胆固醇酯。其中第二步胆固醇酯化反应过程早已阐明,第三步肝脏选择性摄取HDL2中胆固醇酯的机理,我们已作了研讨[1]。但关于第一步HDL3介导细胞内胆固醇流出的机理,至今尚未阐明,有几种代表观点:① 胆固醇通过简单扩散透过细胞膜,进入细胞间液与HDL结合并被运走[2];②细胞上HDL受体介导细胞内胆固醇流出[3];③细胞内胆固醇流出是由HDL中脂质部分介导的[4];④HDL中两种组分,即载脂蛋白与脂质部分均参与了细胞内胆固醇的流出[5]。本研究将以大鼠腹腔巨噬细胞为对象来探讨细胞内胆固醇流出的机理。
, http://www.100md.com
1 材料与方法
1.1 材 料
健康人血由上海市中心血站提供。Wistar大鼠由我校实验动物部提供。RPMI-1640培养基系GIBCO产品。胰蛋白酶系Difco进口分装。异硫氰酸荧光素酯(fluorescence isothiocyanate, FITC)系上海第二军医大学药学系工厂产品。胆固醇酶联试剂盒系上海十八药厂产品。超速离心机系Beckman产品。CO2培养箱系日本Tabaiespec公司产品。荧光分光光度计系日本Hitachi产品。D-Hanks液(pH7.4)含0.8%NaCl、0.04%KCl、0.006%Na2HPO4*H2O、0.006%KH2PO4、0.035%NaHCO3和0.002%酚红。细胞培养基为含10%小牛血清、100 mg/L青霉素和100 mg/L链霉素的RPMI-1640液。
, http://www.100md.com
1.2 无载脂蛋白E-高密度脂蛋白3的制备与纯化
参照我室方法[2]。人新鲜血浆经超速离心后,采用吸流法,取密度在1.125~1.210 kg/L部分,经肝素-Sepharose CL-4B亲和层析制备,经电泳证明不含载脂蛋白E。本实验所用HDL3均为无载脂蛋白E-HDL3。
1.3 大鼠腹腔巨噬细胞制备
以85%普通饲料、2%胆固醇、0.5%胆酸钠和12.5%猪油配成的高脂饲料喂养老鼠,建立高脂模型。实验前4天,大鼠腹腔注射3%无菌硫代乙醇酸钠肉汤,诱导巨噬细胞产生。实验时将大鼠乙醚麻醉处死,用D-Hanks液腹腔灌洗收集腹腔巨噬细胞,1 000 r/min离心10 min,将沉淀用含10%小牛血清的RPMI-1640培养基制成悬液,调节细胞浓度至3×109个/L,接种于直径35 mm培养皿中。置37℃、5%CO2孵箱中培养,3 h后洗去未贴壁的细胞,加入2 mL培养基,预培养24 h后加入各种样品。
, 百拇医药
1.4 N-乙酰咪唑修饰高密度脂蛋白3
参照我室方法[6]。
1.5 高密度脂蛋白3的异硫氰酸荧光素酯标记及异硫氰酸荧光素酯-高密度脂蛋白3的纯化
参照我室方法[7]。
1.6 细胞内胆固醇含量的测定
用1 mL 0.5%胰蛋白酶消化贴壁细胞,洗涤,超声波粉碎,离心后取上清液,按胆固醇-酶联法测定胆固醇含量。
1.7 N-乙酰咪唑修饰对高密度脂蛋白3介导巨噬细胞内胆固醇流出的影响
实验分三组,每组4皿。分别加入100 μg牛血清白蛋白(BSA)、100 μg HDL3和100 μg N-乙酰咪唑-HDL3。37℃培养24 h,测定细胞内胆固醇含量。用q检验方法进行数据显著性差异分析。
, http://www.100md.com
1.8 高密度脂蛋白3和N-乙酰咪唑-高密度脂蛋白3介导细胞内胆固醇外流的时间-效应曲线和剂量-效应曲线
三组各取10皿细胞,分别加入100 μg BSA、100 μg HDL3、100 μg N-乙酰咪唑-HDL3。每组再分别分成三组,37℃分别培养12 h(n=3)、24 h(n=4)和36 h(n=3),测定细胞内胆固醇含量,绘制时间-效应曲线。取10皿细胞,分别加入50 μg(n=3)、100 μg(n=4)和150 μg(n=3)HDL3,相应浓度依次为25、50和75 mg/L。另各取10皿细胞,分别加入相应剂量的BSA和N-乙酰咪唑-HDL3。37℃培养24 h,测定细胞内胆固醇含量,绘制剂量-效应曲线。
1.9 细胞结合、内吞和释放载脂蛋白实验
取6皿细胞,加入100 μg 异硫氰酸荧光素酯-HDL3,总体积定容至2 mL,37℃培养3 h后用无酚红D-Hanks液洗三遍,分成三组(每组2皿)。第一组每皿加入1.5 mL含0.5%胰蛋白酶的无酚红D-Hanks液,室温消化2 min,回收细胞,超声波粉碎,测定细胞结合内吞的荧光强度(激发波长495 nm,发射波长519 nm)。第二组每皿加1 mL含0.5%胰蛋白酶的无酚红D-Hanks液,0℃处理15 min,离心洗涤后加入1.5 mL含0.5%胰蛋白酶的无酚红D-Hanks液,室温消化2 min,回收细胞,超声波粉碎后加三氯醋酸沉淀蛋白质,分离沉淀和上清液,分别测定细胞内吞三氯醋酸沉淀部分和上清液部分的荧光强度。第三组按第二组0℃处理后再加入2 mL培养基,37℃培养2 h,取上清液加入三氯醋酸沉淀蛋白质,分别测定细胞释放的三氯醋酸沉淀部分和上清液部分的荧光强度。
, http://www.100md.com
2 结 果
2.1 N-乙酰咪唑修饰高密度脂蛋白3对其介导巨噬细胞内胆固醇流出的影响
从表1(Table 1)中可见,BSA、HDL3和N-乙酰咪唑-HDL3分别介导2.87%、40.68%和8.69%细胞内胆固醇流出,Q检验结果显示HDL3组与BSA组及N-乙酰咪唑-HDL3组均有显著性差异(P<0.05)。而BSA组与N-乙酰咪唑-HDL3组之间差异不显著(P>0.05)。
2.2 高密度脂蛋白3和N-乙酰咪唑-高密度脂蛋白3介导巨噬细胞内胆固醇流出的时间-效应曲线和剂量-效应曲线
由图1(Figure 1)中可见,随着时间的延长,HDL3介导细胞内胆固醇流出增加,细胞内胆固醇含量逐渐减少,而N-乙酰咪唑-HDL3组变化不明显。
, http://www.100md.com
表1. N-乙酰咪唑修饰对高密度脂蛋白3介导巨噬细胞内胆固醇流出的影响.
Table 1. Cholesterol efflux from macrophages in the presence of HDL3 and N-acetylimidazole-HDL3(
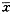 ±s,n=4). Groups
±s,n=4). GroupsTC
(μg/plate)
Cholesterol
efflux
Efflux
, 百拇医药 percentage (%)
Control
80.6±3.3
0
0
BSA
78.3±4.7
2.31
2.87
HDL3
47.8±5.4ab
32.78
, http://www.100md.com
40.68
N-ALD-HDL3
73.6±4.7
7.00
8.69
ALD-HDL3: N-acetylimidazole-HDL3. a: P<0.05, compared with control and BSA group; b: P<0.05, compared with N-ALD-HDL3 group.

图1. 高密度脂蛋白3和N-乙酰咪唑-高密度脂蛋白3介导巨噬细胞内胆固醇流出的时间-效应曲线(24 h组n=4,其它时间组n=3).
, http://www.100md.com
Figure 1. Time-course of cholesterol efflux from macrophages in the presence of HDL3 and N-acetylimidazole treated HDL3 ( n=4 at 24 h, n=3 at other time).
同样,图2(Figure 2)结果显示,随着剂量的增加,HDL3介导细胞内胆固醇流出量逐渐增加,细胞内胆固醇含量逐渐减少,而N-乙酰咪唑-HDL3组无明显变化。
2.3 细胞结合、内吞和释放载脂蛋白实验
表2(Table 2)结果显示,细胞内吞的荧光强度占结合荧光强度的65.0%,细胞释放的荧光强度占内吞荧光强度的78.4%,且两者的荧光强度分别以94.4%和94.2%的比例存在于三氯醋酸沉淀部分。

, http://www.100md.com
图2. 高密度脂蛋白3和N-乙酰咪唑-高密度脂蛋白3介导巨噬细胞内胆固醇流出的剂量-效应曲线 (100 μg组n=4,其它剂量组n=3).
Figure 2. Cholesterol efflux from macrophages in the presence of HDL3 and N-acetylimidazole-HDL3 (n=4 at 100 μg, n=3 at other dose).
表2. 细胞结合、内吞和释放荧光强度.
Table 2. Cell-associated,cell-endocytic and cell-released fluorescence strength (FS) after incubation of macrophages with FITC-HDL3(
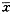 ±s,n=2). Groups
±s,n=2). Groups, 百拇医药
FS
Precepitable FS
Souluble FS
Associated(Ⅰ)
14.8±0.2
-
-
Endocytic(Ⅱ)
-
9.1±0.8
0.5±0.1
Released(Ⅲ)
, http://www.100md.com
-
7.1±0.3
0.4±0.1
Ⅱ/Ⅰ(%)
65.0
-
-
Ⅲ/Ⅱ(%)
78.4
-
-
3 讨 论
大量研究表明高密度脂蛋白能促进肝外细胞内胆固醇流出,从而具有抗动脉粥样硬化作用。我们的结果有力证明了这一点(表1),高密度脂蛋白3将巨噬细胞内40.68% 胆固醇介导流出,与牛血清白蛋白组(对照组)有显著性差异(P<0.05)。载脂蛋白A-I是高密度脂蛋白的主要载脂蛋白,它的缺失或者减少会引起血浆高密度脂蛋白减少和冠心病发病率的增加。载脂蛋白A-I能识别高密度脂蛋白受体,修饰它使其不能与细胞结合,对研究受体在细胞内胆固醇外流中的功能非常有用。N-乙酰咪唑特异修饰高密度脂蛋白中的酪氨酸,几乎能完全阻断细胞与高密度脂蛋白的结合,细胞内胆固醇的流出率也显著降低(P<0.05),说明高密度脂蛋白3促进细胞内胆固醇的流出是由受体介导的。从时间-效应曲线(图1)和剂量-效应曲线(图2)上可以看出,高密度脂蛋白3介导细胞内胆固醇流出的能力随时间的延长和剂量的增加而增强,而N-乙酰咪唑-高密度脂蛋白3组无明显变化,这更进一步说明了高密度脂蛋白3介导巨噬细胞内胆固醇的流出是由受体介导的。
, 百拇医药
用异硫氰酸荧光素酶标记观察载脂蛋白的摄取和代谢的实验中,细胞内吞的荧光强度占结合量的65.0%,三氯醋酸检测出存在于三氯醋酸沉淀部分的荧光强度占94.4%,即内吞以后异硫氰酸荧光素酶仍与载脂蛋白相结合,说明载脂蛋白在巨噬细胞内未经溶酶体降解。这与我们实验室以前在大鼠肝窦状隙细胞中得到的结果一致[1]。释放到介质中的荧光强度占内吞量的78.4%,并且以94.2%的比例存在于三氯醋酸沉淀部分(表2)。说明巨噬细胞与高密度脂蛋白3作用过程中,细胞摄取了高密度脂蛋白3,并且未被溶酶体降解,而是以逆向胞饮的途径释放出来。
从本实验结果我们可以提出高密度脂蛋白3介导巨噬细胞内胆固醇外流的假说,即高密度脂蛋白3通过载脂蛋白A-I与细胞受体作用被细胞内吞,不经溶酶体途径降解,而是摄取胞浆中胆固醇,以逆向胞饮方式释放到细胞外。
[基金项目] 国家自然科学基金资助课题(项目编号39570158)
, 百拇医药
[作者简介] 陈佩芳,女,46岁,主管技师,参与国家自然科学基金资助课题5次,发表论文20余篇,两次赴香港中文大学生物化学系进修。
参考文献
[1] 魏 强, 吴满平, 陈佩芳, 等. HDL受体和肝性脂酶在肝选择性摄取HDL2-CE中的协同作用 [J]. 生物化学与生物物理学报, 1996, 28: 659-662
[2] Rothblat GH, Mahlberg FH, Johnson WJ, et al. Apolipoproteins, membrane cholesterol domains, and the regulation of cholesterol efflux [J]. J Lipid Res, 1992, 33: 1 091-098
[3] Shotte JF, Oram JF, Bierman EL. Binding of HDL to cell receptors promotes translocation of cholesterol from intercellular membranes to the cell surface [J]. J Bio Chem, 1987, 262: 12 001-012
, http://www.100md.com
[4] Mahlberg FH, Glick JM, Kafz SL, et al. Influence of apolipoprotein A-I, A-II, and Cs on the metabolism of membrane and lyosomal cholesterol in macrophages [J]. J Biol Chem, 1991, 266: 19 931-935
[5] Oram JF, Mendez JA, Slotte JP, et al. HDL apolipoproteins mediated removal of sterol from intracellular pools but not from plasma membranes of cholesterol-loaded fibroblasts [J]. Arterioscler Thromb, 1991, 11: 403-413
[6] 吴满平, 陈佩芳, 卜书红, 等. 乙酰咪唑修饰对高密度脂蛋白结合人肝癌SMMC-7721细胞的影响 [J]. 上海医科大学学报, 1994, 21: 321-323
[7] 吴满平, 陈佩芳, 陈其善, 等. 大鼠肝外非实质细胞的高密度脂蛋白非溶酶体途径内吞 [J]. 生物化学与生物物理学报, 1993, 25: 543-544
1999-12-03 收到
2000-03-15 修回, 百拇医药