端粒酶反义DNA影响肺癌细胞体外生长的初步研究
作者:岳文涛 赖百塘 汪蕙 湛秀萍
单位:岳文涛 赖百塘(101149 北京市结核病胸部肿瘤研究所);汪蕙(101149 北京市结核病胸部肿瘤研究所);湛秀萍(101149 北京市结核病胸部肿瘤研究所)
关键词:端粒酶;反义核苷酸;肺肿瘤
中国肺癌杂志000202 【摘要】 目的 研究端粒酶反义核苷酸对肺癌细胞体外生长的影响,探讨针对端粒酶进行肺癌基因治疗的可行性。方法 人工合成硫化修饰六核苷酸端粒酶DNA序列[5′-d(TTAGGG)-3′],在体外与端粒酶阳性肺癌细胞系801-D共同培养,观察其对肺癌细胞端粒酶活性、细胞形态和生长特性的影响。结果 端粒酶反义DNA对端粒酶阳性肺癌细胞系801-D的生长和集落形成有明显的抑制作用,细胞形态发生明显改变。端粒酶反义DNA的抑制作用与其浓度呈正比。结论 端粒酶反义DNA序列对肺癌细胞系801-D体外生长有明显的抑制作用。
, 百拇医药
Inhibition of lung cancer cell line growth in vitro by telomerase anti-sense oligonucleotides
YUE Wentao, LAI Baitang, WANG Hui, ZHAN Xiuping. Beijing Tuberculosis and Thoracic Tumor Research Institute, Beijing 101149, P.R.China
【Abstract】 Objective To research the inhibition of lung cancer cell line by telomerase anti-sense DNA, and explore the possibility of its clinical application. Methods A phosphorothioate oligonucleotide (PS-ODN) with sequence identical to the repeat sequence of the mammaliam telomere [5′-d(TTAGGG)-3′] and a control scrambled sequence 5′-d(TGTGAG)-3′ were incubated with a lung cancer cell line 801-D, and the effects of PS-ODN on cell line growth, colony-forming and growth shape were detected. Results Telomerase anti-sense DNA inhibited telomerase activation cell line 801-D growth and colony-forming. The activity of the 6-mer telomere mimic demonstrated a dose dependency. No activity was observed with the scrambled controls. Conclusion These results demonstrated the inhibitive effects of a short hexameric oligonucleotide telomere mimic on lung cancer cell line growth in vitro and the potential utility of telomerase anti-sense DNA as cancer cell inhibitors.
, 百拇医药
【Key words】 Telomerase Anti-sense oligonucleotides Lung neoplasms
端粒是位于真核细胞染色体末端的一种保护性结构,起着保护和稳定染色体的作用。随着细胞分裂,其长度会逐渐缩短,最终过度缩短的端粒成为细胞停止分裂增殖的信号,导致细胞衰老死亡。因此人们形象地称它为细胞的“分裂钟”[1]。人们发现在肿瘤细胞中广泛存在着一种不依赖模板的DNA聚合酶——端粒酶,能在端粒末端加入重复序列,从而维持端粒长度的稳定。目前认为端粒酶激活是肿瘤细胞无限增殖所必需的。国内外学者已经提出了多种以限制端粒酶扩充为靶位点的肿瘤治疗的新思路,特别是特异和非特异反义核苷酸封闭hTR(human telomerase RNA)。研究发现反义RNA、DNA都对细胞提取液中的端粒酶活性有抑制作用[2,3]。人类端粒酶RNA模板区序列为3′-GG-GAAGAGCCAAUCCCAAUCUGUUUU[3]。我们合成了一段与端粒酶模板关键区互补,经硫化修饰的DNA片段(phosphorothioate oligonucleotide,PS-ODN),序列为5′-d(TTAGGG)-3′。同时合成5′-d(TGTGAG)-3′的DNA片断作对照(CPS-ODN),其碱基组成与PS-ODN完全相同,但排列顺序不同。本研究旨在观察端粒酶反义DNA在体外条件下对肺癌细胞系的生长抑制作用。
, http://www.100md.com
1 材料与方法
1.1 寡核苷酸合成 PS-ODN:5′-d(TTAGGG)-3′,CPS-ODN:5′-d(TGTGAG)-3′,于上海生工生物公司合成,全硫化修饰。冻干粉溶解于PBS(phosphate-buffer saline)。经过滤除菌后置于1.5ml微量离心管,4℃冰箱保存备用。
1.2 端粒酶检测 端粒酶检测采用端粒重复序列扩增(telomeric repeat amplification protocal,TRAP)技术略加改进。
1.3 细胞系 肺癌大细胞系801-D来自中国人民解放军301医院,经TRAP检测端粒酶为阳性。培养基RPMI-1640加10%血清和200U/ml链霉素。
1.4 PS-ODN体外抑制端粒酶活性 在801-D细胞端粒酶提取液中加入PS-ODN,浓度分别为1μmol/L、5μmol/L和10μmol/L,应用TRAP检测端粒酶活性。观察PS-ODN在体外条件下对端粒酶活性的抑制作用。
, http://www.100md.com
1.5 PS-ODN剂量的选择 为确定合适的PS-ODN作用剂量,我们进行了预试验。将对数生长期801-D细胞消化计数,稀释到100个/ml。接种到24孔板,每孔1ml。加入PS-ODN,浓度由0至20μmol/L分成六组,37℃温箱培养10d。Giemsa染色,计数50个细胞以上的集落。根据细胞集落形成的抑制情况选择PS-ODN的最佳作用剂量。结果显示PS-ODN在低浓度即对801-D集落形成有抑制作用,随着剂量的增加其抑制作用逐渐增强(表1)。在5μmol/L较低浓度下,PS-ODN对801-D集落形成抑制率达到77.9%。由此我们选择5μmol/L作为PS-ODN作用的最佳剂量。
表1 各种浓度的PS-ODN对肺癌细胞集落形成的抑制作用
Tab 1 Inhibition of PS-ODN on colony formation
of lung cancer cell lines Concentration of
, 百拇医药
PS-ODN(μmol/L)
1.25
2.5
5
10
20
0
No. of colony
37
25
14
15
4
, http://www.100md.com
55
36
32
13
11
6
67
Average
36.5
28.5
13.5
13
5
, http://www.100md.com 61
Inhibition rate
40.2%
53.3%
77.9%
78.7%
91.8%
/
1.6 PS-ODN对801-D集落形成的抑制作用 801-D细胞消化计数,制备细胞悬液,检查活细胞率和单个细胞率。按400个细胞/皿接种9只平皿,分成三组,分别为PS-ODN 5μmol/L,CPS-ODN 5μmol/L和空白对照组,于37℃ 5% CO2培养箱内培养10d。Giemsa染色后计数集落(细胞数>50个),并从第5天起相差显微镜下观察各组细胞形态有无差异。
, http://www.100md.com
1.7 PS-ODN对801-D群体生长的影响 24孔板每孔接种10000个801-D细胞,分三组,分别用PBS、PS-ODN 5μmol/L、CPS-ODN 5μmol/L处理,隔日取3孔细胞行胎盘蓝染色,计数活细胞,并绘制生长曲线。
1.8 统计学处理 采用χ2检验。
2 结果
2.1 PS-ODN在体外对端粒酶活性的影响 TRAP方法显示,PS-ODN在5μmol/L、10μmol/L浓度下对801-D细胞端粒酶提取液中的端粒酶活性有明显的抑制作用,而碱基组成相同、序列不同的CPS-ODN则没有抑制作用。
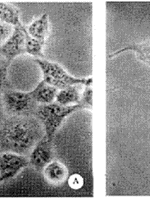
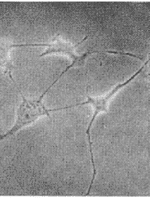
2.2 PS-ODN对801-D集落形成及细胞形态的影响 结果显示经5μmol/L PS-ODN处理,801-D集落形成率明显低于5μmol/L CPS-ODN组和空白对照组(P<0.01)。5μmol/L CPS-ODN组集落形成率与空白对照组比较无显著差异(P>0.05)。PS-ODN对801-D集落形成有很强的抑制作用,抑制率达89%(表2)。镜下观察显示,实验组细胞有明显的形态学改变,主要表现为每集落细胞数少,呈纤维细胞样改变,细胞扁平,表面较多纤维状突起。内部结构不清,胞浆少(图1)。

, 百拇医药
图1 PS-ODN对801-D细胞形态的影响
A:CPS-ODN(5μmol/L);B:PS-ODN(5μmol/L)
Fig 1 Influence of PS-ODN on morphology of 801-D cell lines
A:CPS-ODN(5μmol/L);B:PS-ODN(5μmol/L)
表2 PS-ODN和CPS-ODN对肺癌细胞集落形成的抑制作用
Tab 2 Comparison of inhibition between PS-ODN and CPS-ODN
on colony formation of lung cancer cell lines Items
, http://www.100md.com
PS-ODN
(5μmol/L)
CPS-ODN
(5μmol/L)
Control
No. of colony
group 1
22
117
193
group 2
28
, http://www.100md.com
209
207
group 3
17
208
201
Average
22
178
200
Colony formation rate
5.5%
44.5%
, http://www.100md.com
50%
2.3 PS-ODN对801-D群体生长的影响 图2显示PS-ODN对801-D群体生长也有明显的抑制作用,这种抑制作用出现得较为缓和。5μmol/LPS-ODN与801-D细胞共同培养,经7d后PS-ODN对801-D的生长开始起抑制作用,第9~11天达到最强抑制,抑制率达到61.7%,而CPS-ODN对801-D细胞生长没有明显影响。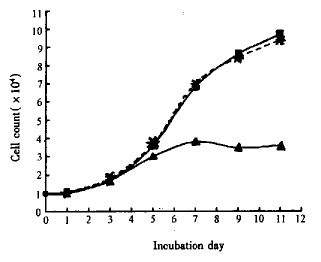
图2 PS-ODN抑制801-D细胞生长
▲:PS-ODN(5μmol/L);■:CPS-ODN(5μmol/L);:PBS。共同培养5~7d后PS-ODN 5μmol/L处理的细胞生长开始受到抑制。
第9~11天达到最强抑制。CPS-ODN对801-D细胞生长无明显影响。
, 百拇医药
Fig 2 Inhibition of PS-ODN on 801-D cell lines growth
▲:PS-ODN(5μmol/L);■:CPS-ODN(5μmol/L);:PBS. Inhibition of PS-ODN was observed after incubating for 5 to 7 days and came to the strongest extent on the 9th to 11th day. CPS-ODN had no influence on the growth of 801-D cells.
3 讨论
端粒酶是一种核糖核蛋白体,主要由蛋白质和RNA组分组成,其蛋白质组分具有逆转录酶活性,能以RNA组分为模板,从头合成端粒酶,从而在细胞分裂过程中保持端粒长度的稳定,使细胞分裂不受端粒长度的控制。多数研究者认为端粒酶激活可能是肿瘤无限生长所必需的。目前已经在大多数人类恶性肿瘤中检测到端粒酶活性,而良性肿瘤和正常组织端粒酶一般为阴性[5,6]。因此以抑制端粒酶扩充为肿瘤治疗的靶位点具有广阔的临床应用前景。
, http://www.100md.com
本研究结果显示:PS-ODN在低浓度下(5μmol/L)与801-D共同培养,对肺癌细胞系的集落形成和群体生长都有明显的抑制作用,相差显微摄影显示经PS-ODN共同培养10d后,801-D细胞形态发生明显改变,呈衰老表现。而相应浓度的CPS-ODN则对801-D集落形成无明显影响。说明硫化基团和寡核苷酸对细胞生长并无影响,是特定的核苷酸序列在起作用。
此外,本研究还观察到PS-ODN的抑制作用有一定的潜伏期。生长曲线显示PS-ODN对801-D的生长抑制作用在共同培养7d后开始出现,在第9~11天达到最大抑制。Feng等[7]的研究显示用反义RNA抑制hTR后,Hela细胞仍会继续分裂23~26次后才开始死亡,与本研究结果相似。我们设想这种抑制作用潜伏期的出现与端粒酶抑制剂的作用机理有关。端粒酶抑制剂是通过抑制端粒酶活性起作用,导致细胞分裂过程中端粒缩短得不到补偿,最终使细胞衰老、死亡[8]。虽然肿瘤细胞端粒通常较正常组织细胞缩短,但仍有一定长度,所以端粒酶被抑制后,肿瘤细胞仍会继续分裂,直到端粒被缩短到极限,才停止分裂,衰老死亡。所以对于不同肿瘤(甚至同一肿瘤的不同个体),由于端粒长度不同,对端粒酶抑制剂反应的时间亦不相同。同时,这个结果有利于端粒酶抑制剂应用于肿瘤临床治疗。由于人体内造血细胞等正常细胞亦呈现端粒酶活性,所以应用端粒酶抑制剂可能会出现严重的副作用[5,6]。但肿瘤细胞端粒长度较正常细胞短,而且分裂增殖旺盛,端粒消耗得更快,如果同时给予端粒酶反义DNA,肿瘤细胞会先于正常细胞衰老死亡。这样,如果选择好给药间隔,我们就能在杀伤肿瘤细胞的同时,保护体内端粒酶呈阳性的正常组织免受损害。但是,Msta等[9]报告端粒酶反义DNA与Burkitt's淋巴瘤来源的细胞系OMA-BLI共同培养24h后即对其生长有明显的抑制作用,与本研究结果不同。这可能是由于不同细胞系的特性所致。
, 百拇医药
目前,以限制端粒酶扩充为肿瘤治疗靶点的研究刚刚起步,并取得了一定的进展,如果端粒酶抑制剂确实能够在体内条件下抑制肿瘤细胞的生长,那么对于肿瘤的治疗将有重要意义。因此,有必要对各种端粒酶抑制剂在体内外对肿瘤细胞和正常细胞的影响进行进一步的研究。相信随着人们对端粒、端粒酶的作用和调控机制的进一步认识,随着人们对端粒酶抑制剂体内外研究资料的积累,端粒酶最终可能成为恶性肿瘤治疗的新靶点。
参 考 文 献
1,Olovnikov AM. A theory of marginotomy: The incomplete copying of template margin in enzymic synthesis of polynucleotides and biological significance of the phenomenon. J Theor Biol,1973,41(2)∶181-190.
, 百拇医药
2,Norton JC, Piatyszek MA, Wright WE. Inhibition of human telomerase activity by peptide nucleic acids. Nature Biol,1996,14(5)∶615-619.
3,Zahler AM, Williamson JR, Cech T, et al. Inhibition of telomerase by G-quartet DNA structures. Nature Biol,1991,350(25)∶718-720.
4,Kim NW, Piatyszek MA, Ptowse KR. Specific association of human telomerase activity with immortal cells and cancer. Science,1994,266(23)∶2011-2014.
, http://www.100md.com
5,Shay JW. Telomerase in the early detection. Cancer J Clin Pathol,1997,50(2)∶106-109.
6,Shay JW, Bacchetfis S. A survey of telomerase activity in human. Cancer Eur J Cancer,1997,33(5)∶787-791.
7,Mata JE, Joshi SS, Balen B, et al. A hexameric phosphorothioate oligonucleotide telomerase inhibitor. Toxicol Appl Pharmacol,1997,144(1)∶189-197.
8,Dahse R, Fiedler W, Erust G, et al. Telomeres and telomerase: biological and clinical importance. Clin Chem,1997,43(5)∶708-714.
9,Freng J, Funk WD, Wang SS, et al. The RNA component of human telomerase. Science,1996,269(1)∶1236-1241.
(收稿:1999-12-13 修回:2000-04-07), 百拇医药
单位:岳文涛 赖百塘(101149 北京市结核病胸部肿瘤研究所);汪蕙(101149 北京市结核病胸部肿瘤研究所);湛秀萍(101149 北京市结核病胸部肿瘤研究所)
关键词:端粒酶;反义核苷酸;肺肿瘤
中国肺癌杂志000202 【摘要】 目的 研究端粒酶反义核苷酸对肺癌细胞体外生长的影响,探讨针对端粒酶进行肺癌基因治疗的可行性。方法 人工合成硫化修饰六核苷酸端粒酶DNA序列[5′-d(TTAGGG)-3′],在体外与端粒酶阳性肺癌细胞系801-D共同培养,观察其对肺癌细胞端粒酶活性、细胞形态和生长特性的影响。结果 端粒酶反义DNA对端粒酶阳性肺癌细胞系801-D的生长和集落形成有明显的抑制作用,细胞形态发生明显改变。端粒酶反义DNA的抑制作用与其浓度呈正比。结论 端粒酶反义DNA序列对肺癌细胞系801-D体外生长有明显的抑制作用。
, 百拇医药
Inhibition of lung cancer cell line growth in vitro by telomerase anti-sense oligonucleotides
YUE Wentao, LAI Baitang, WANG Hui, ZHAN Xiuping. Beijing Tuberculosis and Thoracic Tumor Research Institute, Beijing 101149, P.R.China
【Abstract】 Objective To research the inhibition of lung cancer cell line by telomerase anti-sense DNA, and explore the possibility of its clinical application. Methods A phosphorothioate oligonucleotide (PS-ODN) with sequence identical to the repeat sequence of the mammaliam telomere [5′-d(TTAGGG)-3′] and a control scrambled sequence 5′-d(TGTGAG)-3′ were incubated with a lung cancer cell line 801-D, and the effects of PS-ODN on cell line growth, colony-forming and growth shape were detected. Results Telomerase anti-sense DNA inhibited telomerase activation cell line 801-D growth and colony-forming. The activity of the 6-mer telomere mimic demonstrated a dose dependency. No activity was observed with the scrambled controls. Conclusion These results demonstrated the inhibitive effects of a short hexameric oligonucleotide telomere mimic on lung cancer cell line growth in vitro and the potential utility of telomerase anti-sense DNA as cancer cell inhibitors.
, 百拇医药
【Key words】 Telomerase Anti-sense oligonucleotides Lung neoplasms
端粒是位于真核细胞染色体末端的一种保护性结构,起着保护和稳定染色体的作用。随着细胞分裂,其长度会逐渐缩短,最终过度缩短的端粒成为细胞停止分裂增殖的信号,导致细胞衰老死亡。因此人们形象地称它为细胞的“分裂钟”[1]。人们发现在肿瘤细胞中广泛存在着一种不依赖模板的DNA聚合酶——端粒酶,能在端粒末端加入重复序列,从而维持端粒长度的稳定。目前认为端粒酶激活是肿瘤细胞无限增殖所必需的。国内外学者已经提出了多种以限制端粒酶扩充为靶位点的肿瘤治疗的新思路,特别是特异和非特异反义核苷酸封闭hTR(human telomerase RNA)。研究发现反义RNA、DNA都对细胞提取液中的端粒酶活性有抑制作用[2,3]。人类端粒酶RNA模板区序列为3′-GG-GAAGAGCCAAUCCCAAUCUGUUUU[3]。我们合成了一段与端粒酶模板关键区互补,经硫化修饰的DNA片段(phosphorothioate oligonucleotide,PS-ODN),序列为5′-d(TTAGGG)-3′。同时合成5′-d(TGTGAG)-3′的DNA片断作对照(CPS-ODN),其碱基组成与PS-ODN完全相同,但排列顺序不同。本研究旨在观察端粒酶反义DNA在体外条件下对肺癌细胞系的生长抑制作用。
, http://www.100md.com
1 材料与方法
1.1 寡核苷酸合成 PS-ODN:5′-d(TTAGGG)-3′,CPS-ODN:5′-d(TGTGAG)-3′,于上海生工生物公司合成,全硫化修饰。冻干粉溶解于PBS(phosphate-buffer saline)。经过滤除菌后置于1.5ml微量离心管,4℃冰箱保存备用。
1.2 端粒酶检测 端粒酶检测采用端粒重复序列扩增(telomeric repeat amplification protocal,TRAP)技术略加改进。
1.3 细胞系 肺癌大细胞系801-D来自中国人民解放军301医院,经TRAP检测端粒酶为阳性。培养基RPMI-1640加10%血清和200U/ml链霉素。
1.4 PS-ODN体外抑制端粒酶活性 在801-D细胞端粒酶提取液中加入PS-ODN,浓度分别为1μmol/L、5μmol/L和10μmol/L,应用TRAP检测端粒酶活性。观察PS-ODN在体外条件下对端粒酶活性的抑制作用。
, http://www.100md.com
1.5 PS-ODN剂量的选择 为确定合适的PS-ODN作用剂量,我们进行了预试验。将对数生长期801-D细胞消化计数,稀释到100个/ml。接种到24孔板,每孔1ml。加入PS-ODN,浓度由0至20μmol/L分成六组,37℃温箱培养10d。Giemsa染色,计数50个细胞以上的集落。根据细胞集落形成的抑制情况选择PS-ODN的最佳作用剂量。结果显示PS-ODN在低浓度即对801-D集落形成有抑制作用,随着剂量的增加其抑制作用逐渐增强(表1)。在5μmol/L较低浓度下,PS-ODN对801-D集落形成抑制率达到77.9%。由此我们选择5μmol/L作为PS-ODN作用的最佳剂量。
表1 各种浓度的PS-ODN对肺癌细胞集落形成的抑制作用
Tab 1 Inhibition of PS-ODN on colony formation
of lung cancer cell lines Concentration of
, 百拇医药
PS-ODN(μmol/L)
1.25
2.5
5
10
20
0
No. of colony
37
25
14
15
4
, http://www.100md.com
55
36
32
13
11
6
67
Average
36.5
28.5
13.5
13
5
, http://www.100md.com 61
Inhibition rate
40.2%
53.3%
77.9%
78.7%
91.8%
/
1.6 PS-ODN对801-D集落形成的抑制作用 801-D细胞消化计数,制备细胞悬液,检查活细胞率和单个细胞率。按400个细胞/皿接种9只平皿,分成三组,分别为PS-ODN 5μmol/L,CPS-ODN 5μmol/L和空白对照组,于37℃ 5% CO2培养箱内培养10d。Giemsa染色后计数集落(细胞数>50个),并从第5天起相差显微镜下观察各组细胞形态有无差异。
, http://www.100md.com
1.7 PS-ODN对801-D群体生长的影响 24孔板每孔接种10000个801-D细胞,分三组,分别用PBS、PS-ODN 5μmol/L、CPS-ODN 5μmol/L处理,隔日取3孔细胞行胎盘蓝染色,计数活细胞,并绘制生长曲线。
1.8 统计学处理 采用χ2检验。
2 结果
2.1 PS-ODN在体外对端粒酶活性的影响 TRAP方法显示,PS-ODN在5μmol/L、10μmol/L浓度下对801-D细胞端粒酶提取液中的端粒酶活性有明显的抑制作用,而碱基组成相同、序列不同的CPS-ODN则没有抑制作用。
2.2 PS-ODN对801-D集落形成及细胞形态的影响 结果显示经5μmol/L PS-ODN处理,801-D集落形成率明显低于5μmol/L CPS-ODN组和空白对照组(P<0.01)。5μmol/L CPS-ODN组集落形成率与空白对照组比较无显著差异(P>0.05)。PS-ODN对801-D集落形成有很强的抑制作用,抑制率达89%(表2)。镜下观察显示,实验组细胞有明显的形态学改变,主要表现为每集落细胞数少,呈纤维细胞样改变,细胞扁平,表面较多纤维状突起。内部结构不清,胞浆少(图1)。




, 百拇医药
图1 PS-ODN对801-D细胞形态的影响
A:CPS-ODN(5μmol/L);B:PS-ODN(5μmol/L)
Fig 1 Influence of PS-ODN on morphology of 801-D cell lines
A:CPS-ODN(5μmol/L);B:PS-ODN(5μmol/L)
表2 PS-ODN和CPS-ODN对肺癌细胞集落形成的抑制作用
Tab 2 Comparison of inhibition between PS-ODN and CPS-ODN
on colony formation of lung cancer cell lines Items
, http://www.100md.com
PS-ODN
(5μmol/L)
CPS-ODN
(5μmol/L)
Control
No. of colony
group 1
22
117
193
group 2
28
, http://www.100md.com
209
207
group 3
17
208
201
Average
22
178
200
Colony formation rate
5.5%
44.5%
, http://www.100md.com
50%
2.3 PS-ODN对801-D群体生长的影响 图2显示PS-ODN对801-D群体生长也有明显的抑制作用,这种抑制作用出现得较为缓和。5μmol/LPS-ODN与801-D细胞共同培养,经7d后PS-ODN对801-D的生长开始起抑制作用,第9~11天达到最强抑制,抑制率达到61.7%,而CPS-ODN对801-D细胞生长没有明显影响。

图2 PS-ODN抑制801-D细胞生长
▲:PS-ODN(5μmol/L);■:CPS-ODN(5μmol/L);:PBS。共同培养5~7d后PS-ODN 5μmol/L处理的细胞生长开始受到抑制。
第9~11天达到最强抑制。CPS-ODN对801-D细胞生长无明显影响。
, 百拇医药
Fig 2 Inhibition of PS-ODN on 801-D cell lines growth
▲:PS-ODN(5μmol/L);■:CPS-ODN(5μmol/L);:PBS. Inhibition of PS-ODN was observed after incubating for 5 to 7 days and came to the strongest extent on the 9th to 11th day. CPS-ODN had no influence on the growth of 801-D cells.
3 讨论
端粒酶是一种核糖核蛋白体,主要由蛋白质和RNA组分组成,其蛋白质组分具有逆转录酶活性,能以RNA组分为模板,从头合成端粒酶,从而在细胞分裂过程中保持端粒长度的稳定,使细胞分裂不受端粒长度的控制。多数研究者认为端粒酶激活可能是肿瘤无限生长所必需的。目前已经在大多数人类恶性肿瘤中检测到端粒酶活性,而良性肿瘤和正常组织端粒酶一般为阴性[5,6]。因此以抑制端粒酶扩充为肿瘤治疗的靶位点具有广阔的临床应用前景。
, http://www.100md.com
本研究结果显示:PS-ODN在低浓度下(5μmol/L)与801-D共同培养,对肺癌细胞系的集落形成和群体生长都有明显的抑制作用,相差显微摄影显示经PS-ODN共同培养10d后,801-D细胞形态发生明显改变,呈衰老表现。而相应浓度的CPS-ODN则对801-D集落形成无明显影响。说明硫化基团和寡核苷酸对细胞生长并无影响,是特定的核苷酸序列在起作用。
此外,本研究还观察到PS-ODN的抑制作用有一定的潜伏期。生长曲线显示PS-ODN对801-D的生长抑制作用在共同培养7d后开始出现,在第9~11天达到最大抑制。Feng等[7]的研究显示用反义RNA抑制hTR后,Hela细胞仍会继续分裂23~26次后才开始死亡,与本研究结果相似。我们设想这种抑制作用潜伏期的出现与端粒酶抑制剂的作用机理有关。端粒酶抑制剂是通过抑制端粒酶活性起作用,导致细胞分裂过程中端粒缩短得不到补偿,最终使细胞衰老、死亡[8]。虽然肿瘤细胞端粒通常较正常组织细胞缩短,但仍有一定长度,所以端粒酶被抑制后,肿瘤细胞仍会继续分裂,直到端粒被缩短到极限,才停止分裂,衰老死亡。所以对于不同肿瘤(甚至同一肿瘤的不同个体),由于端粒长度不同,对端粒酶抑制剂反应的时间亦不相同。同时,这个结果有利于端粒酶抑制剂应用于肿瘤临床治疗。由于人体内造血细胞等正常细胞亦呈现端粒酶活性,所以应用端粒酶抑制剂可能会出现严重的副作用[5,6]。但肿瘤细胞端粒长度较正常细胞短,而且分裂增殖旺盛,端粒消耗得更快,如果同时给予端粒酶反义DNA,肿瘤细胞会先于正常细胞衰老死亡。这样,如果选择好给药间隔,我们就能在杀伤肿瘤细胞的同时,保护体内端粒酶呈阳性的正常组织免受损害。但是,Msta等[9]报告端粒酶反义DNA与Burkitt's淋巴瘤来源的细胞系OMA-BLI共同培养24h后即对其生长有明显的抑制作用,与本研究结果不同。这可能是由于不同细胞系的特性所致。
, 百拇医药
目前,以限制端粒酶扩充为肿瘤治疗靶点的研究刚刚起步,并取得了一定的进展,如果端粒酶抑制剂确实能够在体内条件下抑制肿瘤细胞的生长,那么对于肿瘤的治疗将有重要意义。因此,有必要对各种端粒酶抑制剂在体内外对肿瘤细胞和正常细胞的影响进行进一步的研究。相信随着人们对端粒、端粒酶的作用和调控机制的进一步认识,随着人们对端粒酶抑制剂体内外研究资料的积累,端粒酶最终可能成为恶性肿瘤治疗的新靶点。
参 考 文 献
1,Olovnikov AM. A theory of marginotomy: The incomplete copying of template margin in enzymic synthesis of polynucleotides and biological significance of the phenomenon. J Theor Biol,1973,41(2)∶181-190.
, 百拇医药
2,Norton JC, Piatyszek MA, Wright WE. Inhibition of human telomerase activity by peptide nucleic acids. Nature Biol,1996,14(5)∶615-619.
3,Zahler AM, Williamson JR, Cech T, et al. Inhibition of telomerase by G-quartet DNA structures. Nature Biol,1991,350(25)∶718-720.
4,Kim NW, Piatyszek MA, Ptowse KR. Specific association of human telomerase activity with immortal cells and cancer. Science,1994,266(23)∶2011-2014.
, http://www.100md.com
5,Shay JW. Telomerase in the early detection. Cancer J Clin Pathol,1997,50(2)∶106-109.
6,Shay JW, Bacchetfis S. A survey of telomerase activity in human. Cancer Eur J Cancer,1997,33(5)∶787-791.
7,Mata JE, Joshi SS, Balen B, et al. A hexameric phosphorothioate oligonucleotide telomerase inhibitor. Toxicol Appl Pharmacol,1997,144(1)∶189-197.
8,Dahse R, Fiedler W, Erust G, et al. Telomeres and telomerase: biological and clinical importance. Clin Chem,1997,43(5)∶708-714.
9,Freng J, Funk WD, Wang SS, et al. The RNA component of human telomerase. Science,1996,269(1)∶1236-1241.
(收稿:1999-12-13 修回:2000-04-07), 百拇医药