糖尿病的胰腺组织超氧化物歧化酶基因表达研究
作者:赵明 杜宏 王扬天 王晓 王竹兰
单位:赵明(南京军区南京总医院内分泌科 210002); 杜宏(南京军区南京总医院内分泌科 210002); 王扬天(南京军区南京总医院内分泌科 210002); 王晓(南京军区南京总医院内分泌科 210002); 王竹兰(南京军区南京总医院内分泌科 210002)
关键词:糖尿病;超氧化物歧化酶
糖尿病的胰腺组织超氧化物歧化酶基因表达研究 摘 要:目的 探讨链脲菌素诱发的糖尿病模型大鼠胰腺组织中自由基清除剂超氧化物歧化酶(SOD)信使核糖核酸(mRNA)的表达,在分子水平上了解糖尿病时胰腺自由基代谢状态。方法 分别在0、4周、12周、24周取其血和胰腺β细胞分别测定血糖、血脂、SOD的mRNA表达研究(采用逆转录-聚合酶链反应检测胰腺组织SOD的mRNA表达)。结果 和正常对照相比,糖尿病大鼠血糖、血脂缓慢上升,胰腺β细胞的SOD的mRNA表达量明显低于正常对照。结论 表明链脲菌素诱发的非胰岛素依赖型糖尿病(NIDDM)模型大鼠的胰腺β细胞中存在SOD的mRNA表达水平低下,这也是糖尿病时胰腺组织中SOD水平下降的原因之一;而且随着高血糖持续时间延长,SOD的mRNA表达水平呈逐渐下降趋势。
, http://www.100md.com
Study of expression of SOD′s mRNA in pancreatic tissue
ZHAO Ming,DU Hong,WANG Yangtian,et al
(Department of Endocrinology,Nanjing General Hospital of PLA,Nanjing 210002)
Abstract:Objective To probe into the expression of scavenger SOD′s mRNA in pancreatic tissue of diabetic rats induced by streptozocin,so as to understand the metabolism of free radicals in NIDDM at molecular levels.Methods We quantitated the blood sugar,lipids and the gene expression of SOD in beta cells of pancreatic tissue at 0,4,12,24 week separately,which were completed by using the reverse transcription-polymerase chain reaction(RT-PCR).Results Compared with control group,the levels of blood sugar and lipids raised slowly,the levels of expression of SOD were low in beta cells of pancreatic tissue.Conclusion These results indicate that there might be a low expression of SOD gene in beta cells of pancreas induced by streptozocin,which is one of the reasons resulting in low SOD levels and become distinct when extending period of hyperglycemia.
, 百拇医药
Key words:Diabetes mellitus Superoxide dismutase(SOD)▲
糖尿病的发生、发展和自由基代谢有密切关系。近几年来在这方面有了许多新进展[1]。但糖尿病导致胰腺组织中自由基代谢异常的确切机理尚不清楚,本文旨在探讨链脲菌素诱发的糖尿病模型大鼠的胰腺组织中超氧化物歧化酶(SOD)信使核糖核酸(mRNA)的表达,了解在分子水平上糖尿病时自由基代谢状态,探索糖尿病的发病机理。
材料和方法
一、动物模型的制备及分组:SD大鼠体重150~250g,雄性,按随机原则把40只大鼠分成两组,每组20只。①糖尿病模型组:参照文献[2],用小剂量链脲菌素尾静脉(25mg/公斤体重)注射,再用高热量饲料饲养,形成类似非胰岛素依赖型糖尿病(NIDDM)的大鼠模型;②对照组:自由饮水,普通饲料。分别在第4周、第12周、第24周做糖耐量试验。
, 百拇医药
二、胰腺β细胞的RNA提取:参照上海第一人民医院糖尿病研究室提供的方法分离出β细胞,主要步骤为:大鼠胆总管逆行插管灌注8ml液体(Hank液、pH7.6、含胶原酶V0.5mg/ml、Hepes10mmol/L),取下胰腺放置50ml烧瓶加入Hank′s液6ml,38℃水浴中消化10分钟,振荡呈细沙样。10%小牛血清的Hank′s液在4℃水中终止消化。用20目过滤网过滤,其过滤液1000g×2分钟离心沉淀,沉淀物放入28%Ficoll液混匀,加入预先依次加好23%、20%、11%的Ficoll液中,800g×15分钟,吸出20%~11%界面,23%~20%界面的细胞团,用Hank′s液洗涤三遍。参照文献方法从β细胞提取RNA[3]。
三、RT-PCR:SOD引物[4]:5′ATTCGAAATGGTGG-3′、3′-CGGTTCCAGATTCG-5′。β-actin引物5′GTGGGCCGCTGTAGGCACCAA-3′、5′-CTCTTT-
, 百拇医药
GATGTCGCACGATTTC-3′。前者由上海生物工程公司合成,后者由南京军区南京总医院普外科李维勤博士惠赠。逆转录多聚酶链反应(RT-PCR)采用Boehringer Mannheim Biochemicals公司的Titan单管RT-PCR系统,PCR25次循环。
四、PCR产物及半定量:取SOD和β-actin的扩增产物各15μl,在2%琼脂糖凝胶电泳后拍照,进行吸光密度扫描,计算出SOD的mRNA表达量和其对应β-actin表达量的比值。
五、统计结果:数据用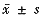 表示,采用t检验。
表示,采用t检验。
结果
1.本实验的大鼠模型的血糖水平上升缓慢,到了第4周空腹血糖仍处于正常范围,但此时测定糖耐量显示30分钟、60分钟、120分钟血糖水平异常。到了第24周大鼠的空腹血糖才明显高于正常,大鼠的血脂从第4周开始就异常升高。这些结果都和NIDDM相似(见表1)。
, http://www.100md.com
表1 血脂、葡萄糖耐量试验结果(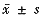 )
)
血 糖(mmol/L)
血 脂(mmol/L)
0
30分钟
60分钟
120分钟
甘油三酯
胆固醇
正常对照组
, http://www.100md.com
5.1±1.1
7.4±0.8
6.8±1.0
6.6±1.3
0.59±0.11
2.23±0.24
糖尿病组(4周)
5.0±1.6
10.4±3.7*
10.9±4.1*
9.5±2.6*
, 百拇医药
1.3±0.3*
3.2±1.1*
(12周)
5.3±0.9▲
13.3±3.4*
14.8±4.1*
15.6±4.9*
1.2±0.2*
3.6±1.4*
(24周)
, http://www.100md.com
5.8±1.0*
13.9±4.0*
15.2±4.2*
17.3±3.6*
1.8±0.4*
5.6±2.3*
注:和正常对照组相比,*P<0.01 ▲P<0.05
2.RT-PCR产物电泳后可见SOD的扩增带为741bp,β-actin的扩增带为540bp。在不同时间的SOD mRNA表达水平不同,随着高血糖时间延长,SOD的mRNA表达水平呈逐渐下降趋势。
, http://www.100md.com
讨论
糖尿病时,全身多个器官和组织包括胰腺组织中自由基代谢异常,表现为SOD、谷光苷肽还原酶(GPH-X)水平低下,丙二醇(MDA)、过氧化脂质(LPO)水平上升[5]。有研究表明致糖尿病的一些药物(链脲菌素、四氧嘧啶等)都能通过降低SOD水平作为损害β细胞诱发糖尿病的先决条件[6]。但SOD下降的原因和机制仍不清楚。目前认为SOD的下降和下列因素有关:①高血糖和其代谢产物都是氧化剂,它们都消耗自由基清除剂如SOD。②糖基化作用,糖尿病时高血糖能和全身多个组织发生非酶促糖基化,影响它们各自的功能,SOD本身糖基化也会降低SOD的生物活性。③自由基能通过氧化核酸、蛋白、细胞膜脂质直接引起细胞损伤。其机理是否存在SOD基因表达水平低下尚不得而知。众所周知,糖尿病的慢性并发症是糖尿病人致残和致盲的主要原因,尽管有证据表明高血糖和糖尿病继发的并发症之间有明显的联系。但高血糖通过何种机制导致组织损害尚不清楚。目前已有证据提示[7]反应性氧族(reactive oxygen species ROS)可能在糖尿病并发症的发生上起重要作用。许多与高血糖有关的生物化学途径如多元醇途径、糖自氧化、蛋白糖基化等均可增加反应性氧族的产生。更进一步的是血管内皮细胞暴露于高糖环境下可导致自由基产生增加,后者(如超氧阴离子)可抑制或灭活NO(NO是一种参与血管自身代谢的内皮细胞源性血管扩张剂)。而抗氧化剂可逆转这种作用。该作者认为糖尿病的慢性并发症(包括大血管、微血管病变)易感性取决于内源性抗氧化剂(如自由基清除剂SOD等)的状态。在不同的病人或组织易于发生并发症可能是抗氧化剂状态不同和醛糖还原酶基因表达不同所致,有人[8]发现红细胞醛糖还原酶在有并发症的胰岛素依赖性糖尿病(IDDM)病人较无并发症明显升高,仅仅发生糖尿病并发症的靶器官对损害敏感,伴有醛糖还原酶基因表达增加。因为胰腺β细胞在生理上清除自由基的酶活性较低,也有证据显示[9]高血糖可抑制天然抗氧化剂防卫系统:纯化的牛Cu/Zn-SOD(超氧化物歧化酶)和不同浓度的葡萄糖(10~100mmol/L)温育可使酶活性降至60%,这可导致对超氧自由基损害的保护减弱。有人[6]用表达Cu/ZnSOD的转基因到小鼠胰腺组织中,结果发现这些转基因的表达比对照组明显增强对四氧嘧啶诱发的糖尿病的抵抗作用,提示自由基代谢中基因变异能影响氧化介导的糖尿病易感性。由此提出糖尿病时胰腺β细胞SOD表达水平会怎样呢本文采用实验性NIDDM大鼠模型,和正常对照相比,血糖、血脂缓慢上升,到24周时已明显高于正常对照大鼠。此时取其胰腺β细胞做SOD的mRNA表达研究,结果发现糖尿病大鼠胰腺β细胞的SOD的mRNA表达量明显低于正常对照。综上所述,本研究进一步证实①链脲菌素诱发的NIDDM模型大鼠的胰腺β细胞中存在SOD的mRNA表达水平低下。②糖尿病时胰腺组织中SOD水平下降的原因之一是其组织中SOD的mRNA表达水平低下。③随着高血糖持续时间延长,SOD的mRNA表达水平呈逐渐下降趋势。■
, 百拇医药
参考文献:
[1]Halliwell B.Free radicals,antioxidants,and human disease:curiosity,cause,or consequence?Lancet,1994,344:721-724.
[2]刘永玉,毛良.实验性NIDDM大鼠模型.中华内分泌代谢杂志,1990,6:115-116.
[3]林万明.PCR技术操作和应用指南.北京:人民军医出版社,1995,354-356.
[4]H-michael K,Junqiang W,Tammy MB,et al.Targeted overexpression of Cu/Zn superoxide dismutase protects pancreatic B-cells against oxidative stress.Diabetes,1997,46:1563-1566.
, 百拇医药
[5]赵明,王亦根,张雯,等.超氧化物歧化酶对链脲菌素诱发的糖尿病自由基代谢的影响.中国糖尿病杂志,1995,3:44-46.
[6]Papaccio G,Frascatore S,Esposito V,et al.Early macrophage infiltration in mice treated with low-streptozocin decrease islet superoxide dismutase levels:prevention by silica pretreatment.Acta Anat Basel,1991,142:147-152.
[7]Mandrup-Poulson T,Helqvist S,Wogensen LD,et al.Cytokines and free radicals as effect molecules in the destruction of pancreatic beta cells.Curr Top Microbiol Immunol,1990,164:169-193.
, 百拇医药
[8]Lenzen S,Drinkger J,Tiedge M.Low antioxidant enzyme gene expression in pancreatic islets compared with various other mouse tissue.Free radic Biol Med,1996,20:463-466.
[9]Ceriello A,Dello RP,Amstad P,et al.High glucose induces antioxidant enzymes in human endothelial cells in culture:evidence linking hyperglycemia and oxidative stress.Diabetes,1996,45:471-477.
收稿日期:1999-08-05
修稿日期:1999-10-26, http://www.100md.com
单位:赵明(南京军区南京总医院内分泌科 210002); 杜宏(南京军区南京总医院内分泌科 210002); 王扬天(南京军区南京总医院内分泌科 210002); 王晓(南京军区南京总医院内分泌科 210002); 王竹兰(南京军区南京总医院内分泌科 210002)
关键词:糖尿病;超氧化物歧化酶
糖尿病的胰腺组织超氧化物歧化酶基因表达研究 摘 要:目的 探讨链脲菌素诱发的糖尿病模型大鼠胰腺组织中自由基清除剂超氧化物歧化酶(SOD)信使核糖核酸(mRNA)的表达,在分子水平上了解糖尿病时胰腺自由基代谢状态。方法 分别在0、4周、12周、24周取其血和胰腺β细胞分别测定血糖、血脂、SOD的mRNA表达研究(采用逆转录-聚合酶链反应检测胰腺组织SOD的mRNA表达)。结果 和正常对照相比,糖尿病大鼠血糖、血脂缓慢上升,胰腺β细胞的SOD的mRNA表达量明显低于正常对照。结论 表明链脲菌素诱发的非胰岛素依赖型糖尿病(NIDDM)模型大鼠的胰腺β细胞中存在SOD的mRNA表达水平低下,这也是糖尿病时胰腺组织中SOD水平下降的原因之一;而且随着高血糖持续时间延长,SOD的mRNA表达水平呈逐渐下降趋势。
, http://www.100md.com
Study of expression of SOD′s mRNA in pancreatic tissue
ZHAO Ming,DU Hong,WANG Yangtian,et al
(Department of Endocrinology,Nanjing General Hospital of PLA,Nanjing 210002)
Abstract:Objective To probe into the expression of scavenger SOD′s mRNA in pancreatic tissue of diabetic rats induced by streptozocin,so as to understand the metabolism of free radicals in NIDDM at molecular levels.Methods We quantitated the blood sugar,lipids and the gene expression of SOD in beta cells of pancreatic tissue at 0,4,12,24 week separately,which were completed by using the reverse transcription-polymerase chain reaction(RT-PCR).Results Compared with control group,the levels of blood sugar and lipids raised slowly,the levels of expression of SOD were low in beta cells of pancreatic tissue.Conclusion These results indicate that there might be a low expression of SOD gene in beta cells of pancreas induced by streptozocin,which is one of the reasons resulting in low SOD levels and become distinct when extending period of hyperglycemia.
, 百拇医药
Key words:Diabetes mellitus Superoxide dismutase(SOD)▲
糖尿病的发生、发展和自由基代谢有密切关系。近几年来在这方面有了许多新进展[1]。但糖尿病导致胰腺组织中自由基代谢异常的确切机理尚不清楚,本文旨在探讨链脲菌素诱发的糖尿病模型大鼠的胰腺组织中超氧化物歧化酶(SOD)信使核糖核酸(mRNA)的表达,了解在分子水平上糖尿病时自由基代谢状态,探索糖尿病的发病机理。
材料和方法
一、动物模型的制备及分组:SD大鼠体重150~250g,雄性,按随机原则把40只大鼠分成两组,每组20只。①糖尿病模型组:参照文献[2],用小剂量链脲菌素尾静脉(25mg/公斤体重)注射,再用高热量饲料饲养,形成类似非胰岛素依赖型糖尿病(NIDDM)的大鼠模型;②对照组:自由饮水,普通饲料。分别在第4周、第12周、第24周做糖耐量试验。
, 百拇医药
二、胰腺β细胞的RNA提取:参照上海第一人民医院糖尿病研究室提供的方法分离出β细胞,主要步骤为:大鼠胆总管逆行插管灌注8ml液体(Hank液、pH7.6、含胶原酶V0.5mg/ml、Hepes10mmol/L),取下胰腺放置50ml烧瓶加入Hank′s液6ml,38℃水浴中消化10分钟,振荡呈细沙样。10%小牛血清的Hank′s液在4℃水中终止消化。用20目过滤网过滤,其过滤液1000g×2分钟离心沉淀,沉淀物放入28%Ficoll液混匀,加入预先依次加好23%、20%、11%的Ficoll液中,800g×15分钟,吸出20%~11%界面,23%~20%界面的细胞团,用Hank′s液洗涤三遍。参照文献方法从β细胞提取RNA[3]。
三、RT-PCR:SOD引物[4]:5′ATTCGAAATGGTGG-3′、3′-CGGTTCCAGATTCG-5′。β-actin引物5′GTGGGCCGCTGTAGGCACCAA-3′、5′-CTCTTT-
, 百拇医药
GATGTCGCACGATTTC-3′。前者由上海生物工程公司合成,后者由南京军区南京总医院普外科李维勤博士惠赠。逆转录多聚酶链反应(RT-PCR)采用Boehringer Mannheim Biochemicals公司的Titan单管RT-PCR系统,PCR25次循环。
四、PCR产物及半定量:取SOD和β-actin的扩增产物各15μl,在2%琼脂糖凝胶电泳后拍照,进行吸光密度扫描,计算出SOD的mRNA表达量和其对应β-actin表达量的比值。
五、统计结果:数据用
结果
1.本实验的大鼠模型的血糖水平上升缓慢,到了第4周空腹血糖仍处于正常范围,但此时测定糖耐量显示30分钟、60分钟、120分钟血糖水平异常。到了第24周大鼠的空腹血糖才明显高于正常,大鼠的血脂从第4周开始就异常升高。这些结果都和NIDDM相似(见表1)。
, http://www.100md.com
表1 血脂、葡萄糖耐量试验结果(
血 糖(mmol/L)
血 脂(mmol/L)
0
30分钟
60分钟
120分钟
甘油三酯
胆固醇
正常对照组
, http://www.100md.com
5.1±1.1
7.4±0.8
6.8±1.0
6.6±1.3
0.59±0.11
2.23±0.24
糖尿病组(4周)
5.0±1.6
10.4±3.7*
10.9±4.1*
9.5±2.6*
, 百拇医药
1.3±0.3*
3.2±1.1*
(12周)
5.3±0.9▲
13.3±3.4*
14.8±4.1*
15.6±4.9*
1.2±0.2*
3.6±1.4*
(24周)
, http://www.100md.com
5.8±1.0*
13.9±4.0*
15.2±4.2*
17.3±3.6*
1.8±0.4*
5.6±2.3*
注:和正常对照组相比,*P<0.01 ▲P<0.05
2.RT-PCR产物电泳后可见SOD的扩增带为741bp,β-actin的扩增带为540bp。在不同时间的SOD mRNA表达水平不同,随着高血糖时间延长,SOD的mRNA表达水平呈逐渐下降趋势。
, http://www.100md.com
讨论
糖尿病时,全身多个器官和组织包括胰腺组织中自由基代谢异常,表现为SOD、谷光苷肽还原酶(GPH-X)水平低下,丙二醇(MDA)、过氧化脂质(LPO)水平上升[5]。有研究表明致糖尿病的一些药物(链脲菌素、四氧嘧啶等)都能通过降低SOD水平作为损害β细胞诱发糖尿病的先决条件[6]。但SOD下降的原因和机制仍不清楚。目前认为SOD的下降和下列因素有关:①高血糖和其代谢产物都是氧化剂,它们都消耗自由基清除剂如SOD。②糖基化作用,糖尿病时高血糖能和全身多个组织发生非酶促糖基化,影响它们各自的功能,SOD本身糖基化也会降低SOD的生物活性。③自由基能通过氧化核酸、蛋白、细胞膜脂质直接引起细胞损伤。其机理是否存在SOD基因表达水平低下尚不得而知。众所周知,糖尿病的慢性并发症是糖尿病人致残和致盲的主要原因,尽管有证据表明高血糖和糖尿病继发的并发症之间有明显的联系。但高血糖通过何种机制导致组织损害尚不清楚。目前已有证据提示[7]反应性氧族(reactive oxygen species ROS)可能在糖尿病并发症的发生上起重要作用。许多与高血糖有关的生物化学途径如多元醇途径、糖自氧化、蛋白糖基化等均可增加反应性氧族的产生。更进一步的是血管内皮细胞暴露于高糖环境下可导致自由基产生增加,后者(如超氧阴离子)可抑制或灭活NO(NO是一种参与血管自身代谢的内皮细胞源性血管扩张剂)。而抗氧化剂可逆转这种作用。该作者认为糖尿病的慢性并发症(包括大血管、微血管病变)易感性取决于内源性抗氧化剂(如自由基清除剂SOD等)的状态。在不同的病人或组织易于发生并发症可能是抗氧化剂状态不同和醛糖还原酶基因表达不同所致,有人[8]发现红细胞醛糖还原酶在有并发症的胰岛素依赖性糖尿病(IDDM)病人较无并发症明显升高,仅仅发生糖尿病并发症的靶器官对损害敏感,伴有醛糖还原酶基因表达增加。因为胰腺β细胞在生理上清除自由基的酶活性较低,也有证据显示[9]高血糖可抑制天然抗氧化剂防卫系统:纯化的牛Cu/Zn-SOD(超氧化物歧化酶)和不同浓度的葡萄糖(10~100mmol/L)温育可使酶活性降至60%,这可导致对超氧自由基损害的保护减弱。有人[6]用表达Cu/ZnSOD的转基因到小鼠胰腺组织中,结果发现这些转基因的表达比对照组明显增强对四氧嘧啶诱发的糖尿病的抵抗作用,提示自由基代谢中基因变异能影响氧化介导的糖尿病易感性。由此提出糖尿病时胰腺β细胞SOD表达水平会怎样呢本文采用实验性NIDDM大鼠模型,和正常对照相比,血糖、血脂缓慢上升,到24周时已明显高于正常对照大鼠。此时取其胰腺β细胞做SOD的mRNA表达研究,结果发现糖尿病大鼠胰腺β细胞的SOD的mRNA表达量明显低于正常对照。综上所述,本研究进一步证实①链脲菌素诱发的NIDDM模型大鼠的胰腺β细胞中存在SOD的mRNA表达水平低下。②糖尿病时胰腺组织中SOD水平下降的原因之一是其组织中SOD的mRNA表达水平低下。③随着高血糖持续时间延长,SOD的mRNA表达水平呈逐渐下降趋势。■
, 百拇医药
参考文献:
[1]Halliwell B.Free radicals,antioxidants,and human disease:curiosity,cause,or consequence?Lancet,1994,344:721-724.
[2]刘永玉,毛良.实验性NIDDM大鼠模型.中华内分泌代谢杂志,1990,6:115-116.
[3]林万明.PCR技术操作和应用指南.北京:人民军医出版社,1995,354-356.
[4]H-michael K,Junqiang W,Tammy MB,et al.Targeted overexpression of Cu/Zn superoxide dismutase protects pancreatic B-cells against oxidative stress.Diabetes,1997,46:1563-1566.
, 百拇医药
[5]赵明,王亦根,张雯,等.超氧化物歧化酶对链脲菌素诱发的糖尿病自由基代谢的影响.中国糖尿病杂志,1995,3:44-46.
[6]Papaccio G,Frascatore S,Esposito V,et al.Early macrophage infiltration in mice treated with low-streptozocin decrease islet superoxide dismutase levels:prevention by silica pretreatment.Acta Anat Basel,1991,142:147-152.
[7]Mandrup-Poulson T,Helqvist S,Wogensen LD,et al.Cytokines and free radicals as effect molecules in the destruction of pancreatic beta cells.Curr Top Microbiol Immunol,1990,164:169-193.
, 百拇医药
[8]Lenzen S,Drinkger J,Tiedge M.Low antioxidant enzyme gene expression in pancreatic islets compared with various other mouse tissue.Free radic Biol Med,1996,20:463-466.
[9]Ceriello A,Dello RP,Amstad P,et al.High glucose induces antioxidant enzymes in human endothelial cells in culture:evidence linking hyperglycemia and oxidative stress.Diabetes,1996,45:471-477.
收稿日期:1999-08-05
修稿日期:1999-10-26, http://www.100md.com