骨髓基质细胞与异种脱蛋白骨生物相容性的体外实验
作者:苏群 戴国华 李军 汪涛 夏堪冀
单位:(重庆市第三人民医院 400013)
关键词:
重庆医学000336 骨组织工程研究为治疗骨缺损、骨不连开辟了新的途经[1]。目前,国内外学者多采用成骨细胞、骨膜细胞和骨髓基质细胞种植于人工合成材料上制备组织工程化骨[2-5]。采用骨髓基质细胞和天然材料,尤其是脱蛋白骨来制备组织工程化骨的研究报道甚少[6]。本实验检测骨髓基质细胞与脱蛋白骨体外生物相溶性,旨在为采用这两者制备组织工程化骨提供依据。
1 材料和方法
1.1 材料
PRMI 1640(GIBCO)、加强型小牛血清(HyClone)、胰蛋白酶(GIBCO)、EDTA(Sigma)、四唑盐(MTT,Sigma)、考马斯亮蓝G—250、24孔培养板、紫外分光光度计、酶标仪、碱性磷酸酶试剂盒(上海荣盛生物技术公司)、脱蛋白骨(自制)。
, 百拇医药
1.2 方法
1.2.1 脱蛋白骨的制备:取脑外科手术切除的颅骨骨块,制备成3mm×3mm×3mm大小骨粒,置于氯仿丙酮(1∶1)脱脂48h,然后逐渐乙醇至水,流水冲洗。再入20%过氧化氢72h,每12小时换液一次。再入三蒸水洗涤,浸泡24h。置于180℃烤箱内烘烤4h,冷却后密封冷藏备用。
1.2.2 骨髓基质细胞培养:健康新西兰大白免2.2~2.5Kg(重庆医科大学实验动物中心),采用速眠新(解放军农牧大学兽医所)肌注麻醉后,用16—21号骨穿刺针吸单侧股骨骨髓1.5~2ml,肝素抗凝,再加RPMI1640混匀,过Ficoll(1.077)收集界面层细胞悬液,洗涤二次,4号针头反复抽吸,制成单个细胞悬液,以3×106/ml细胞数接种在25ml塑料培养瓶内。培养基为RPMI 1640,内含10%加强型小牛血清。置于37℃、5% CO2,饱和湿度的孵箱内培养,3~5天全量换液,除去悬浮细胞,以后3~4天半量换液。细胞生长汇合成单层后,用0.25%胰酶和0.02%EDTA消化,计数,进行传代培养。
, 百拇医药
1.2.3 细胞接种:将传至第三代的细胞以2×104/ml细胞数接种于24孔培养板内。分为两组:实验组每孔另加脱蛋白骨粒1~2块,对照组单加细胞。不同时点观察、处理及检测。
1.2.4 倒置显微镜观察:逐日观察细胞生长和贴附脱蛋白骨的情况。
1.2.5 MTT法测定细胞增殖:于培养的4、6、8、10天向培养板内加入MTT 100μl(5mg/ml),继续培养4小时,小心吸出上清液,加二甲基亚砜1ml,轻轻震荡10分钟,待结晶溶液后吸出150μl加入96孔板内,选择波长550nm,酶标仪测定吸光值。
1.2.6 考马斯亮蓝测定细胞蛋白含量:将培养4、6、8、19天的细胞上清液吸除,加入0.2%TritonX-100 200μl,4℃冰箱内过夜,制成细胞裂解液。取出裂解液200μl,加入2ml考马斯蓝液混匀,放置5分钟。用紫外分光光度计在595nm处测定吸光值。
, 百拇医药
1.2.7 碱性磷酸酶测定:用上法制成细胞裂解液,按试剂盒说明书要求操作。用紫外分光光度计在405nm处测定吸光值。
1.2.8 光学显微镜观察:将与细胞共培养10天的骨粒取出,10%福尔马林固定,甲酸脱钙,常规脱水,石蜡切片,HE染色,镜下观察。
1.2.9 扫描电镜观察:将与细胞共培养10天的骨粒取出,2%戊二醛固定、脱水,乙酸异戊酯置换,临界点干燥,表面喷金后观察。
1.2.10 统计方法:所获数据进行t检验。
2 结果
2.1 倒置显微镜观察:原代培养细胞接种后24小时可见短梭形多边形细胞贴壁,以后逐渐增大,胞突变宽变长,3~5天形成散在集落。集落逐渐增大,12~14天融合成单层,细胞变为长梭形。传代细胞4小时后基本贴壁,10~12天长满瓶底。
, http://www.100md.com
两组细胞生长情况基本相似,前4天细胞数量逐渐增多,体积增大。细胞从脱蛋白骨向外长出,或者向骨粒方向延伸。随培养时间延长,板内细胞进一步增多,并与骨粒上长出的细胞连接成片。
2.2 光学显微镜观察:镜下见多数骨小梁表面有细胞被复。细胞扁平状,部分区域可见细胞与骨小梁间有浅伊红色物质沉着。
2.3 扫描电镜观察:脱蛋白骨表面粗糙,可见大小不等的裂隙与微孔。细胞贴附于骨粒表面,或向裂隙或微孔内生长。细胞为梭形或多边形,其表面有丝状突起,部分区域可见细胞外基质。
2.4 细胞增殖、细胞蛋白质含量和碱性磷酸酶测定:随培养时间延长,两组细胞数量和蛋白质含量均增加,其MTT和考马斯亮蓝检测吸光值均增加。碱性磷酸酶测定吸光值随培养时间延长,无明显变化。两组吸光值差异无显著性意义(P>0.05)。测定结果见表1。
表1 各组MTT、蛋白质和ALP测定吸光值(n=3,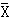 ±S)
±S)
, 百拇医药
MTT
蛋白质
ALP
实验组
对照组
实验组
对照组
实验组
对照组
4天
0.42±0.04
0.38±0.02
0.88±0.15
, http://www.100md.com
0.89±0.04
0.20±0.01
0.20±0.01
6天
0.48±0.15
0.42±0.16
1.46±0.10
1.56±0.04
0.19±0.01
0.19±0.01
8天
0.69±0.14
, http://www.100md.com
0.62±0.19
1.63±0.07
1.56±0.04
0.19±0.01
0.19±0.02
10天
0.81±0.18
0.79±0.15
1.56±0.02
1.59±0.07
0.22±0.02
0.22±0.22
, http://www.100md.com
2 讨论
本实验显示兔骨髓基质细胞与异种脱蛋白骨有较好的体外细胞生物相容性。形态学观察发现基质细胞既从周边向骨粒生长,又从骨粒表面向其微孔和裂隙内生长,并分泌细胞外基。MTT和考马斯亮蓝检测表明,脱蛋白骨对骨髓基质细胞体外增殖和蛋白质合成无不良影响。碱性磷酸酶是成骨细胞分化的标志酶。ALP检测未发现脱蛋白骨有抑制骨髓基质细胞合成ALP的作用。本实验结果提示脱蛋白骨可用于骨组织工程载体材料的研究。
与人工合成材料相比,脱蛋白骨作为组织工程载体有如下优点:①具有天然密集的微孔和裂隙结构,能够为基质细胞增值、分化与成骨提供接受自然的三维空间;②脱蛋白骨的吸收与新骨的形成基本同步,既为新骨生成提供支架,又不影响新骨的塑形;③脱蛋白骨细胞界面较好,有利于细胞的贴附、迁移与增殖;④脱蛋白骨具有可塑性及一定的机械强度,容易加工成所需的形状并有支撑作用;⑤单纯与复合脱蛋白骨已应用于临床,取得了初步疗效[7、8]。不过,脱蛋白骨尚存在一些不足之处:①作为异体或异种骨,其免疫原性难以彻底消除;②脱蛋白骨的处理方法不同,其免疫原性和生物力学性能不同[9];③尚有传染乙肝、爱滋病或动物病毒性疾病之嫌。因此,值得寻找更好的处理方法,扬长避短,用于骨组织工程研究。
, 百拇医药
骨组织工程研究中种子细胞有多种,比如成骨细胞、骨膜细胞、骨髓基质细胞和骨外血管周细胞。本实验选用骨髓基质细胞作为种子细胞基于以下原因:①取材方便,损伤小;②基质细胞增殖力强,易于扩增培养;③骨髓基质内含有较多的骨源性干祖细胞,体内外实验证实,基质细胞具有成骨能力[10]。④骨髓复合移植治疗骨缺损、不连已取得较好疗效[11]。不过,尚需对骨髓基质细胞的分离与培养方法进一步研究,以便保留更多的未分化原始间叶干细胞,以及更好地向骨源性细胞分化。
参考文献
1,尹飙,苏增贵.组织工程学在骨缺损中的应用研究.国外医学生物医学工程,1999,22(2):83
2,Angele P,Kjuat R Nerlich M, et al. Engineering of osteochondral tissue with bone marrow mesenchymal progenitor cells in derivatized Hyaluronal-Gelatin composite sponge. Tissue Eng, 1999, 5(6):545
, http://www.100md.com
3,Goldstein AS, Zhu G, Morris GE, et ai. Effect of osteoblastic culture conditions on the structure of Poly (DL-Lactic-co-Glycolic Acid)foam scaffolds. Tissue Eng, 1999,5(5):421
4,郭昭庆,党耕町,王志国,等.种植骨髓基质细胞的骨组织工程学研究.中华外科杂志,1999,37(7):421
5,Breitbart AS, Grande DA, Kessler R, et al. Tissue engineered bone repair of calvarial defects using cultured periosteal cells. Plastic and Reconstructive Surgery, 1998, 101(3):567
, http://www.100md.com
6,Nolan PC, Nickolast RM, Mulbolland BJ, et al. Culture of human osteoblasts on bemineralised ltuman bone. Possible means of graft enhancement. J Bone Joint Surg Br,1992,74(2):284
7,姚伦龙,陈剑飞,胡晓波,等.生物性骨载体修复股骨长缺损.中国修重复建外科杂志,1997,11(3):136
8,Johnson EE, Urist MR. Human bone morphogenetic protein allografting for reconstruction of femoral nonunion. Clin Orthop, 2000,(371):61
9,胡永康,安洪,曹本珍,等.四种脱蛋白骨组织学和生物力学比较研究.中华创伤杂志,1998,14(5):277
10,刘延青,娄思权.骨髓基质中的骨源性干细胞.中华骨科杂志,2000,20(2):114
11,Tiedeman JJ, Garvin KL, Kile TA, et al. The role of a composite, demineralized bone matix and bone marrow in the treatment of osseous defects. Orthopedics,1995,18(12):1153, 百拇医药
单位:(重庆市第三人民医院 400013)
关键词:
重庆医学000336 骨组织工程研究为治疗骨缺损、骨不连开辟了新的途经[1]。目前,国内外学者多采用成骨细胞、骨膜细胞和骨髓基质细胞种植于人工合成材料上制备组织工程化骨[2-5]。采用骨髓基质细胞和天然材料,尤其是脱蛋白骨来制备组织工程化骨的研究报道甚少[6]。本实验检测骨髓基质细胞与脱蛋白骨体外生物相溶性,旨在为采用这两者制备组织工程化骨提供依据。
1 材料和方法
1.1 材料
PRMI 1640(GIBCO)、加强型小牛血清(HyClone)、胰蛋白酶(GIBCO)、EDTA(Sigma)、四唑盐(MTT,Sigma)、考马斯亮蓝G—250、24孔培养板、紫外分光光度计、酶标仪、碱性磷酸酶试剂盒(上海荣盛生物技术公司)、脱蛋白骨(自制)。
, 百拇医药
1.2 方法
1.2.1 脱蛋白骨的制备:取脑外科手术切除的颅骨骨块,制备成3mm×3mm×3mm大小骨粒,置于氯仿丙酮(1∶1)脱脂48h,然后逐渐乙醇至水,流水冲洗。再入20%过氧化氢72h,每12小时换液一次。再入三蒸水洗涤,浸泡24h。置于180℃烤箱内烘烤4h,冷却后密封冷藏备用。
1.2.2 骨髓基质细胞培养:健康新西兰大白免2.2~2.5Kg(重庆医科大学实验动物中心),采用速眠新(解放军农牧大学兽医所)肌注麻醉后,用16—21号骨穿刺针吸单侧股骨骨髓1.5~2ml,肝素抗凝,再加RPMI1640混匀,过Ficoll(1.077)收集界面层细胞悬液,洗涤二次,4号针头反复抽吸,制成单个细胞悬液,以3×106/ml细胞数接种在25ml塑料培养瓶内。培养基为RPMI 1640,内含10%加强型小牛血清。置于37℃、5% CO2,饱和湿度的孵箱内培养,3~5天全量换液,除去悬浮细胞,以后3~4天半量换液。细胞生长汇合成单层后,用0.25%胰酶和0.02%EDTA消化,计数,进行传代培养。
, 百拇医药
1.2.3 细胞接种:将传至第三代的细胞以2×104/ml细胞数接种于24孔培养板内。分为两组:实验组每孔另加脱蛋白骨粒1~2块,对照组单加细胞。不同时点观察、处理及检测。
1.2.4 倒置显微镜观察:逐日观察细胞生长和贴附脱蛋白骨的情况。
1.2.5 MTT法测定细胞增殖:于培养的4、6、8、10天向培养板内加入MTT 100μl(5mg/ml),继续培养4小时,小心吸出上清液,加二甲基亚砜1ml,轻轻震荡10分钟,待结晶溶液后吸出150μl加入96孔板内,选择波长550nm,酶标仪测定吸光值。
1.2.6 考马斯亮蓝测定细胞蛋白含量:将培养4、6、8、19天的细胞上清液吸除,加入0.2%TritonX-100 200μl,4℃冰箱内过夜,制成细胞裂解液。取出裂解液200μl,加入2ml考马斯蓝液混匀,放置5分钟。用紫外分光光度计在595nm处测定吸光值。
, 百拇医药
1.2.7 碱性磷酸酶测定:用上法制成细胞裂解液,按试剂盒说明书要求操作。用紫外分光光度计在405nm处测定吸光值。
1.2.8 光学显微镜观察:将与细胞共培养10天的骨粒取出,10%福尔马林固定,甲酸脱钙,常规脱水,石蜡切片,HE染色,镜下观察。
1.2.9 扫描电镜观察:将与细胞共培养10天的骨粒取出,2%戊二醛固定、脱水,乙酸异戊酯置换,临界点干燥,表面喷金后观察。
1.2.10 统计方法:所获数据进行t检验。
2 结果
2.1 倒置显微镜观察:原代培养细胞接种后24小时可见短梭形多边形细胞贴壁,以后逐渐增大,胞突变宽变长,3~5天形成散在集落。集落逐渐增大,12~14天融合成单层,细胞变为长梭形。传代细胞4小时后基本贴壁,10~12天长满瓶底。
, http://www.100md.com
两组细胞生长情况基本相似,前4天细胞数量逐渐增多,体积增大。细胞从脱蛋白骨向外长出,或者向骨粒方向延伸。随培养时间延长,板内细胞进一步增多,并与骨粒上长出的细胞连接成片。
2.2 光学显微镜观察:镜下见多数骨小梁表面有细胞被复。细胞扁平状,部分区域可见细胞与骨小梁间有浅伊红色物质沉着。
2.3 扫描电镜观察:脱蛋白骨表面粗糙,可见大小不等的裂隙与微孔。细胞贴附于骨粒表面,或向裂隙或微孔内生长。细胞为梭形或多边形,其表面有丝状突起,部分区域可见细胞外基质。
2.4 细胞增殖、细胞蛋白质含量和碱性磷酸酶测定:随培养时间延长,两组细胞数量和蛋白质含量均增加,其MTT和考马斯亮蓝检测吸光值均增加。碱性磷酸酶测定吸光值随培养时间延长,无明显变化。两组吸光值差异无显著性意义(P>0.05)。测定结果见表1。
表1 各组MTT、蛋白质和ALP测定吸光值(n=3,
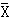 ±S)
±S), 百拇医药
MTT
蛋白质
ALP
实验组
对照组
实验组
对照组
实验组
对照组
4天
0.42±0.04
0.38±0.02
0.88±0.15
, http://www.100md.com
0.89±0.04
0.20±0.01
0.20±0.01
6天
0.48±0.15
0.42±0.16
1.46±0.10
1.56±0.04
0.19±0.01
0.19±0.01
8天
0.69±0.14
, http://www.100md.com
0.62±0.19
1.63±0.07
1.56±0.04
0.19±0.01
0.19±0.02
10天
0.81±0.18
0.79±0.15
1.56±0.02
1.59±0.07
0.22±0.02
0.22±0.22
, http://www.100md.com
2 讨论
本实验显示兔骨髓基质细胞与异种脱蛋白骨有较好的体外细胞生物相容性。形态学观察发现基质细胞既从周边向骨粒生长,又从骨粒表面向其微孔和裂隙内生长,并分泌细胞外基。MTT和考马斯亮蓝检测表明,脱蛋白骨对骨髓基质细胞体外增殖和蛋白质合成无不良影响。碱性磷酸酶是成骨细胞分化的标志酶。ALP检测未发现脱蛋白骨有抑制骨髓基质细胞合成ALP的作用。本实验结果提示脱蛋白骨可用于骨组织工程载体材料的研究。
与人工合成材料相比,脱蛋白骨作为组织工程载体有如下优点:①具有天然密集的微孔和裂隙结构,能够为基质细胞增值、分化与成骨提供接受自然的三维空间;②脱蛋白骨的吸收与新骨的形成基本同步,既为新骨生成提供支架,又不影响新骨的塑形;③脱蛋白骨细胞界面较好,有利于细胞的贴附、迁移与增殖;④脱蛋白骨具有可塑性及一定的机械强度,容易加工成所需的形状并有支撑作用;⑤单纯与复合脱蛋白骨已应用于临床,取得了初步疗效[7、8]。不过,脱蛋白骨尚存在一些不足之处:①作为异体或异种骨,其免疫原性难以彻底消除;②脱蛋白骨的处理方法不同,其免疫原性和生物力学性能不同[9];③尚有传染乙肝、爱滋病或动物病毒性疾病之嫌。因此,值得寻找更好的处理方法,扬长避短,用于骨组织工程研究。
, 百拇医药
骨组织工程研究中种子细胞有多种,比如成骨细胞、骨膜细胞、骨髓基质细胞和骨外血管周细胞。本实验选用骨髓基质细胞作为种子细胞基于以下原因:①取材方便,损伤小;②基质细胞增殖力强,易于扩增培养;③骨髓基质内含有较多的骨源性干祖细胞,体内外实验证实,基质细胞具有成骨能力[10]。④骨髓复合移植治疗骨缺损、不连已取得较好疗效[11]。不过,尚需对骨髓基质细胞的分离与培养方法进一步研究,以便保留更多的未分化原始间叶干细胞,以及更好地向骨源性细胞分化。
参考文献
1,尹飙,苏增贵.组织工程学在骨缺损中的应用研究.国外医学生物医学工程,1999,22(2):83
2,Angele P,Kjuat R Nerlich M, et al. Engineering of osteochondral tissue with bone marrow mesenchymal progenitor cells in derivatized Hyaluronal-Gelatin composite sponge. Tissue Eng, 1999, 5(6):545
, http://www.100md.com
3,Goldstein AS, Zhu G, Morris GE, et ai. Effect of osteoblastic culture conditions on the structure of Poly (DL-Lactic-co-Glycolic Acid)foam scaffolds. Tissue Eng, 1999,5(5):421
4,郭昭庆,党耕町,王志国,等.种植骨髓基质细胞的骨组织工程学研究.中华外科杂志,1999,37(7):421
5,Breitbart AS, Grande DA, Kessler R, et al. Tissue engineered bone repair of calvarial defects using cultured periosteal cells. Plastic and Reconstructive Surgery, 1998, 101(3):567
, http://www.100md.com
6,Nolan PC, Nickolast RM, Mulbolland BJ, et al. Culture of human osteoblasts on bemineralised ltuman bone. Possible means of graft enhancement. J Bone Joint Surg Br,1992,74(2):284
7,姚伦龙,陈剑飞,胡晓波,等.生物性骨载体修复股骨长缺损.中国修重复建外科杂志,1997,11(3):136
8,Johnson EE, Urist MR. Human bone morphogenetic protein allografting for reconstruction of femoral nonunion. Clin Orthop, 2000,(371):61
9,胡永康,安洪,曹本珍,等.四种脱蛋白骨组织学和生物力学比较研究.中华创伤杂志,1998,14(5):277
10,刘延青,娄思权.骨髓基质中的骨源性干细胞.中华骨科杂志,2000,20(2):114
11,Tiedeman JJ, Garvin KL, Kile TA, et al. The role of a composite, demineralized bone matix and bone marrow in the treatment of osseous defects. Orthopedics,1995,18(12):1153, 百拇医药