组织和器官移植之未来T-细胞协同刺激通路修饰剂能否彻底改变排斥反应的预防?
作者:David M.Harlan,MD Allan D.Kirk,MD,PhD
单位:
关键词:
美国医学会杂志中文版000307 虽然移植疗法彻底改变了晚期器官(肾、肝、心、肺和胰岛β-细胞)衰竭患者的治疗,但是在预防治疗移植物排斥反应方面仍存在明显问题。抗排斥反应的治疗并非总是有效,患者须每天服用,而且价格昂贵并存在明显的毒副作用。新近的进展提示免疫系统的自我调节能力要比以前了解的为高。本文讨论了免疫系统的功能以及新的治疗制剂。这些新的药物可以修饰所谓协同刺激受体信号系统,支持移植物功能而通常不抑制免疫系统。
The Future of Organ and Tissue Transplantation
Can T-Cell Costimulatory Pathway Modifiers Revolutionize the Prevention of Graft Rejection?
, http://www.100md.com
治疗性移植已被广泛接受并成为一种有效的治疗模式。仅在1997年,就有近20 000美国人接受了治疗性的并且常常是救命的器官移植1。遗憾的是仅有一小部分需要移植的患者得到了治疗性移植。器官分享联合情报网的资料表明,需要器官移植的患者远远多于可提供的器官,二者之比为3比1。统计资料更将广泛使用的器官和组织移植可能获得的健康益处降到最低程度。在美国,估计每年75%的死亡为慢性疾病(即:心血管和脑血管疾病,慢性阻塞性肺疾病,慢性肝脏疾病和肝硬变,恶性肿瘤以及糖尿病等)所致,这些疾病均可从广泛使用移植治疗获益2。
除了器官来源不足外,还有几种因素限制了移植的广泛开展。尽管对急性排斥反应的预防治疗已有很大改善,但是慢性排斥反应仍存在明显的问题。例如,一半的异体肾移植在10年内失败3,4。大部分1年后失败的肾移植为慢性移植物排斥反应所致5。遗憾的是,虽然免疫学家对主要的急性排斥反应机制已有较详细的了解,但是对慢性排斥反应的了解则相对较少,它可能表现为几种不同的过程(免疫的和非免疫的)共同损害异体移植物的功能6。由于慢性排斥反应的主要组织特征是血管增生性改变,所以一些研究人员已对生长因子对该过程的可能作用进行了检测7。影响慢性移植物排斥反应的重要因素还包括急性排斥反应的次数、供体的质量、某些免疫抑制药的应用以及某些导致血管疾病的传统危险因素(如高血压和高血脂)5。
, http://www.100md.com
无论如何,现行治疗方法的不足对严重烧伤患者阻碍了救命的皮肤异体移植,对Ι型糖尿病患者阻碍了胰岛细胞移植8-10,对患短肠综合征患者阻碍了小肠移植11。目前多数患者均接受实质器官移植。即使现行免疫抑制治疗有效,亦存在治疗费用昂贵12,通常需要终生每天服药问题,而且可显著增加感染、癌症及其他疾病(如:骨质疏松、高血糖、白内障和肾功能不全)的危险13-18。当移植受者为避免服用太多或太少的免疫抑制剂而采用适中方案时,他们还需按照复杂的药物计量表每日服药,并且需密切随访以便将已知并发症的危险降至最低。所以的确有必要改善维持异体移植物功能的方法(通过抑制免疫系统介导的排斥反应)。
免疫学概况
所有的多细胞生物都有抵御其他生物体入侵的防御系统。即使海绵(sponge)都会破坏其他无关海绵的移植组织19,20。所以,我们可以明确推测,没有免疫系统的多细胞生物,在进化的压力下,是不能长期生存的,而且就目前所知还没有一种能够生存。由于将组织和器官从一个物种的个体移植到另一个体并非一种自然现象,所以对异体移植物的免疫应答是一个物种对直接威胁其生存的反应的副产物。
, http://www.100md.com
进化免疫学家将免疫系统分为2个相互联系的系统,即先天性和适应性免疫系统(innate and adaptive immune systems)21。较原始的先天性免疫系统由吞噬细胞组成,吞噬细胞通过各种线索识别、吞噬和消化侵入的病原体。在哺乳动物,先天性免疫系统由多核白细胞、单核细胞、巨噬细胞和树突状细胞组成。适应性免疫系统随着脊椎动物的进化大约在4~6亿年前开始出现。适应性免疫系统是一个具有明确的T和B淋巴细胞簇的更为先进的免疫系统;这是在大约2~3亿年前随着哺乳类和鸟类的共同祖先进化而产生的。这种先进免疫系统的明显特点是T和B淋巴细胞表达抗原特异性受体(仅识别1个靶物质)。B淋巴细胞制造抗原特异性抗体,而T淋巴细胞则负责所谓细胞介导的免疫应答。主要是这种细胞的免疫应答造成了异体移植物的排斥反应。
T淋巴细胞引导的抗移植物免疫应答
T淋巴细胞的主要作用是引导识别并消灭受损细胞(毒素和病毒损害)的免疫应答。T淋巴细胞也引导对同种异体移植细胞、组织和器官的免疫应答。一个成年人有近1010~1012个T淋巴细胞,每个T淋巴细胞仅能识别一个靶物质。但是由于大多数特殊淋巴细胞都存在许多副本,所以一个正常人的T淋巴细胞系列可识别近109~1010个不同的抗原22。
, http://www.100md.com
然而,T淋巴细胞并非识别整个抗原。抗原特异性T-细胞受体(TCRs)主要识别整个抗原的一小段肽链,而整个抗原则是通过细胞表面之主要组织相容性复合体(MHC)蛋白呈递的(图1)。几乎所有组织细胞均存在MHC-I类分子,MHC-I呈递细胞内制造的蛋白片段(即:自体蛋白和可能被感染病毒基因编码的蛋白两种)。MHC-II类分子仅存在于特殊的抗原呈递细胞上,它呈递细胞外制作的抗原片段,然后此抗原片段由特殊的抗原呈递细胞吞噬、消化,并最后被呈递。由于MHC分子本身是多形的,所以两个无关的个体具有完全一样的MHC是极不可能的。这种供体与宿主MHC的不同正是启动抗移植物免疫应答的主要原因,这也正是为什么在得T细胞用它们的抗原特异性T-细胞受体(TCR)识别抗原(Ag)。T-细胞受体仅识别由主要组织相容性复合物(MHC)分子呈递的抗原片段。CD4+ T-细胞簇识别由MHC-II类分子呈递的抗原,而MHC-II类分子仅在特殊的抗原呈递细胞上呈递;CD8+ T-细胞簇识别MHC-I类分子呈递的抗原,MHC-I类分子的表达比较普遍到供移植的器官时,要对许多候选受者进行MHC配伍检测的原因。发现一个完全配伍的受者可大大减轻强烈免疫应答的可能性4。
, 百拇医药
图1 抗原的识别
人们常常根据T淋巴细胞表面其他蛋白复合体的存在将其分为两个亚群,即所谓的CD4+和CD8+T细胞簇(图1)。 CD4+T细胞仅识别由专职抗原呈递细胞(先天性免疫系统细胞)MHC-II类复合体呈递的抗原。而CD8+T细胞则识别由MHC-I类复合体呈递的抗原。CD4+和CD8+两种T细胞在造成移植物排斥的免疫应答中均起着重要作用。而且,上述先天性和适应性免疫系统在抗异体移植物的免疫应答中亦起着重要作用。
一个个体的T淋巴细胞有近1%对另一(非配伍的)个体的MHC复合体蛋白有交叉反应。所以有近1%的受者T淋巴细胞可以直接识别移植组织细胞上的MHC分子。此外,当宿主的先天性免疫系统细胞遇到在移植中(由于外科和缺血损伤)被破坏的组织和细胞时,那些被损伤的供体细胞就会被消化,这样供体细胞抗原就会被呈递给宿主的T淋巴细胞(间接识别),从而进一步促进抗移植物免疫应答。
, http://www.100md.com
T-细胞激活的双信号模式
虽然TCRs必须识别MHC呈递的抗原多肽才能激活抗原特异性T细胞,但是Lafferty 和 Cunningham23认为仅仅识别还不足于激活一个T细胞。他们的研究扩大了Bretscher 和Cohn24,25的早期工作,导致了T-细胞激活双信号模式的产生(图2)。此模式认为,一个适当呈递抗原的TCR识别不但应发送第1信号到T细胞,而且还需同时发送第2信号(协同刺激信号)激活T细胞。从这个假说可得出两个推论。第一,没有抗原识别而传递的第2信号对于T细胞来说是一个中性事件。第二,假如一个T细胞遇到它的同源MHC抗原但在抗原识别的同时未获得第2信号,那么这个T细胞将不是死亡就是在以后再遇到此抗原时对激活产生阻抗。
第二个推论提示了一种预防抗异体移植物免疫应答的新途径。迄今所用其他经典抗排斥方法均为非特异性地造成T-细胞应答迟钝。例如,目前已明确的糖皮质激素和钙神经碱磷酸脂酶阻滞剂(环孢素和FK-506)可阻滞MHC介导的到达T-细胞的信号(即第1信号)。其他广泛应用的药剂,如:硫唑嘌呤和酶酚酸酯(mycophenolate mofetil) 可干扰嘌呤合成,从而阻抑所有能快速增殖的细胞,如:T细胞对抗原入侵的应答。最无选择性的是那些无选择性地清除T细胞的方法,如:半体照射、胸导管引流以及抗胸腺细胞球蛋白的使用4。双信号模式提示,在T细胞首次遇到移植器官时,可特异性地阻断这种T细胞协同刺激受体的药物仅使那些抗原特异性T细胞失去活力,对未遇到同源抗原的其他T细胞则无损害。
, http://www.100md.com
协同刺激分子
June 及其同事26发现,用两个抗体的混合物刺激T细胞,一个抗体刺激TCR另一个引导拮抗先前未特征化的44-kd细胞表面受体,能诱导T细胞快速增殖。与通过表面受体抗体激活T细胞的方法不同,这种诱导不被环孢素抑制27。被此抗体标定的细胞表面受体最初称为Tp44,而后被命名为CD28。CD28是第一个已报道并广泛研究的协同刺激T细胞受体。已有报道表明几种受体-反受体对(receptor-counter-receptor pairs)具有协同刺激受体样功能,移植免疫学家对图3A和B所示两个受体反受体对特别感兴趣,因为这些受体反受体对在实验动物模型中具有预防排斥反应的作用。
CD28-B7反受体组由4个独特的受体组成。两个B7受体,B7-1(或CD80)和B7-2(或CD86)已被克隆28-30,已知是通过激活抗原呈递细胞表达的,尽管表达的动力学和水平略有不同。当TCR产生的一个信号被同时传递时,两个B7的任何一种与一个T细胞的CD28相互作用均可以协同刺激T细胞激活31。T细胞也表达另一种称为CTLA4(或CD152)的受体,这个受体对两种B7受体都起着反受体的作用32,33。CD152确定后数年中,对其确切功能进行了争论。有两篇报道34,35同时描述了去除CD152小鼠的表型,从而使许多疑问得以澄清。两篇文章都报道CD152基因裂解的小鼠早期即死亡,显示了淋巴细胞的明显激活,表现为巨脾、淋巴结病和心、胰及其他实质组织淋巴细胞浸润。如此,尽管许多详情尚不明确,但CD28-B7的相互作用激活T细胞,而A.T细胞介导的抗原识别虽然是必需的,但并不足以激活一个抗原特异性T细胞。首先由Lafferty和 Cunningham23提出,后被其他人发展的双信号模式显示,由T-细胞受体介导的第1信号和另一个协同刺激受体介导的第2信号必须被同时传递给T细胞。 B.双信号模式设定,没有T-细胞受体介导的第1信号,由协同刺激受体介导的第2信号对T细胞无作用,但是没有第2信号的第1信号则能灭活细胞或引起细胞的死亡。MHC表示主要组织相容性复合物;Ag表示抗原;TCR表示T-细胞受体A.CD28-B7反受体组由两个B7配体(CD80和CD86)和两个T-细胞受体(CD28和CTLA4[CD152])组成。两个B7配体均能与CD28和CD152二者结合。假如一个T细胞接受一个T-细胞受体(TCR)介导的信号,那么B7CD28的相互作用就产生一个协同刺激信号,此信号可促进整个T细胞的激活,包括CD154的表达。B7-CD152的相互作用表现为抑制T细胞激活。B.CD40-CD154受体对的相互作用很明确地引起对抗原呈递细胞(APC)的作用,包括上调炎性介质、粘附分子和B7的表达。这样,被其CD40受体激活的APC(Antigen-presenting Cell)对T细胞起一种更为有效的刺激细胞的作用CD152-B7的相互作用则似乎限制T细胞的反应。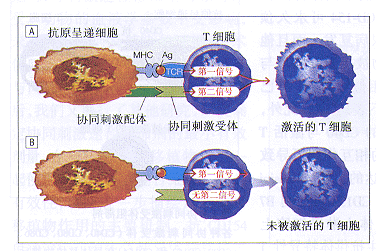
, 百拇医药
图2 T-细胞激活的双信号模式
图3 协同刺激受体
Linsley等33曾寻找开发一种阻滞CD28-B7相互作用的试剂。采用分子生物学技术,他们制作了一种嵌合分子,这种分子是由CD28或CD152的细胞外域与IgG的重链(分别为CD28-Ig和CTLA4-Ig)相结合组成的。后来发现CD28-Ig不能有效干扰CD28-B7信号系统,而CTLA4-Ig36则可有效地与CD28竞争同B7两个配体相结合,从而防止T细胞的激活。
在移植免疫中,CD40-CD154受体对(图3B)的历史甚至更短。B淋巴细胞表达CD40。CD40是一种细胞表面的受体,它们在抗原刺激后介导免疫球蛋白由早期IgM应答转变为后期IgG应答的过程中是很重要的。对高IgM综合征的研究证明,此类患者的T细胞对B细胞CD40的反受体有缺陷37。这种T-细胞反受体原先称做gp39,后来叫做CD40配体(或CD40L),最近则叫做CD154。这样,由于CD154遗传性缺失时,B淋巴细胞的功能产生缺陷而使CD154被确定,随后抗CD154抗体对T细胞功能的作用也被确定。
, 百拇医药
在小动物移植模型的协同刺激受体阻滞剂
Lenschow等38报道协同刺激受体阻滞剂可以特异性地预防小鼠对移植物的排斥反应。这是个里程碑性的研究。此后,人们对T-细胞协同刺激受体信号系统的兴趣大大增加。使用胰腺β-细胞毒素(streptozotocin)诱导小鼠发生糖尿病,然后将人的胰岛注射移植到小鼠的一侧肾被膜下,虽可暂时治愈小鼠的糖尿病,但是几天后人的胰岛受到排斥,导致疾病复发。Lenshow等证明,在移植术后两周内使用CTLA4-Ig可使移植物长期保存功能,使小鼠达到无糖尿病生存。他们还报道,假如含人胰岛的肾脏在移植后几个星期被切除,糖尿病立刻复发。这表明移植的人胰岛起着维持正常血糖的作用。在手术切除移植了胰岛的肾后,于对侧肾被膜下再次注射胰岛,只有当两次注射的胰岛是来自同一供体(人)时,移植的胰岛才能对糖尿病有效,来自其他供体的胰岛则会受到排斥。这表明老鼠的免疫系统已经能够识别来自同一个人的供体组织,它们仅对不同供体的相同细胞(胰岛)产生正常的免疫应答。随后的一些报道表明,在啮齿类动物可用干扰CD28-B7信号系统的试剂重复诱导异体移植物的生存39-42。最近的报道甚至表明此类试剂可以消除慢性排斥反应特征性的血管病变43-46。
, 百拇医药
首次提示调节CD40-CD154相互作用的药剂也可诱导移植物长期存活的报道于1995年发表。Parker等47发现,在肾被膜下移植异体胰岛术前和术后7周,使用供体特异性小淋巴细胞和抗CD-154可永久预防排斥反应和糖尿病复发。而且他们提出这种移植物被接受的机理与CTLA4-Ig诱导的相似48,即:小淋巴细胞表达极少或不表达B7。此外,小B淋巴细胞上的CD40与激活T细胞上的CD154的相互作用可导致B淋巴细胞B7表达的上调。Rossini及其同事48指出抗CD154可抑制B7表达的上调,使供体小淋巴细胞上的MHC分子与宿主抗供体特异性T细胞相互作用,而这种T细胞未获得所需的B7-CD28协同刺激信号,这样就使宿主能够容忍供体组织。此后,又有一些证明抗CD154移植物免疫耐受作用的报告发表48-53。
尽管在啮齿动物进行的研究引人入胜,移植免疫学文献充满了在老鼠移植模型发现的有希望的治疗方法,但是在其他动物进行的试验均告失败。我们54以及其他作者55均发现,尽管采用了相似的条件,但是 CDLA4-Ig在非人类的灵长类动物不能可靠防止对异体移植物的排斥反应。虽然移植物的接受在小鼠相对较易,但是在Larsen56以前,从来没有人报道可用简单、无毒的方法预防动物对异体全厚皮肤移植物的排斥反应,即使是在小鼠。鉴于抗CD154可防止B7的表达上调,CDLA4-Ig可与B7结合并阻碍B7-CD28信号系统(图4),Larsen及其同事们测试了两种试剂联合用于小鼠全厚层异体移植模型的效果。显然,两种试剂任何一种单独使用均是无效的,然而两种试剂短期联合使用则几乎可使所有实验动物的异体移植皮肤均长期存活。同样令人惊奇的是,他们观察到,假如这些试剂与环孢素共同使用, CTLA4-Ig和抗CD154的移植物促进作用就会受到阻滞。 因为环孢素干扰了由衔接抗原的TCR转导的信号(双信号模式中的第1信号)。这些资料强烈提示协同刺激途径修饰剂并非仅仅地是另一类免疫抑制药。这表明它们的全部治疗效果有赖于TCR介导的抗原识别。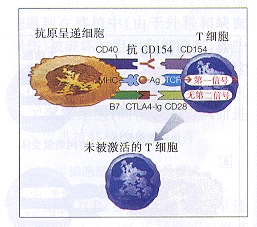
, http://www.100md.com
图4 协同刺激受体阻滞剂
各种协同刺激受体(CD40、CD80、CD86、CD28、CD152和CD154)在异体移植物排斥反应中的确切作用尚未完全明确。B7-CD28和CD40-CD154反受体组是相互关连的。在啮齿动物这些相互作用的阻滞剂能有效预防异体移植物的排斥反应。研究表明,在啮齿动物CTLA4-Ig40,41或者抗CD15447,48能预防异体排斥反应,二者结合使用则非常有效56。 MHC代表主要组织相容性复合物;Ag代表抗原;TCR代表T-细胞受体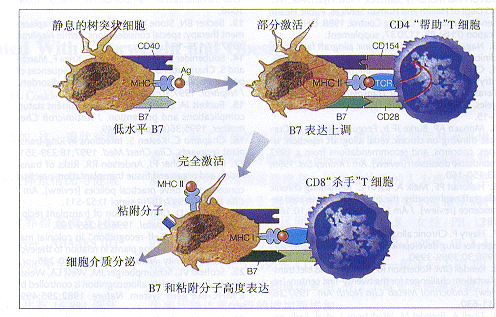
图5 CD4和CD8 T-细胞的激活与异体移植物排斥反应
宿主组织抗原(Ag)由“专职的”抗原呈递细胞呈递给CD4 T细胞致使CD4 T细胞激活61-64。然后这些被激活的CD4 T细胞完全激活抗原呈递细胞,而抗原呈递细胞又能刺激CD8 T细胞使其成为杀伤细胞。静止的专职抗原呈递细胞也能被移植过程中释放的脂多糖类和炎性介质部分激活,引起主要组织相容性复合物(MHC)II类和B7的表达增加。TCR表示T-细胞受体
, http://www.100md.com
协同刺激通路修饰剂在非人类灵长动物模型的作用
鉴于在鼠类全厚层异体植皮模型联合应用CTLA4-Ig和抗CD154治疗的效果,我们在恒河猴异体肾移植模型进行了类似实验54。年轻恒河猴在双侧肾切除后,有目的地移植非配伍的异体肾。正如预期的那样,对照组异体移植肾均于8天内发生排斥反应。移植手术后即用CTLA4-Ig和抗CD154联合治疗28天的动物均能维持移植物正常功能至少达6个月。然而,与小鼠实验结果不同的是,单独使用抗CD154对预防急性异体肾移植排斥反应是有效的。与啮齿类动物研究一致的是,联合刺激途径修饰剂可很好耐受。动物的血液学参数不受影响,未表现出任何易感染的证据,手术伤口均正常愈合,其体重增加情况与同窝同伴一致。这些研究发表后,我们又进行了其他研究,以便确定协同刺激途径修饰剂的最小有效剂量,在与传统保护移植物试剂一起使用时这些试剂能否维持它们的有效性,以及进一步描绘试剂保护移植物作用的主要机制。抗CD154单独治疗在预防急性异体肾移植排斥反应方面有很高的疗效57。例如,两只动物在肾移植后第一个月使用了6个剂量的抗CD154,结果显示移植物生存期明显延长,其中一只在移植术后120天发生了排斥反应,另一只动物在术后750多天肾脏功能一直正常(这意味着不用抗排斥治疗达700多天)。另外9只移植了一个异体肾的动物,术后1个月给予6个剂量的抗CD154,以后5个月每月1个剂量,结果这些动物均未发生移植物排斥反应。然而,与我们以前在小鼠获得的材料一致,传统的免疫抑制剂似乎具有消除抗CD154功效的作用。采用FK-506、类固醇、或酶酚酸酯治疗,结果并非全部成功57。最令人惊奇的是,异体移植物活检显示激活的T细胞浸润移植组织,然而这些细胞并不浸入肾血管、肾小管或肾小球37。此外,我们还与其他研究者合作,对这些试剂是否可支持恒河猴异体胰岛存活进行了研究。这些实验亦获得相似的结果58。
, 百拇医药
试剂是如何起作用的?
关于这些移植免疫学进展的免疫学背景,最近已有较为详尽的总结59。图4所示简单模型(由Lenschow38和Rossini等48首次提出用以解释协同刺激通道修饰剂预防组织和器官移植排斥反应的能力)现在知道是过于简单化了60。例如,在用协同刺激通道修饰剂预防排斥反应的动物,其移植物亦表达一定的B7分子,这与未治疗动物排斥反应器官是无法区分的56。
目前认为T细胞(CD4和CD8簇)与先天性免疫系统之间的相互作用是导致排斥移植器官免疫应答的基础(图5)。获取和/或移植过程所致供体组织损伤必然导致供体组织抗原的释放,宿主先天性免疫系统细胞(包括树突状细胞)可借此获得这些外来抗原。此外,手术创伤还可造成局部炎性介质的释放,移植部位的树突状细胞亦会因此而被部分激活。静止的树突状细胞表达低水平的MHC-II类和B7协同刺激配体,但不表达白介素(IL)12这样的细胞介质。但是在树突状细胞被激活时,它们可产生较多的IL-12并表达更高的MHC-II类和B7分子。假如这些呈递外来MHC片段的、被部分激活的树突状细胞遇到具有对此MHC抗原特异性TCR的CD4 T细胞,那么这些抗原特异性T细胞将被激活。
, 百拇医药
静止的T细胞极少或不表达CD154,而激活的CD4 T细胞则快速增加CD154的表达。在这点上,一个正的增强环被建立。CD4 T细胞的CD154对树突状细胞的CD40起着配体的作用,反过来它又导致树突状细胞的进一步激活。完全激活的树突状细胞高度表达几种基因产物(即:MHC-I类和II类分子,B7协同刺激分子以及粘附分子)并产生更多的IL-12那样的炎性介质。根据Ridge61,Schoenberger62和Bennett等63的研究,Lanzavecchia将这种完全激活的树突状细胞描述为通过“杀伤执照”的细胞64,因为它能有效刺激被称做细胞毒素T淋巴细胞(CTLs)的CD8 T-细胞成熟,而CTLs则为整个抗移植物免疫应答必须的(图5)。
根据上述作用顺序,抗CD154可通过阻滞CD4 T-细胞进一步激活已部分激活的树突状细胞,在开始时,阻断渐次增强的激活序列,从而防止CTLs的成熟。尽管这个模式过于简化。例如,抗CD154在灵长动物可以阻断正在发生的排斥反应54。其他的研究亦报告抗CD154在实验动物能阻止正在进行的自身免疫综合征,即使是在疾病的晚期65,66。此外,此模式仅揭示了抗CD154的一个间接作用,即阻滞CD4 T细胞完全激活树突状细胞。然而,我们已发现一些抗CD154灭活CD4 T细胞的直接作用的证据(P.J.Blair,PhD.未发表资料.1999)。
, http://www.100md.com
移植的未来?
免疫抑制治疗的进步造就了器官移植,而器官移植又保护了成千上万的晚期疾病患者。然而,迄今对于作出许多贡献的免疫抑制剂来说,其作用已达到极限。较新的免疫抑制治疗方案虽使移植后并发症明显增加,但移植物和患者的生存却无进一步改善67,68。现代临床研究必须转向开发具有长期疗效的抗排斥疗法,并减少对全面免疫抑制的依赖。对T-细胞协同刺激的研究揭示了免疫系统以前被人们忽视的完美调节其活力的能力。利用这些调节机制,通过间断使用相对无毒的试剂达到持久的移植物无排斥生存是可行的。认真研究这些新试剂的临床试验已获批准,人们将以极大的兴趣期待他们的发现。
陈永亮 译 黄志强 校
JAMA 1999;282:1076~1082, 百拇医药
单位:
关键词:
美国医学会杂志中文版000307 虽然移植疗法彻底改变了晚期器官(肾、肝、心、肺和胰岛β-细胞)衰竭患者的治疗,但是在预防治疗移植物排斥反应方面仍存在明显问题。抗排斥反应的治疗并非总是有效,患者须每天服用,而且价格昂贵并存在明显的毒副作用。新近的进展提示免疫系统的自我调节能力要比以前了解的为高。本文讨论了免疫系统的功能以及新的治疗制剂。这些新的药物可以修饰所谓协同刺激受体信号系统,支持移植物功能而通常不抑制免疫系统。
The Future of Organ and Tissue Transplantation
Can T-Cell Costimulatory Pathway Modifiers Revolutionize the Prevention of Graft Rejection?
, http://www.100md.com
治疗性移植已被广泛接受并成为一种有效的治疗模式。仅在1997年,就有近20 000美国人接受了治疗性的并且常常是救命的器官移植1。遗憾的是仅有一小部分需要移植的患者得到了治疗性移植。器官分享联合情报网的资料表明,需要器官移植的患者远远多于可提供的器官,二者之比为3比1。统计资料更将广泛使用的器官和组织移植可能获得的健康益处降到最低程度。在美国,估计每年75%的死亡为慢性疾病(即:心血管和脑血管疾病,慢性阻塞性肺疾病,慢性肝脏疾病和肝硬变,恶性肿瘤以及糖尿病等)所致,这些疾病均可从广泛使用移植治疗获益2。
除了器官来源不足外,还有几种因素限制了移植的广泛开展。尽管对急性排斥反应的预防治疗已有很大改善,但是慢性排斥反应仍存在明显的问题。例如,一半的异体肾移植在10年内失败3,4。大部分1年后失败的肾移植为慢性移植物排斥反应所致5。遗憾的是,虽然免疫学家对主要的急性排斥反应机制已有较详细的了解,但是对慢性排斥反应的了解则相对较少,它可能表现为几种不同的过程(免疫的和非免疫的)共同损害异体移植物的功能6。由于慢性排斥反应的主要组织特征是血管增生性改变,所以一些研究人员已对生长因子对该过程的可能作用进行了检测7。影响慢性移植物排斥反应的重要因素还包括急性排斥反应的次数、供体的质量、某些免疫抑制药的应用以及某些导致血管疾病的传统危险因素(如高血压和高血脂)5。
, http://www.100md.com
无论如何,现行治疗方法的不足对严重烧伤患者阻碍了救命的皮肤异体移植,对Ι型糖尿病患者阻碍了胰岛细胞移植8-10,对患短肠综合征患者阻碍了小肠移植11。目前多数患者均接受实质器官移植。即使现行免疫抑制治疗有效,亦存在治疗费用昂贵12,通常需要终生每天服药问题,而且可显著增加感染、癌症及其他疾病(如:骨质疏松、高血糖、白内障和肾功能不全)的危险13-18。当移植受者为避免服用太多或太少的免疫抑制剂而采用适中方案时,他们还需按照复杂的药物计量表每日服药,并且需密切随访以便将已知并发症的危险降至最低。所以的确有必要改善维持异体移植物功能的方法(通过抑制免疫系统介导的排斥反应)。
免疫学概况
所有的多细胞生物都有抵御其他生物体入侵的防御系统。即使海绵(sponge)都会破坏其他无关海绵的移植组织19,20。所以,我们可以明确推测,没有免疫系统的多细胞生物,在进化的压力下,是不能长期生存的,而且就目前所知还没有一种能够生存。由于将组织和器官从一个物种的个体移植到另一个体并非一种自然现象,所以对异体移植物的免疫应答是一个物种对直接威胁其生存的反应的副产物。
, http://www.100md.com
进化免疫学家将免疫系统分为2个相互联系的系统,即先天性和适应性免疫系统(innate and adaptive immune systems)21。较原始的先天性免疫系统由吞噬细胞组成,吞噬细胞通过各种线索识别、吞噬和消化侵入的病原体。在哺乳动物,先天性免疫系统由多核白细胞、单核细胞、巨噬细胞和树突状细胞组成。适应性免疫系统随着脊椎动物的进化大约在4~6亿年前开始出现。适应性免疫系统是一个具有明确的T和B淋巴细胞簇的更为先进的免疫系统;这是在大约2~3亿年前随着哺乳类和鸟类的共同祖先进化而产生的。这种先进免疫系统的明显特点是T和B淋巴细胞表达抗原特异性受体(仅识别1个靶物质)。B淋巴细胞制造抗原特异性抗体,而T淋巴细胞则负责所谓细胞介导的免疫应答。主要是这种细胞的免疫应答造成了异体移植物的排斥反应。
T淋巴细胞引导的抗移植物免疫应答
T淋巴细胞的主要作用是引导识别并消灭受损细胞(毒素和病毒损害)的免疫应答。T淋巴细胞也引导对同种异体移植细胞、组织和器官的免疫应答。一个成年人有近1010~1012个T淋巴细胞,每个T淋巴细胞仅能识别一个靶物质。但是由于大多数特殊淋巴细胞都存在许多副本,所以一个正常人的T淋巴细胞系列可识别近109~1010个不同的抗原22。
, http://www.100md.com
然而,T淋巴细胞并非识别整个抗原。抗原特异性T-细胞受体(TCRs)主要识别整个抗原的一小段肽链,而整个抗原则是通过细胞表面之主要组织相容性复合体(MHC)蛋白呈递的(图1)。几乎所有组织细胞均存在MHC-I类分子,MHC-I呈递细胞内制造的蛋白片段(即:自体蛋白和可能被感染病毒基因编码的蛋白两种)。MHC-II类分子仅存在于特殊的抗原呈递细胞上,它呈递细胞外制作的抗原片段,然后此抗原片段由特殊的抗原呈递细胞吞噬、消化,并最后被呈递。由于MHC分子本身是多形的,所以两个无关的个体具有完全一样的MHC是极不可能的。这种供体与宿主MHC的不同正是启动抗移植物免疫应答的主要原因,这也正是为什么在得T细胞用它们的抗原特异性T-细胞受体(TCR)识别抗原(Ag)。T-细胞受体仅识别由主要组织相容性复合物(MHC)分子呈递的抗原片段。CD4+ T-细胞簇识别由MHC-II类分子呈递的抗原,而MHC-II类分子仅在特殊的抗原呈递细胞上呈递;CD8+ T-细胞簇识别MHC-I类分子呈递的抗原,MHC-I类分子的表达比较普遍到供移植的器官时,要对许多候选受者进行MHC配伍检测的原因。发现一个完全配伍的受者可大大减轻强烈免疫应答的可能性4。

, 百拇医药
图1 抗原的识别
人们常常根据T淋巴细胞表面其他蛋白复合体的存在将其分为两个亚群,即所谓的CD4+和CD8+T细胞簇(图1)。 CD4+T细胞仅识别由专职抗原呈递细胞(先天性免疫系统细胞)MHC-II类复合体呈递的抗原。而CD8+T细胞则识别由MHC-I类复合体呈递的抗原。CD4+和CD8+两种T细胞在造成移植物排斥的免疫应答中均起着重要作用。而且,上述先天性和适应性免疫系统在抗异体移植物的免疫应答中亦起着重要作用。
一个个体的T淋巴细胞有近1%对另一(非配伍的)个体的MHC复合体蛋白有交叉反应。所以有近1%的受者T淋巴细胞可以直接识别移植组织细胞上的MHC分子。此外,当宿主的先天性免疫系统细胞遇到在移植中(由于外科和缺血损伤)被破坏的组织和细胞时,那些被损伤的供体细胞就会被消化,这样供体细胞抗原就会被呈递给宿主的T淋巴细胞(间接识别),从而进一步促进抗移植物免疫应答。
, http://www.100md.com
T-细胞激活的双信号模式
虽然TCRs必须识别MHC呈递的抗原多肽才能激活抗原特异性T细胞,但是Lafferty 和 Cunningham23认为仅仅识别还不足于激活一个T细胞。他们的研究扩大了Bretscher 和Cohn24,25的早期工作,导致了T-细胞激活双信号模式的产生(图2)。此模式认为,一个适当呈递抗原的TCR识别不但应发送第1信号到T细胞,而且还需同时发送第2信号(协同刺激信号)激活T细胞。从这个假说可得出两个推论。第一,没有抗原识别而传递的第2信号对于T细胞来说是一个中性事件。第二,假如一个T细胞遇到它的同源MHC抗原但在抗原识别的同时未获得第2信号,那么这个T细胞将不是死亡就是在以后再遇到此抗原时对激活产生阻抗。
第二个推论提示了一种预防抗异体移植物免疫应答的新途径。迄今所用其他经典抗排斥方法均为非特异性地造成T-细胞应答迟钝。例如,目前已明确的糖皮质激素和钙神经碱磷酸脂酶阻滞剂(环孢素和FK-506)可阻滞MHC介导的到达T-细胞的信号(即第1信号)。其他广泛应用的药剂,如:硫唑嘌呤和酶酚酸酯(mycophenolate mofetil) 可干扰嘌呤合成,从而阻抑所有能快速增殖的细胞,如:T细胞对抗原入侵的应答。最无选择性的是那些无选择性地清除T细胞的方法,如:半体照射、胸导管引流以及抗胸腺细胞球蛋白的使用4。双信号模式提示,在T细胞首次遇到移植器官时,可特异性地阻断这种T细胞协同刺激受体的药物仅使那些抗原特异性T细胞失去活力,对未遇到同源抗原的其他T细胞则无损害。
, http://www.100md.com
协同刺激分子
June 及其同事26发现,用两个抗体的混合物刺激T细胞,一个抗体刺激TCR另一个引导拮抗先前未特征化的44-kd细胞表面受体,能诱导T细胞快速增殖。与通过表面受体抗体激活T细胞的方法不同,这种诱导不被环孢素抑制27。被此抗体标定的细胞表面受体最初称为Tp44,而后被命名为CD28。CD28是第一个已报道并广泛研究的协同刺激T细胞受体。已有报道表明几种受体-反受体对(receptor-counter-receptor pairs)具有协同刺激受体样功能,移植免疫学家对图3A和B所示两个受体反受体对特别感兴趣,因为这些受体反受体对在实验动物模型中具有预防排斥反应的作用。
CD28-B7反受体组由4个独特的受体组成。两个B7受体,B7-1(或CD80)和B7-2(或CD86)已被克隆28-30,已知是通过激活抗原呈递细胞表达的,尽管表达的动力学和水平略有不同。当TCR产生的一个信号被同时传递时,两个B7的任何一种与一个T细胞的CD28相互作用均可以协同刺激T细胞激活31。T细胞也表达另一种称为CTLA4(或CD152)的受体,这个受体对两种B7受体都起着反受体的作用32,33。CD152确定后数年中,对其确切功能进行了争论。有两篇报道34,35同时描述了去除CD152小鼠的表型,从而使许多疑问得以澄清。两篇文章都报道CD152基因裂解的小鼠早期即死亡,显示了淋巴细胞的明显激活,表现为巨脾、淋巴结病和心、胰及其他实质组织淋巴细胞浸润。如此,尽管许多详情尚不明确,但CD28-B7的相互作用激活T细胞,而A.T细胞介导的抗原识别虽然是必需的,但并不足以激活一个抗原特异性T细胞。首先由Lafferty和 Cunningham23提出,后被其他人发展的双信号模式显示,由T-细胞受体介导的第1信号和另一个协同刺激受体介导的第2信号必须被同时传递给T细胞。 B.双信号模式设定,没有T-细胞受体介导的第1信号,由协同刺激受体介导的第2信号对T细胞无作用,但是没有第2信号的第1信号则能灭活细胞或引起细胞的死亡。MHC表示主要组织相容性复合物;Ag表示抗原;TCR表示T-细胞受体A.CD28-B7反受体组由两个B7配体(CD80和CD86)和两个T-细胞受体(CD28和CTLA4[CD152])组成。两个B7配体均能与CD28和CD152二者结合。假如一个T细胞接受一个T-细胞受体(TCR)介导的信号,那么B7CD28的相互作用就产生一个协同刺激信号,此信号可促进整个T细胞的激活,包括CD154的表达。B7-CD152的相互作用表现为抑制T细胞激活。B.CD40-CD154受体对的相互作用很明确地引起对抗原呈递细胞(APC)的作用,包括上调炎性介质、粘附分子和B7的表达。这样,被其CD40受体激活的APC(Antigen-presenting Cell)对T细胞起一种更为有效的刺激细胞的作用CD152-B7的相互作用则似乎限制T细胞的反应。

, 百拇医药
图2 T-细胞激活的双信号模式

图3 协同刺激受体
Linsley等33曾寻找开发一种阻滞CD28-B7相互作用的试剂。采用分子生物学技术,他们制作了一种嵌合分子,这种分子是由CD28或CD152的细胞外域与IgG的重链(分别为CD28-Ig和CTLA4-Ig)相结合组成的。后来发现CD28-Ig不能有效干扰CD28-B7信号系统,而CTLA4-Ig36则可有效地与CD28竞争同B7两个配体相结合,从而防止T细胞的激活。
在移植免疫中,CD40-CD154受体对(图3B)的历史甚至更短。B淋巴细胞表达CD40。CD40是一种细胞表面的受体,它们在抗原刺激后介导免疫球蛋白由早期IgM应答转变为后期IgG应答的过程中是很重要的。对高IgM综合征的研究证明,此类患者的T细胞对B细胞CD40的反受体有缺陷37。这种T-细胞反受体原先称做gp39,后来叫做CD40配体(或CD40L),最近则叫做CD154。这样,由于CD154遗传性缺失时,B淋巴细胞的功能产生缺陷而使CD154被确定,随后抗CD154抗体对T细胞功能的作用也被确定。
, 百拇医药
在小动物移植模型的协同刺激受体阻滞剂
Lenschow等38报道协同刺激受体阻滞剂可以特异性地预防小鼠对移植物的排斥反应。这是个里程碑性的研究。此后,人们对T-细胞协同刺激受体信号系统的兴趣大大增加。使用胰腺β-细胞毒素(streptozotocin)诱导小鼠发生糖尿病,然后将人的胰岛注射移植到小鼠的一侧肾被膜下,虽可暂时治愈小鼠的糖尿病,但是几天后人的胰岛受到排斥,导致疾病复发。Lenshow等证明,在移植术后两周内使用CTLA4-Ig可使移植物长期保存功能,使小鼠达到无糖尿病生存。他们还报道,假如含人胰岛的肾脏在移植后几个星期被切除,糖尿病立刻复发。这表明移植的人胰岛起着维持正常血糖的作用。在手术切除移植了胰岛的肾后,于对侧肾被膜下再次注射胰岛,只有当两次注射的胰岛是来自同一供体(人)时,移植的胰岛才能对糖尿病有效,来自其他供体的胰岛则会受到排斥。这表明老鼠的免疫系统已经能够识别来自同一个人的供体组织,它们仅对不同供体的相同细胞(胰岛)产生正常的免疫应答。随后的一些报道表明,在啮齿类动物可用干扰CD28-B7信号系统的试剂重复诱导异体移植物的生存39-42。最近的报道甚至表明此类试剂可以消除慢性排斥反应特征性的血管病变43-46。
, 百拇医药
首次提示调节CD40-CD154相互作用的药剂也可诱导移植物长期存活的报道于1995年发表。Parker等47发现,在肾被膜下移植异体胰岛术前和术后7周,使用供体特异性小淋巴细胞和抗CD-154可永久预防排斥反应和糖尿病复发。而且他们提出这种移植物被接受的机理与CTLA4-Ig诱导的相似48,即:小淋巴细胞表达极少或不表达B7。此外,小B淋巴细胞上的CD40与激活T细胞上的CD154的相互作用可导致B淋巴细胞B7表达的上调。Rossini及其同事48指出抗CD154可抑制B7表达的上调,使供体小淋巴细胞上的MHC分子与宿主抗供体特异性T细胞相互作用,而这种T细胞未获得所需的B7-CD28协同刺激信号,这样就使宿主能够容忍供体组织。此后,又有一些证明抗CD154移植物免疫耐受作用的报告发表48-53。
尽管在啮齿动物进行的研究引人入胜,移植免疫学文献充满了在老鼠移植模型发现的有希望的治疗方法,但是在其他动物进行的试验均告失败。我们54以及其他作者55均发现,尽管采用了相似的条件,但是 CDLA4-Ig在非人类的灵长类动物不能可靠防止对异体移植物的排斥反应。虽然移植物的接受在小鼠相对较易,但是在Larsen56以前,从来没有人报道可用简单、无毒的方法预防动物对异体全厚皮肤移植物的排斥反应,即使是在小鼠。鉴于抗CD154可防止B7的表达上调,CDLA4-Ig可与B7结合并阻碍B7-CD28信号系统(图4),Larsen及其同事们测试了两种试剂联合用于小鼠全厚层异体移植模型的效果。显然,两种试剂任何一种单独使用均是无效的,然而两种试剂短期联合使用则几乎可使所有实验动物的异体移植皮肤均长期存活。同样令人惊奇的是,他们观察到,假如这些试剂与环孢素共同使用, CTLA4-Ig和抗CD154的移植物促进作用就会受到阻滞。 因为环孢素干扰了由衔接抗原的TCR转导的信号(双信号模式中的第1信号)。这些资料强烈提示协同刺激途径修饰剂并非仅仅地是另一类免疫抑制药。这表明它们的全部治疗效果有赖于TCR介导的抗原识别。

, http://www.100md.com
图4 协同刺激受体阻滞剂
各种协同刺激受体(CD40、CD80、CD86、CD28、CD152和CD154)在异体移植物排斥反应中的确切作用尚未完全明确。B7-CD28和CD40-CD154反受体组是相互关连的。在啮齿动物这些相互作用的阻滞剂能有效预防异体移植物的排斥反应。研究表明,在啮齿动物CTLA4-Ig40,41或者抗CD15447,48能预防异体排斥反应,二者结合使用则非常有效56。 MHC代表主要组织相容性复合物;Ag代表抗原;TCR代表T-细胞受体

图5 CD4和CD8 T-细胞的激活与异体移植物排斥反应
宿主组织抗原(Ag)由“专职的”抗原呈递细胞呈递给CD4 T细胞致使CD4 T细胞激活61-64。然后这些被激活的CD4 T细胞完全激活抗原呈递细胞,而抗原呈递细胞又能刺激CD8 T细胞使其成为杀伤细胞。静止的专职抗原呈递细胞也能被移植过程中释放的脂多糖类和炎性介质部分激活,引起主要组织相容性复合物(MHC)II类和B7的表达增加。TCR表示T-细胞受体
, http://www.100md.com
协同刺激通路修饰剂在非人类灵长动物模型的作用
鉴于在鼠类全厚层异体植皮模型联合应用CTLA4-Ig和抗CD154治疗的效果,我们在恒河猴异体肾移植模型进行了类似实验54。年轻恒河猴在双侧肾切除后,有目的地移植非配伍的异体肾。正如预期的那样,对照组异体移植肾均于8天内发生排斥反应。移植手术后即用CTLA4-Ig和抗CD154联合治疗28天的动物均能维持移植物正常功能至少达6个月。然而,与小鼠实验结果不同的是,单独使用抗CD154对预防急性异体肾移植排斥反应是有效的。与啮齿类动物研究一致的是,联合刺激途径修饰剂可很好耐受。动物的血液学参数不受影响,未表现出任何易感染的证据,手术伤口均正常愈合,其体重增加情况与同窝同伴一致。这些研究发表后,我们又进行了其他研究,以便确定协同刺激途径修饰剂的最小有效剂量,在与传统保护移植物试剂一起使用时这些试剂能否维持它们的有效性,以及进一步描绘试剂保护移植物作用的主要机制。抗CD154单独治疗在预防急性异体肾移植排斥反应方面有很高的疗效57。例如,两只动物在肾移植后第一个月使用了6个剂量的抗CD154,结果显示移植物生存期明显延长,其中一只在移植术后120天发生了排斥反应,另一只动物在术后750多天肾脏功能一直正常(这意味着不用抗排斥治疗达700多天)。另外9只移植了一个异体肾的动物,术后1个月给予6个剂量的抗CD154,以后5个月每月1个剂量,结果这些动物均未发生移植物排斥反应。然而,与我们以前在小鼠获得的材料一致,传统的免疫抑制剂似乎具有消除抗CD154功效的作用。采用FK-506、类固醇、或酶酚酸酯治疗,结果并非全部成功57。最令人惊奇的是,异体移植物活检显示激活的T细胞浸润移植组织,然而这些细胞并不浸入肾血管、肾小管或肾小球37。此外,我们还与其他研究者合作,对这些试剂是否可支持恒河猴异体胰岛存活进行了研究。这些实验亦获得相似的结果58。
, 百拇医药
试剂是如何起作用的?
关于这些移植免疫学进展的免疫学背景,最近已有较为详尽的总结59。图4所示简单模型(由Lenschow38和Rossini等48首次提出用以解释协同刺激通道修饰剂预防组织和器官移植排斥反应的能力)现在知道是过于简单化了60。例如,在用协同刺激通道修饰剂预防排斥反应的动物,其移植物亦表达一定的B7分子,这与未治疗动物排斥反应器官是无法区分的56。
目前认为T细胞(CD4和CD8簇)与先天性免疫系统之间的相互作用是导致排斥移植器官免疫应答的基础(图5)。获取和/或移植过程所致供体组织损伤必然导致供体组织抗原的释放,宿主先天性免疫系统细胞(包括树突状细胞)可借此获得这些外来抗原。此外,手术创伤还可造成局部炎性介质的释放,移植部位的树突状细胞亦会因此而被部分激活。静止的树突状细胞表达低水平的MHC-II类和B7协同刺激配体,但不表达白介素(IL)12这样的细胞介质。但是在树突状细胞被激活时,它们可产生较多的IL-12并表达更高的MHC-II类和B7分子。假如这些呈递外来MHC片段的、被部分激活的树突状细胞遇到具有对此MHC抗原特异性TCR的CD4 T细胞,那么这些抗原特异性T细胞将被激活。
, 百拇医药
静止的T细胞极少或不表达CD154,而激活的CD4 T细胞则快速增加CD154的表达。在这点上,一个正的增强环被建立。CD4 T细胞的CD154对树突状细胞的CD40起着配体的作用,反过来它又导致树突状细胞的进一步激活。完全激活的树突状细胞高度表达几种基因产物(即:MHC-I类和II类分子,B7协同刺激分子以及粘附分子)并产生更多的IL-12那样的炎性介质。根据Ridge61,Schoenberger62和Bennett等63的研究,Lanzavecchia将这种完全激活的树突状细胞描述为通过“杀伤执照”的细胞64,因为它能有效刺激被称做细胞毒素T淋巴细胞(CTLs)的CD8 T-细胞成熟,而CTLs则为整个抗移植物免疫应答必须的(图5)。
根据上述作用顺序,抗CD154可通过阻滞CD4 T-细胞进一步激活已部分激活的树突状细胞,在开始时,阻断渐次增强的激活序列,从而防止CTLs的成熟。尽管这个模式过于简化。例如,抗CD154在灵长动物可以阻断正在发生的排斥反应54。其他的研究亦报告抗CD154在实验动物能阻止正在进行的自身免疫综合征,即使是在疾病的晚期65,66。此外,此模式仅揭示了抗CD154的一个间接作用,即阻滞CD4 T细胞完全激活树突状细胞。然而,我们已发现一些抗CD154灭活CD4 T细胞的直接作用的证据(P.J.Blair,PhD.未发表资料.1999)。
, http://www.100md.com
移植的未来?
免疫抑制治疗的进步造就了器官移植,而器官移植又保护了成千上万的晚期疾病患者。然而,迄今对于作出许多贡献的免疫抑制剂来说,其作用已达到极限。较新的免疫抑制治疗方案虽使移植后并发症明显增加,但移植物和患者的生存却无进一步改善67,68。现代临床研究必须转向开发具有长期疗效的抗排斥疗法,并减少对全面免疫抑制的依赖。对T-细胞协同刺激的研究揭示了免疫系统以前被人们忽视的完美调节其活力的能力。利用这些调节机制,通过间断使用相对无毒的试剂达到持久的移植物无排斥生存是可行的。认真研究这些新试剂的临床试验已获批准,人们将以极大的兴趣期待他们的发现。
陈永亮 译 黄志强 校
JAMA 1999;282:1076~1082, 百拇医药