雷公藤甲素对体内外诱生TNF和IL-6的影响
作者:李玫 吴宗贵 秦永文 仲人前 张玲珍 李莉 马鹏程
单位:李玫(第二军医大学长征医院心血管内科,上海 200003);吴宗贵(第二军医大学长征医院心血管内科,上海 200003);秦永文(长海医院心血管内科);仲人前(长征医院实验诊断科);张玲珍(长征医院实验诊断科);李莉(长征医院实验诊断科);马鹏程(中国医学科学院协和医科大学皮肤病研究所)
关键词:雷公藤甲素;平滑肌细胞;肿瘤坏死因子;白细胞介素6
第二军医大学学报000317 【摘要】 目的:观察雷公藤甲素(T10)对肿瘤坏死因子(TNF)、白细胞介素6(IL-6)在平滑肌细胞(SMC)、腹腔巨噬细胞(MΦ)的分泌以及在小鼠体内诱生的影响。方法:体外主动脉SMC培养,腹腔注射给药及眼球摘除取血,细胞毒结晶紫染色法测定TNF,依赖细胞株MTT比色法测定IL-6。结果:T10注射浓度(0~0.375 mg/kg)与小鼠血清中TNF,IL-6水平呈显著负相关(P<0.01);腹腔MΦ培养上清中TNF及IL-6分泌与T10给药浓度(0~1.1 μmol/L)呈显著负相关(P<0.01);0.275 μmol/L T10对指数增殖期SMC自分泌及在脂多糖(LPS)、氧化修饰低密度脂蛋白胆固醇(oxLDL)刺激下分泌TNF,IL-6,TNF和IL-6的相互诱生亦有明显抑制(P<0.01)。结论:T10可以抑制TNF,IL-6的体内外诱生。
, http://www.100md.com
【中图分类号】 R 543.5; R 979.5 【文献标识码】 A 【文章编号】 0258-879X(2000)03-0254-03
Effects of triptolide on the release of TNF and IL-6 in vivo and in vitro
LI Mei WU Zong-Gui
(Department of Cardiovasology, Changzheng Hospital, Second Military Medical University, Shanghai 200003, China)
QIN Yong-Wen
(Department of Cardiovasology, Changhai Hospital)
, 百拇医药
ZHONG Ren-Qian ZHANG Ling-Zhen LI Li
(Department of Clinical Laboratories, Changzheng Hospital)
MA Peng-Cheng
(Institute of Dermatology, CAMS and PUMC)
【ABSTRACT】 Objective: To study the inhibitory effects of triptolide (T10) on the release of TNF and IL-6 in mice in vivo and from rabbit aorta smooth muscle cells (SMC) and mice peritoneal macrophages in vitro.Methods:Culture of aorta SMC in vitro,abdominal injection medication and drawing blood through ophthalmectomy,cytotoxic crystal violet staining for measurement of TNF, and dependent-cells MTT colorimetry for measurement of IL-6 were all performed.Results: The level of TNF and IL-6 in mice serum was negatively correlated with the injected dosage of T10 (0-0.375 mg/kg)(P<0.01).The level of TNF and IL-6 in culture medium was also negatively correlated with the dosage of T10 (0-1.1 μmol/L,P<0.01).The self-secretion and the release of TNF and IL-6 from exponential SMC induced by LPS and oxLDL and the interaction of TNF and IL-6 could be inhibited by T10 (P<0.01).Conclusion:T10 can inhibit the release of TNF and IL-6 both in vivo and in vitro.
, http://www.100md.com
【KEY WORDS】 triptolide; smooth muscle cells; tumor necrosis factor; interleukin-6▲
[Acad J Sec Mil Med Univ, 2000, 21(3): 254-256]
动脉粥样硬化(AS)的机制尚未完全阐明。近年研究提供大量证据表明炎症、免疫机制参与AS过程:在血管损伤部位的AS病灶中的细胞成份如内皮细胞(EC)、平滑肌细胞(SMC)、巨噬细胞(MΦ)和T淋巴细胞都具有免疫活性,通过合成、分泌细胞因子、生长因子参与AS的发生、发展,并影响其并发症的预后。本文研究具有抗炎、免疫抑制作用的单体雷公藤甲素(T10)对炎性细胞因子TNF,IL-6在体内外诱生的影响,探讨该类药物在冠心病防治中的潜在作用。
1 材料和方法
, 百拇医药
1.1 动物与试剂 健康纯种新西兰白兔5只,雄性,体质量1.5~2.0 kg。ICR昆明种小鼠40只,8~12周龄,体质量约30 g,雌雄兼用(第二军医大学实验动物中心提供)。细胞株:L929细胞株(第二军医大学微生物学教研室),B9细胞株(长征医院血液科)。T10(中国医学科学院协和医科大学皮肤病研究所,纯度>98%),RPMI 1640培养基(Gibco, US),抗肌动蛋白单克隆抗体、卡西霉素(A23187),LPS,LDL(溶于10 μmol/L CuSO4中,37℃温育24 h,制备成oxLDL[1])、放线菌素D(Sigma,US),rHu-TNF(日本Dainippon制药公司,活性为1×107 U/ml),rHu-IL-6(美国Genetics Institute,活性为5.9×104 U/ml),小牛血清(NCS:华美),卡介苗(BCG)(上海生物制品研究所)。
, http://www.100md.com
1.2 方法
1.2.1 体外诱生 (1)小鼠腹腔MΦ[2]:ICR小鼠10只颈椎脱位法处死,冷D-Hank液冲洗小鼠腹腔3次,合并冲洗液离心、洗涤,并除去红细胞。用含10%NCS RPMI 1640培养液调整细胞密度为106个/ml,以1 ml/孔加入24孔板,5% CO2培养箱中贴壁2 h,倾去上清液,洗涤后加入A23187 (1 mmol/L)继续培养6 h,然后每孔加入含有不同浓度T10(每种浓度设5个复孔)和LPS(100 ng/ml)的培养液,继续培养6 h,收集上清,-20℃冻存待测TNF;继续培养24 h,收集上清冻存待测IL-6。 不同处理方式对MΦ分泌TNF及IL-6的影响:①以0.275 μmol/L T10预处理MΦ 2 h,洗涤后再与LPS共育6 h或24 h;②将0.275 μmol/L T10与LPS加入MΦ培养液中共育6 h或24 h,分别收集培养上清待测TNF及IL-6。(2) 兔主动脉SMC:无菌分离兔主动脉中膜,组织贴块法原代和传代培养SMC,培养的细胞经形态学、抗肌动蛋白单抗免疫细胞化学染色证实为SMC,无内皮细胞、成纤维细胞污染。以含20% NCS RPMI 1640培养液培养的SMC为指数增殖期细胞,经0.5% NCS同步化培养的SMC为静止期细胞。实验采用传3~6代生长状态良好的SMC制成悬液,以3×104/孔接种到24孔板上,20% NCS培养液培养24 h后形成细胞单层,弃上清,加入含有T10和诱生剂(每种设3个复孔)的无血清培养液,继续培养24 h后,收集上清冻存待测。另取一组已形成单层的SMC以0.5% NCS同步化培养24 h后,无血清培养24 h,收集上清待测TNF及IL-6。
, 百拇医药
1.2.2 体内诱生[3] ICR小鼠20只随机分为对照组和3个实验组,均于腹腔注射BCG溶液0.2 ml(含BCG 7.5 mg),实验组于次日起连续6 d腹腔注射不同浓度T10溶液0.2 ml(给药浓度分别为0.125,0.25,0.375 mg/ml),对照组注射等量生理盐水。于第6天给药1 h后腹腔注射0.2 ml LPS溶液(含LPS 1 μg),90 min后摘除眼球收集血液,4℃放置过夜,离心取血清,56℃水浴灭活,冻存待测TNF及IL-6。
1.2.3 TNF,IL-6的生物活性测定 采用L929作为靶细胞的细胞毒结晶紫染色法测定TNF[4]。采用IL-6依赖性细胞株B9的MTT比色法测定IL-6的活性[5]。
1.3 统计学处理 数据以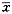 ±s表示,采用t检验、方差分析和直线相关分析。
±s表示,采用t检验、方差分析和直线相关分析。
, 百拇医药
2 结 果
2.1 T10体外抑制小鼠腹腔MΦ产生TNF及IL-6的量效关系 (1)T10对经A 23187启动后的LPS刺激的小鼠腹腔MΦ分泌TNF和IL-6均有抑制作用,且随T10浓度增加抑制作用增强。T10浓度与上清中TNF,IL-6的活性单位数间呈显著负相关(分别为r=-0.923 3,P<0.01;r=-0.931 7,P<0.01),见图1。(2)不同处理方式的影响:以0.275 μmol/L T10预处理MΦ 2 h,洗涤后再与LPS共育6 h或24 h后所得的TNF为(65.53±5.06) U,IL-6为 (57.67±5.53) U;而将0.275 μmol/L T10与LPS同时加入MΦ培养液共育6 h或24 h后,所得TNF为(57.93±4.40) U,IL-6为(41.55±5.60) U。两种处理方式均使TNF及IL-6水平下降,但后者作用更为明显,抑制程度更强(对TNF的抑制率分别为37.56%和44.81%;IL-6的抑制率分别为32.77%和41.55%)。
, http://www.100md.com
图1 T10体外抑制小鼠腹腔巨噬细胞产生TNF及
IL-6的量效关系
Fig 1 Dose-dependent effect of T10 on secretion
of TNF and IL-6 from mice peritoneal
macrophages in vitro
n=5; ○:TNF; ●: IL-6
2.2 T10对体外SMC产生TNF和IL-6的抑制作用 LPS 10 μg/ml,oxLDL 5 μg/ml和IL-6 20 U/ml或TNF 10 U/ml与指数生长期SMC共育24 h,均能不同程度地诱生TNF [(96.42±8.27) U, (72.56±7.37) U和(64.33±5.12) U] 和IL-6 [(76.38±8.36) U, (62.26±7.49) U和(83.32±9.11) U]。指数生长期SMC本身亦分泌少量TNF (6.43±2.16) U和IL-6 (25.00±4.45) U。加入0.275 μmol/L T10则能显著抑制TNF [(39.08±4.12) U, (23.54±3.57) U和(13.67±3.01) U]及IL-6 [(31.34±5.03) U, (26.37±4.21) U和(43.62±6.02) U]的分泌。静止期SMC的培养上清内未测到TNF及IL-6。
, 百拇医药
2.3 T10对LPS体内诱生TNF,IL-6的影响 ICR小鼠注射BCG后第7天再注射LPS,90 min后血清中出现高水平的TNF及IL-6活性。但是,若在注射LPS之前,连续6 d给小鼠腹腔内注射不同浓度的T10(0.125,0.25,0.375 mg/kg),于末次给药后1 h再注射LPS,90 min后取血,则小鼠血清中TNF及IL-6水平均显著降低,T10浓度与血清中TNF及IL-6水平呈显著负相关(分别为r=-0.987 4,P<0.01;r=-0.973 1,P<0.01),见图2。
图2 T10抑制LPS对TNF,IL-6的体内诱生
Fig 2 Inhibition of T10 on the secretion of TNF
, 百拇医药
and IL-6 induced by LPS in vivo
n=5; ○:TNF; ●:IL-6
3 讨 论
本研究中曾将T10以不同浓度直接加在培养液中观察其对L929细胞和B9细胞的直接作用。发现当所加的药物浓度与所稀释的待测上清中所含T10的最高浓度相同时,对这些细胞株的生长既无抑制也无促进作用。因此,培养上清中残留的药物对细胞因子的测定无直接影响。近年来的研究证实,粥样硬化动脉壁有单核-MΦ和T淋巴细胞浸润,细胞因子表达增加[6]。血管壁损伤部位的细胞既是细胞因子的来源,又是它们作用的靶细胞,而炎性细胞因子如TNF和IL-6是炎症和免疫反应的介质,也是细胞之间相互作用的媒介,它们的作用呈“网络效应”,共同调节血管壁细胞的损伤反应,影响AS发生发展,在维持和放大炎性增殖反应中起着重要的作用。因此,减少局部炎症免疫反应、阻断炎性介质网在AS的防治中具有积极的意义。
, http://www.100md.com
T10是雷公藤的主要活性成份之一,属活性最高的环氧化二萜内酯化合物,先前的研究表明该类化合物具有抗炎、免疫抑制和抗增殖作用[7]。本研究发现,T10对LPS在小鼠体内外诱生TNF和IL-6,对指数生长期SMC自分泌及经LPS,oxLDL刺激分泌TNF和IL-6,TNF与IL-6的相互诱生均有明显抑制作用。T10的作用机制尚待进一步研究,可能与抑制细胞生长、减少细胞合成分泌细胞因子、降低机体和细胞对刺激的反应性有关。通过MΦ不同处理方式比较作用2 h后除去T10的后续作用与T10持续作用的差异,结果表明处理2 h后即使去除T10,对经LPS刺激的MΦ生成TNF,IL-6仍有抑制作用,但持续作用时抑制程度更明显。提示延长作用时间可加强其对细胞因子生成的抑制。本研究为从抗炎、抑制免疫,阻断炎性介质网络角度防治AS,以及开发T10的临床应用提供了理论基础。■
, http://www.100md.com 基金项目:国家自然科学基金资助项目(39670316)
作者简介:李玫(1971-),女(汉族),硕士,住院医师
【参 考 文 献】
[1] Jovinge S, Ares MP, Kallin B, et al. Human monocytes/macrophages release TNF-α in response to ox-LDL[J]. Arterioscler Thromb Vasc Biol, 1996,16(12):1573-1579.
[2] Fang J, Zheng QY, Wang HB. Effects of esculentoside A on tumor necrosis factor production by mice peritoneal macrophages[J]. Mediators Inflam, 1992,1:6375-6377.
, 百拇医药
[3] Engelberts I, von Asmuth EJ, van-der Linden CJ, et al. The interrelation between TNF, IL-6, and PAF secretion induced by LPS in vivo and in vitro murine model[J]. Lymphokine Cytokine Res, 1991,10(1-2):127-131.
[4] Jeffes EW 3d, Schmitz K, Yamamoto R, et al. A simple nonisotopic in vitro bioassay for LT and TNF employing sodium fluoride-treated L929 target cells that detects picogram quantity of LT and TNF is as sensitive as TNF assays done with ELISA methodology[J]. Lymphokine Cytokine Res, 1991,10(1-2):147-151.
, 百拇医药
[5] 侯 建. 四甲基偶氮唑蓝比色法检测人血清白细胞介素6[J]. 中华医学检验杂志,1993,16(4):208-210.
[6] Kishikawa H, Shimokama T, Watanabe T. Localization of T lymphocytes and macrophages expressing IL-1, IL-2 receptor, IL-6 and TNF in human aortic intima. Role of cell-mediated immunity in human atherogenesis[J]. Virchows Arch A Pathol Anat Histopathol, 1993,423(6):433-442.
[7] 岗艳云,张正行. 雷公藤及其单体的药理作用研究进展[J]. 中国药科大学学报,1995,26(4):252-256.
【收稿日期】 1999-08-11
【修回日期】 1999-12-20, 百拇医药
单位:李玫(第二军医大学长征医院心血管内科,上海 200003);吴宗贵(第二军医大学长征医院心血管内科,上海 200003);秦永文(长海医院心血管内科);仲人前(长征医院实验诊断科);张玲珍(长征医院实验诊断科);李莉(长征医院实验诊断科);马鹏程(中国医学科学院协和医科大学皮肤病研究所)
关键词:雷公藤甲素;平滑肌细胞;肿瘤坏死因子;白细胞介素6
第二军医大学学报000317 【摘要】 目的:观察雷公藤甲素(T10)对肿瘤坏死因子(TNF)、白细胞介素6(IL-6)在平滑肌细胞(SMC)、腹腔巨噬细胞(MΦ)的分泌以及在小鼠体内诱生的影响。方法:体外主动脉SMC培养,腹腔注射给药及眼球摘除取血,细胞毒结晶紫染色法测定TNF,依赖细胞株MTT比色法测定IL-6。结果:T10注射浓度(0~0.375 mg/kg)与小鼠血清中TNF,IL-6水平呈显著负相关(P<0.01);腹腔MΦ培养上清中TNF及IL-6分泌与T10给药浓度(0~1.1 μmol/L)呈显著负相关(P<0.01);0.275 μmol/L T10对指数增殖期SMC自分泌及在脂多糖(LPS)、氧化修饰低密度脂蛋白胆固醇(oxLDL)刺激下分泌TNF,IL-6,TNF和IL-6的相互诱生亦有明显抑制(P<0.01)。结论:T10可以抑制TNF,IL-6的体内外诱生。
, http://www.100md.com
【中图分类号】 R 543.5; R 979.5 【文献标识码】 A 【文章编号】 0258-879X(2000)03-0254-03
Effects of triptolide on the release of TNF and IL-6 in vivo and in vitro
LI Mei WU Zong-Gui
(Department of Cardiovasology, Changzheng Hospital, Second Military Medical University, Shanghai 200003, China)
QIN Yong-Wen
(Department of Cardiovasology, Changhai Hospital)
, 百拇医药
ZHONG Ren-Qian ZHANG Ling-Zhen LI Li
(Department of Clinical Laboratories, Changzheng Hospital)
MA Peng-Cheng
(Institute of Dermatology, CAMS and PUMC)
【ABSTRACT】 Objective: To study the inhibitory effects of triptolide (T10) on the release of TNF and IL-6 in mice in vivo and from rabbit aorta smooth muscle cells (SMC) and mice peritoneal macrophages in vitro.Methods:Culture of aorta SMC in vitro,abdominal injection medication and drawing blood through ophthalmectomy,cytotoxic crystal violet staining for measurement of TNF, and dependent-cells MTT colorimetry for measurement of IL-6 were all performed.Results: The level of TNF and IL-6 in mice serum was negatively correlated with the injected dosage of T10 (0-0.375 mg/kg)(P<0.01).The level of TNF and IL-6 in culture medium was also negatively correlated with the dosage of T10 (0-1.1 μmol/L,P<0.01).The self-secretion and the release of TNF and IL-6 from exponential SMC induced by LPS and oxLDL and the interaction of TNF and IL-6 could be inhibited by T10 (P<0.01).Conclusion:T10 can inhibit the release of TNF and IL-6 both in vivo and in vitro.
, http://www.100md.com
【KEY WORDS】 triptolide; smooth muscle cells; tumor necrosis factor; interleukin-6▲
[Acad J Sec Mil Med Univ, 2000, 21(3): 254-256]
动脉粥样硬化(AS)的机制尚未完全阐明。近年研究提供大量证据表明炎症、免疫机制参与AS过程:在血管损伤部位的AS病灶中的细胞成份如内皮细胞(EC)、平滑肌细胞(SMC)、巨噬细胞(MΦ)和T淋巴细胞都具有免疫活性,通过合成、分泌细胞因子、生长因子参与AS的发生、发展,并影响其并发症的预后。本文研究具有抗炎、免疫抑制作用的单体雷公藤甲素(T10)对炎性细胞因子TNF,IL-6在体内外诱生的影响,探讨该类药物在冠心病防治中的潜在作用。
1 材料和方法
, 百拇医药
1.1 动物与试剂 健康纯种新西兰白兔5只,雄性,体质量1.5~2.0 kg。ICR昆明种小鼠40只,8~12周龄,体质量约30 g,雌雄兼用(第二军医大学实验动物中心提供)。细胞株:L929细胞株(第二军医大学微生物学教研室),B9细胞株(长征医院血液科)。T10(中国医学科学院协和医科大学皮肤病研究所,纯度>98%),RPMI 1640培养基(Gibco, US),抗肌动蛋白单克隆抗体、卡西霉素(A23187),LPS,LDL(溶于10 μmol/L CuSO4中,37℃温育24 h,制备成oxLDL[1])、放线菌素D(Sigma,US),rHu-TNF(日本Dainippon制药公司,活性为1×107 U/ml),rHu-IL-6(美国Genetics Institute,活性为5.9×104 U/ml),小牛血清(NCS:华美),卡介苗(BCG)(上海生物制品研究所)。
, http://www.100md.com
1.2 方法
1.2.1 体外诱生 (1)小鼠腹腔MΦ[2]:ICR小鼠10只颈椎脱位法处死,冷D-Hank液冲洗小鼠腹腔3次,合并冲洗液离心、洗涤,并除去红细胞。用含10%NCS RPMI 1640培养液调整细胞密度为106个/ml,以1 ml/孔加入24孔板,5% CO2培养箱中贴壁2 h,倾去上清液,洗涤后加入A23187 (1 mmol/L)继续培养6 h,然后每孔加入含有不同浓度T10(每种浓度设5个复孔)和LPS(100 ng/ml)的培养液,继续培养6 h,收集上清,-20℃冻存待测TNF;继续培养24 h,收集上清冻存待测IL-6。 不同处理方式对MΦ分泌TNF及IL-6的影响:①以0.275 μmol/L T10预处理MΦ 2 h,洗涤后再与LPS共育6 h或24 h;②将0.275 μmol/L T10与LPS加入MΦ培养液中共育6 h或24 h,分别收集培养上清待测TNF及IL-6。(2) 兔主动脉SMC:无菌分离兔主动脉中膜,组织贴块法原代和传代培养SMC,培养的细胞经形态学、抗肌动蛋白单抗免疫细胞化学染色证实为SMC,无内皮细胞、成纤维细胞污染。以含20% NCS RPMI 1640培养液培养的SMC为指数增殖期细胞,经0.5% NCS同步化培养的SMC为静止期细胞。实验采用传3~6代生长状态良好的SMC制成悬液,以3×104/孔接种到24孔板上,20% NCS培养液培养24 h后形成细胞单层,弃上清,加入含有T10和诱生剂(每种设3个复孔)的无血清培养液,继续培养24 h后,收集上清冻存待测。另取一组已形成单层的SMC以0.5% NCS同步化培养24 h后,无血清培养24 h,收集上清待测TNF及IL-6。
, 百拇医药
1.2.2 体内诱生[3] ICR小鼠20只随机分为对照组和3个实验组,均于腹腔注射BCG溶液0.2 ml(含BCG 7.5 mg),实验组于次日起连续6 d腹腔注射不同浓度T10溶液0.2 ml(给药浓度分别为0.125,0.25,0.375 mg/ml),对照组注射等量生理盐水。于第6天给药1 h后腹腔注射0.2 ml LPS溶液(含LPS 1 μg),90 min后摘除眼球收集血液,4℃放置过夜,离心取血清,56℃水浴灭活,冻存待测TNF及IL-6。
1.2.3 TNF,IL-6的生物活性测定 采用L929作为靶细胞的细胞毒结晶紫染色法测定TNF[4]。采用IL-6依赖性细胞株B9的MTT比色法测定IL-6的活性[5]。
1.3 统计学处理 数据以
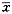 ±s表示,采用t检验、方差分析和直线相关分析。
±s表示,采用t检验、方差分析和直线相关分析。, 百拇医药
2 结 果
2.1 T10体外抑制小鼠腹腔MΦ产生TNF及IL-6的量效关系 (1)T10对经A 23187启动后的LPS刺激的小鼠腹腔MΦ分泌TNF和IL-6均有抑制作用,且随T10浓度增加抑制作用增强。T10浓度与上清中TNF,IL-6的活性单位数间呈显著负相关(分别为r=-0.923 3,P<0.01;r=-0.931 7,P<0.01),见图1。(2)不同处理方式的影响:以0.275 μmol/L T10预处理MΦ 2 h,洗涤后再与LPS共育6 h或24 h后所得的TNF为(65.53±5.06) U,IL-6为 (57.67±5.53) U;而将0.275 μmol/L T10与LPS同时加入MΦ培养液共育6 h或24 h后,所得TNF为(57.93±4.40) U,IL-6为(41.55±5.60) U。两种处理方式均使TNF及IL-6水平下降,但后者作用更为明显,抑制程度更强(对TNF的抑制率分别为37.56%和44.81%;IL-6的抑制率分别为32.77%和41.55%)。

, http://www.100md.com
图1 T10体外抑制小鼠腹腔巨噬细胞产生TNF及
IL-6的量效关系
Fig 1 Dose-dependent effect of T10 on secretion
of TNF and IL-6 from mice peritoneal
macrophages in vitro
n=5; ○:TNF; ●: IL-6
2.2 T10对体外SMC产生TNF和IL-6的抑制作用 LPS 10 μg/ml,oxLDL 5 μg/ml和IL-6 20 U/ml或TNF 10 U/ml与指数生长期SMC共育24 h,均能不同程度地诱生TNF [(96.42±8.27) U, (72.56±7.37) U和(64.33±5.12) U] 和IL-6 [(76.38±8.36) U, (62.26±7.49) U和(83.32±9.11) U]。指数生长期SMC本身亦分泌少量TNF (6.43±2.16) U和IL-6 (25.00±4.45) U。加入0.275 μmol/L T10则能显著抑制TNF [(39.08±4.12) U, (23.54±3.57) U和(13.67±3.01) U]及IL-6 [(31.34±5.03) U, (26.37±4.21) U和(43.62±6.02) U]的分泌。静止期SMC的培养上清内未测到TNF及IL-6。
, 百拇医药
2.3 T10对LPS体内诱生TNF,IL-6的影响 ICR小鼠注射BCG后第7天再注射LPS,90 min后血清中出现高水平的TNF及IL-6活性。但是,若在注射LPS之前,连续6 d给小鼠腹腔内注射不同浓度的T10(0.125,0.25,0.375 mg/kg),于末次给药后1 h再注射LPS,90 min后取血,则小鼠血清中TNF及IL-6水平均显著降低,T10浓度与血清中TNF及IL-6水平呈显著负相关(分别为r=-0.987 4,P<0.01;r=-0.973 1,P<0.01),见图2。

图2 T10抑制LPS对TNF,IL-6的体内诱生
Fig 2 Inhibition of T10 on the secretion of TNF
, 百拇医药
and IL-6 induced by LPS in vivo
n=5; ○:TNF; ●:IL-6
3 讨 论
本研究中曾将T10以不同浓度直接加在培养液中观察其对L929细胞和B9细胞的直接作用。发现当所加的药物浓度与所稀释的待测上清中所含T10的最高浓度相同时,对这些细胞株的生长既无抑制也无促进作用。因此,培养上清中残留的药物对细胞因子的测定无直接影响。近年来的研究证实,粥样硬化动脉壁有单核-MΦ和T淋巴细胞浸润,细胞因子表达增加[6]。血管壁损伤部位的细胞既是细胞因子的来源,又是它们作用的靶细胞,而炎性细胞因子如TNF和IL-6是炎症和免疫反应的介质,也是细胞之间相互作用的媒介,它们的作用呈“网络效应”,共同调节血管壁细胞的损伤反应,影响AS发生发展,在维持和放大炎性增殖反应中起着重要的作用。因此,减少局部炎症免疫反应、阻断炎性介质网在AS的防治中具有积极的意义。
, http://www.100md.com
T10是雷公藤的主要活性成份之一,属活性最高的环氧化二萜内酯化合物,先前的研究表明该类化合物具有抗炎、免疫抑制和抗增殖作用[7]。本研究发现,T10对LPS在小鼠体内外诱生TNF和IL-6,对指数生长期SMC自分泌及经LPS,oxLDL刺激分泌TNF和IL-6,TNF与IL-6的相互诱生均有明显抑制作用。T10的作用机制尚待进一步研究,可能与抑制细胞生长、减少细胞合成分泌细胞因子、降低机体和细胞对刺激的反应性有关。通过MΦ不同处理方式比较作用2 h后除去T10的后续作用与T10持续作用的差异,结果表明处理2 h后即使去除T10,对经LPS刺激的MΦ生成TNF,IL-6仍有抑制作用,但持续作用时抑制程度更明显。提示延长作用时间可加强其对细胞因子生成的抑制。本研究为从抗炎、抑制免疫,阻断炎性介质网络角度防治AS,以及开发T10的临床应用提供了理论基础。■
, http://www.100md.com 基金项目:国家自然科学基金资助项目(39670316)
作者简介:李玫(1971-),女(汉族),硕士,住院医师
【参 考 文 献】
[1] Jovinge S, Ares MP, Kallin B, et al. Human monocytes/macrophages release TNF-α in response to ox-LDL[J]. Arterioscler Thromb Vasc Biol, 1996,16(12):1573-1579.
[2] Fang J, Zheng QY, Wang HB. Effects of esculentoside A on tumor necrosis factor production by mice peritoneal macrophages[J]. Mediators Inflam, 1992,1:6375-6377.
, 百拇医药
[3] Engelberts I, von Asmuth EJ, van-der Linden CJ, et al. The interrelation between TNF, IL-6, and PAF secretion induced by LPS in vivo and in vitro murine model[J]. Lymphokine Cytokine Res, 1991,10(1-2):127-131.
[4] Jeffes EW 3d, Schmitz K, Yamamoto R, et al. A simple nonisotopic in vitro bioassay for LT and TNF employing sodium fluoride-treated L929 target cells that detects picogram quantity of LT and TNF is as sensitive as TNF assays done with ELISA methodology[J]. Lymphokine Cytokine Res, 1991,10(1-2):147-151.
, 百拇医药
[5] 侯 建. 四甲基偶氮唑蓝比色法检测人血清白细胞介素6[J]. 中华医学检验杂志,1993,16(4):208-210.
[6] Kishikawa H, Shimokama T, Watanabe T. Localization of T lymphocytes and macrophages expressing IL-1, IL-2 receptor, IL-6 and TNF in human aortic intima. Role of cell-mediated immunity in human atherogenesis[J]. Virchows Arch A Pathol Anat Histopathol, 1993,423(6):433-442.
[7] 岗艳云,张正行. 雷公藤及其单体的药理作用研究进展[J]. 中国药科大学学报,1995,26(4):252-256.
【收稿日期】 1999-08-11
【修回日期】 1999-12-20, 百拇医药