锌对新生大鼠海马神经元bcl-2 mRNA表达的影响
作者:王福俤 赵法
单位:王福俤(第二军医大学海军医学系军队卫生学教研室,上海 200433);赵法(第二军医大学海军医学系军队卫生学教研室,上海 200433)
关键词:锌;海马神经元;基因,bcl-2;凋亡
第二军医大学学报000308 【摘要】 目的:观察微量元素锌对新生大鼠海马神经元细胞凋亡抑制基因bcl-2 mRNA表达的影响,探讨锌影响中枢神经系统发育的分子机制。方法:采用无血清培养Wistar新生大鼠海马神经元细胞,分别在无血清培养液中加入不同浓度的ZnSO4溶液培养7 d,采用图像分析技术分析其生长分化情况;收集海马神经元细胞,利用Northern 杂交技术检测海马神经元bcl-2 mRNA表达情况。结果:锌在0.5~4 mg/L浓度时,海马神经元胞体面积、长径、短径以及bcl-2 mRNA表达水平均明显高于对照组。结论:锌可通过提高bcl-2 mRNA转录水平抑制海马神经元细胞凋亡、促进神经元生长发育。
, http://www.100md.com
【中图分类号】 R 591.1 【文献标识码】 A 【文章编号】 0258-879X(2000)03-0222-04
Effect of zinc on expression of bcl-2 mRNA in new born rat hippocampal neurons
WANG Fu-Di ZHAO Fa-Ji
(Department of Military Hygiene, Faculty of Navy Medicine, Second Military Medical University, Shanghai 200433, China)
【ABSTRACT】 Objective:To determine the molecular mechanisms of zinc effect on the central nervous system development and function, we observed the expression of bcl-2 mRNA in hippocampal neurons, which was an apoptosis inhibitory proto-oncogene. Methods:The new born hippocampal neurons were cultured in serum free medium with different zinc level for 7 days. And then we used image analytical system to analyze the soma area, body maximum and minimum diameter of hippocampal neurons, and used Northern blot method to examine bcl-2 mRNA expression of hippocampal neurons respectively. Results:The results showed that the diameter and volume of supplemented zinc neurons (0.5, 1.0 and 4.0 mg/L) were greater than those in no-zinc supplemented neurons (control group). The bcl-2 mRNA expression of cultured hippocampal neurons in medium with zinc in 0.5, 1.0 and 4.0 mg/L was higher than that in control group respectively. Conclusion:The results suggest that zinc can inhibit the apoptosis and promote the development of neurons by increasing bcl-2 transcription level.
, 百拇医药
【KEY WORDS】 zinc; hippocampal neurons; genes, bcl-2; apoptosis▲
[Acad J Sec Mil Med Univ, 2000, 21(3): 222-225]
微量元素锌为人体必需微量元素之一,与脑发育及其功能密切相关。发育期即孕期或哺乳期锌缺乏可引起脑结构及功能明显受损,甚至可导致大脑的先天性畸形[1,2]。王福庄等[3]发现锌对体外培养的新生大鼠海马神经元生长发育有明显的促进作用,但锌影响中枢神经系统(CNS)或神经元生长发育的机制至今还不十分清楚。细胞凋亡是一种不同于细胞死亡的主动性细胞死亡机制,被认为是与有丝分裂功能相反的调节细胞群体的方式,与正常组织的群体力学、胚胎发育、细胞免疫等密切相关。细胞凋亡不仅存在于正常生理状态下,在CNS发育过程中也存在[4];并且神经细胞凋亡与许多神经系统疾病如Parkinson病密切相关[5]。目前已发现多种基因编码的产物参与细胞凋亡的发生与调控,其中就有bcl-2家族基因,包括bcl-2,bcl-x,bax,bad,bak,mcl-1和A1等。而原癌基因bcl-2是调节细胞凋亡最基本的成员,被认为是能特异地抑制细胞凋亡发生的“抗凋亡基因”[6,7]。为了进一步探讨锌与CNS发育的关系、明确锌与神经元bcl-2的联系,我们在体外观察了锌对海马神经元bcl-2 mRNA表达的影响。
, http://www.100md.com
1 材料和方法
1.1 种植培养液组成及无血清饲养培养液 种植培养液组成为80% DMEM培养基(Gibco公司产品)、10%小牛血清、10%马血清、L-谷氨酰胺 100 mg/L、脱氧核糖核酸酶Ⅰ 40 mg/L;无血清饲养培养液组成为99% DMEM,谷氨酰胺 100 mg/L,1% N3组合液。N3组合液组成为:胰岛素 10 μg/ml、转铁蛋白 200 μg/ml、腐胺 200 μmol/L、亚硒酸钠 60 nmol/L、皮质酮 40 μg/ml、三碘甲腺原氨酸 20 μg/ml、黄体酮 40 nmol/L及 0.001%牛血清白蛋白。HEPES、马血清、脱氧核糖核酸酶Ⅰ及胰蛋白酶均为 Sigma公司产品,L-谷氨酰胺及小牛血清为华美公司产品。
1.2 实验组培养液组成 实验分5组,即配制5种培养液。对照组(control):对照组培养液即为无血清饲养培养液;其他实验组分别在对照组培养液中加入ZnSO4.7H2O溶液,使其锌水平分别达到:0.25 mg/L(低锌组)、0.5 mg/L(中锌组)、1.0 mg/L(高锌组)及4.0 mg/L(过锌组)。
, 百拇医药
1.3 海马神经元的体外培养 按王福庄[3,8]等报道的海马神经元无血清培养法进行培养。取当日出生的Wistar大鼠,在无菌条件下断头、取脑,分离出双侧海马,置于含0.125%胰蛋白酶消化液(pH 7.2)中,在37℃,10% CO2条件下孵育30 min,用种植培养液终止消化,将消化后的组织移入离心管中,加入2 ml种植培养液,用细口径滴管吹打数次,以促进神经元细胞离解。静置2~3 min,吸出上层细胞悬液,以种植培养液稀释成0.5×106个/ml细胞密度, 接种于涂有小牛皮胶的35 mm塑料培养皿中,每皿2 ml。置培养皿于36℃,10% CO2培养箱中。24 h后倾去培养皿中种植培养液,分别改用无血清饲养培养液(包括对照组和实验组)进行培养。第3天换液,更换一半新鲜饲养培养液。对培养7 d的海马神经元进行有关指标检测。
1.4 神经元胞体、面积及直径的测量 取培养7 d的海马神经元,采用ABC法对神经特异性烯醇化酶(NSE)进行免疫组化染色,神经细胞染成棕褐色,在图像分析仪上测量神经元胞体面积、长径和短径。以 ±s表示,采用方差分析进行统计学分析。
±s表示,采用方差分析进行统计学分析。
, 百拇医药
1.5 海马神经元bcl-2 mRNA的检测 采用Northern blot技术进行检测。根据bcl-2 cDNA序列设计合成探针[9],其寡聚核苷酸顺序为5′-CACTG AATGC TCTCC GGTAC CGCAG TTCAA ACTCA TCGCC-3′。将探针寡聚核苷酸溶液稀释至10 μg/μl;取5 μl探针溶液,加入水至9 μl,沸水浴5 min,冰浴中变性5 min;按宝丽曼公司Random Primer Labelling Kit试剂盒加入2 μl反应缓冲液、3×1 μl dNTP(C,G,T),5 μl α-32P-dATP及1 μl Klenow;37℃保温35 min;利用Sephadex-G50柱分离探针(1×TE洗脱),并在液闪仪上测CPM计数。采取常规方法抽提培养的海马神经元总RNA、RNA变性电泳、转膜过夜(硝酸纤维素膜,Amersham公司产品)、淋洗、预杂交、杂交、压片(-80℃ 72 h)、冲洗X线片。对X线片进行密度扫描。
2 结 果
, http://www.100md.com
2.1 锌对海马神经元胞体面积、最大长径及最小短径的影响 由表1可见,除低浓度组(0.25 mg/L)外,其他实验组海马神经元胞体面积、最大长径及最小短径均明显大于对照组,且具有统计学意义。其中以1.0 mg/L组海马神经元胞体面积、最大长径及最小短径为最大,提示在1.0 mg/L浓度时可最大限度促进神经元生长发育,并非锌的浓度越高(4.0 mg/L)越能促进细胞生长。
表1 锌对海马神经元胞体面积、最大长径及最小短径的影响
Tab 1 Effect of zinc on soma area, body maximum
and minimum diameter(n=20, ±s) Group
±s) Group
Soma
, 百拇医药
area
(A/μm2)
Maximum
diameter
(d/μm)
Minimum
diameter
(d/μm)
Control
65.36±13.74
11.4±1.7
4.7±0.8
, http://www.100md.com
Zinc(ρB/mg.L-1)
0.25
66.18±12.31
11.3±1.7
4.7±0.6
0.5
74.38±10.25*
12.3±1.5**
4.8±0.6
1.0
, 百拇医药
82.51±15.92**
14.3±2.3**
5.6±0.7**
4.0
76.32±12.49*
13.2±2.0**
5.1±0.7**
*P<0.05, **P<0.01 compared with control group
2.2 锌对海马神经元bcl-2 mRNA表达的影响 由图1可见,体外培养的大鼠海马神经元中存在bcl-2 mRNA表达。比较不同锌浓度组海马神经元bcl-2 mRNA杂交信号强弱,发现1 mg/L组杂交信号最强,而低锌组(0.25 mg/L)和对照组杂交信号最低,杂交强度仅为1 mg/L组的28.0%和24.1%;中度锌浓度组(0.5 mg/L)和过高锌浓度组(4 mg/L)杂交信号虽明显强于对照组和0.25 mg/L组,但却明显弱于1 mg/L组;0.5 mg/L组和4 mg/L组杂交强度分别仅为1 mg/L组的52.3%和61.7%。研究结果提示一定浓度的锌可促进海马神经元bcl-2 mRNA的表达;低浓度锌(0.25 mg/L)不能引起bcl-2表达变化,但过高浓度的锌(4 mg/L)同样也不能最大程度地促进bcl-2 mRNA表达。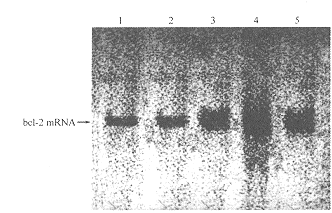
, 百拇医药
图1 锌对海马神经元bcl-2 mRNA表达的影响
Fig 1 Effect of zinc on bcl-2 mRNA expression
of hippocampal neurons
Samples were prepared from hippocampal neurons of control group (lane 1), 0.25 mg/L zine group (lane 2), 0.5 mg/L zinc group (lane 3), 1.0 mg/L zinc group (lane 4) and 4.0 mg/L zinc group (lane 5) respectively
3 讨 论
微量元素锌为人体必需微量元素,细胞内锌在一定浓度下可以抑制细胞凋亡,而锌浓度过低则促进细胞凋亡发生[10]。发育期锌缺乏可引起动物脑功能明显受损,严重缺锌时还会导致大脑的先天性畸形[1,2]。这些病理变化可能与低锌引发神经细胞凋亡有一定关系。为了验证该设想我们最近进行一项实验发现,发育期锌缺乏小鼠脑组织bcl-2 mRNA表达下降(待发表),提示锌缺乏引发的脑功能损伤与脑组织bcl-2 mRNA表达水平低下存在密切联系。本实验研究发现锌可促进体外培养的海马神经元生长发育及bcl-2 mRNA表达,提示锌离子可直接调控bcl-2基因表达,并可能通过提高bcl-2 mRNA表达水平来抑制细胞凋亡。王福庄等[3]发现锌对体外培养的新生大鼠海马神经元生长发育有明显的促进作用。提高bcl-2 mRNA表达水平可能是锌促进CNS或神经元生长发育的一个重要机制。
, 百拇医药
原癌基因bcl-2是调节细胞凋亡最基本的成员,被认为是能特异地抑制细胞凋亡发生的“抗凋亡基因”[6,7]。bcl-2主要在血液、淋巴系统中表达,也在一些非淋巴组织中表达,如在许多有丝分裂的组织,主要包括发育中和成熟分裂后的神经细胞均可表达此蛋白。bcl-2作为细胞凋亡调节网络中最重要的基因,影响或被影响着其他细胞凋亡相关基因、分子,如TGFβ,Hsp70,ICE,Myc及p53等。bcl-2表达具有多种生理活性,它可以阻止或降低射线、自由基、化学药物等引起的细胞凋亡,对氧化损伤造成的细胞凋亡具有肯定的抑制作用[11]。以往大量研究资料提示bcl-2的抗细胞凋亡机制可能包括[12]:(1)bcl-2作为一种抗氧化剂,调节细胞的氧化还原状态而抑制细胞凋亡的发生;(2) 通过直接或间接地影响内质网中Ca2+释放而实现抑制或调节细胞凋亡的发生;(3) bcl-2家族基因之间通过BH1和BH2高度保守同源区形成同源或异源二聚体,调节相互活性,对细胞存亡产生不同的效应。另外,bcl-2的作用也可能涉及到核孔复合物的信号转导等。锌促进神经元bcl-2 mRNA表达水平,bcl-2基因再通过以上复杂机制调节细胞凋亡过程。目前一些实验还发现细胞中过多表达Cu-Zn SOD,对培养的神经细胞株和原代神经元凋亡均有抑制作用[13]。锌元素具有广泛的生理功能,它是Cu-Zn SOD正常组分之一,可促进Cu-Zn SOD的表达。可见锌调控神经细胞凋亡不但与bcl-2表达有关,还与Cu-Zn SOD表达变化有关。虽然调控bcl-2表达并不是锌影响神经细胞凋亡的唯一途径,但从我们的研究资料可以认为bcl-2表达变化是锌影响神经元凋亡的重要机制之一,锌调控bcl-2的详细机制还有待进一步实验研究。
, http://www.100md.com
致谢 本工作得到第二军医大学军队卫生学教研室全体老师及研究生的大力协助,在此表示衷心感谢。■
基金项目:国家自然科学基金资助项目(39770643,39970641);全军“九五”青年基金项目(98Q1043)
作者简介:王福俤(1968-),男(汉族),博士,讲师
【参 考 文 献】
[1] 王福俤, 赵法,郭俊生. 锌缺乏对小鼠脑发育及功能影响的实验研究[J]. 第二军医大学学报,2000,21(1):38-41.
[2] 王福俤, 赵法, 郭俊生,等.发育期锌缺乏对行为学的影响[J]. 国外医学.卫生学分册,1997,24(4):231-233.
, 百拇医药
[3] 王福庄, 丁爱石, 魏 文, 等. 锌对新生大鼠海马培养神经元生长发育的作用[J]. 营养学报, 1995,17(4):357-362.
[4] Hengartner MO, Ellis RE, Horvitz HR. Caenorhabditis elegans gene ced-9 protects cells from programmed cell death[J]. Nature, 1992,356(6369):494-499.
[5] Marshall KA, Daniel SE, Cairns N, et al. Upregulation of the anti-apoptotic protein bcl-2 may be an early event in neurodegeneration: studies on Parkinson′s incidental Lewy body disease[J]. Biochem Biophys Res Commun, 1997,240(1):84-87.
, 百拇医药
[6] Mah SP, Zhong LT, Liu Y, et al. The protooncogene bcl-2 inhibits apoptosis in PC12 cells[J]. J Neurochem, 1993,60(3):1183-1186.
[7] Garcia I, Martinou I, Tsujimoto Y, et al. Prevention of programmed cell death of sympathetic neurons by the bcl-2 proto-oncogene[J]. Science, 1992,258(5080):302-304.
[8] 丁爱石, 王福庄. 新生大鼠海马神经元在无血清培养液中的生长特性[J]. 细胞生物学杂志, 1993,15(2):88-90.
[9] Chen J, Graham SH, Nakayama M, et al. Apoptosis repressor genes bcl-2 and bcl-x-long are expressed in the rat brain following global ischemia[J]. J Cereb Blood Flow Metab,1997,17(1):2-10.
, 百拇医药
[10] Sunderman FW Jn. The influence of zinc on apoptosis[J]. Ann Clin Lab Sci, 1995,25(2):134-142.
[11] Hochenbery DM, Oltval ZN, Milliman CL. Bcl-2 functions in an antioxidant pathway to prevent apoptosis[J]. Cell, 1993,75(2):241-245.
[12] 叶建锋,舒斯云,包新民. 原癌基因bcl-2与神经组织程序化细胞死亡[J]. 中国神经科学杂志, 1998,14(1):53-58.
[13] Greenlund LJS, Deckwerth TL, Johnson EM Jr. Superoxide dismutase delays neuronal apoptosis: a role reactive oxygen species in programmed neuronal death[J]. Neuron, 1995,14(2):303-315.
【收稿日期】 1999-10-28
【修回日期】 1999-12-30, 百拇医药
单位:王福俤(第二军医大学海军医学系军队卫生学教研室,上海 200433);赵法(第二军医大学海军医学系军队卫生学教研室,上海 200433)
关键词:锌;海马神经元;基因,bcl-2;凋亡
第二军医大学学报000308 【摘要】 目的:观察微量元素锌对新生大鼠海马神经元细胞凋亡抑制基因bcl-2 mRNA表达的影响,探讨锌影响中枢神经系统发育的分子机制。方法:采用无血清培养Wistar新生大鼠海马神经元细胞,分别在无血清培养液中加入不同浓度的ZnSO4溶液培养7 d,采用图像分析技术分析其生长分化情况;收集海马神经元细胞,利用Northern 杂交技术检测海马神经元bcl-2 mRNA表达情况。结果:锌在0.5~4 mg/L浓度时,海马神经元胞体面积、长径、短径以及bcl-2 mRNA表达水平均明显高于对照组。结论:锌可通过提高bcl-2 mRNA转录水平抑制海马神经元细胞凋亡、促进神经元生长发育。
, http://www.100md.com
【中图分类号】 R 591.1 【文献标识码】 A 【文章编号】 0258-879X(2000)03-0222-04
Effect of zinc on expression of bcl-2 mRNA in new born rat hippocampal neurons
WANG Fu-Di ZHAO Fa-Ji
(Department of Military Hygiene, Faculty of Navy Medicine, Second Military Medical University, Shanghai 200433, China)
【ABSTRACT】 Objective:To determine the molecular mechanisms of zinc effect on the central nervous system development and function, we observed the expression of bcl-2 mRNA in hippocampal neurons, which was an apoptosis inhibitory proto-oncogene. Methods:The new born hippocampal neurons were cultured in serum free medium with different zinc level for 7 days. And then we used image analytical system to analyze the soma area, body maximum and minimum diameter of hippocampal neurons, and used Northern blot method to examine bcl-2 mRNA expression of hippocampal neurons respectively. Results:The results showed that the diameter and volume of supplemented zinc neurons (0.5, 1.0 and 4.0 mg/L) were greater than those in no-zinc supplemented neurons (control group). The bcl-2 mRNA expression of cultured hippocampal neurons in medium with zinc in 0.5, 1.0 and 4.0 mg/L was higher than that in control group respectively. Conclusion:The results suggest that zinc can inhibit the apoptosis and promote the development of neurons by increasing bcl-2 transcription level.
, 百拇医药
【KEY WORDS】 zinc; hippocampal neurons; genes, bcl-2; apoptosis▲
[Acad J Sec Mil Med Univ, 2000, 21(3): 222-225]
微量元素锌为人体必需微量元素之一,与脑发育及其功能密切相关。发育期即孕期或哺乳期锌缺乏可引起脑结构及功能明显受损,甚至可导致大脑的先天性畸形[1,2]。王福庄等[3]发现锌对体外培养的新生大鼠海马神经元生长发育有明显的促进作用,但锌影响中枢神经系统(CNS)或神经元生长发育的机制至今还不十分清楚。细胞凋亡是一种不同于细胞死亡的主动性细胞死亡机制,被认为是与有丝分裂功能相反的调节细胞群体的方式,与正常组织的群体力学、胚胎发育、细胞免疫等密切相关。细胞凋亡不仅存在于正常生理状态下,在CNS发育过程中也存在[4];并且神经细胞凋亡与许多神经系统疾病如Parkinson病密切相关[5]。目前已发现多种基因编码的产物参与细胞凋亡的发生与调控,其中就有bcl-2家族基因,包括bcl-2,bcl-x,bax,bad,bak,mcl-1和A1等。而原癌基因bcl-2是调节细胞凋亡最基本的成员,被认为是能特异地抑制细胞凋亡发生的“抗凋亡基因”[6,7]。为了进一步探讨锌与CNS发育的关系、明确锌与神经元bcl-2的联系,我们在体外观察了锌对海马神经元bcl-2 mRNA表达的影响。
, http://www.100md.com
1 材料和方法
1.1 种植培养液组成及无血清饲养培养液 种植培养液组成为80% DMEM培养基(Gibco公司产品)、10%小牛血清、10%马血清、L-谷氨酰胺 100 mg/L、脱氧核糖核酸酶Ⅰ 40 mg/L;无血清饲养培养液组成为99% DMEM,谷氨酰胺 100 mg/L,1% N3组合液。N3组合液组成为:胰岛素 10 μg/ml、转铁蛋白 200 μg/ml、腐胺 200 μmol/L、亚硒酸钠 60 nmol/L、皮质酮 40 μg/ml、三碘甲腺原氨酸 20 μg/ml、黄体酮 40 nmol/L及 0.001%牛血清白蛋白。HEPES、马血清、脱氧核糖核酸酶Ⅰ及胰蛋白酶均为 Sigma公司产品,L-谷氨酰胺及小牛血清为华美公司产品。
1.2 实验组培养液组成 实验分5组,即配制5种培养液。对照组(control):对照组培养液即为无血清饲养培养液;其他实验组分别在对照组培养液中加入ZnSO4.7H2O溶液,使其锌水平分别达到:0.25 mg/L(低锌组)、0.5 mg/L(中锌组)、1.0 mg/L(高锌组)及4.0 mg/L(过锌组)。
, 百拇医药
1.3 海马神经元的体外培养 按王福庄[3,8]等报道的海马神经元无血清培养法进行培养。取当日出生的Wistar大鼠,在无菌条件下断头、取脑,分离出双侧海马,置于含0.125%胰蛋白酶消化液(pH 7.2)中,在37℃,10% CO2条件下孵育30 min,用种植培养液终止消化,将消化后的组织移入离心管中,加入2 ml种植培养液,用细口径滴管吹打数次,以促进神经元细胞离解。静置2~3 min,吸出上层细胞悬液,以种植培养液稀释成0.5×106个/ml细胞密度, 接种于涂有小牛皮胶的35 mm塑料培养皿中,每皿2 ml。置培养皿于36℃,10% CO2培养箱中。24 h后倾去培养皿中种植培养液,分别改用无血清饲养培养液(包括对照组和实验组)进行培养。第3天换液,更换一半新鲜饲养培养液。对培养7 d的海马神经元进行有关指标检测。
1.4 神经元胞体、面积及直径的测量 取培养7 d的海马神经元,采用ABC法对神经特异性烯醇化酶(NSE)进行免疫组化染色,神经细胞染成棕褐色,在图像分析仪上测量神经元胞体面积、长径和短径。以
 ±s表示,采用方差分析进行统计学分析。
±s表示,采用方差分析进行统计学分析。, 百拇医药
1.5 海马神经元bcl-2 mRNA的检测 采用Northern blot技术进行检测。根据bcl-2 cDNA序列设计合成探针[9],其寡聚核苷酸顺序为5′-CACTG AATGC TCTCC GGTAC CGCAG TTCAA ACTCA TCGCC-3′。将探针寡聚核苷酸溶液稀释至10 μg/μl;取5 μl探针溶液,加入水至9 μl,沸水浴5 min,冰浴中变性5 min;按宝丽曼公司Random Primer Labelling Kit试剂盒加入2 μl反应缓冲液、3×1 μl dNTP(C,G,T),5 μl α-32P-dATP及1 μl Klenow;37℃保温35 min;利用Sephadex-G50柱分离探针(1×TE洗脱),并在液闪仪上测CPM计数。采取常规方法抽提培养的海马神经元总RNA、RNA变性电泳、转膜过夜(硝酸纤维素膜,Amersham公司产品)、淋洗、预杂交、杂交、压片(-80℃ 72 h)、冲洗X线片。对X线片进行密度扫描。
2 结 果
, http://www.100md.com
2.1 锌对海马神经元胞体面积、最大长径及最小短径的影响 由表1可见,除低浓度组(0.25 mg/L)外,其他实验组海马神经元胞体面积、最大长径及最小短径均明显大于对照组,且具有统计学意义。其中以1.0 mg/L组海马神经元胞体面积、最大长径及最小短径为最大,提示在1.0 mg/L浓度时可最大限度促进神经元生长发育,并非锌的浓度越高(4.0 mg/L)越能促进细胞生长。
表1 锌对海马神经元胞体面积、最大长径及最小短径的影响
Tab 1 Effect of zinc on soma area, body maximum
and minimum diameter(n=20,
 ±s) Group
±s) GroupSoma
, 百拇医药
area
(A/μm2)
Maximum
diameter
(d/μm)
Minimum
diameter
(d/μm)
Control
65.36±13.74
11.4±1.7
4.7±0.8
, http://www.100md.com
Zinc(ρB/mg.L-1)
0.25
66.18±12.31
11.3±1.7
4.7±0.6
0.5
74.38±10.25*
12.3±1.5**
4.8±0.6
1.0
, 百拇医药
82.51±15.92**
14.3±2.3**
5.6±0.7**
4.0
76.32±12.49*
13.2±2.0**
5.1±0.7**
*P<0.05, **P<0.01 compared with control group
2.2 锌对海马神经元bcl-2 mRNA表达的影响 由图1可见,体外培养的大鼠海马神经元中存在bcl-2 mRNA表达。比较不同锌浓度组海马神经元bcl-2 mRNA杂交信号强弱,发现1 mg/L组杂交信号最强,而低锌组(0.25 mg/L)和对照组杂交信号最低,杂交强度仅为1 mg/L组的28.0%和24.1%;中度锌浓度组(0.5 mg/L)和过高锌浓度组(4 mg/L)杂交信号虽明显强于对照组和0.25 mg/L组,但却明显弱于1 mg/L组;0.5 mg/L组和4 mg/L组杂交强度分别仅为1 mg/L组的52.3%和61.7%。研究结果提示一定浓度的锌可促进海马神经元bcl-2 mRNA的表达;低浓度锌(0.25 mg/L)不能引起bcl-2表达变化,但过高浓度的锌(4 mg/L)同样也不能最大程度地促进bcl-2 mRNA表达。

, 百拇医药
图1 锌对海马神经元bcl-2 mRNA表达的影响
Fig 1 Effect of zinc on bcl-2 mRNA expression
of hippocampal neurons
Samples were prepared from hippocampal neurons of control group (lane 1), 0.25 mg/L zine group (lane 2), 0.5 mg/L zinc group (lane 3), 1.0 mg/L zinc group (lane 4) and 4.0 mg/L zinc group (lane 5) respectively
3 讨 论
微量元素锌为人体必需微量元素,细胞内锌在一定浓度下可以抑制细胞凋亡,而锌浓度过低则促进细胞凋亡发生[10]。发育期锌缺乏可引起动物脑功能明显受损,严重缺锌时还会导致大脑的先天性畸形[1,2]。这些病理变化可能与低锌引发神经细胞凋亡有一定关系。为了验证该设想我们最近进行一项实验发现,发育期锌缺乏小鼠脑组织bcl-2 mRNA表达下降(待发表),提示锌缺乏引发的脑功能损伤与脑组织bcl-2 mRNA表达水平低下存在密切联系。本实验研究发现锌可促进体外培养的海马神经元生长发育及bcl-2 mRNA表达,提示锌离子可直接调控bcl-2基因表达,并可能通过提高bcl-2 mRNA表达水平来抑制细胞凋亡。王福庄等[3]发现锌对体外培养的新生大鼠海马神经元生长发育有明显的促进作用。提高bcl-2 mRNA表达水平可能是锌促进CNS或神经元生长发育的一个重要机制。
, 百拇医药
原癌基因bcl-2是调节细胞凋亡最基本的成员,被认为是能特异地抑制细胞凋亡发生的“抗凋亡基因”[6,7]。bcl-2主要在血液、淋巴系统中表达,也在一些非淋巴组织中表达,如在许多有丝分裂的组织,主要包括发育中和成熟分裂后的神经细胞均可表达此蛋白。bcl-2作为细胞凋亡调节网络中最重要的基因,影响或被影响着其他细胞凋亡相关基因、分子,如TGFβ,Hsp70,ICE,Myc及p53等。bcl-2表达具有多种生理活性,它可以阻止或降低射线、自由基、化学药物等引起的细胞凋亡,对氧化损伤造成的细胞凋亡具有肯定的抑制作用[11]。以往大量研究资料提示bcl-2的抗细胞凋亡机制可能包括[12]:(1)bcl-2作为一种抗氧化剂,调节细胞的氧化还原状态而抑制细胞凋亡的发生;(2) 通过直接或间接地影响内质网中Ca2+释放而实现抑制或调节细胞凋亡的发生;(3) bcl-2家族基因之间通过BH1和BH2高度保守同源区形成同源或异源二聚体,调节相互活性,对细胞存亡产生不同的效应。另外,bcl-2的作用也可能涉及到核孔复合物的信号转导等。锌促进神经元bcl-2 mRNA表达水平,bcl-2基因再通过以上复杂机制调节细胞凋亡过程。目前一些实验还发现细胞中过多表达Cu-Zn SOD,对培养的神经细胞株和原代神经元凋亡均有抑制作用[13]。锌元素具有广泛的生理功能,它是Cu-Zn SOD正常组分之一,可促进Cu-Zn SOD的表达。可见锌调控神经细胞凋亡不但与bcl-2表达有关,还与Cu-Zn SOD表达变化有关。虽然调控bcl-2表达并不是锌影响神经细胞凋亡的唯一途径,但从我们的研究资料可以认为bcl-2表达变化是锌影响神经元凋亡的重要机制之一,锌调控bcl-2的详细机制还有待进一步实验研究。
, http://www.100md.com
致谢 本工作得到第二军医大学军队卫生学教研室全体老师及研究生的大力协助,在此表示衷心感谢。■
基金项目:国家自然科学基金资助项目(39770643,39970641);全军“九五”青年基金项目(98Q1043)
作者简介:王福俤(1968-),男(汉族),博士,讲师
【参 考 文 献】
[1] 王福俤, 赵法,郭俊生. 锌缺乏对小鼠脑发育及功能影响的实验研究[J]. 第二军医大学学报,2000,21(1):38-41.
[2] 王福俤, 赵法, 郭俊生,等.发育期锌缺乏对行为学的影响[J]. 国外医学.卫生学分册,1997,24(4):231-233.
, 百拇医药
[3] 王福庄, 丁爱石, 魏 文, 等. 锌对新生大鼠海马培养神经元生长发育的作用[J]. 营养学报, 1995,17(4):357-362.
[4] Hengartner MO, Ellis RE, Horvitz HR. Caenorhabditis elegans gene ced-9 protects cells from programmed cell death[J]. Nature, 1992,356(6369):494-499.
[5] Marshall KA, Daniel SE, Cairns N, et al. Upregulation of the anti-apoptotic protein bcl-2 may be an early event in neurodegeneration: studies on Parkinson′s incidental Lewy body disease[J]. Biochem Biophys Res Commun, 1997,240(1):84-87.
, 百拇医药
[6] Mah SP, Zhong LT, Liu Y, et al. The protooncogene bcl-2 inhibits apoptosis in PC12 cells[J]. J Neurochem, 1993,60(3):1183-1186.
[7] Garcia I, Martinou I, Tsujimoto Y, et al. Prevention of programmed cell death of sympathetic neurons by the bcl-2 proto-oncogene[J]. Science, 1992,258(5080):302-304.
[8] 丁爱石, 王福庄. 新生大鼠海马神经元在无血清培养液中的生长特性[J]. 细胞生物学杂志, 1993,15(2):88-90.
[9] Chen J, Graham SH, Nakayama M, et al. Apoptosis repressor genes bcl-2 and bcl-x-long are expressed in the rat brain following global ischemia[J]. J Cereb Blood Flow Metab,1997,17(1):2-10.
, 百拇医药
[10] Sunderman FW Jn. The influence of zinc on apoptosis[J]. Ann Clin Lab Sci, 1995,25(2):134-142.
[11] Hochenbery DM, Oltval ZN, Milliman CL. Bcl-2 functions in an antioxidant pathway to prevent apoptosis[J]. Cell, 1993,75(2):241-245.
[12] 叶建锋,舒斯云,包新民. 原癌基因bcl-2与神经组织程序化细胞死亡[J]. 中国神经科学杂志, 1998,14(1):53-58.
[13] Greenlund LJS, Deckwerth TL, Johnson EM Jr. Superoxide dismutase delays neuronal apoptosis: a role reactive oxygen species in programmed neuronal death[J]. Neuron, 1995,14(2):303-315.
【收稿日期】 1999-10-28
【修回日期】 1999-12-30, 百拇医药