LPS刺激对RAW264.7细胞p38蛋白激酶的细胞内定位的影响
作者:张琳 姜勇 张璐
单位:张琳(1969-),女,河南郑州人,1999年毕业于第一军医大学,博士;张琳(第一军医大学病理生理学教研室和全军休克微循环重点实验室,广东 广州 510515);姜勇(第一军医大学病理生理学教研室和全军休克微循环重点实验室,广东 广州 510515);张璐(第一军医大学病理生理学教研室和全军休克微循环重点实验室,广东 广州 510515)
关键词:丝裂原活化蛋白激酶;脂多糖;移位
第一军医大学学报000302 摘要:目的 探讨p38蛋白激酶信号传导的过程及其在细胞中的特异性作用机制。方法 应用间接荧光标记免疫探针技术及共聚焦激光扫描技术观察单核细胞中p38蛋白激酶的分布及LPS对其分布的影响。结果p38在未受刺激的静息单核细胞及内皮生长因子(EGF)刺激的单核细胞胞浆和胞核中荧光强度均呈弥散性分布;脂多糖(LPS)刺激使细胞核区的荧光强度明显增强,而胞浆区域的荧光强度降低。激酶动力学的研究显示,p38激活先于p38移位。LPS刺激后30 min,p38激酶活性即达到高峰,随后2 h内逐步下降,p38激酶活性呈一过性增高;LPS刺激45 min后,核区荧光强度达到峰值,且在2 h内维持在高水平。结论 单核细胞由LPS激活后,其p38蛋白激酶由胞浆转位到胞核,反应具有一定的特异性;p38移位入核依赖于p38磷酸化活化及由细胞浆移位到细胞核是一系列连续发生的事件。
, http://www.100md.com
中图分类号:Q55; R-33 文献标识码:A 文章编号:1000-2588 (2000)-03-0197-05
The effect of lipopolysaccharide on the intracellular localization of p38 MAP kinase in RAW264.7 cells
ZHANG Lin, JIANG Yong, ZHANG Lu
(Departments of Pathophysiology and Key Lab for Shock and Microcirculation of PLA, First Military Medical University, Guangzhou 510515, China)
Abstract: Objective To elucidate the mechanisms of specific signal transduction of p38 MAPK. Methods Distribution of p38 MAP kinase in RAW264.7 cells and the influence of lipopolysaccharide ( LPS) were checked by confocal laser scan and immuno-fluorescence probe indirect labeling techniques. Results It was found that p38 labeled with fluorescence spread all over the cytosol and the nucleus the quiescent cells or cells stimulated by EGF, while the fluorescent intensity reduced in the cytosol area on the stimulation of LPS. Translocation of p38 MAP kinase to the nucleus induced by LPS showed a significant dose-dependent response. Furthermore, it was shown from the dynamics study that the translocation of p38 took place following its activation. On the stimulation of LPS, the kinase activity of p38 reached its peak in 30 min which was followed by a dropping down of kinase activity in 2 h, while the fluorescent intensity in the nuclei of RAW264.7 cells reached its saturated height in 45 min which was thenceforth kept on the high level. Conclusion p38 MAP kinase moved to the nuclei of RAW264.7 cells on the stimulation of LPS, which is a specific response induced by LPS. The translocation of p38 is dependent on its activation by phosphorylation.
, 百拇医药
Key words: mitogen-activated protein kinase; lipopolysaccharide; translocation
丝裂原激活蛋白激酶(MAPK)传导通路是多种细胞生理过程的重要调节系统[1~3]。MAPK在进化过程中采用了三级激酶循序激活的形式传递信号。独特的激酶结构、多条并行的信号通路以及对上游激酶和下游底物的选择性都提示MAPK信号传导的特异性[1~3]。与其他多种细胞内蛋白激酶类似,MAPK激活后常常发生细胞内移位。p38通路是最近确定的一条MAPK信号传导通路[4],至少包括p38(α)、p38β、p38γ和p38δ 4种亚型[4~7],其参与炎症、应激等病理生理反应,调节细胞周期和凋亡过程[4~8]。细胞接受刺激后,某些蛋白激酶被激活,移位到细胞内特定的部位,与特定的生物大分子发生作用,从而介导特定的细胞反应。由于蛋白激酶在细胞内的定位及其相关刺激引起的移位不仅影响其对细胞内底物的选择性激活作用,而且也影响着激酶本身被其它激酶的激活,因此,对MAPK的研究对于揭示激酶的信号特异性转导机制和功能调节有着重要的意义。本研究应用共聚焦激光扫描技术观察了脂多糖(LPS)刺激RAW264.7细胞带来p38 MAPK的移位过程。
, http://www.100md.com
1 材料与方法
1.1 主要实验仪器
ACAS 570激光扫描共聚焦显微镜 (Laser scanning confocal microscope,LSCM,美国MERIDIAN公司)、35 mm Petri细胞培养皿(美国Meridian Instrument公司);NAPCO2-5420-1型二氧化碳式培养箱(美国精密科学公司),倒置显微镜IMT-2(日本Olympus公司)。
1.2 主要实验材料
鼠抗人p38(α)IgG、单核细胞株RAW264.7(由美国The Scripps Research Institute 韩家淮教授馈赠),异硫氰酸荧光素(FITC)标记的羊抗鼠IgG(购自军事医学科学院),LPS、EGF(购自Sigma公司)。
, 百拇医药
1.3 单核细胞株RAW264.7的培养
用0.25%的胰酶消化对数生长期的单核细胞株RAW264.7,用DMEM完全培养基调节细胞浓度为1´ 109/L。将1´ 109/L的细胞接种在改良的Petri皿中,用含5%小牛血清的DMEM培养基于二氧化碳水套式培养箱(5%CO2)中培养。
1.4 抗原抗体反应
培养在特定小皿上的RAW264.7细胞在接受不同刺激后,用pH为7.2的PBS于4℃清洗两遍,以 1%多聚甲醛+0.025%戊二醛固定2 h,PBS洗5 min,放入湿盒,滴加稀释的p38(α)单抗(1:2 000),混匀,4℃过夜。PBS振动洗涤10 min,加入FITC标记的羊抗鼠IgG二抗,于37℃湿盒避光孵育30~60 min,吸出染液,PBS冲洗10 min,Petri皿底留少许缓冲液待测。
, 百拇医药
1.5 细胞的刺激与实验分组
1.5.1 LPS诱导p38(a )入核的效应 实验共分3组:(1)用LPS(100 μg/L)刺激45 min后的单核细胞株RAW264.7;(2)血清饥饿5 h后用内皮因子EGF(10 nmol/L)刺激30 min后固定的单核细胞株;(3)不加任何刺激的单核细胞株阴性对照组。
1.5.2 LPS诱导p38(α) MAPK入核的过程 用浓度为100 μg/L 的LPS刺激培养的单核细胞株RAW264.7,研究LPS诱导p38移位过程。实验共观察7个时间点,即LPS刺激单核细胞0、5、15、30、45、60和120 min。
1.5.3 不同浓度LPS诱导p38(α) MAPK移位的作用 用不同浓度的LPS刺激RAW264.7细胞45 min,观察其对p38 MAPK移位的影响。设不加刺激的单核细胞为对照组,其余各组分别用0.1、1、10、100、1 000 μg/L LPS刺激单核细胞。
, http://www.100md.com
1.6 免疫沉淀和蛋白激酶测定
培养的RAW264.7细胞用LPS刺激后,将细胞降温至4℃,用裂解缓冲液(25 mmol/L HEPES,pH 7.6)、137 mmol/L NaCl、3 mmol/L EDTA、3 mmol/L β-glycerophosphate、1% Triton X-100、0.1 mmol/L Na3VO4、1 mmol/L phenylme-thsulfony1 fluoride)裂解细胞。10 000 r/min离心10 min除去细胞核及其它不溶性物质。制备p38多克隆抗体结合的蛋白A/G琼脂糖凝胶颗粒,每ml凝胶颗粒约结合2 mg的抗体。上述细胞裂解液400 μl加入20 μl 50%抗体结合的蛋白A/G琼脂糖凝胶悬浮液,4℃摇动10~16 h。用0.3 ml的裂解缓冲液清洗凝胶颗粒2次,再用0.5 ml激酶反应缓冲液 (20 mmol/L HEPES pH7.6)、20 mmol/L MgCl2、 25 mmol/L β -glycerophosphate、0.1 mmol/L Na3VO4、2 mmol/L DTT)洗1次[5、6]。从RAW细胞裂解液沉淀的内源性p38蛋白用作激酶,4℃保留免疫沉淀。10 μg 髓磷脂碱性蛋白(MBP)(Sigma,St. Louis,MO)作底物。反应溶液包含20 μmol/l ATP及10 U Ci [g -32P]ATP,反应体积为20 μl,在37℃反应30 min,完成激酶活性测定[4]。反应产物用12% 十二烷基硫酸钠(SDS)-聚丙烯酰胺凝胶电泳(PAGE)分离。用放射自显影显示蛋白磷酸化[5~7]。用Bioprofile图象分析系统(购自法国Vilber Lourmat公司)测量底物磷酸化强度。
, http://www.100md.com
1.7 激光扫描共聚焦显微镜检测
应用ACAS 570型LSCM对细胞进行共聚焦激光断层扫描。仪器主要参数:激光波长=488 nm、荧光波长=530 nm、孔径=1 600 μm、步长=0.5 μm、X/Y 点数=180、激光功率=10~20 MW。
2 结果
2.1 培养状态的单核细胞株RAW264.7
差显微镜观察示培养状态的单核细胞株生长良好。接种培养30 min后单核细胞开始贴壁生长,由圆形变为梭形或多角形,伸出伪足,胞浆致密呈颗粒状或网状,胞核圆形,颜色较深(图1)。
图1 培养的单核细胞株RAW264.7× 20
, http://www.100md.com
Fig. 1 Cultured RAW264.7 cells× 20
2.2 LPS对RAW264.7细胞p38(α)细胞内定位的影响
荧光二抗标记后,LSCM扫描,荧光屏显示细胞内有层次不等的伪彩色荧光。空白对照组胞质内无荧光,说明该荧光探针间接与胞内抗原结合,并且有很高的特异性。对单个细胞的不同断层进行了扫描,结果发现RAW264.7细胞受到LPS刺激后,p38向核区集中,致使核区荧光亮度增强,胞浆区荧光强度减弱,这与EGF刺激和未刺激组明显不同 (图2,每个小图像的平均面积为30 μm m×30 μm,细胞断层扫描的顺序为各小图从左至右1~6)。为证实上述结果,用SFP(Simulated fluorescence process)法对细胞进行重组,并确定细胞内荧光强度分布。LPS刺激的RAW264.7细胞,p38分布曲线呈峰形,提示p38在胞核区明显增加;而EGF刺激并未造成p38的移位,p38在单核细胞内呈散在分布(图3),这与静息状态的单核细胞情况相似。
, http://www.100md.com
图 2 不同刺激下的单个单核细胞的断层荧光扫描图
A.LPS刺激组 B. EGF刺激组 C. 阴性对照组
Fig. 2 Scanning of the fluorescent in single monocyte
stimulated with LPS, EGF and nonstimulated moncute
A. LPS-stimulated RAW cell B. EGF-stimulated RAW cell C. Negative control
图 3 SPF方法重组的细胞内三维荧光图像及断层荧光含量的分布曲线
, http://www.100md.com
A. LPS刺激组 B. EGF刺激组 C. 阴性对照组
Fig. 3 3 dimensional image of intracellular
fluorescence and its distribution curve
A.LPS-stimulated RAW cell B. EGF-stimulated RAW cell C. Negative control
2.3 LPS刺激p38α MAPK移位的量效关系
应用LSCM观察了不同浓度LPS作用下RAW264.7细胞核区p38α MAPK的荧光强度变化特点。结果显示,静止细胞核区的平均荧光强度约1 210± 234;LPS浓度为10 μg/L时,其核区平均荧光强度约2 400± 280; LPS浓度为100 μg/L 时细胞核区荧光强度明显升高,其核区平均荧光强度约为3 408± 447;然后维持于平台水平(图4)。
, 百拇医药
图4 细胞核区荧光强度与LPS刺激浓度的关系
Fig. 4 The relationship between the intensity
of nuclear fluorescence and LPS concentration
2.4 LPS作用诱导p38αMAPK移位入核的动力学过程
本研究在LPS浓度为100 μg/L 条件下,应用LSCM观察了LPS作用不同时间对单核细胞株RAW264.7细胞p38αMAPK的激活作用。结果显示,LPS作用于单核细胞15 min后,其细胞核区的荧光强度即有所增高,由刺激前的1210± 201增加到2 410± 304;LPS刺激45 min后细胞核区的荧光强度达到高峰值3 600± 429,然后趋于平稳,2 h之内一直维持在平台水平(图5)。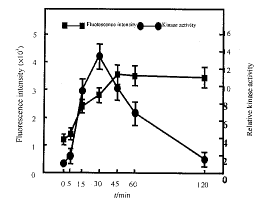
, 百拇医药
图5 细胞核区荧光强度与LPS刺激时间的关系
Fig. 5 The time course of nuclear fluorescence intensity
following LPS stimulation
3 讨论
MAPK传导通路调节着多种细胞过程。p38通路是最近确定的一条MAPK信号传导通路[3、4],参与炎症、应激等病理生理反应,也有研究报道这条通路调节着细胞周期和凋亡过程[3、8、9]。至今已鉴定和克隆了4个新的p38亚型,证实这些亚型之间具有不同的上游激酶和下游底物选择性[3、5~7]。
细胞内蛋白激酶特定的细胞内定位及其在特定刺激作用下的特定移位是细胞信号维持特异性转导的重要机制之一[1、10]。然而,LPS刺激是否引起p38 MAPK移位以及如何移位尚缺乏系统的研究。为了探讨p38信号转导的过程及其特异性机制,本研究应用激光共聚焦显微镜对p38(α)在单核细胞内定位进行观察,发现未受刺激静止的单核细胞,其荧光强度呈弥散性分布,胞浆和胞核中的荧光呈散在均匀分布,提示p38蛋白激酶在未激活前散在、弥漫性地分布于细胞中;LPS刺激后的单核细胞,细胞核区荧光强度明显增强,细胞浆区荧光强度降低,提示单核细胞在LPS作用下,其p38由胞浆移位到胞核。而EGF刺激的单核细胞,情况与静止单核细胞相似,未见明显的p38移核现象,说明LPS引起的p38 MAPK入核有一定的特异性。Raingeaud[11]曾报道转染表位标记p38的COS细胞受UV刺激后,虽然p38被激活,却未观察到这种转染的表位标记的p38明显移位,这种结果可能并未反映内源性p38的真实情况,而是由于细胞过量表达表位标记蛋白所带来的假象。本研究结果与以前报道的其它MAPK如 ERK1、JNK1在受到刺激而激活后进入细胞核的结果一致,且观察到的为内源性p38的移位过程,因此,结论是可靠的。
, http://www.100md.com
我们曾报道LPS对单核细胞株RAW264.7细胞p38的激活作用具有量效依赖效应[8]。本文发现, LPS刺激带来的p38蛋白激酶的细胞内移位也具有明显的量效依赖性关系,这与LPS激活p38蛋白激酶的过程相似。诱导p38移位的饱和LPS浓度为100 μg/L,与激活p38激酶活性的浓度一致;大量增加LPS刺激浓度并不能使p38核移位持续增强,而是维持于一定的水平,说明LPS诱导的p38移位也同样具有饱和效应[8]。
对LPS刺激引起p38入核移位过程的研究表明,LPS 刺激15 min后开始出现明显的细胞核移位,p38的荧光强度在细胞内由刺激前呈弥散性分布,刺激后逐步向细胞核区增强,并于LPS刺激后45 min时达到峰值,之后维持于平台期。这与LPS诱导p38激酶活性的时间曲线明显不同。LPS诱导RAW细胞p38激酶活性呈一过性增强,在LPS刺激后2 h其活性逐渐恢复到接近基础水平[8]。LPS刺激RAW细胞p38移位入核明显滞后于p38激活过程,提示p38移位后入细胞核依赖于p38磷酸化活化,p38磷酸化活化及由细胞浆移位到细胞核是相继发生的连续事件。
, 百拇医药
本研究观察到,在RAW细胞中p38被激活后几乎全部移位入核,提示p38的作用底物可能主要为细胞核区蛋白,而非胞浆区的蛋白底物,或胞浆蛋白底物移位入核后才能被p38作用。
现普遍认为激活的MAPK进入细胞,激活有关的转录因子,使相关基因表达,这是MAPK介导细胞反应的重要机制之一[1~3]。已报道p38可磷酸化调节多个转录因子ATF2、Chop10、MEF2C、SAP1等[12~14]。单核细胞受到LPS刺激后可表达多种蛋白,如ICAM-1、iNOS等,这可能在LPS引起的应激反应中起重要的作用[1~3]。未来的一个重要问题就是研究单核细胞受到LPS刺激后,p38被磷酸化激活后进入细胞核,通过哪些转录因子开启炎症反应相关基因的转录。
(感谢美国The Scripps Research Institute 的韩家淮提供p38抗体)国家杰出青年科学基金资助(39925014)、国家自然科学基金重点(39830400)、面上项目(39800074,39870332)、军队杰出人才基金(98J003)和广东省自然科学基金(980207)资助
, 百拇医药
参考文献
[1] Cano E, Mahadevan LC. Parallel signal processing among mammalian MAPKs[J]. TIBS, 1995, 20:117~22.
[2] 姜 勇, Ulevitch RJ. LPS介导细胞激活的信号转导:从CD14到p38 MAPK通路的研究[J]. 生理科学进展, 1999, 30(1): 29~34.
[3] 姜 勇, 韩家淮. P38 MAPK 信号转导通路[J]. 生命科学, 1999, 11 (3): 102~6.
[4] Han J, Lee JD, Bibbs L et al. A MAP kinase targeted by endotoxin and hyperosmolarity in mammalian cells[J]. Science, 1994, 265: 808~11.
, 百拇医药
[5] Jiang Y, Chen C, Li Z et al. Characterization of the structure and func- tion of a new mitogen-activated protein kinase (p38b )[J]. J Biol Chem, 1996, 271(30): 17920~26.
[6] Li Z, Jiang Y, Ulevitch RJ et al. The primary structure of p38g : A new member of p38 group of MAP kinase[J]. Biochem and Biophy Res Comm ,1996, 228(2): 334~40.
[7] Jiang Y, Gram H, Zhao M et al. Characterization of the structure and function of the fourth member of p38 group MAP kinases- p38d [J]. J Biol Chem, 1997, 272(48):30122~8.
, 百拇医药
[8] Jiang Y, Liu AH, Zhang L et al. The activation of p38 MAPK induced by LPS and its role in TNF-a gene expression[J]. J Med Coll PLA, 1999, 14 (2): 138~43.
[9] Maher P. p38 mitogen-activated protein kinase activation is required for fibroblast growth factor-2-stimulated cell proliferation but not differentiation[J]. J Biol Chem, 1999, 274(25): 17491~8.
[10] Pawson T, Scott JD. Signal through scaffold, anchoring, and adaptor proteins[J]. Science, 1997, 278: 2075~80.
, 百拇医药
[11] Raingeaud J, Gupta S, Rogers JS et al. Pro-inflammatory cytokines and environmental stress cause p38 mitogen-activated protein kinase activation by dual phosphorylation on tyrosine and threonine[J]. J Biol Chem, 1995, 270(13): 7420~6.
[12] Wang XZ, Ron D. Stress-induced phosphorylation and activation of the transcription factor CHOP (GADD153) by p38 MAP kinase[J]. Science, 1996, 272: 1347~9.
[13] Han J, Jiang Y, Li Z et al. Activation of the transcription factor MEF2C by the MAP kinase p38 in inflammation[J]. Nature, 1997, 386(20): 296~9.
[14] 姜 勇. 内毒素激活内皮细胞的信号机制的研究进展[J]. 中华医学 杂志, 1999, 79(1): 76~8.
1999-11-21, 百拇医药
单位:张琳(1969-),女,河南郑州人,1999年毕业于第一军医大学,博士;张琳(第一军医大学病理生理学教研室和全军休克微循环重点实验室,广东 广州 510515);姜勇(第一军医大学病理生理学教研室和全军休克微循环重点实验室,广东 广州 510515);张璐(第一军医大学病理生理学教研室和全军休克微循环重点实验室,广东 广州 510515)
关键词:丝裂原活化蛋白激酶;脂多糖;移位
第一军医大学学报000302 摘要:目的 探讨p38蛋白激酶信号传导的过程及其在细胞中的特异性作用机制。方法 应用间接荧光标记免疫探针技术及共聚焦激光扫描技术观察单核细胞中p38蛋白激酶的分布及LPS对其分布的影响。结果p38在未受刺激的静息单核细胞及内皮生长因子(EGF)刺激的单核细胞胞浆和胞核中荧光强度均呈弥散性分布;脂多糖(LPS)刺激使细胞核区的荧光强度明显增强,而胞浆区域的荧光强度降低。激酶动力学的研究显示,p38激活先于p38移位。LPS刺激后30 min,p38激酶活性即达到高峰,随后2 h内逐步下降,p38激酶活性呈一过性增高;LPS刺激45 min后,核区荧光强度达到峰值,且在2 h内维持在高水平。结论 单核细胞由LPS激活后,其p38蛋白激酶由胞浆转位到胞核,反应具有一定的特异性;p38移位入核依赖于p38磷酸化活化及由细胞浆移位到细胞核是一系列连续发生的事件。
, http://www.100md.com
中图分类号:Q55; R-33 文献标识码:A 文章编号:1000-2588 (2000)-03-0197-05
The effect of lipopolysaccharide on the intracellular localization of p38 MAP kinase in RAW264.7 cells
ZHANG Lin, JIANG Yong, ZHANG Lu
(Departments of Pathophysiology and Key Lab for Shock and Microcirculation of PLA, First Military Medical University, Guangzhou 510515, China)
Abstract: Objective To elucidate the mechanisms of specific signal transduction of p38 MAPK. Methods Distribution of p38 MAP kinase in RAW264.7 cells and the influence of lipopolysaccharide ( LPS) were checked by confocal laser scan and immuno-fluorescence probe indirect labeling techniques. Results It was found that p38 labeled with fluorescence spread all over the cytosol and the nucleus the quiescent cells or cells stimulated by EGF, while the fluorescent intensity reduced in the cytosol area on the stimulation of LPS. Translocation of p38 MAP kinase to the nucleus induced by LPS showed a significant dose-dependent response. Furthermore, it was shown from the dynamics study that the translocation of p38 took place following its activation. On the stimulation of LPS, the kinase activity of p38 reached its peak in 30 min which was followed by a dropping down of kinase activity in 2 h, while the fluorescent intensity in the nuclei of RAW264.7 cells reached its saturated height in 45 min which was thenceforth kept on the high level. Conclusion p38 MAP kinase moved to the nuclei of RAW264.7 cells on the stimulation of LPS, which is a specific response induced by LPS. The translocation of p38 is dependent on its activation by phosphorylation.
, 百拇医药
Key words: mitogen-activated protein kinase; lipopolysaccharide; translocation
丝裂原激活蛋白激酶(MAPK)传导通路是多种细胞生理过程的重要调节系统[1~3]。MAPK在进化过程中采用了三级激酶循序激活的形式传递信号。独特的激酶结构、多条并行的信号通路以及对上游激酶和下游底物的选择性都提示MAPK信号传导的特异性[1~3]。与其他多种细胞内蛋白激酶类似,MAPK激活后常常发生细胞内移位。p38通路是最近确定的一条MAPK信号传导通路[4],至少包括p38(α)、p38β、p38γ和p38δ 4种亚型[4~7],其参与炎症、应激等病理生理反应,调节细胞周期和凋亡过程[4~8]。细胞接受刺激后,某些蛋白激酶被激活,移位到细胞内特定的部位,与特定的生物大分子发生作用,从而介导特定的细胞反应。由于蛋白激酶在细胞内的定位及其相关刺激引起的移位不仅影响其对细胞内底物的选择性激活作用,而且也影响着激酶本身被其它激酶的激活,因此,对MAPK的研究对于揭示激酶的信号特异性转导机制和功能调节有着重要的意义。本研究应用共聚焦激光扫描技术观察了脂多糖(LPS)刺激RAW264.7细胞带来p38 MAPK的移位过程。
, http://www.100md.com
1 材料与方法
1.1 主要实验仪器
ACAS 570激光扫描共聚焦显微镜 (Laser scanning confocal microscope,LSCM,美国MERIDIAN公司)、35 mm Petri细胞培养皿(美国Meridian Instrument公司);NAPCO2-5420-1型二氧化碳式培养箱(美国精密科学公司),倒置显微镜IMT-2(日本Olympus公司)。
1.2 主要实验材料
鼠抗人p38(α)IgG、单核细胞株RAW264.7(由美国The Scripps Research Institute 韩家淮教授馈赠),异硫氰酸荧光素(FITC)标记的羊抗鼠IgG(购自军事医学科学院),LPS、EGF(购自Sigma公司)。
, 百拇医药
1.3 单核细胞株RAW264.7的培养
用0.25%的胰酶消化对数生长期的单核细胞株RAW264.7,用DMEM完全培养基调节细胞浓度为1´ 109/L。将1´ 109/L的细胞接种在改良的Petri皿中,用含5%小牛血清的DMEM培养基于二氧化碳水套式培养箱(5%CO2)中培养。
1.4 抗原抗体反应
培养在特定小皿上的RAW264.7细胞在接受不同刺激后,用pH为7.2的PBS于4℃清洗两遍,以 1%多聚甲醛+0.025%戊二醛固定2 h,PBS洗5 min,放入湿盒,滴加稀释的p38(α)单抗(1:2 000),混匀,4℃过夜。PBS振动洗涤10 min,加入FITC标记的羊抗鼠IgG二抗,于37℃湿盒避光孵育30~60 min,吸出染液,PBS冲洗10 min,Petri皿底留少许缓冲液待测。
, 百拇医药
1.5 细胞的刺激与实验分组
1.5.1 LPS诱导p38(a )入核的效应 实验共分3组:(1)用LPS(100 μg/L)刺激45 min后的单核细胞株RAW264.7;(2)血清饥饿5 h后用内皮因子EGF(10 nmol/L)刺激30 min后固定的单核细胞株;(3)不加任何刺激的单核细胞株阴性对照组。
1.5.2 LPS诱导p38(α) MAPK入核的过程 用浓度为100 μg/L 的LPS刺激培养的单核细胞株RAW264.7,研究LPS诱导p38移位过程。实验共观察7个时间点,即LPS刺激单核细胞0、5、15、30、45、60和120 min。
1.5.3 不同浓度LPS诱导p38(α) MAPK移位的作用 用不同浓度的LPS刺激RAW264.7细胞45 min,观察其对p38 MAPK移位的影响。设不加刺激的单核细胞为对照组,其余各组分别用0.1、1、10、100、1 000 μg/L LPS刺激单核细胞。
, http://www.100md.com
1.6 免疫沉淀和蛋白激酶测定
培养的RAW264.7细胞用LPS刺激后,将细胞降温至4℃,用裂解缓冲液(25 mmol/L HEPES,pH 7.6)、137 mmol/L NaCl、3 mmol/L EDTA、3 mmol/L β-glycerophosphate、1% Triton X-100、0.1 mmol/L Na3VO4、1 mmol/L phenylme-thsulfony1 fluoride)裂解细胞。10 000 r/min离心10 min除去细胞核及其它不溶性物质。制备p38多克隆抗体结合的蛋白A/G琼脂糖凝胶颗粒,每ml凝胶颗粒约结合2 mg的抗体。上述细胞裂解液400 μl加入20 μl 50%抗体结合的蛋白A/G琼脂糖凝胶悬浮液,4℃摇动10~16 h。用0.3 ml的裂解缓冲液清洗凝胶颗粒2次,再用0.5 ml激酶反应缓冲液 (20 mmol/L HEPES pH7.6)、20 mmol/L MgCl2、 25 mmol/L β -glycerophosphate、0.1 mmol/L Na3VO4、2 mmol/L DTT)洗1次[5、6]。从RAW细胞裂解液沉淀的内源性p38蛋白用作激酶,4℃保留免疫沉淀。10 μg 髓磷脂碱性蛋白(MBP)(Sigma,St. Louis,MO)作底物。反应溶液包含20 μmol/l ATP及10 U Ci [g -32P]ATP,反应体积为20 μl,在37℃反应30 min,完成激酶活性测定[4]。反应产物用12% 十二烷基硫酸钠(SDS)-聚丙烯酰胺凝胶电泳(PAGE)分离。用放射自显影显示蛋白磷酸化[5~7]。用Bioprofile图象分析系统(购自法国Vilber Lourmat公司)测量底物磷酸化强度。
, http://www.100md.com
1.7 激光扫描共聚焦显微镜检测
应用ACAS 570型LSCM对细胞进行共聚焦激光断层扫描。仪器主要参数:激光波长=488 nm、荧光波长=530 nm、孔径=1 600 μm、步长=0.5 μm、X/Y 点数=180、激光功率=10~20 MW。
2 结果
2.1 培养状态的单核细胞株RAW264.7
差显微镜观察示培养状态的单核细胞株生长良好。接种培养30 min后单核细胞开始贴壁生长,由圆形变为梭形或多角形,伸出伪足,胞浆致密呈颗粒状或网状,胞核圆形,颜色较深(图1)。

图1 培养的单核细胞株RAW264.7× 20
, http://www.100md.com
Fig. 1 Cultured RAW264.7 cells× 20
2.2 LPS对RAW264.7细胞p38(α)细胞内定位的影响
荧光二抗标记后,LSCM扫描,荧光屏显示细胞内有层次不等的伪彩色荧光。空白对照组胞质内无荧光,说明该荧光探针间接与胞内抗原结合,并且有很高的特异性。对单个细胞的不同断层进行了扫描,结果发现RAW264.7细胞受到LPS刺激后,p38向核区集中,致使核区荧光亮度增强,胞浆区荧光强度减弱,这与EGF刺激和未刺激组明显不同 (图2,每个小图像的平均面积为30 μm m×30 μm,细胞断层扫描的顺序为各小图从左至右1~6)。为证实上述结果,用SFP(Simulated fluorescence process)法对细胞进行重组,并确定细胞内荧光强度分布。LPS刺激的RAW264.7细胞,p38分布曲线呈峰形,提示p38在胞核区明显增加;而EGF刺激并未造成p38的移位,p38在单核细胞内呈散在分布(图3),这与静息状态的单核细胞情况相似。

, http://www.100md.com
图 2 不同刺激下的单个单核细胞的断层荧光扫描图
A.LPS刺激组 B. EGF刺激组 C. 阴性对照组
Fig. 2 Scanning of the fluorescent in single monocyte
stimulated with LPS, EGF and nonstimulated moncute
A. LPS-stimulated RAW cell B. EGF-stimulated RAW cell C. Negative control

图 3 SPF方法重组的细胞内三维荧光图像及断层荧光含量的分布曲线
, http://www.100md.com
A. LPS刺激组 B. EGF刺激组 C. 阴性对照组
Fig. 3 3 dimensional image of intracellular
fluorescence and its distribution curve
A.LPS-stimulated RAW cell B. EGF-stimulated RAW cell C. Negative control
2.3 LPS刺激p38α MAPK移位的量效关系
应用LSCM观察了不同浓度LPS作用下RAW264.7细胞核区p38α MAPK的荧光强度变化特点。结果显示,静止细胞核区的平均荧光强度约1 210± 234;LPS浓度为10 μg/L时,其核区平均荧光强度约2 400± 280; LPS浓度为100 μg/L 时细胞核区荧光强度明显升高,其核区平均荧光强度约为3 408± 447;然后维持于平台水平(图4)。

, 百拇医药
图4 细胞核区荧光强度与LPS刺激浓度的关系
Fig. 4 The relationship between the intensity
of nuclear fluorescence and LPS concentration
2.4 LPS作用诱导p38αMAPK移位入核的动力学过程
本研究在LPS浓度为100 μg/L 条件下,应用LSCM观察了LPS作用不同时间对单核细胞株RAW264.7细胞p38αMAPK的激活作用。结果显示,LPS作用于单核细胞15 min后,其细胞核区的荧光强度即有所增高,由刺激前的1210± 201增加到2 410± 304;LPS刺激45 min后细胞核区的荧光强度达到高峰值3 600± 429,然后趋于平稳,2 h之内一直维持在平台水平(图5)。

, 百拇医药
图5 细胞核区荧光强度与LPS刺激时间的关系
Fig. 5 The time course of nuclear fluorescence intensity
following LPS stimulation
3 讨论
MAPK传导通路调节着多种细胞过程。p38通路是最近确定的一条MAPK信号传导通路[3、4],参与炎症、应激等病理生理反应,也有研究报道这条通路调节着细胞周期和凋亡过程[3、8、9]。至今已鉴定和克隆了4个新的p38亚型,证实这些亚型之间具有不同的上游激酶和下游底物选择性[3、5~7]。
细胞内蛋白激酶特定的细胞内定位及其在特定刺激作用下的特定移位是细胞信号维持特异性转导的重要机制之一[1、10]。然而,LPS刺激是否引起p38 MAPK移位以及如何移位尚缺乏系统的研究。为了探讨p38信号转导的过程及其特异性机制,本研究应用激光共聚焦显微镜对p38(α)在单核细胞内定位进行观察,发现未受刺激静止的单核细胞,其荧光强度呈弥散性分布,胞浆和胞核中的荧光呈散在均匀分布,提示p38蛋白激酶在未激活前散在、弥漫性地分布于细胞中;LPS刺激后的单核细胞,细胞核区荧光强度明显增强,细胞浆区荧光强度降低,提示单核细胞在LPS作用下,其p38由胞浆移位到胞核。而EGF刺激的单核细胞,情况与静止单核细胞相似,未见明显的p38移核现象,说明LPS引起的p38 MAPK入核有一定的特异性。Raingeaud[11]曾报道转染表位标记p38的COS细胞受UV刺激后,虽然p38被激活,却未观察到这种转染的表位标记的p38明显移位,这种结果可能并未反映内源性p38的真实情况,而是由于细胞过量表达表位标记蛋白所带来的假象。本研究结果与以前报道的其它MAPK如 ERK1、JNK1在受到刺激而激活后进入细胞核的结果一致,且观察到的为内源性p38的移位过程,因此,结论是可靠的。
, http://www.100md.com
我们曾报道LPS对单核细胞株RAW264.7细胞p38的激活作用具有量效依赖效应[8]。本文发现, LPS刺激带来的p38蛋白激酶的细胞内移位也具有明显的量效依赖性关系,这与LPS激活p38蛋白激酶的过程相似。诱导p38移位的饱和LPS浓度为100 μg/L,与激活p38激酶活性的浓度一致;大量增加LPS刺激浓度并不能使p38核移位持续增强,而是维持于一定的水平,说明LPS诱导的p38移位也同样具有饱和效应[8]。
对LPS刺激引起p38入核移位过程的研究表明,LPS 刺激15 min后开始出现明显的细胞核移位,p38的荧光强度在细胞内由刺激前呈弥散性分布,刺激后逐步向细胞核区增强,并于LPS刺激后45 min时达到峰值,之后维持于平台期。这与LPS诱导p38激酶活性的时间曲线明显不同。LPS诱导RAW细胞p38激酶活性呈一过性增强,在LPS刺激后2 h其活性逐渐恢复到接近基础水平[8]。LPS刺激RAW细胞p38移位入核明显滞后于p38激活过程,提示p38移位后入细胞核依赖于p38磷酸化活化,p38磷酸化活化及由细胞浆移位到细胞核是相继发生的连续事件。
, 百拇医药
本研究观察到,在RAW细胞中p38被激活后几乎全部移位入核,提示p38的作用底物可能主要为细胞核区蛋白,而非胞浆区的蛋白底物,或胞浆蛋白底物移位入核后才能被p38作用。
现普遍认为激活的MAPK进入细胞,激活有关的转录因子,使相关基因表达,这是MAPK介导细胞反应的重要机制之一[1~3]。已报道p38可磷酸化调节多个转录因子ATF2、Chop10、MEF2C、SAP1等[12~14]。单核细胞受到LPS刺激后可表达多种蛋白,如ICAM-1、iNOS等,这可能在LPS引起的应激反应中起重要的作用[1~3]。未来的一个重要问题就是研究单核细胞受到LPS刺激后,p38被磷酸化激活后进入细胞核,通过哪些转录因子开启炎症反应相关基因的转录。
(感谢美国The Scripps Research Institute 的韩家淮提供p38抗体)国家杰出青年科学基金资助(39925014)、国家自然科学基金重点(39830400)、面上项目(39800074,39870332)、军队杰出人才基金(98J003)和广东省自然科学基金(980207)资助
, 百拇医药
参考文献
[1] Cano E, Mahadevan LC. Parallel signal processing among mammalian MAPKs[J]. TIBS, 1995, 20:117~22.
[2] 姜 勇, Ulevitch RJ. LPS介导细胞激活的信号转导:从CD14到p38 MAPK通路的研究[J]. 生理科学进展, 1999, 30(1): 29~34.
[3] 姜 勇, 韩家淮. P38 MAPK 信号转导通路[J]. 生命科学, 1999, 11 (3): 102~6.
[4] Han J, Lee JD, Bibbs L et al. A MAP kinase targeted by endotoxin and hyperosmolarity in mammalian cells[J]. Science, 1994, 265: 808~11.
, 百拇医药
[5] Jiang Y, Chen C, Li Z et al. Characterization of the structure and func- tion of a new mitogen-activated protein kinase (p38b )[J]. J Biol Chem, 1996, 271(30): 17920~26.
[6] Li Z, Jiang Y, Ulevitch RJ et al. The primary structure of p38g : A new member of p38 group of MAP kinase[J]. Biochem and Biophy Res Comm ,1996, 228(2): 334~40.
[7] Jiang Y, Gram H, Zhao M et al. Characterization of the structure and function of the fourth member of p38 group MAP kinases- p38d [J]. J Biol Chem, 1997, 272(48):30122~8.
, 百拇医药
[8] Jiang Y, Liu AH, Zhang L et al. The activation of p38 MAPK induced by LPS and its role in TNF-a gene expression[J]. J Med Coll PLA, 1999, 14 (2): 138~43.
[9] Maher P. p38 mitogen-activated protein kinase activation is required for fibroblast growth factor-2-stimulated cell proliferation but not differentiation[J]. J Biol Chem, 1999, 274(25): 17491~8.
[10] Pawson T, Scott JD. Signal through scaffold, anchoring, and adaptor proteins[J]. Science, 1997, 278: 2075~80.
, 百拇医药
[11] Raingeaud J, Gupta S, Rogers JS et al. Pro-inflammatory cytokines and environmental stress cause p38 mitogen-activated protein kinase activation by dual phosphorylation on tyrosine and threonine[J]. J Biol Chem, 1995, 270(13): 7420~6.
[12] Wang XZ, Ron D. Stress-induced phosphorylation and activation of the transcription factor CHOP (GADD153) by p38 MAP kinase[J]. Science, 1996, 272: 1347~9.
[13] Han J, Jiang Y, Li Z et al. Activation of the transcription factor MEF2C by the MAP kinase p38 in inflammation[J]. Nature, 1997, 386(20): 296~9.
[14] 姜 勇. 内毒素激活内皮细胞的信号机制的研究进展[J]. 中华医学 杂志, 1999, 79(1): 76~8.
1999-11-21, 百拇医药