红霉素萃取新工艺研究Ⅰ.中性络合萃取体系研究
作者:李洲 秦峰 谷雪蔷
单位:清华大学化工系,北京 100084
关键词:红霉素;红霉素硫氰酸盐;中性络合萃取;工艺
中国抗生素杂志000303 摘 要 研究了一萃取红霉素的中性络合体系,其组成为一高脂肪醇(FA),且以煤油为稀释剂。文中列出了其萃取平衡方程式,建立了分配数学模型。研究结果表明,此新体系具有明显的技术和经济优越性。在红霉素萃取过程中溶剂损耗可从9~10kg/10亿单位降至3kg/10亿单位以下。产品质量(红霉素硫氰酸盐产品)合格,产品回收率与乙酸丁酯萃取时回收率相当。同时,可革除从萃残液中回收溶剂的处理步骤,从而可降低能耗。
Study on new extraction technology of erythromycin Ⅰ.Study on neutral complex extraction systems
, 百拇医药
Li Zhou,Qin Feng,Gu Xueqiang
(Dept of Chem Eng,Tsinghua University,Beijing 100084)
ABSTRACT For the extraction of erythromycin,a new neutral complex extraction system was studied,where,a high-fatty alcohol is used as the extractant,and kerosene as the diluent.
In this system,the extraction equilibrium equation is listed,and the mathematical model of extraction distribution was proposed.
, 百拇医药
Results show that the new extraction systems possess remarkable advantages in technology and economics.The solvent consumption during the extraction process decresses form 9~10 to < 3kg/billion unit.The product of gallimycin is qualified and its recovery yield is almost equal to that of butylacetate extraction process.In addition,the recovrey process of solvent from the raffinate may be eliminated,and the energy consumption was also reduced.
KEY WORDS Erythromycin;Gallimycin;Neutral complex extraction;Process
, http://www.100md.com
红霉素生产是以乙酸丁酯为萃取剂。乙酸丁酯虽然具有良好的物性和一定的萃取能力,但由于其水溶性较大而使其在萃取过程中损耗较大。对红霉素而言,其损耗量达9~10kg/10亿单位,此项消耗费用约占红霉素后提取成本的1/3[1]。同时为减少溶剂消耗,一般还建立了从萃残液中回收溶剂的处理步骤,从而又增加了能源消耗和相应的人力、物力消耗。
针对上述问题,经多年研究,我们先后开发了红霉素的两类萃取体系,即中性络合萃取体系和协同萃取体系,目的均在于减少溶剂消耗。并建立了两种萃取工艺流程,其一处理步骤为萃取、成盐(有机相内成盐)、转碱工艺流程;另一则为萃取、反萃取、成盐(水相内成盐)、转碱工艺流程。两者的主要差别是成盐的介质不同,后续转碱过程基本类同。
本文首先讨论采用中性络合萃取体系进行萃取后反萃取,成红霉素硫氰酸盐(高力霉素),再转碱的工艺过程的研究结果。
1 材料与方法
, 百拇医药
1.1 实验方法
1.1.1 萃取 取定量红霉素发酵液滤液(或红霉素模拟料液),用10%的NaOH溶液调pH值约10.5(或依据实验要求而定),与萃取溶剂定量地加到分液漏斗中,在常温或水浴恒温的条件下振荡混合两相5~10min,静置分层。取出分离的两相,分别测定其红霉素效价,并测定水相中的平衡pH值。
1.1.2 反萃取 反萃取的酸水为乙酸缓冲液。可根据实验要求配制不同pH值的酸水,在常温或水浴恒温条件下在分液漏斗中混合两相(振荡3min),分相后分别测定其中的红霉素效价,并测定水相的平衡pH值。
1.1.3 成盐 将反萃取所得的高浓度红霉素缓冲液用10%的NaOH溶液调pH值至6.0,用鼓泡法去除残存的有机溶剂。继续调pH值至6.8,将水溶液置于25~35℃的水溶液中,缓慢滴加定量的硫氰酸钾溶液,滴加后继续保温搅拌0.5~1.0h,以利于晶体的生长,过滤得红霉素硫氰酸盐湿晶体,用去离子水洗涤3次,每次洗水量约等于晶体量。然后真空干燥(40℃)晶体12h。取样测定红霉素效价,含水量等各项指标。
, 百拇医药
1.1.4 转碱 称取定量的红霉素硫氰酸盐,溶于4.0~4.5倍量(体积/重量比)的丙酮中,在搅拌条件下滴加化学计量的10%~20%的NaOH水溶液,待溶液澄清后分出少量水相,再分两次加进2~6倍丙酮体积的去离子水后静置过夜。过滤后得红霉素湿晶体,先后用水搅洗和顶洗晶体,再经干燥即得红霉素碱成品,取样测定效价及其它指标。
1.2 实验用药品、试剂
实验中所用红霉素标准品为中国药品生物制品检定所制备,红霉素发酵滤液取自红霉素生产厂家。所用试剂除煤油稀释剂为加氢煤油工业品外,其它均为AR级试剂、药品,水为去离子水。
1.3 分析方法
根据红霉素与硫酸作用显棕黄色,在波长485nm处有最大吸收的特点,采用化学法处理而后进行分光光度测定。所用仪器为72型分光光度计。红霉素硫氰酸盐和红霉素碱成品均用生物测定法测定其效价。
, http://www.100md.com
2 结果
2.1 萃取体系的筛选
新的萃取体系的选择是立足于反应萃取基础之上的,它较之常用的物理萃取具有更大的萃取容量和萃取选择性,有关反应萃取的定义在文献[2]中业已述及。
已知在不同水相pH值条件下,红霉素可以分子或离子态存在,并存在以下平衡关系:
MH+(W)←→M(W)+H+(W) (1)
式中M和MH+表示红霉素在水相中的分子和离子存在形式,下标w表示在水相中,上述平衡关系及其转移主要取决于水相中的pH值(图1)。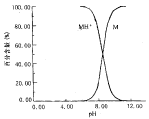
, http://www.100md.com
图1 不同pH条件下红霉素在水溶液中的存在形式
若控制其为分子态时,可采用一中性络合萃取剂进行萃取,降低溶液的pH值,使其转化为离子态时而进行反萃取。又若控制其主要为离子态时,可采用阳离子交换反应的萃取剂进行萃取,它们可在pH≥pKa的条件下进行萃取;而后用酸反萃取,而使萃取剂得以再生复用。
在中性络合萃取体系中可供选择的萃取剂有中性磷(膦)类萃取剂,中性含氧、中性含硫萃取剂,中性酰胺类萃取剂以及中性芳香类萃取剂。但考虑到萃取剂的若干选择原则,特别是在制药行业中的附加限制,可供选择的范围则大大缩小了。在此我们特别考察了所选萃取剂的性能和参数:(1)良好的物性和稳定性;(2)良好的再生、复用性能;(3)良好的抗乳化性能;(4)无毒或毒性很小;(5)价格与现用乙酸丁酯的可比性。
经筛选实验研究开发了以高脂肪醇(用FA表示)为主体的新萃取体系。表1列出它们与乙酸丁酯的萃取性能比较。
, http://www.100md.com
由表1可见,后者对红霉素的萃取能力均强于乙酸丁酯,经综合考虑,选定高碳醇FA1为萃取剂。
为改善萃取剂的物性,实验研究了不同稀释剂对萃取性能的影响,其实验数据列于表2。
2.2 萃取工艺条件研究
分别研究了水相中红霉素浓度、pH值、有机相中萃取剂浓度以及萃取温度等工艺参数对红霉素萃取分配系数的影响。
表1 不同萃取体系对红霉素的萃取性能
相比(O/A):1∶5
平衡水相pH:10.7
振荡时间:3min
萃取温度:23℃
, http://www.100md.com
No.
溶剂
料液C
(u/ml)
萃余相C
(u/ml)
萃取相C
(u/ml)
分配系数D
1
乙酸丁酯
960
20.0
, 百拇医药
934
46.70
2
FA1
616
19.8
3200
161.67
3
FA2
616
16.0
3000
, http://www.100md.com
187.50
4
FA3
616
20.0
3400
170.00
表中FA1、FA2、FA3为不同种类的高碳醇。 表2 采用不同稀释剂-FA1萃取红霉素能力的比较
有机相组成:60%(V/V)FA1+40%(V/V)稀释剂
相比(O/A):1∶1
平衡水相pH:10.6
, 百拇医药
振荡时间:1min
萃取温度:22℃
No.
稀释剂
料液C
(u/ml)
萃余相C
(u/ml)
萃取相C
(u/ml)
分配系数D
1
环己烷
, 百拇医药
1000
32.0
978
30.56
2
正庚烷
1000
21.0
966
46.00
3
加氢煤油
1000
, 百拇医药
22.2
958
43.15
2.2.1 水相中红霉素浓度的影响 实验采用红霉素标准品配制的溶液,在相同条件下,改变溶液浓度,分别测定萃取相的浓度,得萃取平衡等温线(图2)。
由图2曲线可以看出,萃余相浓度与萃取相浓度呈二次曲线关系,经二次多项式拟合,得方程:
Y=3.21X2+54.17X+83.65
经综合考虑,选择煤油(此处为加氢煤油)为稀释剂。
2.2.2 水相平衡pH值对分配系数的影响 如图3所示。
由图3可以看出,当pH值小于8.0时,红霉素的萃取分配系数很低;pH在8~10的范围内,随pH值上升,萃取分配系数增大;pH值大于10以后,萃取分配系数基本不变。萃取时选择pH在9.8~10.3的区间内。
, http://www.100md.com
图2 FA1萃取红霉素平衡等温线
萃取体系:纯FA1;相比(O/A):1∶5;
平衡水相pH值:10.6;萃取温度:20℃;
振荡时间:3min
图3 红霉素萃取分配系数随pH值变化的关系
萃取体系:60%(V/V)FA1+40%(V/V)加氢煤
油;相比(O/A):1∶1;料液浓度:1000u/ml;
萃取温度:23℃;振荡时间:2.5min
, 百拇医药 2.2.3 有机相中萃取浓度对萃取剂分配系数的影响 实验结果列表3。
由表3中的数据作图几近得一直线,即分配系数随萃取剂浓度的增加而加大。
2.2.4 温度的影响 温度不仅影响萃取平衡,而且影响两相的物理性质,是决定分配系数的重要因素。表4列出不同温度下红霉素的萃取分配系数。萃取分配系数随温度的升高而增大。
对表4中的数据取对数,并作lnD-1/T图,可得一斜率为负值的直线。即1nD与1/T成线性关系。由此判定,萃取红霉素的反应为吸热反应,温度升高有利于萃取过程。据此,按Gibbs-Helmholtz公式可近似求得此萃取过程的焓变△Hm=41.8KJ/mol。
2.3 反萃取工艺条件研究
由于红霉素在乙酸缓冲液中有很高的溶解度[3],工业生产中多用它作为反萃剂,本文亦采用乙酸缓冲液作为反萃剂。
, 百拇医药
表3 萃取剂浓度与分配系数的关系
萃取体系:FA1-加氢煤油
料液浓度:1000u/ml
平衡水相pH值:10.6
相比(O/A):1∶1
振荡时间:2min
萃取温度:23℃
No.
萃取剂浓度
(%)(V/V)
萃余相C
(u/ml)
, 百拇医药
萃取相C
(u/ml)
分配系数D
1
20
36.0
960
26.67
2
40
25.8
930
36.04
, 百拇医药
3
60
21.0
900
42.06
4
80
19.4
990
51.03
5
100
17.6
, 百拇医药
1040
59.09
表4 温度对红霉素萃取分配系数的影响
萃取体系:FA1 (60%)-加氢煤油(40%)
料液浓度:960u/ml
平衡水相pH值:10.6
相比(O/A):1∶1
振荡时间:2.5min
No.
温度T
(℃)
, 百拇医药 萃余相C
(u/ml)
萃取相C
(u/ml)
分配系数D
1
14
122.0
800
6.56
2
20
34.0
, 百拇医药
912
26.82
3
24
20.6
880
42.72
4
30
20.0
1000
50.00
5
, 百拇医药
35
12.4
960
77.42
2.3.1 反萃平衡等温线的测定 以含红霉素的FA1(60% V/V)-煤油(40%)为有机相,反萃液为pH4.1的乙酸缓冲液,反萃温度为17℃,相比(O/A)=1∶1,反萃后水相平衡pH为4.44(图4)。
由图4可知,用乙酸缓冲溶液反萃有机相中的红霉素,在上述浓度范围内,反萃平衡等温线近似为一直线,即有机相中的红霉素浓度对反萃分配系数没有影响。用线性方程回归得:
Cy=70.85CX-662.61
2.3.2 反萃pH值与反萃分配系数的关系 实验中采用含红霉素约10000u/ml的FA1(60% V/V)-煤油体系为有机相,水相为乙酸缓冲液,反萃温度为17℃,相比(A/O)=1∶1,反萃时间3min,得到不同平衡pH值条件下红霉素的反萃分配系数(图5)。
, 百拇医药
在上述pH范围内,反萃分配系数与水相平衡pH近似成线性关系,对实验数据进行回归得:
D反=-35.01×pH+202.27 r=0.97
从图5可以看出,在其它条件固定时,水相平衡pH值对反萃效果影响非常显著,近似呈线性关系。由于红霉素对酸的稳定性很差,在pH低于6.0的情况下,容易降解。因此要选择合适的pH值,使其既要满足一定的反萃取能力,又要保证红霉素的生物活性。在实际操作过程中,一般选择反萃水相出口pH值在4.5~5.0之间。为了进一步降低反萃酸水中红霉素的降解,在实验中把得到的反萃液立即回调pH值到6.0,然后再进行吹溶媒以及成盐等操作步骤。
图4 红霉素反萃平衡等温线
, 百拇医药
图5 反萃pH对分配系数的影响
2.3.3 反萃温度与反萃分配系数的关系 有机相为含红霉素约10000u/ml的FA1(60% V/V)-煤油体系,反萃水相为乙酸缓冲液,反萃温度为20℃,相比(A/O)=1∶1,振荡时间3min,水相平衡pH值为4.30。改变反萃温度,得到温度与反萃分配系数的关系(图6)。
从图6可以看出,反萃分配系数随温度的增加而减小,即该过程为一放热过程。温度降低有利于提高反萃分配系数。作1nD反-1/T的关系曲线得图7。
由图7可以看出,1nD反与1/T关系呈良好的线性关系,进而可回归得到反萃分配系数与温度的关系:
1nD反=5817.95/T-16.28 r=0.998
, http://www.100md.com
2.3.4 萃取剂浓度对反萃分配系数的影响 有机相为含红霉素10000u/ml的FA1(不同配比)-煤油体系,水相为乙酸缓冲溶液,实验温度为20℃,相比1∶1,振荡时间3min,水相平衡pH为4.2~4.3,得萃取剂浓度与分配系数的关系(表5)。由表5数据可见,萃取剂浓度越高,反萃分配系数越小。
表5 萃取剂浓度对反萃分配系数的影响 No.
萃取剂浓度
[B](O)
有机相浓度C
(u/ml)
水相浓度C
(u/ml)
, 百拇医药 分配系数D反
1
0.4
134.28
10259.72
76.41
2
0.6
197.13
9794.15
49.68
3
0.8
, 百拇医药
469.49
10445.94
22.25
4
1.0
817.5
9607.93
11.75
2.4 萃取和反萃分配平衡数学模型的建立
2.4.1 萃取分配平衡数学模型 根据红霉素分子在水相中的解离平衡,萃取剂分子在有机相内的聚合反应平衡以及红霉素的萃取反应平衡关系可以推出如下数学模型[4]:
, 百拇医药
代入Ks=exp(-△Hm/RT+C)关系式
D=exp(-△Hm/RT+C).K聚[B]n(O).
(1+10pKa-pH)-1
1nD=-△Hm/RT+C+1nK聚+nln[B]n(O)-
ln(1+10pKa-pH)
设C′=C+1nK聚,D=exp(-△Hm/RT+C′)[B](O)n/(1+10pKa-pH)回归处理16组实验数据,得△Hm=36.33KJ/mol,n=1.1,pKa=8.07。
, http://www.100md.com
D为水相中抗生素浓度、pH值、有机相中萃取剂浓度和操作温度的函数,同时,与该抗生素的pKa(即Ka)值有关。
图6 温度对反萃分配系数的影响
图7 1nD反-1/T关系曲线
2.4.2 反萃取分配平衡数学模型 用18组实验数据进行回归得如下模型:
D反=(1+108.60-pH)exp(42.41×103/RT-24.88)
×[B](O)-1.08
, 百拇医药
由上述方程得待定参数:pKa=8.60,△Hm=-42.41KJ/mol,b=1.08。
2.5 萃取、反萃和成盐工艺条件的确定和现场试验
2.5.1 萃取、反萃和成盐工艺条件的确定 根据萃取和反萃工艺条件研究的结果确定采用如下工艺参数进行现场试验。
萃取 萃取体系:FA1(60% V/V)-加氢煤油(40% V/V);相比(A/O):6~8∶1;平衡pH:9.8~10.3;萃取温度:常温。
反萃取 反萃剂:乙酸缓冲液;相比(O/A):1~2∶1;平衡pH:4.5~5.0;反萃温度:常温。
成盐 硫氰酸钾浓度:50%;结晶pH:6.8~7.0;结晶温度:25~30℃;结晶时间:3h。
, 百拇医药
2.5.2 现场试验和结果 采用实际红霉素发酵滤洗液进行了新萃取体系的萃取、反萃、成盐试验。试验中萃取过程采用Φ20型离心萃取器实现二级逆流萃取,试验结果列于表6。
由表6数据可见,采用新萃取体系其萃取收率平均可达96.08%,反萃收率平均为94.96%,成盐收率平均为82.10%,三步累积平均收率78.62%,稍优于现有生产指标。新萃取体系的优越之处主要在于溶剂损失的大幅度降低,对红霉素硫氰酸盐而言,降至1.72kg/10亿单位,推算红霉素碱产品的溶剂损耗量约为2.15kg/10亿单位(按转碱收率80%计),这一数值大大低于现有的乙酸丁酯萃取工艺的溶剂损耗量。
3 讨论和结论
3.1 系统研究了FA1-煤油新萃取体系对红霉素萃取和反萃取的工艺条件,并建立了相应的分配平衡数学模型。
萃取分配模型(半经验模型):
, 百拇医药
D=exp(-36.33×103/RT+18.77).[B](O)1.1/
(1+108.07-pH)
反萃取分配模型(经验模型):
D反=(1+108.60-pH)exp(42.41×103/RT-
24.88).[B](O)-1.08
3.2 采用实际红霉素发酵滤液进行了萃取、反萃和成盐试验,取得了合格的中间产品红霉素硫氰酸盐(转碱可按现行工艺进行),试验结果表明采用新萃取体系其损耗量较乙酸丁酯大幅度降低。本研究内容可供工业生产中试用。
, http://www.100md.com
表6 现场试验结果 试验批号
1
2
3
4
5
6
7
滤洗液体积(ml)
8584
8616
10148
9920
, 百拇医药
7953
4212
4212
滤洗液效价(u/ml)
2624
2464
1578
2032
2344
2464
2464
溶媒体积(ml)
1430
, http://www.100md.com
1370
1526
1450
1452
635
635
溶媒原始效价(u/ml)
0
0
0
0
1190
0
, 百拇医药
0
萃取相比(A/O)
6.0
6.3
6.7
6.8
6.9
6.6
6.6
平衡pH
10.0
10.0
10.0
, 百拇医药
10.0
10.2
10.3
10.3
废水效价(u/ml)
87
87
60
87
93
0
0
饱和体积(ml)
, http://www.100md.com
1440
1360
1510
1467
1168
641
641
饱和效价(u/ml)
15100
13650
9250
13150
17050
, http://www.100md.com
15400
15400
萃取收率(%)
96.68
96.47
96.20
95.72
96.03
95.10
95.10
酸水体积(ml)
800
923
, http://www.100md.com
807
900
900
600
600
酸水效价(u/ml)
-
-
16000
22600
-
18560
21680
, http://www.100md.com
废水体积(ml)
1194
1340
1490
1435
1145
620
622
废水效价(u/ml)
890
465
500
1085
, http://www.100md.com
740
435
565
反萃相比(A/O)
2∶3
2∶3
1∶2
2∶3
1∶1.3
1∶1
1∶1
反萃收率(%)
94.35
, 百拇医药
96.59
94.59
91.75
95.66
97.18
96.33
成盐母液效价(u/ml)
4960
4190
3070
2861
3540
3730
, http://www.100md.com
3340
母液体积(ml)
800
910
780
900
900
600
600
成品干重(g)
20.0
22.4
16.8
, 百拇医药
20.4
23.9
12.5
12.1
成品效价(u/mg)
717
717
718
722
715
716
716
成盐收率(%)
, 百拇医药
97.34
-
80.81
87.34
-
79.90
84.59
总收率(%)
74.20
75.65
75.33
73.07
85.31
, 百拇医药
86.23
83.47
溶剂损失(升/十亿单位)
-
1.87
2.98
1.05
0.44
1.62
1.57
李洲,男,生于1936年,教授.
参考文献
1,王岳,方金瑞主编.抗生素.北京:科学出版社,1988:337
2,李洲,廖史书,雷文.制药工业中溶剂萃取技术的机制和应用发展方向.中国医药工业杂志,1996;27(2):89
3,刘昌胜,邬行彦.红霉素在几种缓冲溶液中的溶解度.中国抗生素杂志,1995;20(1):17
4,李洲,王进.大环内酯类抗生素的中性络合萃取研究.中国医药工业杂志,1997;28(10):440
修回:1999-11-09, http://www.100md.com
单位:清华大学化工系,北京 100084
关键词:红霉素;红霉素硫氰酸盐;中性络合萃取;工艺
中国抗生素杂志000303 摘 要 研究了一萃取红霉素的中性络合体系,其组成为一高脂肪醇(FA),且以煤油为稀释剂。文中列出了其萃取平衡方程式,建立了分配数学模型。研究结果表明,此新体系具有明显的技术和经济优越性。在红霉素萃取过程中溶剂损耗可从9~10kg/10亿单位降至3kg/10亿单位以下。产品质量(红霉素硫氰酸盐产品)合格,产品回收率与乙酸丁酯萃取时回收率相当。同时,可革除从萃残液中回收溶剂的处理步骤,从而可降低能耗。
Study on new extraction technology of erythromycin Ⅰ.Study on neutral complex extraction systems
, 百拇医药
Li Zhou,Qin Feng,Gu Xueqiang
(Dept of Chem Eng,Tsinghua University,Beijing 100084)
ABSTRACT For the extraction of erythromycin,a new neutral complex extraction system was studied,where,a high-fatty alcohol is used as the extractant,and kerosene as the diluent.
In this system,the extraction equilibrium equation is listed,and the mathematical model of extraction distribution was proposed.
, 百拇医药
Results show that the new extraction systems possess remarkable advantages in technology and economics.The solvent consumption during the extraction process decresses form 9~10 to < 3kg/billion unit.The product of gallimycin is qualified and its recovery yield is almost equal to that of butylacetate extraction process.In addition,the recovrey process of solvent from the raffinate may be eliminated,and the energy consumption was also reduced.
KEY WORDS Erythromycin;Gallimycin;Neutral complex extraction;Process
, http://www.100md.com
红霉素生产是以乙酸丁酯为萃取剂。乙酸丁酯虽然具有良好的物性和一定的萃取能力,但由于其水溶性较大而使其在萃取过程中损耗较大。对红霉素而言,其损耗量达9~10kg/10亿单位,此项消耗费用约占红霉素后提取成本的1/3[1]。同时为减少溶剂消耗,一般还建立了从萃残液中回收溶剂的处理步骤,从而又增加了能源消耗和相应的人力、物力消耗。
针对上述问题,经多年研究,我们先后开发了红霉素的两类萃取体系,即中性络合萃取体系和协同萃取体系,目的均在于减少溶剂消耗。并建立了两种萃取工艺流程,其一处理步骤为萃取、成盐(有机相内成盐)、转碱工艺流程;另一则为萃取、反萃取、成盐(水相内成盐)、转碱工艺流程。两者的主要差别是成盐的介质不同,后续转碱过程基本类同。
本文首先讨论采用中性络合萃取体系进行萃取后反萃取,成红霉素硫氰酸盐(高力霉素),再转碱的工艺过程的研究结果。
1 材料与方法
, 百拇医药
1.1 实验方法
1.1.1 萃取 取定量红霉素发酵液滤液(或红霉素模拟料液),用10%的NaOH溶液调pH值约10.5(或依据实验要求而定),与萃取溶剂定量地加到分液漏斗中,在常温或水浴恒温的条件下振荡混合两相5~10min,静置分层。取出分离的两相,分别测定其红霉素效价,并测定水相中的平衡pH值。
1.1.2 反萃取 反萃取的酸水为乙酸缓冲液。可根据实验要求配制不同pH值的酸水,在常温或水浴恒温条件下在分液漏斗中混合两相(振荡3min),分相后分别测定其中的红霉素效价,并测定水相的平衡pH值。
1.1.3 成盐 将反萃取所得的高浓度红霉素缓冲液用10%的NaOH溶液调pH值至6.0,用鼓泡法去除残存的有机溶剂。继续调pH值至6.8,将水溶液置于25~35℃的水溶液中,缓慢滴加定量的硫氰酸钾溶液,滴加后继续保温搅拌0.5~1.0h,以利于晶体的生长,过滤得红霉素硫氰酸盐湿晶体,用去离子水洗涤3次,每次洗水量约等于晶体量。然后真空干燥(40℃)晶体12h。取样测定红霉素效价,含水量等各项指标。
, 百拇医药
1.1.4 转碱 称取定量的红霉素硫氰酸盐,溶于4.0~4.5倍量(体积/重量比)的丙酮中,在搅拌条件下滴加化学计量的10%~20%的NaOH水溶液,待溶液澄清后分出少量水相,再分两次加进2~6倍丙酮体积的去离子水后静置过夜。过滤后得红霉素湿晶体,先后用水搅洗和顶洗晶体,再经干燥即得红霉素碱成品,取样测定效价及其它指标。
1.2 实验用药品、试剂
实验中所用红霉素标准品为中国药品生物制品检定所制备,红霉素发酵滤液取自红霉素生产厂家。所用试剂除煤油稀释剂为加氢煤油工业品外,其它均为AR级试剂、药品,水为去离子水。
1.3 分析方法
根据红霉素与硫酸作用显棕黄色,在波长485nm处有最大吸收的特点,采用化学法处理而后进行分光光度测定。所用仪器为72型分光光度计。红霉素硫氰酸盐和红霉素碱成品均用生物测定法测定其效价。
, http://www.100md.com
2 结果
2.1 萃取体系的筛选
新的萃取体系的选择是立足于反应萃取基础之上的,它较之常用的物理萃取具有更大的萃取容量和萃取选择性,有关反应萃取的定义在文献[2]中业已述及。
已知在不同水相pH值条件下,红霉素可以分子或离子态存在,并存在以下平衡关系:
MH+(W)←→M(W)+H+(W) (1)
式中M和MH+表示红霉素在水相中的分子和离子存在形式,下标w表示在水相中,上述平衡关系及其转移主要取决于水相中的pH值(图1)。

, http://www.100md.com
图1 不同pH条件下红霉素在水溶液中的存在形式
若控制其为分子态时,可采用一中性络合萃取剂进行萃取,降低溶液的pH值,使其转化为离子态时而进行反萃取。又若控制其主要为离子态时,可采用阳离子交换反应的萃取剂进行萃取,它们可在pH≥pKa的条件下进行萃取;而后用酸反萃取,而使萃取剂得以再生复用。
在中性络合萃取体系中可供选择的萃取剂有中性磷(膦)类萃取剂,中性含氧、中性含硫萃取剂,中性酰胺类萃取剂以及中性芳香类萃取剂。但考虑到萃取剂的若干选择原则,特别是在制药行业中的附加限制,可供选择的范围则大大缩小了。在此我们特别考察了所选萃取剂的性能和参数:(1)良好的物性和稳定性;(2)良好的再生、复用性能;(3)良好的抗乳化性能;(4)无毒或毒性很小;(5)价格与现用乙酸丁酯的可比性。
经筛选实验研究开发了以高脂肪醇(用FA表示)为主体的新萃取体系。表1列出它们与乙酸丁酯的萃取性能比较。
, http://www.100md.com
由表1可见,后者对红霉素的萃取能力均强于乙酸丁酯,经综合考虑,选定高碳醇FA1为萃取剂。
为改善萃取剂的物性,实验研究了不同稀释剂对萃取性能的影响,其实验数据列于表2。
2.2 萃取工艺条件研究
分别研究了水相中红霉素浓度、pH值、有机相中萃取剂浓度以及萃取温度等工艺参数对红霉素萃取分配系数的影响。
表1 不同萃取体系对红霉素的萃取性能
相比(O/A):1∶5
平衡水相pH:10.7
振荡时间:3min
萃取温度:23℃
, http://www.100md.com
No.
溶剂
料液C
(u/ml)
萃余相C
(u/ml)
萃取相C
(u/ml)
分配系数D
1
乙酸丁酯
960
20.0
, 百拇医药
934
46.70
2
FA1
616
19.8
3200
161.67
3
FA2
616
16.0
3000
, http://www.100md.com
187.50
4
FA3
616
20.0
3400
170.00
表中FA1、FA2、FA3为不同种类的高碳醇。 表2 采用不同稀释剂-FA1萃取红霉素能力的比较
有机相组成:60%(V/V)FA1+40%(V/V)稀释剂
相比(O/A):1∶1
平衡水相pH:10.6
, 百拇医药
振荡时间:1min
萃取温度:22℃
No.
稀释剂
料液C
(u/ml)
萃余相C
(u/ml)
萃取相C
(u/ml)
分配系数D
1
环己烷
, 百拇医药
1000
32.0
978
30.56
2
正庚烷
1000
21.0
966
46.00
3
加氢煤油
1000
, 百拇医药
22.2
958
43.15
2.2.1 水相中红霉素浓度的影响 实验采用红霉素标准品配制的溶液,在相同条件下,改变溶液浓度,分别测定萃取相的浓度,得萃取平衡等温线(图2)。
由图2曲线可以看出,萃余相浓度与萃取相浓度呈二次曲线关系,经二次多项式拟合,得方程:
Y=3.21X2+54.17X+83.65
经综合考虑,选择煤油(此处为加氢煤油)为稀释剂。
2.2.2 水相平衡pH值对分配系数的影响 如图3所示。
由图3可以看出,当pH值小于8.0时,红霉素的萃取分配系数很低;pH在8~10的范围内,随pH值上升,萃取分配系数增大;pH值大于10以后,萃取分配系数基本不变。萃取时选择pH在9.8~10.3的区间内。

, http://www.100md.com
图2 FA1萃取红霉素平衡等温线
萃取体系:纯FA1;相比(O/A):1∶5;
平衡水相pH值:10.6;萃取温度:20℃;
振荡时间:3min

图3 红霉素萃取分配系数随pH值变化的关系
萃取体系:60%(V/V)FA1+40%(V/V)加氢煤
油;相比(O/A):1∶1;料液浓度:1000u/ml;
萃取温度:23℃;振荡时间:2.5min
, 百拇医药 2.2.3 有机相中萃取浓度对萃取剂分配系数的影响 实验结果列表3。
由表3中的数据作图几近得一直线,即分配系数随萃取剂浓度的增加而加大。
2.2.4 温度的影响 温度不仅影响萃取平衡,而且影响两相的物理性质,是决定分配系数的重要因素。表4列出不同温度下红霉素的萃取分配系数。萃取分配系数随温度的升高而增大。
对表4中的数据取对数,并作lnD-1/T图,可得一斜率为负值的直线。即1nD与1/T成线性关系。由此判定,萃取红霉素的反应为吸热反应,温度升高有利于萃取过程。据此,按Gibbs-Helmholtz公式可近似求得此萃取过程的焓变△Hm=41.8KJ/mol。
2.3 反萃取工艺条件研究
由于红霉素在乙酸缓冲液中有很高的溶解度[3],工业生产中多用它作为反萃剂,本文亦采用乙酸缓冲液作为反萃剂。
, 百拇医药
表3 萃取剂浓度与分配系数的关系
萃取体系:FA1-加氢煤油
料液浓度:1000u/ml
平衡水相pH值:10.6
相比(O/A):1∶1
振荡时间:2min
萃取温度:23℃
No.
萃取剂浓度
(%)(V/V)
萃余相C
(u/ml)
, 百拇医药
萃取相C
(u/ml)
分配系数D
1
20
36.0
960
26.67
2
40
25.8
930
36.04
, 百拇医药
3
60
21.0
900
42.06
4
80
19.4
990
51.03
5
100
17.6
, 百拇医药
1040
59.09
表4 温度对红霉素萃取分配系数的影响
萃取体系:FA1 (60%)-加氢煤油(40%)
料液浓度:960u/ml
平衡水相pH值:10.6
相比(O/A):1∶1
振荡时间:2.5min
No.
温度T
(℃)
, 百拇医药 萃余相C
(u/ml)
萃取相C
(u/ml)
分配系数D
1
14
122.0
800
6.56
2
20
34.0
, 百拇医药
912
26.82
3
24
20.6
880
42.72
4
30
20.0
1000
50.00
5
, 百拇医药
35
12.4
960
77.42
2.3.1 反萃平衡等温线的测定 以含红霉素的FA1(60% V/V)-煤油(40%)为有机相,反萃液为pH4.1的乙酸缓冲液,反萃温度为17℃,相比(O/A)=1∶1,反萃后水相平衡pH为4.44(图4)。
由图4可知,用乙酸缓冲溶液反萃有机相中的红霉素,在上述浓度范围内,反萃平衡等温线近似为一直线,即有机相中的红霉素浓度对反萃分配系数没有影响。用线性方程回归得:
Cy=70.85CX-662.61
2.3.2 反萃pH值与反萃分配系数的关系 实验中采用含红霉素约10000u/ml的FA1(60% V/V)-煤油体系为有机相,水相为乙酸缓冲液,反萃温度为17℃,相比(A/O)=1∶1,反萃时间3min,得到不同平衡pH值条件下红霉素的反萃分配系数(图5)。
, 百拇医药
在上述pH范围内,反萃分配系数与水相平衡pH近似成线性关系,对实验数据进行回归得:
D反=-35.01×pH+202.27 r=0.97
从图5可以看出,在其它条件固定时,水相平衡pH值对反萃效果影响非常显著,近似呈线性关系。由于红霉素对酸的稳定性很差,在pH低于6.0的情况下,容易降解。因此要选择合适的pH值,使其既要满足一定的反萃取能力,又要保证红霉素的生物活性。在实际操作过程中,一般选择反萃水相出口pH值在4.5~5.0之间。为了进一步降低反萃酸水中红霉素的降解,在实验中把得到的反萃液立即回调pH值到6.0,然后再进行吹溶媒以及成盐等操作步骤。

图4 红霉素反萃平衡等温线

, 百拇医药
图5 反萃pH对分配系数的影响
2.3.3 反萃温度与反萃分配系数的关系 有机相为含红霉素约10000u/ml的FA1(60% V/V)-煤油体系,反萃水相为乙酸缓冲液,反萃温度为20℃,相比(A/O)=1∶1,振荡时间3min,水相平衡pH值为4.30。改变反萃温度,得到温度与反萃分配系数的关系(图6)。
从图6可以看出,反萃分配系数随温度的增加而减小,即该过程为一放热过程。温度降低有利于提高反萃分配系数。作1nD反-1/T的关系曲线得图7。
由图7可以看出,1nD反与1/T关系呈良好的线性关系,进而可回归得到反萃分配系数与温度的关系:
1nD反=5817.95/T-16.28 r=0.998
, http://www.100md.com
2.3.4 萃取剂浓度对反萃分配系数的影响 有机相为含红霉素10000u/ml的FA1(不同配比)-煤油体系,水相为乙酸缓冲溶液,实验温度为20℃,相比1∶1,振荡时间3min,水相平衡pH为4.2~4.3,得萃取剂浓度与分配系数的关系(表5)。由表5数据可见,萃取剂浓度越高,反萃分配系数越小。
表5 萃取剂浓度对反萃分配系数的影响 No.
萃取剂浓度
[B](O)
有机相浓度C
(u/ml)
水相浓度C
(u/ml)
, 百拇医药 分配系数D反
1
0.4
134.28
10259.72
76.41
2
0.6
197.13
9794.15
49.68
3
0.8
, 百拇医药
469.49
10445.94
22.25
4
1.0
817.5
9607.93
11.75
2.4 萃取和反萃分配平衡数学模型的建立
2.4.1 萃取分配平衡数学模型 根据红霉素分子在水相中的解离平衡,萃取剂分子在有机相内的聚合反应平衡以及红霉素的萃取反应平衡关系可以推出如下数学模型[4]:

, 百拇医药
代入Ks=exp(-△Hm/RT+C)关系式
D=exp(-△Hm/RT+C).K聚[B]n(O).
(1+10pKa-pH)-1
1nD=-△Hm/RT+C+1nK聚+nln[B]n(O)-
ln(1+10pKa-pH)
设C′=C+1nK聚,D=exp(-△Hm/RT+C′)[B](O)n/(1+10pKa-pH)回归处理16组实验数据,得△Hm=36.33KJ/mol,n=1.1,pKa=8.07。
, http://www.100md.com
D为水相中抗生素浓度、pH值、有机相中萃取剂浓度和操作温度的函数,同时,与该抗生素的pKa(即Ka)值有关。

图6 温度对反萃分配系数的影响

图7 1nD反-1/T关系曲线
2.4.2 反萃取分配平衡数学模型 用18组实验数据进行回归得如下模型:
D反=(1+108.60-pH)exp(42.41×103/RT-24.88)
×[B](O)-1.08
, 百拇医药
由上述方程得待定参数:pKa=8.60,△Hm=-42.41KJ/mol,b=1.08。
2.5 萃取、反萃和成盐工艺条件的确定和现场试验
2.5.1 萃取、反萃和成盐工艺条件的确定 根据萃取和反萃工艺条件研究的结果确定采用如下工艺参数进行现场试验。
萃取 萃取体系:FA1(60% V/V)-加氢煤油(40% V/V);相比(A/O):6~8∶1;平衡pH:9.8~10.3;萃取温度:常温。
反萃取 反萃剂:乙酸缓冲液;相比(O/A):1~2∶1;平衡pH:4.5~5.0;反萃温度:常温。
成盐 硫氰酸钾浓度:50%;结晶pH:6.8~7.0;结晶温度:25~30℃;结晶时间:3h。
, 百拇医药
2.5.2 现场试验和结果 采用实际红霉素发酵滤洗液进行了新萃取体系的萃取、反萃、成盐试验。试验中萃取过程采用Φ20型离心萃取器实现二级逆流萃取,试验结果列于表6。
由表6数据可见,采用新萃取体系其萃取收率平均可达96.08%,反萃收率平均为94.96%,成盐收率平均为82.10%,三步累积平均收率78.62%,稍优于现有生产指标。新萃取体系的优越之处主要在于溶剂损失的大幅度降低,对红霉素硫氰酸盐而言,降至1.72kg/10亿单位,推算红霉素碱产品的溶剂损耗量约为2.15kg/10亿单位(按转碱收率80%计),这一数值大大低于现有的乙酸丁酯萃取工艺的溶剂损耗量。
3 讨论和结论
3.1 系统研究了FA1-煤油新萃取体系对红霉素萃取和反萃取的工艺条件,并建立了相应的分配平衡数学模型。
萃取分配模型(半经验模型):
, 百拇医药
D=exp(-36.33×103/RT+18.77).[B](O)1.1/
(1+108.07-pH)
反萃取分配模型(经验模型):
D反=(1+108.60-pH)exp(42.41×103/RT-
24.88).[B](O)-1.08
3.2 采用实际红霉素发酵滤液进行了萃取、反萃和成盐试验,取得了合格的中间产品红霉素硫氰酸盐(转碱可按现行工艺进行),试验结果表明采用新萃取体系其损耗量较乙酸丁酯大幅度降低。本研究内容可供工业生产中试用。
, http://www.100md.com
表6 现场试验结果 试验批号
1
2
3
4
5
6
7
滤洗液体积(ml)
8584
8616
10148
9920
, 百拇医药
7953
4212
4212
滤洗液效价(u/ml)
2624
2464
1578
2032
2344
2464
2464
溶媒体积(ml)
1430
, http://www.100md.com
1370
1526
1450
1452
635
635
溶媒原始效价(u/ml)
0
0
0
0
1190
0
, 百拇医药
0
萃取相比(A/O)
6.0
6.3
6.7
6.8
6.9
6.6
6.6
平衡pH
10.0
10.0
10.0
, 百拇医药
10.0
10.2
10.3
10.3
废水效价(u/ml)
87
87
60
87
93
0
0
饱和体积(ml)
, http://www.100md.com
1440
1360
1510
1467
1168
641
641
饱和效价(u/ml)
15100
13650
9250
13150
17050
, http://www.100md.com
15400
15400
萃取收率(%)
96.68
96.47
96.20
95.72
96.03
95.10
95.10
酸水体积(ml)
800
923
, http://www.100md.com
807
900
900
600
600
酸水效价(u/ml)
-
-
16000
22600
-
18560
21680
, http://www.100md.com
废水体积(ml)
1194
1340
1490
1435
1145
620
622
废水效价(u/ml)
890
465
500
1085
, http://www.100md.com
740
435
565
反萃相比(A/O)
2∶3
2∶3
1∶2
2∶3
1∶1.3
1∶1
1∶1
反萃收率(%)
94.35
, 百拇医药
96.59
94.59
91.75
95.66
97.18
96.33
成盐母液效价(u/ml)
4960
4190
3070
2861
3540
3730
, http://www.100md.com
3340
母液体积(ml)
800
910
780
900
900
600
600
成品干重(g)
20.0
22.4
16.8
, 百拇医药
20.4
23.9
12.5
12.1
成品效价(u/mg)
717
717
718
722
715
716
716
成盐收率(%)
, 百拇医药
97.34
-
80.81
87.34
-
79.90
84.59
总收率(%)
74.20
75.65
75.33
73.07
85.31
, 百拇医药
86.23
83.47
溶剂损失(升/十亿单位)
-
1.87
2.98
1.05
0.44
1.62
1.57
李洲,男,生于1936年,教授.
参考文献
1,王岳,方金瑞主编.抗生素.北京:科学出版社,1988:337
2,李洲,廖史书,雷文.制药工业中溶剂萃取技术的机制和应用发展方向.中国医药工业杂志,1996;27(2):89
3,刘昌胜,邬行彦.红霉素在几种缓冲溶液中的溶解度.中国抗生素杂志,1995;20(1):17
4,李洲,王进.大环内酯类抗生素的中性络合萃取研究.中国医药工业杂志,1997;28(10):440
修回:1999-11-09, http://www.100md.com