大鼠内毒素性休克肺ET-1 mRNA和bcl-2的表达及山莨菪碱、地塞米松对肺的保护作用
作者:陈辉 林建东 林财珠 杨锡馨
单位:福建医科大学 附属第一医院麻醉科,福州 350005
关键词:基因表达;凋亡;休克;内毒素;肺损伤;山莨菪碱;地塞米松;大鼠
福建医科大学学报000304
摘要: 目的 探讨内皮素(ET)-1 mRNA和原癌基因bcl-2在大鼠内毒素性休克肺损伤中的作用及山莨菪碱、地塞米松对肺的保护作用。 方法 24只SD大鼠随机分为4组(n=6):Ⅰ组(对照组)静注等量生理盐水;Ⅱ组(休克组)静脉注射脂多糖(LPS)5 mg/kg;Ⅲ组静注山莨菪碱4 mg/kg后0.5 h再静注LPS 5 mg/kg;Ⅳ组静注地塞米松4 mg/kg后0.5 h再静注LPS 5 mg/kg。观察5 h后取肺组织测定ET-1 mRNA和bcl-2。 结果 肺组织ET-1 mRNA表达,Ⅲ、Ⅳ组与Ⅰ组比较差异无显著性,Ⅱ组与Ⅰ、Ⅲ、Ⅳ组比较差异有非常显著性(P<0.01)。bcl-2阳性细胞率Ⅱ组轻微增加,Ⅲ、Ⅳ组显著增加,Ⅰ组阴性表达。 结论 ET-1 mRNA和bcl-2可介导大鼠内毒素性休克时肺的损伤。山莨菪碱和地塞米松可能是通过抑制ET-1 mRNA的表达和促进bcl-2的表达而起到对肺的保护作用。
, http://www.100md.com
中图分类号: R-332; R392.11; R563.02; R977.1; R996 文献标识码: A
文章编号:1000-2235(2000)03-0218-03
Expression of ET-1 mRNA and bcl-2 in Lung Injury Induced
by Endotoxin Shock and the Protective Effect of
Anisodamine or Dexamethasone
CHEN Hui LIN Jian-dong LIN Cai-zhu
(Department of Anesthesiology, The First Affiliated Hospital,Fujian Medical University, Fuzhou 350005, China)
, 百拇医药
ABSTRACT: Objective To study the role of ET-1 mRNA and bcl-2 and the protective effect of anisodamine and dexamethasone in lung injury induced by endotoxic shock. Methods Twenty-four SD mice were randomly divided into four groups(each group n=6). In group Ⅰ and Ⅱ,saline or lipopolysacharide(LPS) 5 mg/kg was administrated intravenously. In group Ⅲ and Ⅳ,anisodamine or dexamethasone was administrated at half an hour before LPS administration. The expression of ET-1 mRNA and bcl-2 of the lung tissue after five hours were analyzed by RT-PCR and immunohistochemical method. Results Expression of ET-1 mRNA in lung tissue of group Ⅱ was enhanced significantly compared with groupⅠ,Ⅲ,Ⅳ(P<0.01). There is no significant difference in group Ⅲ,Ⅳ compared with group Ⅰ. Percent rate of cells with bcl-2 expression increased markedly in group Ⅲ,Ⅳ,and only slightly in group Ⅱ. There was no expression in groupⅠ. Conclusion ET-1 mRNA and bcl-2 may induce lung injury in endotoxic shock. Anisodamine and dexamethasone could protect lung injury induced by endotoxic shock,and its mechanism might involve ET-1 mRNA inhibition and bcl-2 enhancement.
, http://www.100md.com
KEY WORDS: genes expression; apoptosis; shock,endotoxic; lung injury; anisodamine; dexamethasone; rat
内毒素性休克时引起的肺损伤等多器官功能障碍是内毒素性休克死亡的主要原因之一,内毒素性休克时肺损伤的机制尚未完全阐明。笔者于1998年11月~1999年11月选用大鼠静注脂多糖(LPS)内毒素性休克模型,观察休克时大鼠肺组织内皮素(ET)-1 mRNA和原癌基因bcl-2的表达情况,山莨菪碱、地塞米松的保护作用及相互的关系。
1 材料与方法
1.1 大鼠休克模型的制备 24只SD大鼠(福州空军医院动物中心提供),体重220~250 g,雌雄不拘。实验前禁食12 h,自由饮水。氯胺酮2 mg/100 g腹腔注射麻醉,分离颈总动脉插管经换能器测定平均动脉压。动物随机分为4组(n=6):(1)Ⅰ组(对照组),完成以上操作,静脉注射生理盐水0.5 ml;(2):Ⅱ组(休克组),静注2%LPS 5 mg/kg(LPS溶于0.5 ml 生理盐水);(3)Ⅲ组,注射山莨菪碱4 mg/kg后0.5 h再静注LPS 5 mg/kg;(4)Ⅳ组,注射地塞米松3 mg/kg(溶于0.3 ml生理盐水)后0.5 h再静注LPS 5 mg/kg。各组均观察5 h。记录血压以后断头迅速取全肺沥干血渍,取右肺组织约150 mg,-70℃冰箱冷藏,供RT-PCR用,另取肺组织浸泡于中性福尔马林液中作bcl-2 测定。
, 百拇医药
1.2 肺组织ET-1 mRNA测定 肺组织总RNA提取用TraZol液,按说明书测定。RNA提取后测定OD值,然后稀释总RNA至1 μg/μl,取2 μg总RNA用逆转录药盒,按说明书操作,合成cDNA。ET-1引物为:5'-GCT CCT GCT CCT CCT TGA TA。内对照rLp32引物为:5'-GTG AAG CCC AAA GAT CGT C-3'。
1.3 bcl-2检测 所有标本均在同一条件下采用链菌素亲生物素蛋白-过氧化酶连接法(LSAB)进行免疫组织化学染色,一抗稀释度为1∶50,各步间均用PBS洗片,用PBS代替一抗为阴性对照。结果判断:细胞浆出现棕黄色颗粒为染色阳性细胞,切片内阳性细胞率<20%者为阴性显色,>20%者为阳性显色。
1.4 统计处理 数据用 ±s表示,组间差异比较采用t检验方法。
±s表示,组间差异比较采用t检验方法。
, http://www.100md.com
2 结 果
2.1 各组实验期间血压变化情况见附表。
2.2 肺组织ET-1 mRNA表达情况 肺组织ET-1 mRNA表达与内对照比值:Ⅰ组ET-1/rLp32比值为0.56±0.05,Ⅱ、Ⅲ、Ⅳ组分别为1.04±0.13, 0.57±0.09, 0.51±0.08;Ⅲ、Ⅳ组与Ⅰ组比较差异无显著性;Ⅱ组与Ⅰ、Ⅲ、Ⅳ组比较差异有非常显著性(P<0.01)。
附表 实验期间各组血压变化(mmHg) 分 组
注药前
注药后5 h
Ⅰ组
SBP
, http://www.100md.com 150.21±11.82
148.33±16.15
DBP
101.33±13.92
103.16±20.35
Ⅱ组
SBP
142.58±12.71
88.12±17.86
DBP
107.51±15.14
65.61±14.04
, 百拇医药
Ⅲ组
SBP
147.92±15.26
126.46±14.61△
DBP
111.25±14.53
88.34±14.97
Ⅳ组
SBP
144.86±13.47
120.73±15.38△
, 百拇医药
DBP
109.52±12.04
85.81±13.76
与Ⅰ组比较,:P<0.05,:P<0.01; 与Ⅱ组比较,△:P<0.05.2.3 bcl-2表达情况 四组bcl-2表达情况见图1~4。Ⅰ组bcl-2阳性细胞率<20%;Ⅱ组>20%,弱阳性表达;Ⅲ、Ⅳ组>20%,强阳性表达。
3 讨 论
内毒素性休克常可引起包括肺损伤在内的多器官功能衰竭,其病理生理改变主要是内毒素刺激单核细胞、巨噬细胞和中性粒细胞,使大量白细胞集积于肺,引起呼吸爆发并产生活性氧,引发脂质过氧化,导致细胞膜脂质、结构蛋白和核酸等受损,造成肺组织器官的损伤。
目前已经证实呼吸系统是体内内皮素重要的合成代谢和靶器官,肺脏合成内皮素主要为内皮素-1(ET-1),并且主要为ET-1受体。ET-1具有强烈的血管收缩作用和支气管收缩作用。ET-1 释放受许多因素的影响,缺血、缺氧、内毒素、细胞因子、酸碱失衡均可促进内皮素基因表达及释放。笔者的结果显示,大鼠静注内毒素引起内毒素性休克后,肺损伤明显,且ET-1 mRNA表达增强,说明ET-1参与了内毒素性休克肺损伤的病理生理过程。机制可能是:(1)内毒素性休克时肺血流动力学的改变,通过细胞内磷脂酶C而使三磷酸肌醇和甘油二酯增加,再通过蛋白激酶C途径激活c-fos基因,产生jun/fos,然后作用于启动子AP位点,调节ET-1 mRNA的表达[1]。(2)内毒素性休克时肺血管微循环阻塞,使得组织细胞缺氧,从而诱导内皮素产生一种具有DNA结合活性的蛋白因子,它与基因的缺氧诱导性增强子特异结合,促进ET-1 mRNA的表达[2],可显著提高微血管压力,造成肺水肿。(3)内毒素性休克时两条凝血途径被激活,生成的凝血酶通过G蛋白、酪氨酸蛋白激酶途径,促进ET-1 mRNA的表达,而它的表达又可激活中性粒细胞,促进中性粒细胞的聚集[3],刺激或激活炎症细胞导致花生四烯酸释放或增加氧自由基形成[4]等,激活凝血系统,导致肺损伤。
, http://www.100md.com
近年研究证明,内毒素性休克时,胸腺、血管内皮、多形核白细胞、肠上皮细胞、心肌细胞、肾小管上皮细胞均可发生细胞凋亡。bcl-2癌基因不同于其他基因,它延长细胞的生命期限,它的表达可增加对多种促凋亡的抗性。笔者实验中对照组肺组织bcl-2阳性细胞率<20%,而休克组>20%,尽管呈弱阳性表达,亦可说明内毒素性休克时肺细胞发生了凋亡。内毒素性休克引起肺细胞凋亡的机制可能是:(1)对抗细胞凋亡的原癌基因bcl-2,其对抗作用是通过抑制内质网释放Ca2+,使细胞内Ca2+下降而实现的[5]。(2)内毒素性休克时产生大量氧自由基,它诱导细胞凋亡是其细胞毒作用杀伤细胞的重要机制之一。bcl-2基因的蛋白表达产物,定位于氧自由基产生的线粒体膜、核膜和内质网,因此有人认为bcl-2基因产物的这一分布与防止脂质过氧化的功能密切相关[6]。(3)自由基介导的细胞凋亡可通过直接DNA损伤,激活ADP核糖转移酶或间接通过核转录因子(NF-κB)使细胞发生凋亡。而氧自由基增加可使Ca2+不能进入内质网,在细胞内增加,导致核酸内切酶激活从而引起细胞凋亡[7]。
, 百拇医药
治疗内毒素性休克的经典药物山莨菪碱已广泛用于临床,它可解痉、改善微循环和防治缺血再灌注损伤等。笔者发现,山莨菪碱能诱导内毒素休克肺组织bcl-2基因的表达,抑制ET-1 mRNA的表达。山莨菪碱有抗氧自由基和Ca2+拮抗作用,它对内毒素性休克的保护作用机制可能是:(1)具有抗氧化性,可直接清除氧自由基,保护膜蛋白巯基[8],从而诱导bcl-2基因表达和抑制ET-1 mRNA的表达;(2)抑制血小板聚集及血栓形成[9],抑制ET-1 mRNA的表达;(3)抑制细胞内游离钙的升高,避免钙超载发生[10],从而诱导bcl-2基因的表达。
糖皮质激素地塞米松有抗氧化剂的特点和膜保护活性,可抑制水肿和炎症细胞的聚集,阻止炎症介质的产生及使肺泡表面活性物质的生成增加,它对内毒素性休克肺损伤的保护作用可能与它改变肺组织膜脂的过氧化、自由基的形成及细胞内Ca2+分布等有关,从而抑制ET-1 mRNA的表达,及诱导保护基因bcl-2的表达。
, 百拇医药
笔者的研究表明,内毒素性休克时肺ET-1 mRNA与bcl-2的异常表达是内毒素性休克肺损伤的病理生理过程之一,同时表明山莨菪碱和地塞米松对内毒素性休克肺损伤的保护作用,可能是通过抑制ET-1 mRNA表达和诱导bcl-2的表达而发挥作用,这将有助于重新认识内毒素性休克时肺损伤的发生机制,为治疗提供新的理论基础。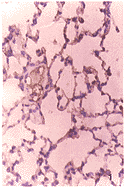
图1 假休克组肺组织bcl-2的阴性表达
图2 休克组肺组织bcl-2的弱阳性表达
图3 东莨菪碱组肺组织bcl-25的强阳性表达
, 百拇医药
图4 地塞米松组肺组织bcl-2的强阳性表达
作者简介:陈 辉(1967~),男,主治医师,医学硕士.
参考文献:
[1] Shindo T,Kurihara H,Kurihara Y,et al. Upregulation of endothelin-1 and adrenomedullin gene expression in the mouse endotoxin shock model[J]. J Cardiovasc Pharmacol, 1998,31(Suppl 1):541~544.
[2] 柳君泽,侯晓丽,方德福.基因的缺氧诱导性调控[J].基础医学与临床, 1997,17(1):15~21.
[3] Gomez-Garre D,Guerm M,Gonzalez E,et al. Aggregation of human polymorphonuclear leukocytes by endothelin: role of platelet-activating factor[J]. Eur J Pharmacol, 1993,224:167~173.
, http://www.100md.com
[4] Ninomiya H,Yu XY,Hasegawa S,et al. Endothelin-1 induces stimulation of prostaglandin synthesis in cells obtained from canine airways by bronchoaveolar lavage[J]. Prostaglanlins, 1992,73:401~408.
[5] Baffy G,Moyashita T,Williamson JR,et al. Apoptosis induced by withdrawal of interleukin-3(IL-3) from an IL-3 dependent hematopoietic cell line is associated with repartitioning of intracellular calcium and is blocked by enforced bcl-2 oncoprotein production[J]. J Biol Chem, 1991,268(9):6511~6519.
, 百拇医药
[6] Korsmeys S. Bcl-2 initiates a new category of oncogenes:regulators of cell death[J]. Blood, 1992,80:879~886.
[7] Christ M,Luu B,Mejia JE,et al. Apoptosis induced by oyster roles in murine lymphoma cell and in normal thymocytes[J]. Immunology, 1993,78(3):455~460.
[8] 黄林帮,申 力,韩 光,等. 别嘌呤醇、山莨菪碱对大鼠应激性损伤的保护作用[J]. 中国病理生理杂志, 1994,10:257~260.
[9] 张英鸽,可 君. 莨菪类药物对大鼠脑、心肌血流量和心指数的影响[J]. 中国药理学与毒理学杂志, 1992,6:110~114.
[10] 王宝蓉,谭月华. 山莨菪碱的细胞保护作用与钙拮抗[J]. 中国药理学通报, 1992,8:257~261.
收稿日期:2000-01-20, http://www.100md.com
单位:福建医科大学 附属第一医院麻醉科,福州 350005
关键词:基因表达;凋亡;休克;内毒素;肺损伤;山莨菪碱;地塞米松;大鼠
福建医科大学学报000304
摘要: 目的 探讨内皮素(ET)-1 mRNA和原癌基因bcl-2在大鼠内毒素性休克肺损伤中的作用及山莨菪碱、地塞米松对肺的保护作用。 方法 24只SD大鼠随机分为4组(n=6):Ⅰ组(对照组)静注等量生理盐水;Ⅱ组(休克组)静脉注射脂多糖(LPS)5 mg/kg;Ⅲ组静注山莨菪碱4 mg/kg后0.5 h再静注LPS 5 mg/kg;Ⅳ组静注地塞米松4 mg/kg后0.5 h再静注LPS 5 mg/kg。观察5 h后取肺组织测定ET-1 mRNA和bcl-2。 结果 肺组织ET-1 mRNA表达,Ⅲ、Ⅳ组与Ⅰ组比较差异无显著性,Ⅱ组与Ⅰ、Ⅲ、Ⅳ组比较差异有非常显著性(P<0.01)。bcl-2阳性细胞率Ⅱ组轻微增加,Ⅲ、Ⅳ组显著增加,Ⅰ组阴性表达。 结论 ET-1 mRNA和bcl-2可介导大鼠内毒素性休克时肺的损伤。山莨菪碱和地塞米松可能是通过抑制ET-1 mRNA的表达和促进bcl-2的表达而起到对肺的保护作用。
, http://www.100md.com
中图分类号: R-332; R392.11; R563.02; R977.1; R996 文献标识码: A
文章编号:1000-2235(2000)03-0218-03
Expression of ET-1 mRNA and bcl-2 in Lung Injury Induced
by Endotoxin Shock and the Protective Effect of
Anisodamine or Dexamethasone
CHEN Hui LIN Jian-dong LIN Cai-zhu
(Department of Anesthesiology, The First Affiliated Hospital,Fujian Medical University, Fuzhou 350005, China)
, 百拇医药
ABSTRACT: Objective To study the role of ET-1 mRNA and bcl-2 and the protective effect of anisodamine and dexamethasone in lung injury induced by endotoxic shock. Methods Twenty-four SD mice were randomly divided into four groups(each group n=6). In group Ⅰ and Ⅱ,saline or lipopolysacharide(LPS) 5 mg/kg was administrated intravenously. In group Ⅲ and Ⅳ,anisodamine or dexamethasone was administrated at half an hour before LPS administration. The expression of ET-1 mRNA and bcl-2 of the lung tissue after five hours were analyzed by RT-PCR and immunohistochemical method. Results Expression of ET-1 mRNA in lung tissue of group Ⅱ was enhanced significantly compared with groupⅠ,Ⅲ,Ⅳ(P<0.01). There is no significant difference in group Ⅲ,Ⅳ compared with group Ⅰ. Percent rate of cells with bcl-2 expression increased markedly in group Ⅲ,Ⅳ,and only slightly in group Ⅱ. There was no expression in groupⅠ. Conclusion ET-1 mRNA and bcl-2 may induce lung injury in endotoxic shock. Anisodamine and dexamethasone could protect lung injury induced by endotoxic shock,and its mechanism might involve ET-1 mRNA inhibition and bcl-2 enhancement.
, http://www.100md.com
KEY WORDS: genes expression; apoptosis; shock,endotoxic; lung injury; anisodamine; dexamethasone; rat
内毒素性休克时引起的肺损伤等多器官功能障碍是内毒素性休克死亡的主要原因之一,内毒素性休克时肺损伤的机制尚未完全阐明。笔者于1998年11月~1999年11月选用大鼠静注脂多糖(LPS)内毒素性休克模型,观察休克时大鼠肺组织内皮素(ET)-1 mRNA和原癌基因bcl-2的表达情况,山莨菪碱、地塞米松的保护作用及相互的关系。
1 材料与方法
1.1 大鼠休克模型的制备 24只SD大鼠(福州空军医院动物中心提供),体重220~250 g,雌雄不拘。实验前禁食12 h,自由饮水。氯胺酮2 mg/100 g腹腔注射麻醉,分离颈总动脉插管经换能器测定平均动脉压。动物随机分为4组(n=6):(1)Ⅰ组(对照组),完成以上操作,静脉注射生理盐水0.5 ml;(2):Ⅱ组(休克组),静注2%LPS 5 mg/kg(LPS溶于0.5 ml 生理盐水);(3)Ⅲ组,注射山莨菪碱4 mg/kg后0.5 h再静注LPS 5 mg/kg;(4)Ⅳ组,注射地塞米松3 mg/kg(溶于0.3 ml生理盐水)后0.5 h再静注LPS 5 mg/kg。各组均观察5 h。记录血压以后断头迅速取全肺沥干血渍,取右肺组织约150 mg,-70℃冰箱冷藏,供RT-PCR用,另取肺组织浸泡于中性福尔马林液中作bcl-2 测定。
, 百拇医药
1.2 肺组织ET-1 mRNA测定 肺组织总RNA提取用TraZol液,按说明书测定。RNA提取后测定OD值,然后稀释总RNA至1 μg/μl,取2 μg总RNA用逆转录药盒,按说明书操作,合成cDNA。ET-1引物为:5'-GCT CCT GCT CCT CCT TGA TA。内对照rLp32引物为:5'-GTG AAG CCC AAA GAT CGT C-3'。
1.3 bcl-2检测 所有标本均在同一条件下采用链菌素亲生物素蛋白-过氧化酶连接法(LSAB)进行免疫组织化学染色,一抗稀释度为1∶50,各步间均用PBS洗片,用PBS代替一抗为阴性对照。结果判断:细胞浆出现棕黄色颗粒为染色阳性细胞,切片内阳性细胞率<20%者为阴性显色,>20%者为阳性显色。
1.4 统计处理 数据用
 ±s表示,组间差异比较采用t检验方法。
±s表示,组间差异比较采用t检验方法。, http://www.100md.com
2 结 果
2.1 各组实验期间血压变化情况见附表。
2.2 肺组织ET-1 mRNA表达情况 肺组织ET-1 mRNA表达与内对照比值:Ⅰ组ET-1/rLp32比值为0.56±0.05,Ⅱ、Ⅲ、Ⅳ组分别为1.04±0.13, 0.57±0.09, 0.51±0.08;Ⅲ、Ⅳ组与Ⅰ组比较差异无显著性;Ⅱ组与Ⅰ、Ⅲ、Ⅳ组比较差异有非常显著性(P<0.01)。
附表 实验期间各组血压变化(mmHg) 分 组
注药前
注药后5 h
Ⅰ组
SBP
, http://www.100md.com 150.21±11.82
148.33±16.15
DBP
101.33±13.92
103.16±20.35
Ⅱ组
SBP
142.58±12.71
88.12±17.86
DBP
107.51±15.14
65.61±14.04
, 百拇医药
Ⅲ组
SBP
147.92±15.26
126.46±14.61△
DBP
111.25±14.53
88.34±14.97
Ⅳ组
SBP
144.86±13.47
120.73±15.38△
, 百拇医药
DBP
109.52±12.04
85.81±13.76
与Ⅰ组比较,:P<0.05,:P<0.01; 与Ⅱ组比较,△:P<0.05.2.3 bcl-2表达情况 四组bcl-2表达情况见图1~4。Ⅰ组bcl-2阳性细胞率<20%;Ⅱ组>20%,弱阳性表达;Ⅲ、Ⅳ组>20%,强阳性表达。
3 讨 论
内毒素性休克常可引起包括肺损伤在内的多器官功能衰竭,其病理生理改变主要是内毒素刺激单核细胞、巨噬细胞和中性粒细胞,使大量白细胞集积于肺,引起呼吸爆发并产生活性氧,引发脂质过氧化,导致细胞膜脂质、结构蛋白和核酸等受损,造成肺组织器官的损伤。
目前已经证实呼吸系统是体内内皮素重要的合成代谢和靶器官,肺脏合成内皮素主要为内皮素-1(ET-1),并且主要为ET-1受体。ET-1具有强烈的血管收缩作用和支气管收缩作用。ET-1 释放受许多因素的影响,缺血、缺氧、内毒素、细胞因子、酸碱失衡均可促进内皮素基因表达及释放。笔者的结果显示,大鼠静注内毒素引起内毒素性休克后,肺损伤明显,且ET-1 mRNA表达增强,说明ET-1参与了内毒素性休克肺损伤的病理生理过程。机制可能是:(1)内毒素性休克时肺血流动力学的改变,通过细胞内磷脂酶C而使三磷酸肌醇和甘油二酯增加,再通过蛋白激酶C途径激活c-fos基因,产生jun/fos,然后作用于启动子AP位点,调节ET-1 mRNA的表达[1]。(2)内毒素性休克时肺血管微循环阻塞,使得组织细胞缺氧,从而诱导内皮素产生一种具有DNA结合活性的蛋白因子,它与基因的缺氧诱导性增强子特异结合,促进ET-1 mRNA的表达[2],可显著提高微血管压力,造成肺水肿。(3)内毒素性休克时两条凝血途径被激活,生成的凝血酶通过G蛋白、酪氨酸蛋白激酶途径,促进ET-1 mRNA的表达,而它的表达又可激活中性粒细胞,促进中性粒细胞的聚集[3],刺激或激活炎症细胞导致花生四烯酸释放或增加氧自由基形成[4]等,激活凝血系统,导致肺损伤。
, http://www.100md.com
近年研究证明,内毒素性休克时,胸腺、血管内皮、多形核白细胞、肠上皮细胞、心肌细胞、肾小管上皮细胞均可发生细胞凋亡。bcl-2癌基因不同于其他基因,它延长细胞的生命期限,它的表达可增加对多种促凋亡的抗性。笔者实验中对照组肺组织bcl-2阳性细胞率<20%,而休克组>20%,尽管呈弱阳性表达,亦可说明内毒素性休克时肺细胞发生了凋亡。内毒素性休克引起肺细胞凋亡的机制可能是:(1)对抗细胞凋亡的原癌基因bcl-2,其对抗作用是通过抑制内质网释放Ca2+,使细胞内Ca2+下降而实现的[5]。(2)内毒素性休克时产生大量氧自由基,它诱导细胞凋亡是其细胞毒作用杀伤细胞的重要机制之一。bcl-2基因的蛋白表达产物,定位于氧自由基产生的线粒体膜、核膜和内质网,因此有人认为bcl-2基因产物的这一分布与防止脂质过氧化的功能密切相关[6]。(3)自由基介导的细胞凋亡可通过直接DNA损伤,激活ADP核糖转移酶或间接通过核转录因子(NF-κB)使细胞发生凋亡。而氧自由基增加可使Ca2+不能进入内质网,在细胞内增加,导致核酸内切酶激活从而引起细胞凋亡[7]。
, 百拇医药
治疗内毒素性休克的经典药物山莨菪碱已广泛用于临床,它可解痉、改善微循环和防治缺血再灌注损伤等。笔者发现,山莨菪碱能诱导内毒素休克肺组织bcl-2基因的表达,抑制ET-1 mRNA的表达。山莨菪碱有抗氧自由基和Ca2+拮抗作用,它对内毒素性休克的保护作用机制可能是:(1)具有抗氧化性,可直接清除氧自由基,保护膜蛋白巯基[8],从而诱导bcl-2基因表达和抑制ET-1 mRNA的表达;(2)抑制血小板聚集及血栓形成[9],抑制ET-1 mRNA的表达;(3)抑制细胞内游离钙的升高,避免钙超载发生[10],从而诱导bcl-2基因的表达。
糖皮质激素地塞米松有抗氧化剂的特点和膜保护活性,可抑制水肿和炎症细胞的聚集,阻止炎症介质的产生及使肺泡表面活性物质的生成增加,它对内毒素性休克肺损伤的保护作用可能与它改变肺组织膜脂的过氧化、自由基的形成及细胞内Ca2+分布等有关,从而抑制ET-1 mRNA的表达,及诱导保护基因bcl-2的表达。
, 百拇医药
笔者的研究表明,内毒素性休克时肺ET-1 mRNA与bcl-2的异常表达是内毒素性休克肺损伤的病理生理过程之一,同时表明山莨菪碱和地塞米松对内毒素性休克肺损伤的保护作用,可能是通过抑制ET-1 mRNA表达和诱导bcl-2的表达而发挥作用,这将有助于重新认识内毒素性休克时肺损伤的发生机制,为治疗提供新的理论基础。

图1 假休克组肺组织bcl-2的阴性表达

图2 休克组肺组织bcl-2的弱阳性表达

图3 东莨菪碱组肺组织bcl-25的强阳性表达

, 百拇医药
图4 地塞米松组肺组织bcl-2的强阳性表达
作者简介:陈 辉(1967~),男,主治医师,医学硕士.
参考文献:
[1] Shindo T,Kurihara H,Kurihara Y,et al. Upregulation of endothelin-1 and adrenomedullin gene expression in the mouse endotoxin shock model[J]. J Cardiovasc Pharmacol, 1998,31(Suppl 1):541~544.
[2] 柳君泽,侯晓丽,方德福.基因的缺氧诱导性调控[J].基础医学与临床, 1997,17(1):15~21.
[3] Gomez-Garre D,Guerm M,Gonzalez E,et al. Aggregation of human polymorphonuclear leukocytes by endothelin: role of platelet-activating factor[J]. Eur J Pharmacol, 1993,224:167~173.
, http://www.100md.com
[4] Ninomiya H,Yu XY,Hasegawa S,et al. Endothelin-1 induces stimulation of prostaglandin synthesis in cells obtained from canine airways by bronchoaveolar lavage[J]. Prostaglanlins, 1992,73:401~408.
[5] Baffy G,Moyashita T,Williamson JR,et al. Apoptosis induced by withdrawal of interleukin-3(IL-3) from an IL-3 dependent hematopoietic cell line is associated with repartitioning of intracellular calcium and is blocked by enforced bcl-2 oncoprotein production[J]. J Biol Chem, 1991,268(9):6511~6519.
, 百拇医药
[6] Korsmeys S. Bcl-2 initiates a new category of oncogenes:regulators of cell death[J]. Blood, 1992,80:879~886.
[7] Christ M,Luu B,Mejia JE,et al. Apoptosis induced by oyster roles in murine lymphoma cell and in normal thymocytes[J]. Immunology, 1993,78(3):455~460.
[8] 黄林帮,申 力,韩 光,等. 别嘌呤醇、山莨菪碱对大鼠应激性损伤的保护作用[J]. 中国病理生理杂志, 1994,10:257~260.
[9] 张英鸽,可 君. 莨菪类药物对大鼠脑、心肌血流量和心指数的影响[J]. 中国药理学与毒理学杂志, 1992,6:110~114.
[10] 王宝蓉,谭月华. 山莨菪碱的细胞保护作用与钙拮抗[J]. 中国药理学通报, 1992,8:257~261.
收稿日期:2000-01-20, http://www.100md.com