脂多糖刺激肺血管内巨噬细胞环氧合酶-2表达的意义
作者:伍伟玲 陈正堂 蔡恩齐 罗显荣 李胜亮
单位:伍伟玲(解放军第四五八医院呼吸内科,广州,510602);陈正堂 蔡恩齐 罗显荣 李胜亮(第三军医大学附属新桥医院全军肿瘤中心 400037 重庆)
关键词:脂多糖类;巨噬细胞,肺血管内;前列腺素;肺损伤,急性
中华创伤杂志000308摘 要:目的 探讨脂多糖(LPS)对肺血管内巨噬细胞(PIM)环氧合酶-2(COX-2)的作用及意义。 方法 改良法分离、培养猪PIM,以LPS(10 μg/ml)刺激,反转录聚合酶链反应(RT-PCR)检测COX-2 mRNA的变化;免疫组化染色法观察COX-2酶蛋白的改变;放射免疫分析法(RIA)测定前列腺素E2(PGE2)变化,以间接显示COX活性的改变。 结果 LPS刺激后,PIM COX-2 mRNA和酶蛋白表达及PGE2浓度急剧增加,显著高于对照组(P<0.01);COX-2酶蛋白表达与细胞上清PGE2含量呈正相关(r=0.94,P<0.01)。 结论 LPS刺激后,PIM COX-2诱导性表达,导致前列腺素(PGs)大量合成和释放,可能在急性肺损伤 (ALI)的发病中起重要作用。
, 百拇医药
Changes of cyclooxygenase-2 in pulmonary intravascular macrophages stimulated by lipopolysaccharides
WU Weiling CHEN Zhengtang CAI Enqi, et al.
(Cancer Center of PLA, Xingqiao Hospital, The Third Military Medical University, Chongqing 400037, China)
Abstract:Objective To study the changes of cyclooxygenase-2 (COX-2) in pulmonary intravascular macrophages (PIMs) stimulated by lipopolysaccharides (LPS). Methods With modification, porcine PIMs were isolated, cultured and stimulated by LPS (10 μg/ml). The changes of COX-2 mRNA was detected by reverse transcription-polymerase chain reaction (RT-PCR). The changes of enzyme protein of COX-2 were observed with a method of immunohistochemistry stain. The content of prostaglandin E2 (PGE2) in the supernatant of PIMs was measured by radio-immunoassay (RIA) so as to indirectly show activity change of COX. Results With LPS stimulation, the expression of PIMs, COX-2 mRNA, enzyme protein and the levels of PGE2 were increased more rapidly than those in the control group (P<0.01). Positive correlation was found between the expression of COX-2 enzyme protein and the content of PGE2 (r=0.94,P<0.01). Conclusions After stimulation of LPS, the synthesis and release of PGs caused by inducible expression of COX-2 in PIMs might play an important role in development of acute lung injury (ALI).
, http://www.100md.com
Key words:Lipopolysaccharides; Macrophages, pulmonary intravascular; Prostaglandins; Lung injuries, acute▲
肺血管内巨噬细胞(pulmonary intravascular macrophage, PIM)为位于肺泡壁毛细血管腔内的肺内单核/巨噬细胞成员之一[1],吞噬、分泌功能非常活跃。Bertram等[2]曾发现,PIM可经环氧合酶(cyclooxygenase,COX)代谢花生四烯酸(arcachidonic acid,AA),释放AA代谢产物(AAM)等炎症介质。Wilbom等[3]报告COX有两型,其中COX-1起生理调节作用; COX-2为诱导型,在脂多糖(LPS)等的刺激下,可大量释放AAM,在机体的炎症反应中起重要作用;并发现肺泡巨噬细胞有COX-2表达。但PIM是否同时存在两型COX,并在急性肺损伤(ALI)等急性炎症性疾病中发挥作用,报道甚少。笔者报告LPS刺激猪PIM后,其COX-2 mRNA和酶蛋白表达量及COX-2活性的改变,进而探讨ALI的发病机制。
, http://www.100md.com
材料与方法
1. 猪PIM的分离、培养:按李胜亮等[4]报告的方法,并行下列改良:一是开胸后不取出心肺,行原位肺灌洗;二是含氯化钙的灌洗液临用前才配制,避免沉淀物影响肺血管灌洗。
2. 实验分组及标本收集 : 吹打下经常规培养2 h后的猪(重庆地区杂种猪)PIM。分为对照组:PIM在无血清的RPMI 1640(Sigma公司,美国)中培养; LPS组:向培养基中加入10 μg/ml 的LPS (escherichia coli serotype 055:B5,Sigma公司,美国)以刺激细胞。检测COX-2 mRNA表达时,收集刺激后0.5,1,2,4,6和8 h 的细胞待测;观察酶蛋白表达和前列腺素E2(PGE2)含量时,则增加12,16,20和24 h 等时相点。
3.COX-2 mRNA检测:用反转录聚合酶链反应(RT-PCR)法。用总RNA提取试剂盒(宝灵曼公司,德国),一步热酚法提取细胞总RNA。取总RNA 1 μg ,65℃变性5 min,依次加入0.5 μg oligo-dT15(Promega公司,美国),4 μl 5×RT-PCR合成酶缓冲液(systhese buffer,含Mg2+ 2.5 mmol/L)(Promega公司,美国),0.125 mmol/L dNTP,10 U反转录酶(AMV),0.01 mmol/L DTT, 40 U RNAase抑制剂,总体积为20 μl。42℃孵育60 min,95℃ 10 min 终止反应,完成cDNA第一链的合成。PCR时, COX-2寡核苷酸引物合成根据Lee等[5]的设计合成。 正义引物:5′-ACTCACTCAGTTTGTTGAGTCATTC-3′。 反义引物:5′-TTTGATTAGTACTGTAGGGTTAATG-3′,用这对引物可特异性扩增出583 bp的COX-2 cDNA序列。为进行质控,每次行RT-PCR时,都对应扩增次黄嘌呤磷酸转移酶(HPRT)作为外对照。HPRT寡核苷酸引物根据Osawa等[6]的设计合成。正义引物:5′-GCTGGTGAAAAGGACCTCTCG-3′, 反义引物:5′-GCAGATGGCCACAGGACTAGA-3′。用这对引物可特异性扩增出258 bp 的HPRT cDNA序列。取1 μl反转录反应液,分别加入5 μl 10×PCR缓冲液 ,1.75 mmol/L Mg2+,0.2 mmol/L dNTP,0.4 μmol/L COX-2或HPRT寡核苷酸引物,5个单位 Taq DNA聚合酶,总反应体积为50 μl,一式三管。PCR反应所需变性、退火和延伸温度分别为94℃,55℃和72℃,反应时间均为1 min,共循环30次。首次94℃下循环需2 min。反应完成后取5 μl PCR反应产物行1.5%琼脂糖凝胶电泳。以PCR maker为分子量标准,对电泳黑白照片进行密度扫描,测其积分吸光度值。
, http://www.100md.com
4. COX-2酶蛋白的检测:采用链霉抗生素蛋白-过氧化物酶连结法(streptavidin-peroxidase conjugated method )[7]。取刺激后0.5,1,2,4,6,8,12,16,20和24 h的细胞 ,加羊抗鼠COX-2多克隆抗体(一抗,中山公司),4℃过夜;再加生物素标记兔抗山羊IgG(二抗,中山公司),37℃温育0.5 h,DAB显色5 min。阴性对照时一抗用0.01 mol/L PBS代替。染色后光镜下作定性观察,在图像分析系统上作定量分析。在每帧图像上随机取10个细胞的积分吸光度值代表免疫反应强度。
5. PIM上清PGE2浓度测定:采用放射免疫法。调PIM为5×106/ml,如上施以刺激;离心,PBS洗2次;加入含30 μmol/L AA的新鲜RPMI 1640培养液,培养10 min;离心,留取上清液,用3H标计的PGE2测量试剂盒 (购自解放军第三O一医院) 检测,操作方法按说明书进行。
, http://www.100md.com
6.统计学分析:实验数据以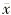 ±s表示,行双因素方差分析和相关分析处理。
±s表示,行双因素方差分析和相关分析处理。
结 果
1. LPS刺激前后PIM COX-2 mRNA的变化:两组PIM HPRT mRNA表达恒定,无显著性差异,表明该实验方法可靠,结果具有可比性。正常对照组PIM COX-2 mRNA无表达。LPS刺激后,COX-2 mRNA从刺激后0.5 h起即增加,4 h达峰值,各时相点均显著高于对照组(P<0.01)。见图1,表1。
, http://www.100md.com
图1 LPS组COX-2mRNA表达(特异性COX-2片段为583 bp,表达峰值在LPS刺激后4 h) RT-PCR
表1 LPS刺激后PIM COX-2 mRNA 表达分析(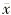 ±s) 组别
±s) 组别
猪数
LPS刺激后时间(h)
0.5
1
2
4
6
, 百拇医药
8
对照组
8
0.50±0.05
0.56±0.04
0.63±0.09
0.55±0.07
0.55±0.01
0.54±0.01
LPS组
8
25.03±1.68*
, 百拇医药
49.35±12.87*
60.94±10.5*
87.93±1.61*
64.05±2.07*
34.96±2.24*
与对照组比较:*P<0.01 2. LPS刺激前后PIM COX-2 酶蛋白的变化:对照组几乎无表达。LPS刺激后, COX-2酶蛋白从0.5 h起增加,峰值在刺激后12 h,各时相点显著高于对照组(P<0.01)。见图2,表2。
表2 LPS刺激后PIM COX-2免疫组化分析(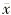 ±s) 组别
±s) 组别
, 百拇医药
猪数
LPS刺激后的时间(h)
0.5
1
2
4
6
8
12
16
20
24
对照组
, 百拇医药 8
3.29±
4.56±
5.15±
5.8±
5.79±
5.14±
4.28±
5.69±
6.30±
6.67±
2.34
3.26
, 百拇医药
3.33
3.34
2.53
2.46
2.54
3.61
2.24
4.22
LPS组
8
26.50±
28.64±
35.22±
, 百拇医药
38.83±
60.63±
87.12±
101.73±
82.73±
61.68±
47.59±
9.63*
8.61*
6.70*
10.68*
, http://www.100md.com 14.24*
16.49*
17.31*
17.13*
10.32*
17.00*
与对照组比较:*P<0.01
图2 LPS刺激后12 h PIM COX-2酶蛋白免疫组化(核周、胞浆、胞膜上呈棕褐色阳性着色 ×200)
, http://www.100md.com
3. LPS刺激前后PIM上清PGE2浓度的变化:对照组无变化(P<0.05)。LPS刺激后,各时相点PGE2均显著高于对照组(P<0.01),且其变化与COX-2 酶蛋白的变化趋势一致,两者呈显著性正相关(r=0.94, P<0.01)。见表3。
表3 LPS刺激后PIM PGE2放射免疫法测定结果(ng/ml,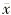 ±s) 组别
±s) 组别
猪数
LPS刺激后的时间(h)
0.5
1
, http://www.100md.com
2
4
6
8
12
16
20
24
对照组
8
1.47±
1.40±
1.45±
1.42±
, 百拇医药
1.39±
1.41±
1.36±
1.33±
1.35±
1.40±
0.09
0.03
0.06
0.04
0.04
0.06
0.04
, 百拇医药
0.01
0.01
0.06
LPS组
8
2.74±
3.49±
4.71±
4.99±
6.34±
6.76±
8.85±
6.41±
, 百拇医药
5.73±
4.95±
0.08*
0.24*
0.02*
0.58*
1.76*
0.75*
0.10*
0.18*
1.22*
, http://www.100md.com
1.17*
与对照组比较:*P<0.01讨 论
PIMs是肺巨噬细胞亚型之一,经黏附斑块黏附于毛细血管内皮细胞表面,与血流有广泛的接触面积。PIM通过吞噬和消化肺循环中的细菌等微生物,形成肺的第一道防线,同时其本身亦被激活。李胜亮等[8]报告,在LPS的刺激下,PIM可释放多种细胞因子或炎症介质如白介素-1,6,8和TNF-α等。提示在严重的血源性感染的情况下,PIM可能参与ALI和全身炎症反应综合征(SIRS)的发病;而且,由于其处在首先被激活的特殊部位,可能在ALI的始动环节中起重要作用。
在本实验中观察到,在未刺激的正常状态下,PIM的COX-2 mRNA及酶蛋白无表达,其主要代谢产物PGE2的水平低且恒定;而LPS(10 μg/ml)刺激后,PIM COX-2 mRNA、酶蛋白表达及其培养上清液中PGE2 含量大量增加。结合Bertram等[2]的实验结果(即PIM可在无刺激的情况下,经COX代谢产生AAM)表明,PIM同时存在COX-1和COX-2 ;而COX-2酶蛋白的表达与PGE2 浓度变化趋势一致,且呈显著正相关(r=0.94, P<0.01),表明LPS刺激PIM所致的PGE2增加主要是由COX-2表达增加所致,可能与COX-1关系不大。Lee等[5]用LPS刺激肺泡巨噬细胞,发现刺激前后COX-1无显著性变化,而COX-2则大量诱导性表达 ,更进一步证明了这一点。COX是AA代谢通路中的第一限速酶。COX-2的大量表达,导致TXA2 、TXB2和PGE2 等代谢产物大量合成释放,在整体情况下,导致AAM间的失衡,引起白细胞活化、血管通透性增加等一系列病理生理改变,诱导或加重失控性炎症反应。因此,本实验结果提示,在LPS等致病因子的作用下,PIM通过COX-2的诱导性表达,在ALI等机体的急性炎症性疾病的发病中起重要作用;选择性抑制COX-2的表达及活性,可能有助于改善机体的炎症反应,给ALI的治疗带来新的途径。
, http://www.100md.com
基金项目:国家自然科学基金资助项目(39670311)
参考文献:
[1]Warner AE, Brajn JD. The cell biology and pathogenic role of pulmonary intravascular macrophage. Am J Physiol, 1990, 258:L1-L2.
[2]Bertram TA, Overby LH, Danitowicz R, et al. Pulmonary intravascular macrophages metabolize arachidonic acid. Am Rev Respir Dis, 1988, 138:936-940.
[3]Wilborn J,Dewitt DL,Peters-Golden M. Expression and role of cyclooxygenase isoforms in alveolar and peritoneal macrophage. Am Physiol, 1995, 268:294-301.
, http://www.100md.com
[4]李胜亮,陈正堂,金敬顺.肺血管内巨噬细胞的分离、培养及鉴定.中华病理学杂志, 1998, 27:66-67.
[5]Lee SH, Soyoola E, Chanmugam D, et al. Selective expression of Mitogen-inducible cyclooxygenase in macrophages stimulated with Lipopolysaccharide. J Biol Chem, 1992, 267:25934-25938.
[6]Osawa M, Hamada HI, Hamade H, et al. Long term lymphopematopoietic reconstitution by a single CD34-low/negative hematopoietic stem cell. Science, 1996, 273:242-245.
[7]蔡文琴,王伯沄,主编.实用免疫细胞化学与核酸分子杂交技术.第1版.成都:四川科学技术出版社, 1994. 91-94.
[8]李胜亮,陈正堂,金敬顺.脂多糖致肺血管内巨噬细胞形态和功能的改变.中华结核和呼吸杂志, 1998, 3:167-169.
收稿日期:1998-11-08, 百拇医药
单位:伍伟玲(解放军第四五八医院呼吸内科,广州,510602);陈正堂 蔡恩齐 罗显荣 李胜亮(第三军医大学附属新桥医院全军肿瘤中心 400037 重庆)
关键词:脂多糖类;巨噬细胞,肺血管内;前列腺素;肺损伤,急性
中华创伤杂志000308摘 要:目的 探讨脂多糖(LPS)对肺血管内巨噬细胞(PIM)环氧合酶-2(COX-2)的作用及意义。 方法 改良法分离、培养猪PIM,以LPS(10 μg/ml)刺激,反转录聚合酶链反应(RT-PCR)检测COX-2 mRNA的变化;免疫组化染色法观察COX-2酶蛋白的改变;放射免疫分析法(RIA)测定前列腺素E2(PGE2)变化,以间接显示COX活性的改变。 结果 LPS刺激后,PIM COX-2 mRNA和酶蛋白表达及PGE2浓度急剧增加,显著高于对照组(P<0.01);COX-2酶蛋白表达与细胞上清PGE2含量呈正相关(r=0.94,P<0.01)。 结论 LPS刺激后,PIM COX-2诱导性表达,导致前列腺素(PGs)大量合成和释放,可能在急性肺损伤 (ALI)的发病中起重要作用。
, 百拇医药
Changes of cyclooxygenase-2 in pulmonary intravascular macrophages stimulated by lipopolysaccharides
WU Weiling CHEN Zhengtang CAI Enqi, et al.
(Cancer Center of PLA, Xingqiao Hospital, The Third Military Medical University, Chongqing 400037, China)
Abstract:Objective To study the changes of cyclooxygenase-2 (COX-2) in pulmonary intravascular macrophages (PIMs) stimulated by lipopolysaccharides (LPS). Methods With modification, porcine PIMs were isolated, cultured and stimulated by LPS (10 μg/ml). The changes of COX-2 mRNA was detected by reverse transcription-polymerase chain reaction (RT-PCR). The changes of enzyme protein of COX-2 were observed with a method of immunohistochemistry stain. The content of prostaglandin E2 (PGE2) in the supernatant of PIMs was measured by radio-immunoassay (RIA) so as to indirectly show activity change of COX. Results With LPS stimulation, the expression of PIMs, COX-2 mRNA, enzyme protein and the levels of PGE2 were increased more rapidly than those in the control group (P<0.01). Positive correlation was found between the expression of COX-2 enzyme protein and the content of PGE2 (r=0.94,P<0.01). Conclusions After stimulation of LPS, the synthesis and release of PGs caused by inducible expression of COX-2 in PIMs might play an important role in development of acute lung injury (ALI).
, http://www.100md.com
Key words:Lipopolysaccharides; Macrophages, pulmonary intravascular; Prostaglandins; Lung injuries, acute▲
肺血管内巨噬细胞(pulmonary intravascular macrophage, PIM)为位于肺泡壁毛细血管腔内的肺内单核/巨噬细胞成员之一[1],吞噬、分泌功能非常活跃。Bertram等[2]曾发现,PIM可经环氧合酶(cyclooxygenase,COX)代谢花生四烯酸(arcachidonic acid,AA),释放AA代谢产物(AAM)等炎症介质。Wilbom等[3]报告COX有两型,其中COX-1起生理调节作用; COX-2为诱导型,在脂多糖(LPS)等的刺激下,可大量释放AAM,在机体的炎症反应中起重要作用;并发现肺泡巨噬细胞有COX-2表达。但PIM是否同时存在两型COX,并在急性肺损伤(ALI)等急性炎症性疾病中发挥作用,报道甚少。笔者报告LPS刺激猪PIM后,其COX-2 mRNA和酶蛋白表达量及COX-2活性的改变,进而探讨ALI的发病机制。
, http://www.100md.com
材料与方法
1. 猪PIM的分离、培养:按李胜亮等[4]报告的方法,并行下列改良:一是开胸后不取出心肺,行原位肺灌洗;二是含氯化钙的灌洗液临用前才配制,避免沉淀物影响肺血管灌洗。
2. 实验分组及标本收集 : 吹打下经常规培养2 h后的猪(重庆地区杂种猪)PIM。分为对照组:PIM在无血清的RPMI 1640(Sigma公司,美国)中培养; LPS组:向培养基中加入10 μg/ml 的LPS (escherichia coli serotype 055:B5,Sigma公司,美国)以刺激细胞。检测COX-2 mRNA表达时,收集刺激后0.5,1,2,4,6和8 h 的细胞待测;观察酶蛋白表达和前列腺素E2(PGE2)含量时,则增加12,16,20和24 h 等时相点。
3.COX-2 mRNA检测:用反转录聚合酶链反应(RT-PCR)法。用总RNA提取试剂盒(宝灵曼公司,德国),一步热酚法提取细胞总RNA。取总RNA 1 μg ,65℃变性5 min,依次加入0.5 μg oligo-dT15(Promega公司,美国),4 μl 5×RT-PCR合成酶缓冲液(systhese buffer,含Mg2+ 2.5 mmol/L)(Promega公司,美国),0.125 mmol/L dNTP,10 U反转录酶(AMV),0.01 mmol/L DTT, 40 U RNAase抑制剂,总体积为20 μl。42℃孵育60 min,95℃ 10 min 终止反应,完成cDNA第一链的合成。PCR时, COX-2寡核苷酸引物合成根据Lee等[5]的设计合成。 正义引物:5′-ACTCACTCAGTTTGTTGAGTCATTC-3′。 反义引物:5′-TTTGATTAGTACTGTAGGGTTAATG-3′,用这对引物可特异性扩增出583 bp的COX-2 cDNA序列。为进行质控,每次行RT-PCR时,都对应扩增次黄嘌呤磷酸转移酶(HPRT)作为外对照。HPRT寡核苷酸引物根据Osawa等[6]的设计合成。正义引物:5′-GCTGGTGAAAAGGACCTCTCG-3′, 反义引物:5′-GCAGATGGCCACAGGACTAGA-3′。用这对引物可特异性扩增出258 bp 的HPRT cDNA序列。取1 μl反转录反应液,分别加入5 μl 10×PCR缓冲液 ,1.75 mmol/L Mg2+,0.2 mmol/L dNTP,0.4 μmol/L COX-2或HPRT寡核苷酸引物,5个单位 Taq DNA聚合酶,总反应体积为50 μl,一式三管。PCR反应所需变性、退火和延伸温度分别为94℃,55℃和72℃,反应时间均为1 min,共循环30次。首次94℃下循环需2 min。反应完成后取5 μl PCR反应产物行1.5%琼脂糖凝胶电泳。以PCR maker为分子量标准,对电泳黑白照片进行密度扫描,测其积分吸光度值。
, http://www.100md.com
4. COX-2酶蛋白的检测:采用链霉抗生素蛋白-过氧化物酶连结法(streptavidin-peroxidase conjugated method )[7]。取刺激后0.5,1,2,4,6,8,12,16,20和24 h的细胞 ,加羊抗鼠COX-2多克隆抗体(一抗,中山公司),4℃过夜;再加生物素标记兔抗山羊IgG(二抗,中山公司),37℃温育0.5 h,DAB显色5 min。阴性对照时一抗用0.01 mol/L PBS代替。染色后光镜下作定性观察,在图像分析系统上作定量分析。在每帧图像上随机取10个细胞的积分吸光度值代表免疫反应强度。
5. PIM上清PGE2浓度测定:采用放射免疫法。调PIM为5×106/ml,如上施以刺激;离心,PBS洗2次;加入含30 μmol/L AA的新鲜RPMI 1640培养液,培养10 min;离心,留取上清液,用3H标计的PGE2测量试剂盒 (购自解放军第三O一医院) 检测,操作方法按说明书进行。
, http://www.100md.com
6.统计学分析:实验数据以
结 果
1. LPS刺激前后PIM COX-2 mRNA的变化:两组PIM HPRT mRNA表达恒定,无显著性差异,表明该实验方法可靠,结果具有可比性。正常对照组PIM COX-2 mRNA无表达。LPS刺激后,COX-2 mRNA从刺激后0.5 h起即增加,4 h达峰值,各时相点均显著高于对照组(P<0.01)。见图1,表1。

, http://www.100md.com
图1 LPS组COX-2mRNA表达(特异性COX-2片段为583 bp,表达峰值在LPS刺激后4 h) RT-PCR
表1 LPS刺激后PIM COX-2 mRNA 表达分析(
猪数
LPS刺激后时间(h)
0.5
1
2
4
6
, 百拇医药
8
对照组
8
0.50±0.05
0.56±0.04
0.63±0.09
0.55±0.07
0.55±0.01
0.54±0.01
LPS组
8
25.03±1.68*
, 百拇医药
49.35±12.87*
60.94±10.5*
87.93±1.61*
64.05±2.07*
34.96±2.24*
与对照组比较:*P<0.01 2. LPS刺激前后PIM COX-2 酶蛋白的变化:对照组几乎无表达。LPS刺激后, COX-2酶蛋白从0.5 h起增加,峰值在刺激后12 h,各时相点显著高于对照组(P<0.01)。见图2,表2。
表2 LPS刺激后PIM COX-2免疫组化分析(
, 百拇医药
猪数
LPS刺激后的时间(h)
0.5
1
2
4
6
8
12
16
20
24
对照组
, 百拇医药 8
3.29±
4.56±
5.15±
5.8±
5.79±
5.14±
4.28±
5.69±
6.30±
6.67±
2.34
3.26
, 百拇医药
3.33
3.34
2.53
2.46
2.54
3.61
2.24
4.22
LPS组
8
26.50±
28.64±
35.22±
, 百拇医药
38.83±
60.63±
87.12±
101.73±
82.73±
61.68±
47.59±
9.63*
8.61*
6.70*
10.68*
, http://www.100md.com 14.24*
16.49*
17.31*
17.13*
10.32*
17.00*
与对照组比较:*P<0.01

图2 LPS刺激后12 h PIM COX-2酶蛋白免疫组化(核周、胞浆、胞膜上呈棕褐色阳性着色 ×200)
, http://www.100md.com
3. LPS刺激前后PIM上清PGE2浓度的变化:对照组无变化(P<0.05)。LPS刺激后,各时相点PGE2均显著高于对照组(P<0.01),且其变化与COX-2 酶蛋白的变化趋势一致,两者呈显著性正相关(r=0.94, P<0.01)。见表3。
表3 LPS刺激后PIM PGE2放射免疫法测定结果(ng/ml,
猪数
LPS刺激后的时间(h)
0.5
1
, http://www.100md.com
2
4
6
8
12
16
20
24
对照组
8
1.47±
1.40±
1.45±
1.42±
, 百拇医药
1.39±
1.41±
1.36±
1.33±
1.35±
1.40±
0.09
0.03
0.06
0.04
0.04
0.06
0.04
, 百拇医药
0.01
0.01
0.06
LPS组
8
2.74±
3.49±
4.71±
4.99±
6.34±
6.76±
8.85±
6.41±
, 百拇医药
5.73±
4.95±
0.08*
0.24*
0.02*
0.58*
1.76*
0.75*
0.10*
0.18*
1.22*
, http://www.100md.com
1.17*
与对照组比较:*P<0.01讨 论
PIMs是肺巨噬细胞亚型之一,经黏附斑块黏附于毛细血管内皮细胞表面,与血流有广泛的接触面积。PIM通过吞噬和消化肺循环中的细菌等微生物,形成肺的第一道防线,同时其本身亦被激活。李胜亮等[8]报告,在LPS的刺激下,PIM可释放多种细胞因子或炎症介质如白介素-1,6,8和TNF-α等。提示在严重的血源性感染的情况下,PIM可能参与ALI和全身炎症反应综合征(SIRS)的发病;而且,由于其处在首先被激活的特殊部位,可能在ALI的始动环节中起重要作用。
在本实验中观察到,在未刺激的正常状态下,PIM的COX-2 mRNA及酶蛋白无表达,其主要代谢产物PGE2的水平低且恒定;而LPS(10 μg/ml)刺激后,PIM COX-2 mRNA、酶蛋白表达及其培养上清液中PGE2 含量大量增加。结合Bertram等[2]的实验结果(即PIM可在无刺激的情况下,经COX代谢产生AAM)表明,PIM同时存在COX-1和COX-2 ;而COX-2酶蛋白的表达与PGE2 浓度变化趋势一致,且呈显著正相关(r=0.94, P<0.01),表明LPS刺激PIM所致的PGE2增加主要是由COX-2表达增加所致,可能与COX-1关系不大。Lee等[5]用LPS刺激肺泡巨噬细胞,发现刺激前后COX-1无显著性变化,而COX-2则大量诱导性表达 ,更进一步证明了这一点。COX是AA代谢通路中的第一限速酶。COX-2的大量表达,导致TXA2 、TXB2和PGE2 等代谢产物大量合成释放,在整体情况下,导致AAM间的失衡,引起白细胞活化、血管通透性增加等一系列病理生理改变,诱导或加重失控性炎症反应。因此,本实验结果提示,在LPS等致病因子的作用下,PIM通过COX-2的诱导性表达,在ALI等机体的急性炎症性疾病的发病中起重要作用;选择性抑制COX-2的表达及活性,可能有助于改善机体的炎症反应,给ALI的治疗带来新的途径。
, http://www.100md.com
基金项目:国家自然科学基金资助项目(39670311)
参考文献:
[1]Warner AE, Brajn JD. The cell biology and pathogenic role of pulmonary intravascular macrophage. Am J Physiol, 1990, 258:L1-L2.
[2]Bertram TA, Overby LH, Danitowicz R, et al. Pulmonary intravascular macrophages metabolize arachidonic acid. Am Rev Respir Dis, 1988, 138:936-940.
[3]Wilborn J,Dewitt DL,Peters-Golden M. Expression and role of cyclooxygenase isoforms in alveolar and peritoneal macrophage. Am Physiol, 1995, 268:294-301.
, http://www.100md.com
[4]李胜亮,陈正堂,金敬顺.肺血管内巨噬细胞的分离、培养及鉴定.中华病理学杂志, 1998, 27:66-67.
[5]Lee SH, Soyoola E, Chanmugam D, et al. Selective expression of Mitogen-inducible cyclooxygenase in macrophages stimulated with Lipopolysaccharide. J Biol Chem, 1992, 267:25934-25938.
[6]Osawa M, Hamada HI, Hamade H, et al. Long term lymphopematopoietic reconstitution by a single CD34-low/negative hematopoietic stem cell. Science, 1996, 273:242-245.
[7]蔡文琴,王伯沄,主编.实用免疫细胞化学与核酸分子杂交技术.第1版.成都:四川科学技术出版社, 1994. 91-94.
[8]李胜亮,陈正堂,金敬顺.脂多糖致肺血管内巨噬细胞形态和功能的改变.中华结核和呼吸杂志, 1998, 3:167-169.
收稿日期:1998-11-08, 百拇医药